文章信息
- 王梦莹, 刘冬静, 黄辉, 吴涛, 曹卫华, 李立明 .
- Wang Mengying, Liu Dongjing, Huang Hui, Wu Tao, Cao Weihua, Li Liming .
- 慢性阻塞性肺疾病遗传易感性研究进展
- A review on the genetic risk factors of chronic obstructive pulmonary disease
- 中华流行病学杂志, 2016, 37(12): 1678-1682
- Chinese journal of Epidemiology, 2016, 37(12): 1678-1682
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.12.023
-
文章历史
收稿日期: 2016-07-12
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是以不完全可逆的气流受限呈进行性发展为特征的疾病,并且这种气流受限和有害气体或颗粒物导致的肺部炎症反应有关[1]。COPD由于患病率和死亡率较高,造成的疾病负担严重,已成为全世界范围内的主要公共卫生问题之一。《全球疾病负担研究》公布,到2020年,COPD将位于世界疾病负担的第五位[2]。全世界30岁以上人群中,COPD的患病率从1990的10.7%上升到2010年的11.7%[3]。美国COPD导致的死亡在全死因顺位中居于第三位[4]。在中国,COPD在慢性病中同样占有重要地位,严重危害人民的身心健康,40岁以上中国人群COPD的患病率为8.2%[5]。COPD可以根据表现型和严重程度分为不同的亚型,如根据肺功能情况,COPD可以分为轻度、中度、重度以及极重度,COPD的病因研究常与肺功能、慢性支气管炎和肺气肿等表型联系起来[1, 6]。
吸烟是COPD的主要环境危险因素,与不吸烟者相比,吸烟者COPD的患病风险较高,且更加容易出现肺功能异常[7-8]。此外,被动吸烟也会导致COPD,且随着暴露量的增加,患病风险逐渐增大[9]。职业暴露也是COPD的环境危险因素之一,职业性暴露于气体、灰尘和蒸汽等都会导致COPD患病风险增加,这可能与工作环境中的有毒有害物质导致的气道高反应性有关[10-11]。
除环境危险因素外,遗传因素也影响其发病风险。COPD存在家族聚集性,COPD患者亲属与非COPD对照亲属相比有较高的复发风险比[12]。双生子研究表明,COPD具有较高的遗传度[13]。此外,在暴露于相同环境的人群中,只有小部分人会患COPD[14]。这些都提示COPD存在个体易感性,遗传因素在COPD的发生中发挥重要作用。
目前已经有大量针对COPD的候选基因关联研究、全基因组关联研究(GWAS),后GWAS时代外显子测序、标准基因集合关联等新的研究方法也被用于COPD遗传易感因素的探索。本文将对这一问题进行综述。
一、 候选基因关联研究炎症、氧化应激-抗氧化应激和蛋白酶-抗蛋白酶等通路在COPD的发生过程中发挥重要作用。COPD的候选基因关联研究主要针对这些通路相关基因展开。
1.炎症相关基因:肿瘤坏死因子(Tumor necrosis factor,TNF),可编码促进炎症细胞因子,参与细胞分化、凋亡等一系列生物过程。动物实验研究发现,TNF基因多态性和肺部炎症以及肺气肿有关[15]。Gingo等[16]研究发现TNF单核苷酸多态性(Single nucleotide polymorphisms,SNP)-308G/A会增加高加索人群COPD的易感性。胡国平等[17]通过Meta分析未发现高加索人群中TNF-308G/A和COPD发病风险存在关联,而在亚洲人群中发现了显著关联。
转化生长因子B1(Transforming growth factor-beta1,TGFB1),位于19q13.1上,可以编码多种细胞因子。Su等[18]在中国人群中发现TGFB1基因多态性和COPD存在显著关联,Zhang等[19]对TGFB1相关研究进行了Meta分析,发现高加索人群中TGFB1基因和COPD相关。此外,多项研究发现TGFB1基因多态性和肺气肿以及肺功能下降有关[20-21]。
维生素D结合蛋白(Vitamin D-binding protein,VDBP):由GC基因编码,在肺部慢性炎症中发挥重要作用。研究发现GC1F基因可以增加亚洲人群COPD的患病风险,但在高加索人群中可能具有保护作用[22-23]。
2.氧化应激-抗氧化应激相关基因:谷胱甘肽S转移酶(Glutathione S-transferases,GSTs):是一种重要的Ⅱ相生物转化酶,可以促进谷胱甘肽和亲电子物质结合从而保护机体免受氧化应激的损害[24]。GST有多种亚型,其中已有多项针对mu(GSTM),pi(GSTP)和theta(GSTT)亚型基因与COPD发病风险的关联研究。多项研究发现GSTP1和GSTM1基因多态性和COPD的发生存在关联[25]。GSTT1单独作用不会增加COPD的患病风险,但GSTM1和GSTT1联合空白基因型会增加亚洲人群COPD的发病风险[26-27]。此外,GSTM1,GSTP1在COPD患者氧化还原平衡方面发挥重要作用,不仅和COPD的发生有关,而且和肺气肿和肺功能下降有关[28]。
微粒体环氧化物酶(Microsomal epoxide hydrolase,EPHX1):位于1号染色体上,是一种重要的生物转化酶,可以清除体内的环氧化物,在抗氧化方面发挥重要作用。EPHX1是影响COPD发生过程的重要候选基因之一,存在高度多态性。EPHX1基因可以影响COPD患者体内的氧化还原平衡过程,和COPD的发生存在关联[29-30]。EPHX1 113基因多态性和EPHX1 139基因多态性可以增加亚洲人群COPD易感性[31]。此外,Budhi等[32]研究发现EPHX1基因多态性和日本人群肺气肿有关。
3.蛋白酶和抗蛋白酶基因相关基因:丝氨酸蛋白酶抑制剂家族基因1(Serpin family A member 1,SERPINA1)位于14q32.1染色体上,主要功能是编码α-1抗胰蛋白酶。α-1抗胰蛋白酶的主要作用是保护肺部纤维结缔组织,防止中性粒细胞弹性蛋白酶对肺部的破坏。α-1抗胰蛋白酶缺乏可导致COPD的发生。已有多项研究证明SERPINA1基因多态性是COPD的遗传易感因素[33-36]。
基质金属蛋白酶12(matrix metalloproteinase,MMP12):属于MMPs家族中的一员,能降解细胞外基质中的蛋白质,参与组织重塑和修复。Hunninghake等[37]研究发现MMP12基因多态性(rs2276109)会降低吸烟者COPD的易感性。Haq等[38]在欧洲人群中进行了一项病例对照研究,发现MMP12单体型和COPD的严重程度有关。
二、 全基因组关联研究候选基因研究时代,虽然有很多基因被证实与COPD或其表型有关,但由于样本量有限、疾病表型定义不明和不同种族之间的异质性等原因,使得研究结果难以在其他研究中得到重复。为了改善候选基因关联研究的局限性,自2009年以来,不少研究者采用大样本的GWAS研究探索COPD的易感基因。有关COPD的GWAS主要结果见表 1。
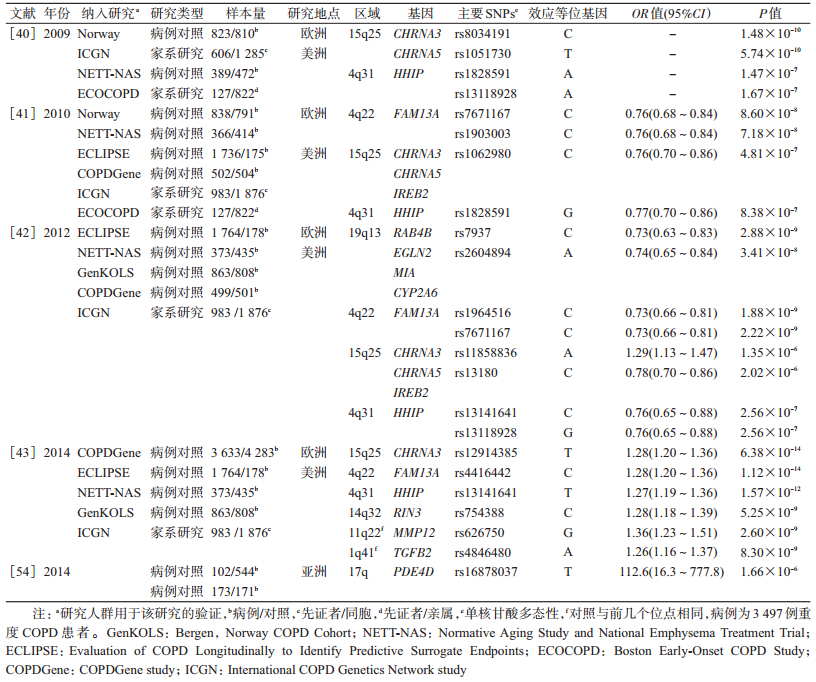
1.候选区域15q25:包括多个和COPD易感性有关的基因。CHRNA3/5和IREB2是该区域重要的候选基因,研究者将GWAS研究结果与表达数量性状基因座的研究结果结合起来分析,发现染色体15q25区域的SNPs和血液以及唾液组织中CHRNA3和IREB2的表达有关[39]。CHRNA3/5和IREB2基因与COPD之间的关联已经在多个种族的人群中得到证实。Pillai等[40]在2009年利用Norway队列中的823例病例和810名对照开展COPD领域的第一个GWAS研究,发现了CHRNA3/5基因多态性与COPD存在关联rs8034191(P=1.48×10-10),并在ICGN、NETT-NAS和ECOCOPD队列人群中证实了这一结果。Cho等[41-42]先后在2010年和2012年通过在美洲和欧洲地区人群中进行大样本的GWAS研究,再次发现CHRNA3/5和IREB2基因与COPD之间的关联。Cho等[43]在2014年通过合并分析来自COPDGene、ECLIPSE、NETT-NAS、GenKOLS和ICGN等多个队列的GWAS数据,证实CHRNA3基因多态性和COPD之间的关联,且这种关联在重度COPD中更加显著。此外,Wilk等[44]针对GWAS开展Meta分析研究发现CHRNA3/5基因多态性和肺部气流受限有关。CHRNA3/5是尼古丁胆碱能受体的亚单位,胆碱能受体存在于支气管上皮细胞和气道炎症反应细胞,该受体对尼古丁比较敏感,当气道受到慢性烟草刺激时,受体的表达会上调,可能影响COPD的易感性[45]。IREB2在肺组织高度表达,主要作用是维持细胞的铁代谢平衡[46],其影响COPD发生的具体机制还有待进一步研究。
2.候选区域4q31:多项GWAS研究发现,染色体4q31区域的HHIP基因附近存在多个和COPD有关的位点,并在多个人群中得到验证。Pillai等[40]在2009年首次通过GWAS研究,发现HHIP的rs1828591(P=1.47×10-7)和rs13118928(P=1.67×10-7)与COPD存在关联。HHIP基因多态性和COPD之间的关联在多个GWAS研究中得到证实,并且研究者发现这种关联与中到重度COPD相比,在重度COPD中更加显著[41-43]。Lao等[47]通过动物实验研究发现,HHIP基因单倍体缺陷会加速吸烟诱导的气道扩张,继而引起肺气肿的发生。此外,Wilk等[48]研究发现HHIP基因多态性还和肺功能有关。HHIP蛋白所在的信号通路在肺部形态形成以及损伤反应中发挥重要作用,HHIP基因多态性可能通过改变HHIP蛋白在肺组织的表达,从而影响COPD的发生[49]。
3.候选区域4q22:2010年Cho等[41]针对4个GWAS开展Meta研究,首次发现4q22染色体上FAM13A基因多态性和COPD的发生存在关联rs7671167(P=8.6×10-8),并在COPDGene、EOCOPD、ICGNS 3个队列人群中得到验证。Cho等[42]在2012年再次发现FAM13A的rs7671167和COPD之间的关联。2014年Cho等[43]在欧洲和美洲人群中纳入6 633例中到重度COPD病例和5 704名对照,利用GWAS分析发现FAM13A的rs4416442和COPD之间存在关联,并用多个样本的Meta分析进行了验证。Guo等[50]在中国汉族人群独立样本中证实了FAM13A和COPD之间的关联。Kim等[51]研究发现FAM13A基因突变会影响肺部FAM13A的表达,可作为FAM13A表达的调控原件。已经有研究证实AKT和COPD的发生有关[52],最新一项研究发现,AKT可以调节FAM13A的磷酸化,继而导致FAM13A细胞质的封存,这可能是FAM13A影响COPD发生的原因[53]。
4. GWAS研究发现的其他候选基因:Cho等[42]在2012年通过ECLIPSE、NETT-NAS、GenKOLS和COPDGene 4个人群GWAS研究的Meta分析,发现19q13染色体区域rs7937(P=2.88×10-9)和COPD存在全基因组水平的关联。19q13区域主要包括RAB4B、GLN2、MIA和CYP2A6基因。Cho等[43]在3 497重度COPD患者和5 704名对照中进行GWAS研究发现11q22染色体区域MMP12基因(P=2.6×10-9)和1q41染色体区域的TGFB2基因(P=8.3×10-9)和COPD存在关联,这两个基因与COPD之间的关联在候选基因时代已被多个研究所证实。此外,该研究还在6 633例中到重度COPD病例和5 704名对照中开展GWAS研究,发现RIN3基因和COPD之间存在关联rs754388(P=5.25×10-9),RIN3是新发现的基因位点,其和COPD之间的关联还需要进一步的探索。Yoon等[54]在韩国人群中纳入102例病例和544名对照进行GWAS研究,发现17q染色体的PDE4D基因和COPD存在关联,并在韩国人群成功验证。
三、 COPD遗传易感因素研究展望1.不同亚型的研究:模糊的亚型定义是COPD候选基因研究结果不一致的主要原因之一,针对COPD的亚型和严重程度进行更细化的分类,以降低研究结果的异质性,更好地对致病基因进行定位。
2.新研究方法的应用:后GWAS时代,许多新的研究方法被用于COPD遗传易感性研究。外显子测序(阵列)是研究疾病罕见突变位点的重要方法。Hobbs等[55]在2016年通过外显子阵列研究发现IL27的一个新突变位点和COPD存在关联。Qiao等[56]利用家系研究设计结合外显子测序方法探索重度COPD的罕见致病位点。基因集合分析和GWAS网络分析的发展提供了识别人类表型分子过程的新方法,更加有利于GWAS结果的解释和分析。McDonald等[57]在基因集合分析的基础上将标准基因集合关联研究用于COPD分子网络的探索和传统通路分析,发现了一些可能影响COPD易感性的新位点。全基因组测序、外显子测序和标准基因集合关联等方法将在未来COPD致病基因探索方面发挥重要作用。
3.致病机制的探索:COPD遗传易感因素研究不仅要在统计学意义上发现疾病的易感基因,更需要从生物学机制上解释基因多态性影响疾病发生的过程。未来的研究需要通过动物实验等基础研究进一步探索基因突变影响COPD发生的生物学机制,并利用人群模型进行验证。
综上所述,目前仅发现少数有关联的COPD候选基因,更多的遗传易感因素还需进一步的探索。在候选基因研究和GWAS研究的基础上,利用新的研究方法和策略探索COPD的致病位点,并对已发现的证据比较充分的候选基因进行生物学机制的验证是未来的工作重点和方向。
利益冲突: 无
| [1] | Mannino DM, Buist AS. Global burden of COPD:risk factors, prevalence, and future Trends[J]. Lancet , 2007, 370(9589) : 765–773. DOI:10.1016/S0140-6736(07)61380-4 |
| [2] | Lopez AD, Murray CCJL. The global burden of disease, 1990-2020[J]. Nat Med , 1998, 4(11) : 1241–1243. DOI:10.1038/3218 |
| [3] | Adeloye D, Chua S, Lee C, et al. Global and regional estimates of COPD prevalence:systematic review and meta-analysis[J]. J Glob Health , 2015, 5(2) : 020415. DOI:10.7189/jogh.05-020415 |
| [4] | Miniño AM, Murphy SL, Xu J, et al. Deaths:final data for 2008[J]. Natl Vital Stat Rep , 2011, 59(10) : 1–126. |
| [5] | Zhong NS, Wang C, Yao WZ, et al. Prevalence of chronic obstructive pulmonary disease in China:a large, population-based survey[J]. Am J Respir Crit Care Med , 2007, 176(8) : 753–760. DOI:10.1164/rccm.200612-1749OC |
| [6] |
中华医学会呼吸病学分会慢性阻塞性肺疾病学组.
慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华结核和呼吸杂志 , 2007, 30(1) : 8–17.
Chronic Obstructive Pulmonary Disease Group, Branch of Chinese Medical Association of Respiratory Diseases. Chronic obstructive pulmonary disease guidelines (Revised Edition 2007)[J]. Chin J Tuberc Respir Dis , 2007, 30(1) : 8–17. |
| [7] | Wang BY, Xiao D, Wang C. Smoking and chronic obstructive pulmonary disease in Chinese population:a meta-analysis[J]. Clin Respir J , 2015, 9(2) : 165–175. DOI:10.1111/crj.12118 |
| [8] | Løkke A, Lange P, Scharling H, et al. Developing COPD:a 25 year follow up study of the general population[J]. Thorax , 2006, 61(11) : 935–939. DOI:10.1136/thx.2006.062802 |
| [9] | Fischer F, Kraemer A. Meta-analysis of the association between second-hand smoke exposure and ischaemic heart diseases, COPD and stroke[J]. BMC Public Health , 2015, 15 : 1202. DOI:10.1186/s12889-015-2489-4 |
| [10] | Eisner MD, Balmes J, Katz PP, et al. Lifetime environmental tobacco smoke exposure and the risk of chronic obstructive pulmonary disease[J]. Environ Health , 2005, 4(1) : 7. DOI:10.1186/1476-069X-4-7 |
| [11] | Hagstad S, Backman H, Bjerg A, et al. Prevalence and risk factors of COPD among never-smokers in two areas of Sweden-Occupational exposure to gas, dust or fumes is an important risk factor[J]. Respir Med , 2015, 109(11) : 1439–1445. DOI:10.1016/j.rmed.2015.09.012 |
| [12] | Lebowitz MD, Knudson RJ, Burrows B. Family aggregation of pulmonary function measurements[J]. Am Rev Respir Dis , 1984, 129(1) : 8–11. DOI:10.1164/arrd.1984.129.1.8 |
| [13] | Ingebrigtsen T, Thomsen SF, Vestbo J, et al. Genetic influences on chronic obstructive pulmonary disease-a twin study[J]. Respir Med , 2010, 104(12) : 1890–1895. DOI:10.1016/j.rmed.2010.05.004 |
| [14] | Bossé Y. Updates on the COPD gene list[J]. Int J Chron Obstruct Pulmon Dis , 2012, 7 : 607–631. DOI:10.2147/COPD.S35294 |
| [15] | Lundblad LKA, Thompson-Figueroa J, Leclair T, et al. Tumor necrosis factor-α overexpression in lung disease:a single cause behind a complex phenotype[J]. Am J Respir Crit Care Med , 2005, 171(12) : 1363–1370. DOI:10.1164/rccm.200410-1349OC |
| [16] | Gingo MR, Silveira LJ, Miller YE, et al. Tumour necrosis factor gene polymorphisms are associated with COPD[J]. Eur Respir J , 2008, 31(5) : 1005–1012. DOI:10.1183/09031936.00100307 |
| [17] |
胡国平, 彭公永, 胡锦兴, 等.
肿瘤坏死因子α-308基因多态性与慢性阻塞性肺疾病易感性的荟萃分析[J]. 中华结核和呼吸杂志 , 2007, 30(8) : 588–594.
Hu GP, Peng GY, Hu JX, et al. Association of tumor necrosis factor alpha 308 G/A gene promoter polymorphism with the presence of chronic obstructive pulmonary disease:a meta-analysis[J]. Chin J Tuberc Respir Dis , 2007, 30(8) : 588–594. DOI:10.3760/j.issn.1001-0939.2007.08.007 |
| [18] | Su ZG, Wen FQ, Feng YL, et al. Transforming growth factor-β1 gene polymorphisms associated with chronic obstructive pulmonary disease in Chinese population[J]. Acta Pharmacol Sin , 2005, 26(6) : 714–720. DOI:10.1111/j.1748-1716.1973.tb05507.x |
| [19] | Zhang L, Chang WW, Ding H, et al. Transforming growth factor-β1 polymorphisms and chronic obstructive pulmonary disease:a meta-analysis[J]. Int J Tuberc Lung Dis , 2011, 15(10) : 1301–1307. DOI:10.5588/ijtld.10.0295 |
| [20] | Ito M, Hanaoka M, Droma Y, et al. The association of transforming growth factor beta 1 gene polymorphisms with the emphysema phenotype of COPD in Japanese[J]. Intern Med , 2008, 47(15) : 1387–1394. DOI:10.2169/internalmedicine.47.1116 |
| [21] | Yucesoy B, Kurzius-Spencer M, Johnson VJ, et al. Association of cytokine gene polymorphisms with rate of decline in lung function[J]. J Occup Environ Med , 2008, 50(6) : 642–648. DOI:10.1097/JOM.0b013e31816515e1 |
| [22] | Xiao M, Wang T, Zhu T, et al. Dual role of vitamin D-binding protein 1F allele in chronic obstructive pulmonary disease susceptibility:a meta-analysis[J]. Genet Mol Res , 2015, 14(2) : 3534–3540. DOI:10.4238/2015.April.17.1 |
| [23] | Horita N, Miyazawa N, Tomaru K, et al. Vitamin D binding protein genotype variants and risk of chronic obstructive pulmonary disease:a meta-analysis[J]. Respirology , 2015, 20(2) : 219–225. DOI:10.1111/resp.12448 |
| [24] | Hu G, Yao W, Zhou Y, et al. Meta-and pooled analyses of the effect of glutathione S-transferase M1 and T1 deficiency on chronic obstructive pulmonary disease[J]. Int J Tuberc Lung Dis , 2008, 12(12) : 1474–1481. |
| [25] | Castaldi PJ, Cho MH, Cohn M, et al. The COPD genetic association compendium:a comprehensive online database of COPD genetic associations[J]. Hum Mol Genet , 2010, 19(3) : 526–534. DOI:10.1093/hmg/ddp519 |
| [26] | Smolonska J, Wijmenga C, Postma DS, et al. Meta-analyses on suspected chronic obstructive pulmonary disease genes:a summary of 20 years' research[J]. Am J Respir Crit Care Med , 2009, 180(7) : 618–631. DOI:10.1164/rccm.200905-0722OC |
| [27] | Xue H, Su J, Sun K, et al. Glutathione S-transferase M1 and T1 gene polymorphism and COPD risk in smokers:an updated analysis[J]. Mol Biol Rep , 2012, 39(4) : 5033–5042. DOI:10.1007/s11033-011-1300-6 |
| [28] | Lakhdar R, Denden S, Knani J, et al. Combined analysis of EPHX1, GSTP1, GSTM1 and GSTT1 gene polymorphisms in relation to chronic obstructive pulmonary disease risk and lung function impairment[J]. Dis Markers , 2011, 30(5) : 253–263. DOI:10.3233/DMA-2011-0782 |
| [29] | Cheng SL, Yu CJ, Chen CJ, et al. Genetic polymorphism of epoxide hydrolase and glutathione S-transferase in COPD[J]. Eur Respir J , 2004, 23(6) : 818–824. DOI:10.1183/09031936.04.00104904 |
| [30] | Lakhdar R, Denden S, Mouhamed MH, et al. Correlation of EPHX1, GSTP1, GSTM1, and GSTT1 genetic polymorphisms with antioxidative stress markers in chronic obstructive pulmonary disease[J]. Exp Lung Res , 2011, 37(4) : 195–204. DOI:10.3109/01902148.2010.535093 |
| [31] | Hu GP, Shi Z, Hu JX, et al. Association between polymorphisms of microsomal epoxide hydrolase and COPD:results from meta-analyses[J]. Respirology , 2008, 13(6) : 837–850. DOI:10.1111/j.1440-1843.2008.01356.x |
| [32] | Budhi A, Hiyama K, Isobe T, et al. Genetic susceptibility for emphysematous changes of the lung in Japanese[J]. Int J Mol Med , 2003, 11(3) : 321–329. DOI:10.3892/ijmm.11.3.321 |
| [33] | Silverman EK, Sandhaus RA. Alpha 1-antitrypsin deficiency[J]. N Engl J Med , 2009, 360(26) : 2749–2757. DOI:10.1056/NEJMcp0900449 |
| [34] | Hersh CP, Dahl M, Ly NP, et al. Chronic obstructive pulmonary disease in α1-antitrypsin PI MZ heterozygotes:a meta-analysis[J]. Thorax , 2004, 59(10) : 843–849. DOI:10.1136/thx.2004.022541 |
| [35] | Dahl M, Hersh CP, Ly NP, et al. The protease inhibitor PI*S allele and COPD:a Meta-analysis[J]. Eur Respir J , 2005, 26(1) : 67–76. DOI:10.1183/09031936.05.00135704 |
| [36] | Janus ED, Phillips NT, Carrell RW. Smoking, lung function, and alpha 1-antitrypsin deficiency[J]. Lancet , 1985, 325(8421) : 152–154. DOI:10.1016/S0140-6736(85)91916-6 |
| [37] | Hunninghake GM, Cho MH, Tesfaigzi Y, et al. MMP12, lung function, and COPD in high-risk populations[J]. N Engl J Med , 2009, 361(27) : 2599–2608. DOI:10.1056/NEJMoa0904006 |
| [38] | Haq I, Chappell S, Johnson SR, et al. Association of MMP-12 polymorphisms with severe and very severe COPD:a case control study of MMPs-1, 9 and 12 in a European population[J]. BMC Med Genet , 2010, 11 : 7. DOI:10.1186/1471-2350-11-7 |
| [39] | Castaldi PJ, Cho MH, Zhou XB, et al. Genetic control of gene expression at novel and established chronic obstructive pulmonary disease loci[J]. Hum Mol Genet , 2015, 24(4) : 1200–1210. DOI:10.1093/hmg/ddu525 |
| [40] | Pillai SG, Ge DL, Zhu GH, et al. A genome-wide association study in chronic obstructive pulmonary disease (COPD):identification of two major susceptibility loci[J]. PLoS Genet , 2009, 5(3) : e1000421. DOI:10.1371/journal.pgen.1000421 |
| [41] | Cho MH, Boutaoui N, Klanderman BJ, et al. Variants in FAM13A are associated with chronic obstructive pulmonary disease[J]. Nat Genet , 2010, 42(3) : 200–202. DOI:10.1038/ng.535 |
| [42] | Cho MH, Castaldi PJ, Wan ES, et al. A genome-wide association study of COPD identifies a susceptibility locus on chromosome 19q13[J]. Hum Mol Genet , 2012, 21(4) : 947–957. DOI:10.1093/hmg/ddr524 |
| [43] | Cho MH, McDonald ML, Zhou XB, et al. Risk loci for chronic obstructive pulmonary disease:a genome-wide association study and meta-analysis[J]. Lancet Respir Med , 2014, 2(3) : 214–225. DOI:10.1016/S2213-2600(14)70002-5 |
| [44] | Wilk JB, Shrine NRG, Loehr LR, et al. Genome-wide association studies identify CHRNA5/3 and HTR4 in the development of airflow obstruction[J]. Am J Respir Crit Care Med , 2012, 186(7) : 622–632. DOI:10.1164/rccm.201202-0366OC |
| [45] | Kim WJ, Lee SD. Candidate genes for COPD:current evidence and research[J]. Int J Chron Obstruct Pulmon Dis , 2015, 10(1) : 2249–2255. DOI:10.2147/COPD.S80227 |
| [46] | Zumbrennen-Bullough KB, Becker L, Garrett L, et al. Abnormal brain iron metabolism in Irp2 deficient mice is associated with mild neurological and behavioral impairments[J]. PLoS One , 2014, 9(6) : e98072. DOI:10.1371/journal.pone.0098072 |
| [47] | Lao TT, Glass K, Qiu WL, et al. Haploinsufficiency of Hedgehog interacting protein causes increased emphysema induced by cigarette smoke through network rewiring[J]. Genome Med , 2015, 7(1) : 12. DOI:10.1186/s13073-015-0137-3 |
| [48] | Wilk JB, Chen TH, Gottlieb DJ, et al. A genome-wide association study of pulmonary function measures in the Framingham Heart Study[J]. PLoS Genet , 2009, 5(3) : e1000429. DOI:10.1371/journal.pgen.1000429 |
| [49] | Chuang PT, Kawcak T, McMahon AP. Feedback control of mammalian Hedgehog signaling by the Hedgehog-binding protein, Hip1, modulates Fgf signaling during branching morphogenesis of the lung[J]. Genes Dev , 2003, 17(3) : 342–347. DOI:10.1101/gad.1026303 |
| [50] | Guo Y, Lin H, Gao K, et al. Genetic analysis of IREB2, FAM13A and XRCC5 variants in Chinese Han patients with chronic obstructive pulmonary disease[J]. Biochem Biophys Res Commun , 2011, 415(2) : 284–287. DOI:10.1016/j.bbrc.2011.10.042 |
| [51] | Kim WJ, Lim MN, Hong Y, et al. Association of lung function genes with chronic obstructive pulmonary disease[J]. Lung , 2014, 192(4) : 473–480. DOI:10.1007/s00408-014-9579-4 |
| [52] | Bozinovski S, Vlahos R, Hansen M, et al. Akt in the pathogenesis of COPD[J]. Int J Chron Obstruct Pulmon Dis , 2006, 1(1) : 31–38. |
| [53] | Jin ZG, Chung JW, Mei WY, et al. Regulation of nuclear-cytoplasmic shuttling and function of Family with sequence similarity 13, member A (Fam13a), by B56-containing PP2As and Akt[J]. Mol Biol Cell , 2015, 26(6) : 1160–1173. DOI:10.1091/mbc.E14-08-1276 |
| [54] | Yoon HK, Hu HJ, Rhee CK, et al. Polymorphisms in PDE4D are associated with a risk of COPD in non-emphysematous Koreans[J]. COPD , 2014, 11(6) : 652–658. DOI:10.3109/15412555.2014.898045 |
| [55] | Hobbs BD, Parker MM, Chen H, et al. Exome array analysis identifies a common variant in IL27 associated with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med , 2016, 194(1) : 48–57. DOI:10.1164/rccm.201510-2053OC |
| [56] | Qiao DD, Lange C, Beaty TH, et al. Exome sequencing analysis in severe, early-onset chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med , 2016, 193(12) : 1353–1363. DOI:10.1164/rccm.201506-1223OC |
| [57] | McDonald ML, Mattheisen M, Cho MH, et al. Beyond GWAS in COPD:probing the landscape between gene-set associations, genome-wide associations and protein-protein interaction networks[J]. Hum Hered , 2014, 78(3/4) : 131–139. DOI:10.1159/000365589 |
 2016, Vol. 37
2016, Vol. 37