文章信息
- 贾吴琳, 丁玲, 任志英, 吴婷婷, 赵维敏, 樊石磊, 王金桃 .
- Jia Wulin, Ding Ling, Ren Zhiying, Wu Tingting, Zhao Weimin, Fan Shilei, Wang Jintao .
- 叶酸与p16蛋白在宫颈癌变中的作用及其相互效应
- Effects of both folic acid, p16 protein expression and their interaction on progression of cervical cancerization
- 中华流行病学杂志, 2016, 37(12): 1647-1652
- Chinese journal of Epidemiology, 2016, 37(12): 1647-1652
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.12.018
-
文章历史
收稿日期: 2016-06-07
宫颈癌是最主要的妇科恶性肿瘤之一[1]。叶酸既可作为嘌呤和嘧啶合成的前体,参与DNA的合成,也可作为体内一碳单位的主要载体,在DNA甲基化过程中起着至关重要的作用。本课题组先前报道了叶酸缺乏可增加宫颈癌发生的风险[2],并发现叶酸缺乏与p16基因CpG岛甲基化异常均可增加宫颈癌变的风险,且两者之间存在正相加交互作用[3]。p16基因是一种肿瘤抑制基因,在多种肿瘤细胞中均显示p16基因失活。本研究前期发现,与多数肿瘤不同,p16蛋白在宫颈上皮内瘤样变(CIN)和宫颈癌患者组均呈高表达,且与红细胞叶酸缺乏之间存在正相加交互效应[4]。据此假设:叶酸势必通过调节p16蛋白的表达进而在宫颈癌的进展中起作用。为验证该假设,本文从人群和体外研究的角度,探讨血清叶酸与p16蛋白表达在宫颈癌变中的作用及其相互效应,并对宫颈癌细胞进行叶酸干预,分析叶酸对宫颈癌细胞中p16蛋白表达的影响,以期为宫颈癌病因和发病机制的研究提供新的依据。
材料与方法1.研究对象:选取2009-2011年在山西省肿瘤医院、太原市妇幼保健院和介休市妇幼保健院就诊并经病理学确诊的正常宫颈(NC)妇女80例、低度宫颈上皮内瘤样变(CINⅠ)患者55例、高度宫颈上皮内瘤样变(CINⅡ/Ⅲ)患者55例、宫颈鳞状细胞癌(SCC)患者64例共计254例为研究对象,排除营养性巨幼细胞性贫血、溶血性疾病、消化道疾病、其他肿瘤患者以及3个月内B族维生素使用者。采用结构式问卷收集研究对象的人口学特征、宫颈癌相关因素等资料,同时采集全部研究对象入院后、系统治疗前清晨空腹静脉血5 ml和手术(或活检)宫颈组织标本,常规处理,置于-80 ℃保存待检。本研究经山西医科大学伦理委员会批准,且获得研究对象知情同意。
2.细胞系的选择与叶酸干预:选择高危型HPV16阳性宫颈癌细胞Caski和HPV阴性宫颈癌细胞C33A(均购自中国医学科学院基础研究所),分别置于RPMI-1640和MEM-EBSS培养基中进行培养、传代。取对数生长期的细胞(1×105 cell/ml),施加不同浓度叶酸进行分组培养:设1.0 μg/ml为对照组,0.1 μg/ml为叶酸缺乏组,10、50、100、500、1 000 μg/ml为6个叶酸干预组。
3.实验指标的检测:
(1)PCR检测宫颈组织HPV16 DNA:采用酚-氯仿法提取宫颈组织总DNA,参照本课题组前期建立的PCR扩增方法进行HPV16 DNA扩增[5],确定HPV16感染状态。
(2)微生物法测定血清叶酸含量:用l%抗坏血酸溶液处理血清样本,离心取上清,参照本课题组前期建立的微生物法检测血清叶酸含量[6]。
(3)Western-blot方法检测p16蛋白的表达:取宫颈组织(约50 mg)/宫颈癌细胞(1×105 cell/ml),裂解、离心、取上清。采用本课题组建立的Western-blot方法[7],检测p16蛋白表达水平。一抗为兔抗人p16单克隆抗体(1:1 000,英国Abcam公司),设内参对照为鼠抗人β-actin抗体(1:800,武汉博士德生物工程有限公司),分别在16 kD和43 kD处获得p16和内参蛋白β-actin特异性抗体结合蛋白条带,利用Quantity One软件分析条带的A值。以目的条带与内参β-actin条带的A值之比作为p16蛋白的相对表达量。
(4)MTT法检测细胞活性:取对数生长期细胞(1×105 cell/ml),施加不同浓度叶酸培养48 h后,加5 mg/ml MTT试剂10 μl继续培养4 h,弃上清液,每孔各加150 μl DMSO,振荡15 min,用490 nm波长测定各孔A值,计算细胞增殖抑制率=(对照组平均A值-实验组平均A值)/对照组平均A值×100%。
(5)流式细胞术(FCM)检测细胞凋亡情况:取对数生长期细胞(1×105 cell/ml),接种于含不同浓度叶酸的培养液中培养48 h,用0.25%的胰蛋白酶消化,制成细胞悬液,参照本研究前期建立的流式细胞术检测细胞凋亡率[8]。
4.统计学分析:利用SPSS 19.0软件进行相关资料的χ2检验、Kruskal-Wallis检验、方差分析、Pearson相关分析,计算因素与宫颈癌变之间关联强度的OR值及其95%CI。应用相加效应模型进行交互作用评价,并计算交互作用相对超额危险度(RERI)、交互作用归因危险比(API)和交互作用指数(S)进行交互作用的定量分析。以P < 0.05为差异有统计学意义。
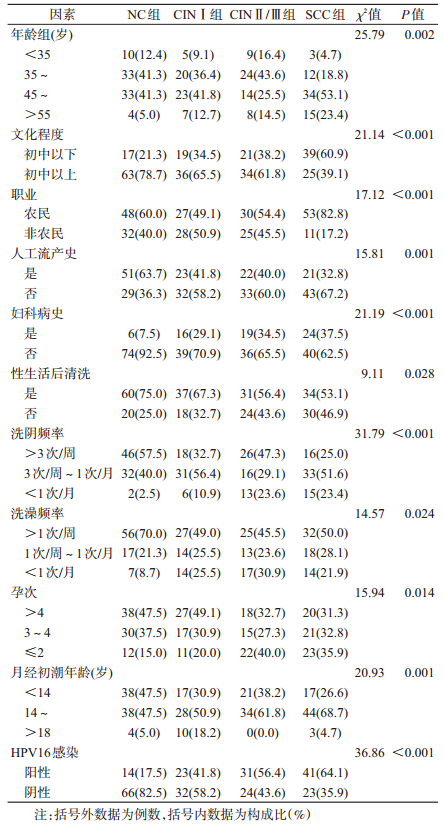
结果1.人口学特征及相关因素:各组研究对象在民族、出生地、居住地、婚姻状况、吸烟、饮酒、经期性生活、首次性交年龄、首次生育年龄、人工流产次数、肿瘤家族史、绝经、产次等方面均衡可比,差异均无统计学意义(P > 0.05),但年龄、文化程度、职业、人工流产史、妇科病史、性生活后清洗、洗阴频率、洗澡频率、孕次、月经初潮年龄、HPV16感染在各组间分布的差异均有统计学意义(P < 0.05),见表 1。
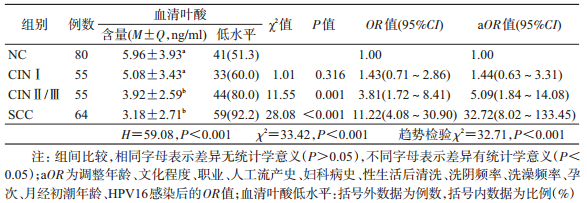
2.血清叶酸与宫颈癌变的关系:由于血清叶酸含量为非正态分布,故采用Kruskal-Wallis检验。结果显示,血清叶酸含量在各组间的总体分布差异有统计学意义(H=59.08,P < 0.001),且随着宫颈病变程度的加重而逐渐下降。采用Bonferroni法两两比较后发现,SCC组和CINⅡ/Ⅲ组的血清叶酸含量均低于CINⅠ组和NC组,差异有统计学意义,但在SCC组与CINⅡ/Ⅲ组、CINⅠ组与NC组间的差异均无统计学意义。进一步以NC组血清叶酸含量的50%(5.96 ng/ml)点值为界,以≤5.96 ng/ml为低叶酸水平进行分析,结果显示,随着宫颈病变程度的加重,低血清叶酸所致OR值逐渐升高(趋势检验χ2=32.71,P < 0.001),见表 2。
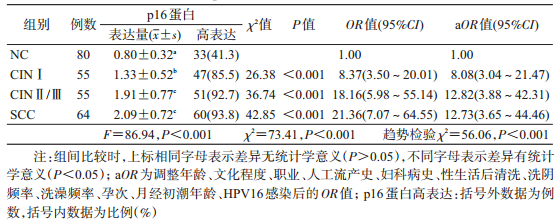
3. p16蛋白与宫颈癌变的关系:p16蛋白表达量在各组间的总体分布差异有统计学意义(F=86.94,P < 0.05),且随着宫颈病变程度的加重逐渐上升。两两比较后发现,除SCC组与CINⅡ/Ⅲ组之间p16蛋白表达差异无统计学意义外,其余各组之间差异均有统计学意义。进一步以NC组p16蛋白表达量的50%(0.80)点值为界,以≥0.80为高蛋白表达进行分析,结果显示,随着宫颈病变程度的加重,p16蛋白的高表达所致OR值逐渐升高(趋势检验χ2=56.06,P < 0.001),见表 3。
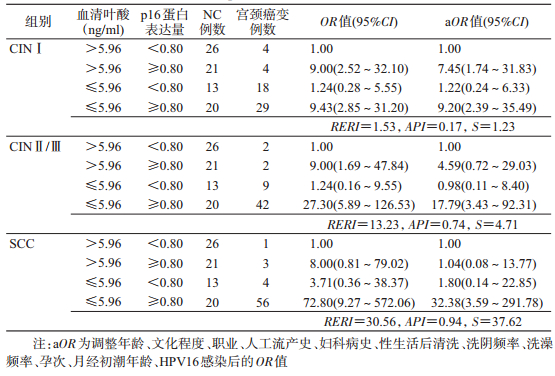
4.血清叶酸与p16蛋白在宫颈癌变中的交互作用:分别以NC组血清叶酸含量的50%点值(5.96 ng/ml)和p16蛋白表达量的50%点值(0.80)作为低叶酸水平与p16蛋白高表达的界值,应用相加作用模型进行交互效应分析。结果显示,血清叶酸缺乏与p16蛋白高表达对CINⅠ、CINⅡ/Ⅲ和SCC的发生均呈现正相加交互作用,交互作用RERI、API和S均显示正相加效应,调整宫颈癌相关因素后这种交互作用仍存在(表 4)。
5.叶酸对宫颈癌细胞增殖、凋亡及p16蛋白表达的影响:对C33A和Caski宫颈癌细胞施加不同浓度叶酸干预后发现,随着叶酸浓度的增加,宫颈癌细胞增殖抑制率(C33A:r=0.928,P=0.003;Caski:r=0.962,P=0.001)和凋亡率(C33A:r=0.984,P < 0.001;Caski:r=0.986,P < 0.001)均逐渐上升,p16蛋白表达量逐渐降低(C33A:r=-0.817,P=0.025;Caski:r=-0.871,P=0.011);细胞增殖抑制率(C33A:r=-0.935,P=0.002;Caski:r=-0.963,P=0.001)和凋亡率(C33A:r=-0.844,P=0.017;Caski:r=-0.898,P=0.006)与p16蛋白表达均呈负相关关系;在相同叶酸水平,Caski细胞p16蛋白的表达高于C33A细胞(图 1)。
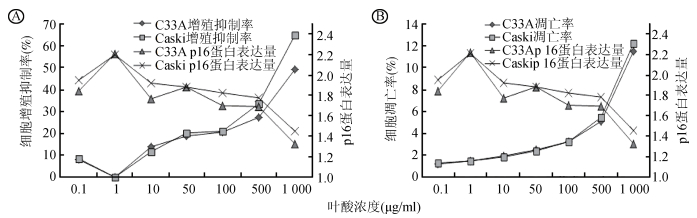
|
| 图 1 叶酸对宫颈癌细胞增殖(A)凋亡(B)及p16蛋白表达的影响 |
宫颈癌的发生发展是一个渐变过程,从NC-CIN-原位癌-浸润癌是一个连续过程[9]。有研究报道,高危型HPV感染率在NC、CINⅠ、CINⅡ和CINⅢ中分别为8.7%、45.3%、73.3%和85.0%[10],而世界范围研究报道的宫颈癌中HPV感染率高达99.7%[11]。HPV感染发展为宫颈癌是一个较为漫长的过程,一般经历8~15年,因此探寻宫颈病变发生的早期标志物,对于宫颈癌预防关口的前移具有重要意义。近年来,越来越多的研究者发现,尽管HPV感染在妇女中常见,但只有不超过1%HPV感的染妇女进展为宫颈癌,因此可能存在其他与HPV共同作用的因素影响宫颈癌的发生发展。
叶酸作为人体所必需的B族维生素,其缺乏可导致基因组DNA链断裂、染色体不稳定、尿嘧啶错配等,破坏DNA的合成和修复,影响核酸、组蛋白甲基化的修饰,进而增加肿瘤发病的风险[12]。本研究结果显示,从NC、CINⅠ、CINⅡ/Ⅲ到SCC组,血清叶酸水平逐渐降低,提示叶酸缺乏可增加宫颈癌变发生的风险。进一步对宫颈癌细胞进行体外叶酸干预,结果提示叶酸可以有效抑制宫颈癌细胞的增殖,促进其凋亡。研究发现,HPV与宿主DNA整合是发生宫颈癌的关键环节,这种整合易发生于染色体的脆性位点FRA3B[13],而叶酸缺乏可增加这种整合的概率。提示叶酸缺乏可能导致HPV的持续感染,进而增加宫颈癌的发病风险,在人群中适量补充叶酸对宫颈癌及其癌前病变发生风险的降低可能具有重要意义。
宫颈癌的发生、发展是多因素共同作用的复杂生物学过程,涉及癌基因的激活和抑癌基因的失活[14]。p16基因是第一个被发现参与细胞周期调控的抑癌基因,p16蛋白是细胞周期中重要的负性调节因子,在多种恶性肿瘤中呈低表达[15-16]。本研究检测了不同级别宫颈病变中p16蛋白的表达水平,结果显示,随着宫颈病变程度的加重,p16蛋白的表达水平呈升高趋势,细胞实验研究结果也显示,p16蛋白表达与两种宫颈癌细胞的增殖抑制率和凋亡率呈负相关关系,这种现象与多种肿瘤中p16蛋白呈低表达的结果相悖。p16蛋白主要通过p16-CyclinD-CDK4/6-pRb-E2F通路来调控细胞周期,在此级联调节中,pRb对p16蛋白表达起着负反馈抑制作用[17]。在HPV16感染的宫颈组织中,由于HPV16 E7蛋白与Rb结合后,导致抑癌基因Rb失活,进而解除了pRb蛋白对p16蛋白表达的负反馈抑制作用,使p16表达量增高[18]。本研究结果显示,p16蛋白表达水平在HPV16阳性的Caski细胞中高于HPV阴性的C33A细胞,也进一步佐证了这种负反馈抑制作用。国内外也有相关研究提示,与正常宫颈妇女相比,p16蛋白在宫颈癌及癌前病变中呈高表达[19-20],与本研究结果相一致,提示p16蛋白高表达可增加宫颈癌变发生的风险。本研究结果还特别发现叶酸缺乏可增加宫颈癌细胞中p16蛋白的表达。
交互作用分析结果提示,叶酸缺乏与p16蛋白高表达均可增加宫颈癌变的风险,且在宫颈癌变中可能具有重要的协同作用,且该交互效应随着宫颈病变的加重逐渐增大。体外实验结果显示,随着叶酸干预浓度的增加,p16蛋白表达量逐渐降低,且p16蛋白表达与细胞的增殖抑制率和凋亡率呈负相关关系,相同叶酸水平,p16蛋白的表达在HPV16阳性的Caski高于C33A,提示补充叶酸可逆转宫颈癌细胞中p16蛋白的高表达,而HPV16感染与p16异常高表达可能对宫颈癌的发生具有协同效应,其作用及具体机制尚待深入研究。
本研究选择了不同宫颈病变阶段的妇女为研究对象,从群体角度揭示了从NC、CINⅠ、CINⅡ/Ⅲ到SCC组血清叶酸与p16蛋白的变化特点和相互作用规律,但未从个体前瞻性的观察角度揭示这一过程,这是本研究的局限所在。此外,本研究中存在OR值95%CI范围较宽的现象,分析其原因,一方面可能与所检测指标在不同个体存在较大异质性有关,另一方面可能与样本量不足有关,尤其在分层后进行交互效应分析时,这种情况更为明显。为了进一步验证叶酸与p16蛋白表达对宫颈癌变发生与进展的作用,尚需进行前瞻性队列研究,以提供更为可靠的证据。
利益冲突: 无
| [1] |
陈万青, 郑荣寿, 张思维, 等.
2012年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤 , 2016, 25(1) : 1–8.
Chen WQ, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in China, 2012[J]. Chin Cancer , 2016, 25(1) : 1–8. DOI:10.11735/j.issn.1004-0242.2016.01.A001 |
| [2] |
王金桃, 马晓晨, 程玉英, 等.
叶酸与宫颈癌关系的病例对照研究[J]. 中华流行病学杂志 , 2006, 27(5) : 424–427.
Wang JT, Ma XC, Cheng YY, et al. A case-control study on the association between folate and cervical cancer[J]. Chin J Epidemiol , 2006, 27(5) : 424–427. DOI:10.3760/j.issn.0254-6450.2006.05.016 |
| [3] |
吴婷婷, 王金桃, 丁玲, 等.
叶酸缺乏和p16基因CpG岛甲基化对宫颈癌变的作用[J]. 中华疾病控制杂志 , 2013, 17(1) : 9–12.
Wu TT, Wang JT, Ding L, et al. Folate deficiency and aberrant methylation of p16 CpG islands on cervical cancer and its precancerous lesions[J]. Chin J Dis Control Prev , 2013, 17(1) : 9–12. |
| [4] |
许娟, 王金桃, 丁玲, 等.
红细胞叶酸与p16基因表达在子宫颈癌变中的作用及其交互效应[J]. 肿瘤研究与临床 , 2015, 27(4) : 228–233, 242.
Xu J, Wang JT, Ding L, et al. Interaction effects between blood folate and p16 gene expression in progression of cervical cancerization[J]. Cancer Res Clin , 2015, 27(4) : 228–233, 242. DOI:10.3760/cma.j.issn.1006-9801.2015.04.003 |
| [5] |
王金桃, 高尔生, 程玉英, 等.
内源性雌、孕激素与人乳头瘤病毒在宫颈癌发生中的协同作用研究[J]. 中华流行病学杂志 , 2005, 26(5) : 370–373.
Wang JT, Gao ES, Cheng YY, et al. Analysis on synergistic action between estrogen, progesterone and human papillomaviruses in cervical cancer[J]. Chin J Epidemiol , 2005, 26(5) : 370–373. DOI:10.3760/j.issn.0254-6450.2005.05.017 |
| [6] |
孙雪松, 丁玲, 陈芳, 等.
叶酸缺乏及其与HPV16感染的交互效应对宫颈癌变的影响[J]. 中华流行病学杂志 , 2014, 35(4) : 437–441.
Sun XS, Ding L, Chen F, et al. Effects of folate deficiency with HPV16 infection on cervix cancerization[J]. Chin J Epidemiol , 2014, 35(4) : 437–441. DOI:10.3760/cma.j.issn.0254-6450.2014.04.021 |
| [7] |
王金桃, 霍晓旭, 丁玲, 等.
叶酸与DNA甲基转移酶1在宫颈癌及癌前病变中的作用[J]. 中华流行病学杂志 , 2011, 32(6) : 617–621.
Wang JT, Huo XX, Ding L, et al. Effect of folic acid and DNA methyltransferase 1 on cervical cancer and its precancerous lesion[J]. Chin J Epidemiol , 2011, 32(6) : 617–621. DOI:10.3760/cma.j.issn.0254-6450.2011.06.019 |
| [8] |
陈霄, 王金桃, 白丽霞, 等.
宫颈癌变中叶酸缺乏与脆性组氨酸三联体基因表达异常的相互作用[J]. 中华流行病学杂志 , 2015, 36(4) : 387–392.
Chen X, Wang JT, Bai LX, et al. Interaction between folate deficiency and aberrant expression related to fragile histidine triad gene in the progression of cervical cancerization[J]. Chin J Epidemiol , 2015, 36(4) : 387–392. DOI:10.3760/cma.j.issn.0254-6450.2015.04.020 |
| [9] |
林小娟, 赵霞.
人乳头瘤病毒感染与宫颈上皮内瘤变[J]. 实用妇产科杂志 , 2013, 29(3) : 167–170.
Lin XJ, Zhao X. Human papillomavirus infection and cervical intraepithelial neoplasia[J]. J Pract Obstet Gynecol , 2013, 29(3) : 167–170. DOI:10.3969/j.issn.1003-6946.2013.03.004 |
| [10] |
李霓, 代敏.
中国妇女人乳头状瘤病毒感染的多中心横断面研究[J]. 中华疾病控制杂志 , 2008, 12(5) : 411–415.
Li N, Dai M. Human papillomavirus infection in China:a multi-centric cross-sectional study[J]. Chin J Dis Control Prev , 2008, 12(5) : 411–415. DOI:10.3969/j.issn.1674-3679.2008.05.001 |
| [11] | Walboomers JMM, Jacobs MV, Manos MM, et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J]. J Pathol , 1999, 189(1) : 12–19. DOI:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F |
| [12] | Novakovic P, Stempak JM, Sohn KJ, et al. Effects of folate deficiency on gene expression in the apoptosis and cancer pathways in colon cancer cells[J]. Carcinogenesis , 2006, 27(5) : 916–924. DOI:10.1093/carcin/bgi312 |
| [13] | Lu X, Parvathaneni S, Hara T, et al. Replication stress induces specific enrichment of RECQ1 at common fragile sites FRA3B and FRA16D[J]. Mol Cancer , 2013, 12(1) : 29. DOI:10.1186/1476-4598-12-29 |
| [14] | Schoell WMJ, Janicek MF, Mirhashemi R. Epidemiology and biology of cervical cancer[J]. Semin Surg Oncol , 1999, 16(3) : 203–211. DOI:10.1002/(SICI)1098-2388(199904/05)16:3<203::AID-SSU2>3.0.CO;2-C |
| [15] | Zhang C, Ye LG, Guan SL, et al. Autoantibodies against P16 protein-derived peptides may be a potential biomarker for non-small cell lung cancer[J]. Tumor Biol , 2014, 35(3) : 2047–2051. DOI:10.1007/s13277-013-1271-4 |
| [16] |
马炬明, 施正杰, 陈磊, 等.
抑癌基因p16的表达与胃癌细胞增殖及胃癌患者预后的关系[J]. 中华肿瘤杂志 , 2012, 34(1) : 21–25.
Ma JM, Shi ZJ, Chen L, et al. Expression of multiple tumor suppressor gene p16 and its relationship with prognosis of gastric cancer patients[J]. Chin J Oncol , 2012, 34(1) : 21–25. DOI:10.3760/cma.j.issn.0253-3766.2012.01.005 |
| [17] | Negri G, Egarter-Vigl E, Kasal ABS, et al. p16INK4a is a useful marker for the diagnosis of adenocarcinoma of the cervix uteri and its precursors:an immunohistochemical study with immunocytochemical correlations[J]. Am J Surg Pathol , 2003, 27(2) : 187–193. DOI:10.1097/00000478-200302000-00006 |
| [18] | Murphy JF, Lennon F, Steele C, et al. Engagement of CD44 modulates cyclooxygenase induction, VEGF generation, and proliferation in human vascular endothelial cells[J]. FASEB J , 2005, 19(3) : 446–448. DOI:10.1096/fj.03-1376fje |
| [19] |
余星平, 黄利鸣, 黄益玲, 等.
P16、P15、Smad7及TGF-β1在宫颈癌中的表达及意义[J]. 中国妇幼保健 , 2011, 26(18) : 2813–2815.
Yu XP, Huang LM, Huang YL, et al. Expressions and significances of P16, P15, Smad7 and TGF-β1 in cervical cancer[J]. Mater Child Health Care Chin , 2011, 26(18) : 2813–2815. |
| [20] | Tosun G, Sendag F, Zeybek B, et al. Immunohistochemical expressions of p16 and p53 proteins in cervical intraepithelial neoplasia and in benign cervical tissue[J]. Eur J Gynaecol Oncol , 2010, 31(6) : 627–631. |
 2016, Vol. 37
2016, Vol. 37