文章信息
- 王美霞, 袁满琼, 方亚 .
- Wang Meixia, Yuan Manqiong, Fang Ya .
- 基于离散型地理信息的H7N9流感病毒动态时空传播模式
- Research on spatiotemporal spread of avian influenza A(H7N9) virus based on discrete geographic information
- 中华流行病学杂志, 2016, 37(11): 1491-1496
- Chinese journal of Epidemiology, 2016, 37(11): 1491-1496
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.11.012
-
文章历史
收稿日期: 2016-06-21
2. 361002 厦门, 福建省高校卫生技术评估重点实验室
2. Key Laboratory of Health Technology Assessment of Universities in Fujian Province, Xiamen 361002, China
随着甲型禽流感病毒引起的人畜共患传染性疾病的不断增加,流感病毒的进化和传播引起了越来越多的关注。2013年3月下旬,人类感染H7N9病毒的病例自上海开始陆续在长江三角洲一带的城市被发现,此后还出现两次发病高峰。截至2014年6月4日,人类感染H7N9的病死率高达37.6%[1],两次高峰期后人感染H7N9病例仍散发存在。活禽市场被认为是H7N9的主要传染源所在地[2]。在该病毒流行期间,为控制疫情进一步扩散,大量活禽市场被关闭从而降低了感染风险[3-4]。尽管如此,H7N9病毒因其内部基因的高频率突变[5],有可能在人间大流行。虽然目前尚不支持H7N9病毒能够人传人[6],但是其再次流行的潜在风险及高致病性仍然受到社会的广泛关注。然而,作为新型重组的RNA流感病毒,H7N9病毒的传播模式仍不明确,传播路径亦不清楚。系统进化树分析已逐渐成为探索病原体传播模式的热点工具[7]。通过分析病毒基因序列可以追踪病毒在进化过程中留下的空间传播轨迹[8]。追溯病毒的进化史和空间传播轨迹有利于进一步研究病毒进化动力学[9-10]。针对病毒在空间维度下的传播模式研究主要基于离散型地理信息(discrete state)和连续型地理信息(continuous space)两种。离散型地理信息是指将地理位置的信息作为各自独立的点,据此,病毒在地理位置之间的转移可用马尔科夫链进行模拟。离散型地理信息传播模型可在贝叶斯理论框架下构建,从而达到对病毒的历史传播轨迹进行推断和检验假设[7]。已有研究通过该方法模拟了H5N1和狂犬病毒(RABV)的时间空间动态传播[11-12]。本研究通过收集来自中国的H7N9病毒血凝素(HA)和神经酰胺酶(NA)基因片段的核苷酸序列,基于基因系统进化史,提取病毒在空间进化和传播过程留下的足迹,从时间和空间维度构建H7N9病毒的传播动态模式图,探索病毒的空间传播路径。
资料与方法1.数据来源:选取全球共享禽流感数据倡议组织(GISAID,http://platform.gisaid.org/epi3/frontend)网站发布的中国以人类为宿主的H7N9流感病毒HA和NA基因全长序列数据。共获得347条HA和347条NA基因序列,剔除不完整或重复的序列,保留108条HA和96条NA序列,序列的核苷酸数分别为1 683和1 413。根据中国传染病报告信息管理系统病例报告,共有16个省(自治区、直辖市)报告H7N9禽流感确诊病例。本研究样本来自中国报告H7N9禽流感确诊病例的28个地理位置。除广西和河北外,基本包含了H7N9禽流感所发生的空间位置。各条序列采样地点的经度和纬度信息(省份的经纬度信息以省会城市为准)见表 1。
2.方法:采用BioEdit 7.0软件对下载的核苷酸序列进行ClustalW多序列比对。通过BEAST 1.8.2软件在贝叶斯理论框架下对比对好的核苷酸序列构建离散型地理信息传播模式[13]。模型设定如下:碱基替换模型选用GRT+G+I;先验分布采用均匀分布U(0,0.01)分布;分子时钟模型选用exponential relax clock或strict clock model;同时为每一条序列添加对应的采样地点信息,构建离散型地理信息;选用symmetric substitution model,运用贝叶斯随机搜索变量选择(Bayesian stochastic search variable selection,BBSVS)方法,建立贝叶斯因子(Bayes Factor,BF)检验以推断空间地理间传播可能性,从而构建基于离散型地理信息的时空传播模型;马尔科夫链长为100个百万步长,每10 000步长输出一个结果。通过运行程序获得进化和传播的数据结果。用TreeAnnotator软件对结果中的trees数据文件进行分析,获得最大进化分支可信度(Maximum clade credibility,MCC)系统进化树,用FigTree软件进行展示。为使传播模式可视化,采用SPREAD 1.0.6软件对时空传播模型结果进行分析,生成锁眼标记语言(Keyhole Markup Language,KML)文件以表达流感病毒的空间数据,最终以Google Earth软件以动画形式,直观地追踪H7N9病毒在时间和空间上的传播轨迹。
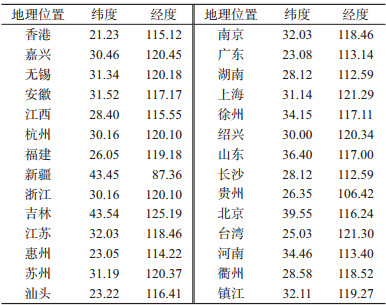
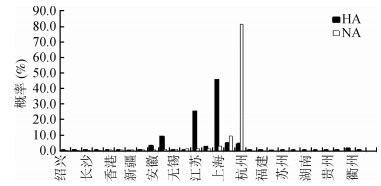
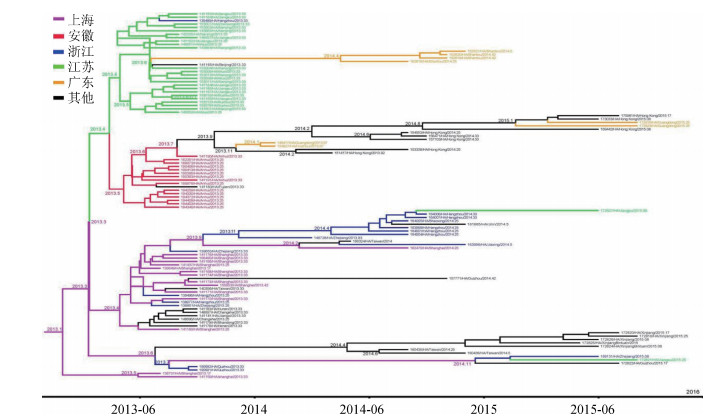
结果1.传播初始地:通过构建离散型地理信息传播模式,获得人类宿主H7N9病毒中的HA及NA基因全长片段,推断得出的感染人类的H7N9病毒初始传播地点概率分布。感染人类的H7N9病毒可能从上海或杭州传出,其概率值分别为44.8%和81.4%,见图 1。浙江地区的H7N9病毒开始进化为可感染人类病毒的时间可追溯到2012年10月,比上海地区的(2013年1月)早。病毒在动物或者人类宿主中经过几个月后,最终分化成各个地区中可以感染人类的禽流感病毒。病毒于2013年3、4月开始向上海市和浙江省邻近的江苏省和安徽省份分化,在广东地区的分化时间大概在2013年5、6月,其他地区病毒的分化时间更晚。见图 2、3。
|
| 图 1 H7N9禽流感病毒HA和NA片段的后验地理位置分布概率BSSVS统计结果 |
|
| 注:横坐标为时间刻度,结点处示病毒分化的时间点;不同颜色示病毒采集地 图 2 H7N9禽流感病毒HA基因片段的MCC系统进化树 |
|
| 注:横坐标为时间刻度,结点处示病毒分化的时间点;不同颜色示病毒采集地 图 3 H7N9禽流感病毒NA基因片段的MCC系统进化树 |
2. H7N9病毒的时空动态传播路径:传播路径的可能性采用BSSVS法,对BF值是否为零进行检验,根据传播路径可以推测出感染人类的H7N9病毒传播初始地可能为上海市或杭州市,并对周边地区产生一定的影响,动态图显示随着时间的推进其波及范围逐渐增大。经过几个月后,在2013年3、4月已经传到了邻近省份安徽、江苏。从动态传播路径可以看出在浙江、安徽及上海等地区发生的禽流感疫情对周边地区影响范围大并存在交叉(圈之间存在重叠),主要是对江苏省的影响。2013年8、9月H7N9病毒传播过程加剧,在3个月内传向10余处地区;最后传向华南华北甚至更远的新疆地区,但是由华东传向新疆的可能性较小(黑色线),见图 4。
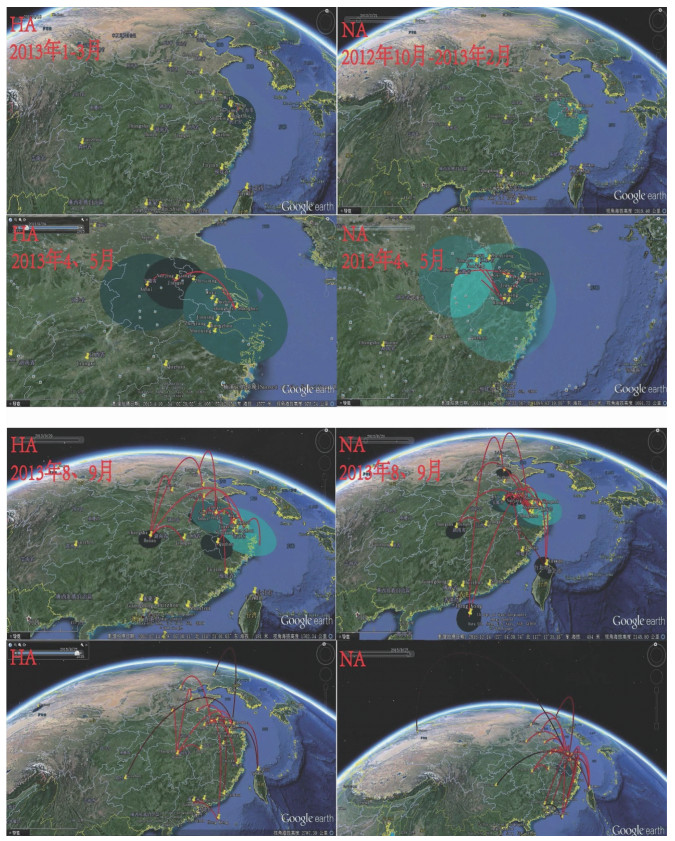
|
| 注:Google Earth软件展示的H7N9病毒时空传播路径动画截图;左上角为时间刻度,地图上展示的是不同时间点,不同地理位置间的传播情况;线条红色越深表示传播的可能性越大(BF非零);圆圈为影响范围,颜色越浅表示对周边的影响力越大 图 4 H7N9禽流感病毒的时空传播路径 |
本研究以H7N9病毒两个主要表面糖蛋白抗原基因核苷酸序列为基础,通过构建离散型地理信息时空传播模型,同时基于时间和空间两个维度探索了H7N9病毒的传播模式。序列信息来源于GISAID数据库,该数据库由共享禽流感数据的科学家国际联盟组建,供研究者探索病毒的进化、传播遗传和致病机制,具有高度的权威性和可靠性。
病毒的抗原漂移使其可以在不同的空间地理位置、不同宿主中进行复制与重组,促使病毒在空间进行传播。本研究模拟出H7N9禽流感病毒空间动态传播路径。根据动态传播模型结果推测出H7N9禽流感病毒可能的初始传播地为上海或杭州市,并追溯到开始向感染人类的病毒进化的具体时间点,为病毒溯源研究提供了线索。有研究利用系统进化树分析初步推断了H7N9禽流感病毒以上海市和杭州市作为初始传播地点之一的传播路径[14],与本研究得出的结果一致。基于全国流感疫情的监测情况也可以获得可能的初始传播地点,但无法获得病毒进化早期所在点或者存在隐性感染的地区,而通过基因进化史(带时间刻度标尺的系统进化树)则可以追溯早期流感病毒可能存在的初始传播地。根据结果推测H7N9禽流感病毒可能的传播轨迹为候鸟迁徙到上海市或浙江省,并与当地禽类携带的禽流感病毒进行重组与突变,最终形成初步可以感染人类的H7N9禽流感病毒,最早开始分化时间可推至2012年10月。在向能够感染人类的高致病性病毒分化期间,H7N9病毒可能在禽类中呈现“沉默感染”,或人类宿主中无症状“隐性感染”,例如儿童[15]。经过几个月后,最终成为具有感染人类能力的新型重配甲型禽流感病,在初始地感染后对周围产生一定影响并向周边省份迅速传播。江苏省作为上海市、浙江省和安徽省交叉影响的区域,有研究通过分析人感染H7N9禽流感的流行病学特征显示江苏省的发病数位居第三,病死率达45.9%,高于全部病例的病死率[16]。但3个省(市)对其影响情况有待进一步的研究。有研究认为不同地理位置之间的传播与活禽销售交易有关,例如浙江省向上海市和江苏省传播[2]。2013年4、5月病毒传向安徽省和江苏省等周围地区,根据流感统计数据,病例报告数以4月居多,尤其是浙江省、上海市和江苏省[17]。同年8、9月的H7N9禽流感病毒传播加剧,3个月内传向10余处地区,并逐步向华南华北地区甚至更远的新疆地区传播。该时间点H7N9流感开始出现第二波疫情,并且较第一次疫情更为严重。杭州市作为H7N9禽流感病毒的初始传播地,病毒进化较慢,向外传播比上海市晚,可能与上海和杭州市不同的社会环境因素(如人口密度)和自然环境因素(如活禽交易)有关[18]。值得注意的是,H7N9病毒从华东地区直接传向新疆地区的可能性较小,而新疆地区一直是我国禽流感高发省之一,新疆地区H7N9流感疫情的发生有可能是基于候鸟-水-家禽的病毒扩散与传播最终导致的[19],有待进一步探索。
综上所述,本研究基于病毒进化史构建的离散型地理信息传播模型,模拟了H7N9流感病毒在时间和空间维度下的历史传播轨迹,以一种可视化的三维形式重现了H7N9病毒在不同地理位置间的传播情况。若能在早期及时收集病毒分离株的信息,可以更准确提供病毒初始传播地、不同地理位置间动态传播及对周围的影响情况,为早期流感疫情的防控及流感病毒溯源研究提供依据。
利益冲突: 无| [1] |
任瑞琦, 周蕾, 向妮娟, 等.
中国内地人感染H7N9禽流感疫情流行病学特征分析[J]. 中华流行病学杂志 , 2014, 35(12) : 1362–1365.
Ren RQ, Zhou L, Xiang NJ, et al. Epidemiological characteristics of human avian influenza A(H7N9) virus infection in China[J]. Chin J Epidemiol , 2014, 35(12) : 1362–1365. DOI:10.3760/cma.j.issn.0254-6450.2014.12.11 |
| [2] | Ling F, Chen E, Liu Q, et al. Hypothesis on the source, transmission and characteristics of infection of avian influenza A (H7N9) virus-based on analysis of field epidemiological investigation and gene sequence analysis[J]. Zoon Public Health , 2015, 62(1) : 29–37. DOI:10.1111/zph.12110 |
| [3] | Yu HJ, Wu JT, Cowling BJ, et al. Effect of closure of live poultry markets on poultry-to-person transmission of avian influenza A H7N9 virus:an ecological study[J]. Lancet , 2014, 383(9916) : 541–548. DOI:10.1016/s0140-6736(13)61904-2 |
| [4] | Yuan J, Lau EHY, Li KB, et al. Effect of live poultry market closure on avian influenza A(H7N9) virus activity in Guangzhou, China, 2014[J]. Emerg Infect Dis , 2015, 21(10) : 1784–1793. DOI:10.3201/eid2110.150623 |
| [5] | Husain M. Avian influenza A (H7N9) virus infection in humans:epidemiology, evolution and pathogenesis[J]. Infect Genet Evol , 2014, 28 : 304–312. DOI:10.1016/j.meegid.2014.10.016 |
| [6] | Yang Y, Zhang Y, Fang L, et al. Household transmissibility of avian influenza A(H7N9) virus, China, February to May 2013 and October 2013 to March 2014[J]. Eurosurveillance , 2015, 20(10) : 21056. DOI:10.2807/1560-7917.ES2015.20.10.21056 |
| [7] | Lemey P, Rambaut A, Drummond AJ, et al. Bayesian phylogeography finds its roots[J]. PLoS Comp Biol , 2009, 5(9) : e1000520. DOI:10.1371/journal.pcbi.1000520 |
| [8] | Holmes EC. The phylogeography of human viruses[J]. Mol Ecol , 2004, 13(4) : 745–756. DOI:10.1046/j.1365-294X.2003.02051.x |
| [9] | Rambaut A, Pybus OG, Nelson MI, et al. The genomic and epidemiological dynamics of human influenza A virus[J]. Nature , 2008, 453(7195) : 615–619. DOI:10.1038/nature06945 |
| [10] | Russell CA, Jones TC, Barr IG, et al. The global circulation of seasonal influenza A(H3N2) viruses[J]. Science , 2008, 320(5874) : 340–346. DOI:10.1126/science.1154137 |
| [11] | Wallace RG, HoDac H, Lathrop RH, et al. A statistical phylogeography of influenza A H5N1[J]. Proc Natl Acad Sci USA , 2007, 104(11) : 4473–4478. DOI:10.1073/pnas.0700435104 |
| [12] | Dibia IN, Sumiarto B, Susetya H, et al. Phylogeography of the current rabies viruses in Indonesia[J]. J Vet Sci , 2015, 16(4) : 459–466. DOI:10.4142/jvs.2015.16.4.459 |
| [13] | Bouckaert RR. Ancestral reconstruction/discrete phylogeography with BEAST 2.0[DB/OL]. (2012-12-13)[2015-09-17]. http://www.beast2.org/wiki/index.php/Tutorials.2012. |
| [14] |
杜鹏程, 于伟文, 陈禹保, 等.
利用系统进化树对H7N9大数据预测传播模型的评估[J]. 中国生物工程杂志 , 2014, 34(11) : 18–23.
Du PC, Yu WW, Chen YB, et al. Evaluation of the H7N9 transmission model predicted by big data by phylogenetic tree[J]. China Biotechnol , 2014, 34(11) : 18–23. DOI:10.13523/j.cb.20141103 |
| [15] |
许可, 鲍倡俊.
人感染H7N9禽流感流行病学研究进展[J]. 江苏预防医学 , 2015, 26(1) : 43–47.
Xu K, Bao CJ. Progresses in the epidemiological study of human infectioned H7N9 avian influenza[J]. Jiangsu J Prev Med , 2015, 26(1) : 43–47. DOI:10.13668/j.issn.1006-9070.2015.01.015 |
| [16] |
任瑞琦.人感染H7N9禽流感流行病学特征及发病危险因素研究[D].北京:中国疾病预防控制中心, 2015.
Ren RQ. Epidemiological characteristics and risk factors of human infection with avian influenza A(H7N9) virus in mainland China[D]. Beijing:Chinese Center for Disease Control and Prevention, 2015. |
| [17] |
蔡春生, 高永清, 何春梅, 等.
中国人感染H7N9禽流感流行特点分析[J]. 浙江农业学报 , 2015, 27(7) : 1168–1172.
Cai CS, Gao YQ, He CM, et al. Epidemiological characteristics of human infections with avian influenza A (H7N9) virus in china[J]. Acta Agric Zhejiang , 2015, 27(7) : 1168–1172. DOI:10.3969/j.issn.1004-1524.2015.07.09 |
| [18] |
郎猛.基于GIS的H7N9预测分析及信息管理系统开发[D].哈尔滨:哈尔滨理工大学, 2015.
Lang M. The design of H7N9 environment factor analysis and information systems research based on GIS[D]. Harbin:Harbin University of Science and Technology, 2015. http://cdmd.cnki.com.cn/article/cdmd-10214-1015576157.htm |
| [19] |
王露, 乃吉米丁·帕哈提, 晁先锋, 等.
新疆喀什地区活禽市场环境与职业暴露人群禽流感感染状况[J]. 职业与健康 , 2016, 32(1) : 121–123.
Wang L, Naijimiding PHT, Chao XF, et al. Live poultry market environment and avian influenza infection status of occupational exposure population in Kashi Area of Xinjiang[J]. Occup Health , 2016, 32(1) : 121–123. DOI:10.13329/j.cnki.zyyjk.2016.0085 |
 2016, Vol. 37
2016, Vol. 37