文章信息
- 孙扬, 王友信, 张杰, 于鑫玮, 盖思齐, 王皓, 董晶, 郭秀花, 王嵬 .
- Sun Yang, Wang Youxin, Zhang Jie, Yu Xinwei, Ge Siqi, Wang Hao, Dong Jing, Guo Xiuhua, Wang Wei .
- 不同性别人群免疫球蛋白G N-糖基化结构谱型比较
- Comparison of gender specific structure profiles of immunoglobulin G N-glycans
- 中华流行病学杂志, 2016, 37(10): 1409-1412
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(10): 1409-1412
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.10.018
-
文章历史
收稿日期: 2016-06-12
2. 100050 北京, 首都医科大学宣武医院体检中心;
3. WA6027 澳大利亚珀斯, 埃迪斯科文大学医学科学院
2. Center for Physical Examination, Xuanwu Hospital, Capital Medical University, Beijing 100050, China;
3. School of Medical Sciences and Health, Edith Cowan University, Joondalup WA6027, Australia
糖基化(Glycosylation)是一种普遍的蛋白质翻译后修饰现象,可发生于绝大多数膜蛋白和分泌蛋白上[1],不仅反映细胞的类型和状态,也参与细胞的生长、分化、凋亡、信号转导和致癌突变等全部生物学行为[2-5]。免疫球蛋白G(IgG) 由于其Fc段297位上高度保守的N-糖基化位点和能够参与免疫炎症反应的功能特点,成为研究蛋白质糖基化的完美模型[6]。全基因组关联研究也显示,单个蛋白质的糖链结构分析更能准确地反映糖基化的功能[7]。已有研究显示,IgG Fc段糖基化修饰的改变可调节其免疫功能[8],主要糖基的增加或缺乏可增加IgG的遗传异质性[9]。如末端半乳糖基化和甘露糖残基可影响补体C1q与IgG的结合,从而加强补体依赖的细胞毒作用;而核心岩藻糖基化的增加能够加强IgG与受体FcγRIIIa的结合,从而降低抗体依赖的细胞毒作用[10]。本研究检测了北京宣武医院669名体检对象的IgG N-糖基结构,并对不同性别人群糖基化水平进行比较,为深入开展疾病与糖基化的关联性研究提供基础资料。
对象与方法1. 研究对象:选取2012年1-6月在北京宣武医院体检的人群,共913人。按照纳入排除标准:排除有呼吸系统、心血管系统、消化系统、泌尿生殖系统及心理疾病的患者;过去2周内未服用过任何药物。最后纳入669人。
2. 样本采集及处理:使用乙二胺四乙酸二钠(EDTA)真空采血管采集研究对象晨起空腹肘部外周静脉血液样本,按照样本编号顺序、平稳地置于离心机内,4 ℃ 3 000 r/min离心10 min,迅速吸取上层血浆样本5 ml(根据离心后上层血浆量而定),分装于5个1.5 ml离心管,置于-80 ℃低温冰箱中保存。
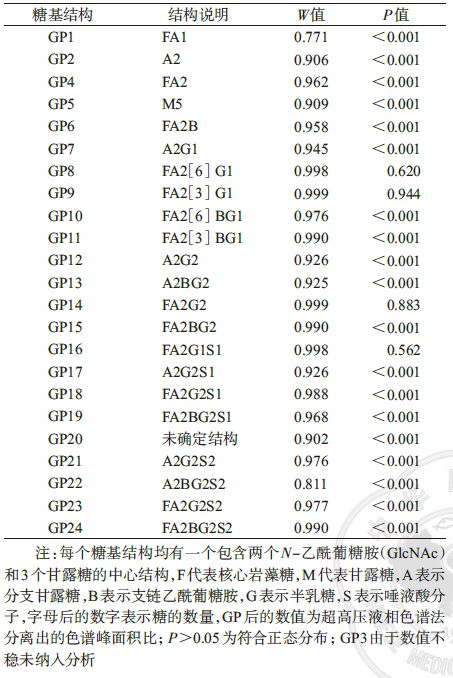
3. 糖基检测:采用Huffman等[11]于2014年发表的超高压液相色谱法串联质谱法,采用2-AB荧光染料对糖链进行标记,并通过超高压液相色谱进行分离。最终分离出24个色谱峰,每个峰代表 1种或多种糖基结构,其结构信息由质谱仪测得。在24个测得的色谱峰基础上,经过计算得到54个糖基衍生结构,每个糖基结构均有一个包含两个N-乙酰葡糖胺(GlcNAc)和3个甘露糖的中心结构,F代表核心岩藻糖,M代表甘露糖,A表示分支甘露糖,B表示支链乙酰葡糖胺,G表示半乳糖,S表示唾液酸分子,字母后的数字表示糖的数量,total表示24个直接测得的糖基结构中所有包含相应糖基的结构浓度之和。
4. 统计学分析:采用SAS 9.4软件进行统计学分析,因为样本量<2 000,采用Shapiro-Wilk W检验对糖基分布进行正态性检验,正态分布资料以x、s描述,不同性别人群IgG糖基化比较采用两独立样本t检验;非正态分布资料以M(QR)描述,不同性别IgG糖基化比较采用非参数检验,检验水准α=0.05。糖基衍生结构均不服从正态分布,组间比较采用非参数检验。
结 果1. 人口学指标:669名健康参与者的平均年龄为(44.23±9.82)岁。其中,男性235人(35.13%),平均年龄为(43.99±11.60)岁;女性434人(64.87%),平均年龄为(44.36±8.72)岁。
2. IgG N-糖基结构谱型分布:对IgG N-糖基结构的分布进行正态性检验,结果显示,只有GP8、GP9、GP14、GP16服从正态分布(P>0.05),见表 1。
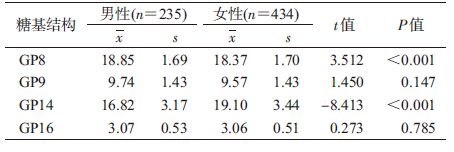
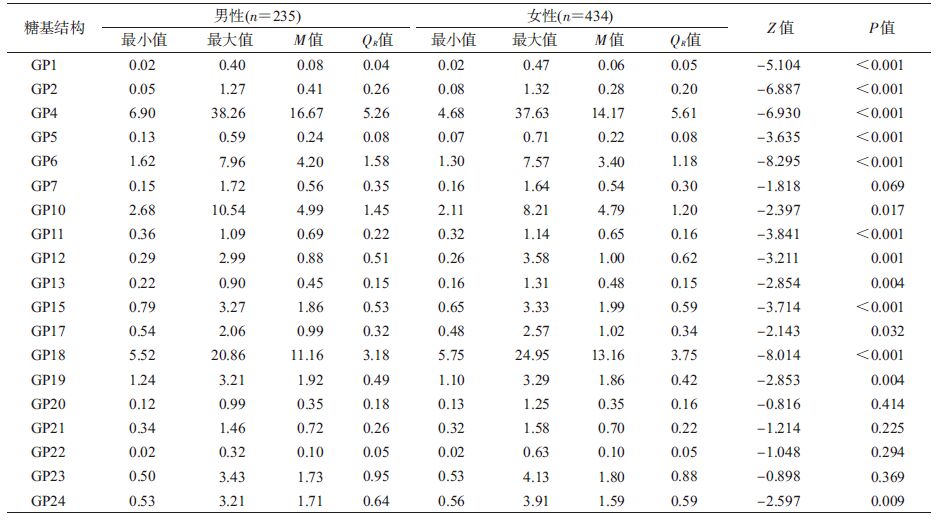
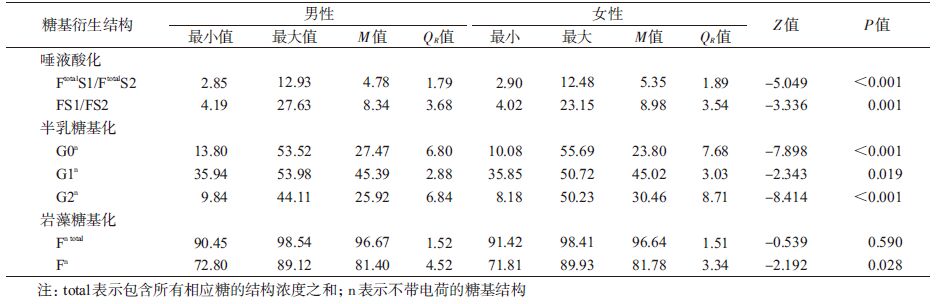
3. N-糖基结构的性别比较:正态分布的IgG N-糖基结构的性别比较见表 2,偏态分布的IgG N-糖基结构的性别比较见表 3。GP1、GP2、GP4、GP5、GP6、GP8、GP10、GP11、GP19、GP24均为男性高于女性;GP12、GP13、GP14、GP15、GP17、GP18为女性高于男性。根据各个色谱峰代表的糖基结构,经过不同公式的计算,得出有生物学意义的糖基衍生结构。女性Fn水平高于男性,差异有统计学意义(P=0.028);女性G0n(P<0.001),G1n(P=0.019)低于男性,而G2n(P<0.001)水平高于男性,差异均有统计学意义;FtotalS1/FtotalS2(P<0.001),女性FS1/FS2 (P=0.001)高于男性,且差异均有统计学意义。见表 4。
本研究显示,在24个液相色谱峰中,只有GP8、 GP9、 GP14、 GP16服从正态分布(P>0.05)。提示在临床应用中,医学参考值范围的计算方法应考虑具体某种糖基含量在人群中分布的不同而不同。
性别比较分析,Fn水平在女性中高于男性,且差异有统计学意义(P=0.028),提示女性核心岩藻糖基化水平高于男性;女性G0n(P<0.001)、G1n(P=0.019)低于男性,而G2n(P<0.001)水平高于男性,差异均有统计学意义,因此,从整体水平上看,女性的半乳糖基化水平高于男性;FtotalS1/FtotalS2(P< 0.001),FS1/FS2(P=0.001)在女性中高于男性,且差异均有统计学意义,提示男性唾液酸化水平高于女性。以上结果表明,IgG N-糖基结构水平可能存在性别决定性,在糖基标志物的发展过程中应加以区别,同时,当研究具体疾病对IgG N-糖基化的发生发展的影响时,性别因素应作为混杂因素进行校正,或进行分层分析。
有研究显示,IgG糖基化可能调节IgG与FcγR受体及C1q补体的结合[12],从而引起机体炎症反应,而大部分疾病都是通过炎症反应的发病机制影响生物体的功能和健康[13]。因此,研究IgG的糖基化对于揭示疾病发生发展过程具有重要意义。
超高压液相色谱串联质谱的方法实现了对IgG N-糖链的高通量检测,为糖基化对疾病发生发展的影响奠定了基础。这些糖基结构的分析为下一步特异糖链的结构解析奠定了基础,并为糖链结构与生物学功能研究提供了新的思路。而不同性别人群糖基结构差异提示蛋白质的糖基化修饰水平可能有性别决定性,这也为大量开展蛋白质糖基化水平检测提供基础信息,从而为疾病的诊断预测提供科学依据。
| [1] | Lauc G. Sweet secret of the multicellular life[J]. Biochim Biophys Acta , 2006, 1760 (4) : 525–526 DOI:10.1016/j.bbagen.2005.12.010 |
| [2] | Hakamata W, Miura K, Hirano T, et al. Identification of a novel glycan processing enzyme with exo-acting β-allosidase activity in the Golgi apparatus using a new platform for the synthesis of fluorescent substrates[J]. Bioorg Med Chem , 2015, 23 (1) : 73–79 DOI:10.1016/j.bmc.2014.11.023 |
| [3] | Ko SY, Lin YP, Lin YS, et al. Advanced glycation end products enhance amyloid precursor protein expression by inducing reactive oxygen species[J]. Free Radic Biol Med , 2010, 49 (3) : 474–480 DOI:10.1016/j.freeradbiomed.2010.05.005 |
| [4] | Gewinner C, Hart G, Zachara N, et al. The coactivator of transcription CREB-binding protein interacts preferentially with the glycosylated form of Stat5[J]. J Biol Chem , 2004, 279 (5) : 3563–3572 DOI:10.1074/jbc.M306449200 |
| [5] | Saroha A, Biswas S, Chatterjee BP, et al. Altered glycosylation and expression of plasma alpha-1-acid glycoprotein and haptoglobin in rheumatoid arthritis[J]. J Chromatogr B , 2011, 879 (20) : 1839–1843 DOI:10.1016/j.jchromb.2011.04.024 |
| [6] | Gornik O, Pavić T, Lauc G. Alternative glycosylation modulates function of IgG and other proteins-implications on evolution and disease[J]. Biochim Biophys Acta , 2012, 1820 (9) : 1318–1326 DOI:10.1016/j.bbagen.2011.12.004 |
| [7] | Lauc G, Essafi A, Huffman JE, et al. Genomics meets glycomics-the first GWAS study of human N-Glycome identifies HNF1α as a master regulator of plasma protein fucosylation[J]. PLoS Genet , 2010, 6 (12) : e1001256 DOI:10.1371/journal.pgen.1001256 |
| [8] | Zauner G, Selman MHJ, Bondt A, et al. Glycoproteomic analysis of antibodies[J]. Mol Cell Proteomics , 2013, 12 (4) : 856–865 DOI:10.1074/mcp.R112.026005 |
| [9] | Li X, Wu J, Ptacek T, et al. Allelic-dependent expression of an activating Fc receptor on B cells enhances humoral immune responses[J]. Sci Transl Med , 2013, 5 (216) : 216ra175 DOI:10.1126/scitranslmed.3007097 |
| [10] | Quast I, Lünemann JD. Fc glycan-modulated immunoglobulin G effector functions[J]. J Clin Immunol , 2014, 34 (Suppl 1) : S51–55 DOI:10.1007/s10875-014-0018-3 |
| [11] | Huffman JE, Pučić-Baković M, Klarić L, et al. Comparative performance of four methods for high-throughput glycosylation analysis of immunoglobulin G in genetic and epidemiological research[J]. Mol Cell Proteomics , 2014, 13 (6) : 1598–1610 DOI:10.1074/mcp.M113.037465 |
| [12] | Zauner G, Selman M, Bondt A, et al. Glycoproteomic analysis of antibodies[J]. Mol Cell Proteomics , 2013, 12 (4) : 856–865 DOI:10.1074/mcp.R112.026005.Epub2013Jan16 |
| [13] | Novokmet M, Lukic E, Vuckovic F, et al. Changes in IgG and total plasma protein glycomes in acute systemic inflammation[J]. Sci Reports , 2014, 4 : 4347 DOI:10.1038/srep04347 |
 2016, Vol. 37
2016, Vol. 37