文章信息
- 付利万, 张美仙, 高利旺, 米杰 .
- Fu Liwan, Zhang Meixian, Gao Liwang, Mi Jie .
- SEC16B基因多态性与体质指数和肥胖关联的Meta分析
- Association between SEC16B polymorphisms and body mass index variation or risk of obesity: a Meta-analysis
- 中华流行病学杂志, 2016, 37(9): 1288-1295
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(9): 1288-1295
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.09.021
-
文章历史
收稿日期: 2016-03-31
近年来,不论发达国家还是发展中国家,肥胖患病率均以惊人速度增长[1]。肥胖是由遗传和环境因素及其相互作用形成的一种复杂疾病[2],运动和饮食等生活行为对肥胖的发生发展起到十分关键的作用,但是环境和生活行为改变最终是通过基因表达的改变而发挥作用[3],因此肥胖遗传易感性的研究不容忽视。SEC16B又称亮氨酸转录调控因子2(LZTR2),定位于1q25.2。欧洲人群的全基因组关联研究(GWAS)于2009年首次发现SEC16B基因rs10913469位点与BMI和肥胖存在关联性[4],即rs10913469位点C等位基因增加肥胖发生风险。随后,由人体测量学性状遗传研究(Genetic Investigation of Anthropometrics Traits,GIANT)协会进行的一项大规模GWAS研究发现SEC16B基因rs543874位点G等位基因与欧洲人群BMI存在正相关[5]。但是,此后来自欧洲、亚洲和其他种族人群的基因多态性与BMI和/或肥胖关系的验证研究结果存在不一致[6-31]。虽然大部分研究显示正向关联,但有些研究[7, 10, 15-16, 19, 30]未发现它们之间的关联性,经基因位点人群验证所需样本量估算,这些研究样本量普遍较小,所以统计效能有限,难以发现相关关系;此外,研究人群的种族、年龄和生活环境不同,可能对结果产生一定影响。基于此,本研究拟采用Meta分析方法,综合定量分析已发表的关于SEC16B基因多态性与亚洲、欧洲、非洲以及美洲地区不同种族人群BMI和肥胖关联性的文献,探讨SEC16B基因多态性与不同种族人群BMI和肥胖的关系。
资料与方法1. 文献检索策略:计算机检索万方数据库(Wanfangdata)、中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)、PubMed、Embase、Web of Science、NIH GWAS catalog数据库。检索时限为2009年至2015年6月。英文检索词:“obesity”OR “obese”、“body mass index”OR“BMI”、“SEC16B” OR “SEC16 homolog B” OR “rs10913469”OR “rs543874”、“polymorphism” OR “polymorphisms”OR “variant” OR “variation”。中文检索词:“肥胖”、“体重指数”、“SEC16B基因或rs10913469或rs543874”、“多态性”。在遗传关联研究中,一些原始研究往往结合Meta分析,因此本文未排除Meta分析文献。此外,还采用文献追溯法,尽可能查全相关文献。
2. 文献纳入和排除标准:纳入标准包括①研究SEC16B基因多态性与BMI和/或肥胖的关联;②横断面研究或病例对照研究;③研究人群或对照人群基因型分布符合Hardy-Weinberg平衡定律(HWE);④统计方法恰当,数据质量可靠,有原始数据或根据报告结果能够推算出效应值(effect size,β)和/或OR值及其95%CI;⑤对同一作者或研究同一人群的重复发表文献,选择样本量较大和较为完整的作为纳入文献。排除标准包括①基因型分布不符合HWE;②家系研究或者双生子研究;③未评估SEC16B基因多态性与BMI或肥胖的关联;④评论、会议摘要或讲座等文献。
3. 文献筛选和信息提取:依据纳入标准,首先通过阅读标题和摘要进行初步筛选,排除不符合要求的文献后,对入选文献通读全文进行再次筛选。对纳入文献使用自拟提取表提取资料,提取信息包括文献特征(第一作者,发表年份,研究对象的种族、年龄及病例组和对照组诊断标准等)以及样本量和研究的单核苷酸多态性(SNP)等。整个过程使用Excel软件,由2名评价者独立完成,不一致处由第三位评价者一起讨论决定。
4. 文献质量评价:根据基因关联性研究报告规范(STREGA)标准进行质量评价[32],内容包括:基因分型成功率与一致率、研究人群基因型分布、研究人群所在队列的分型描述、研究人群(病例对照)的特征、匹配以及分型情况、混杂变量的存在与控制、协变量的调整、多重比较的校正、数据统计方法的报道,共11项,符合一项记1分,总分11分。累计>9分为高质量,≤9分为低质量。
5. 统计学分析:数据分析采用Stata 12.0软件。计算I2统计量对所纳入研究进行异质性检验,P≤0.05为存在异质性,采用随机效应模型合并效应值,否则采用固定效应模型。在加性遗传模型下合并效应值,对于BMI,采用一般倒方差法计算合并 β值及其95%CI;对于肥胖性状,直接合并OR值及其95%CI。按种族、年龄和文献质量进行亚组分析SEC16B基因多态性与肥胖的关联。逐一剔除每一项研究进行敏感性分析。采用漏斗图、Begg’s检验和Egger’s检验评价发表偏倚,P>0.05时无明显发表偏倚。
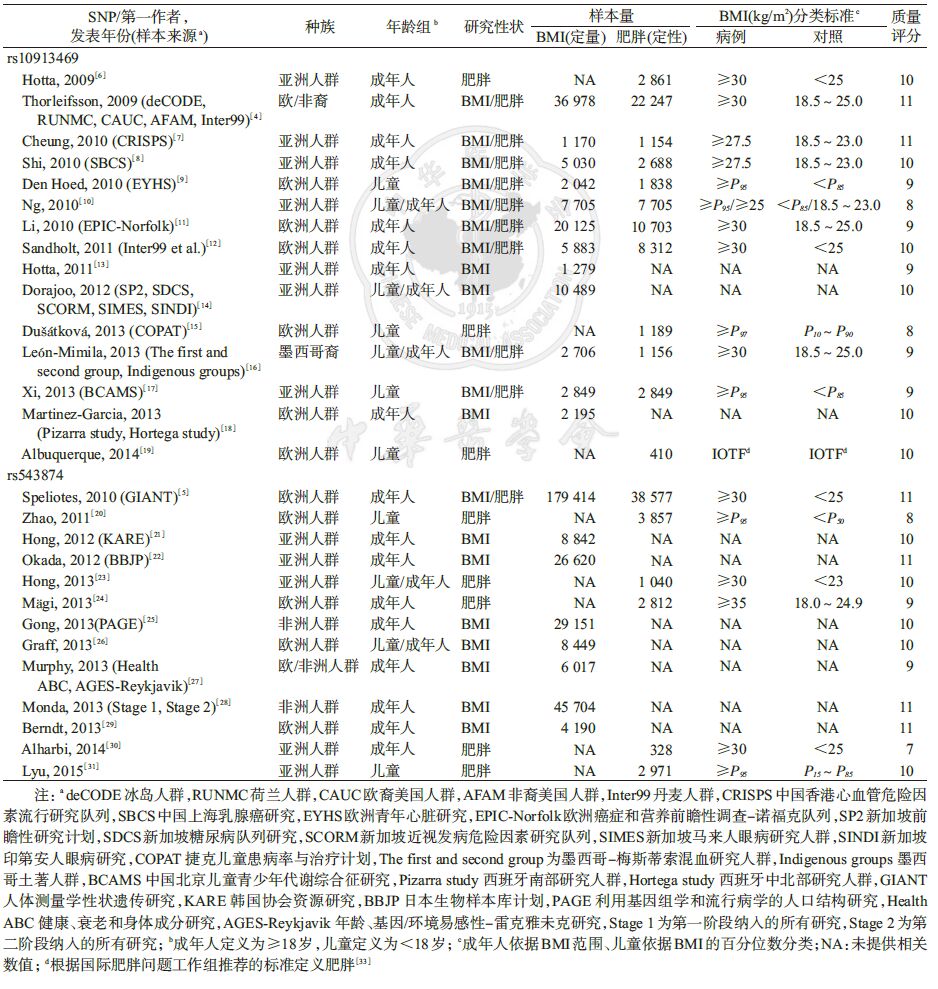
结 果1. 纳入文献概况:文献检索流程见图 1。最终纳入28篇文献,研究对象424 690人,其中rs10913469相关15篇,与BMI和肥胖的关联研究分别纳入98 451人和63 112人;rs543874相关13篇,与BMI和肥胖的关联研究分别纳入308 387人和49 585人。纳入人群包括成年人和儿童,以欧洲和亚洲人种为主,也包括小部分来自非洲和美洲地区的人群。入选文献基本特征、质量评分和涉及的多态性位点见表 1。

|
| 图 1 SEC16B基因多态性与BMI和肥胖关联的 Meta分析文献筛选流程 |
2. SEC16B基因多态性与BMI关联:该基因rs10913469和rs543874效应等位基因分别为C和G。Meta分析显示,2个位点均与BMI显著关联,每改变一个效应等位基因引起的BMI水平改变[β 值(95%CI)]分别为0.04(0.03~0.05)、0.03(0.02~0.04),见图 2。

|
| 图 2 rs10913469(A)和rs543874(B)位点与BMI关联Meta分析森林图(加性遗传模型) |
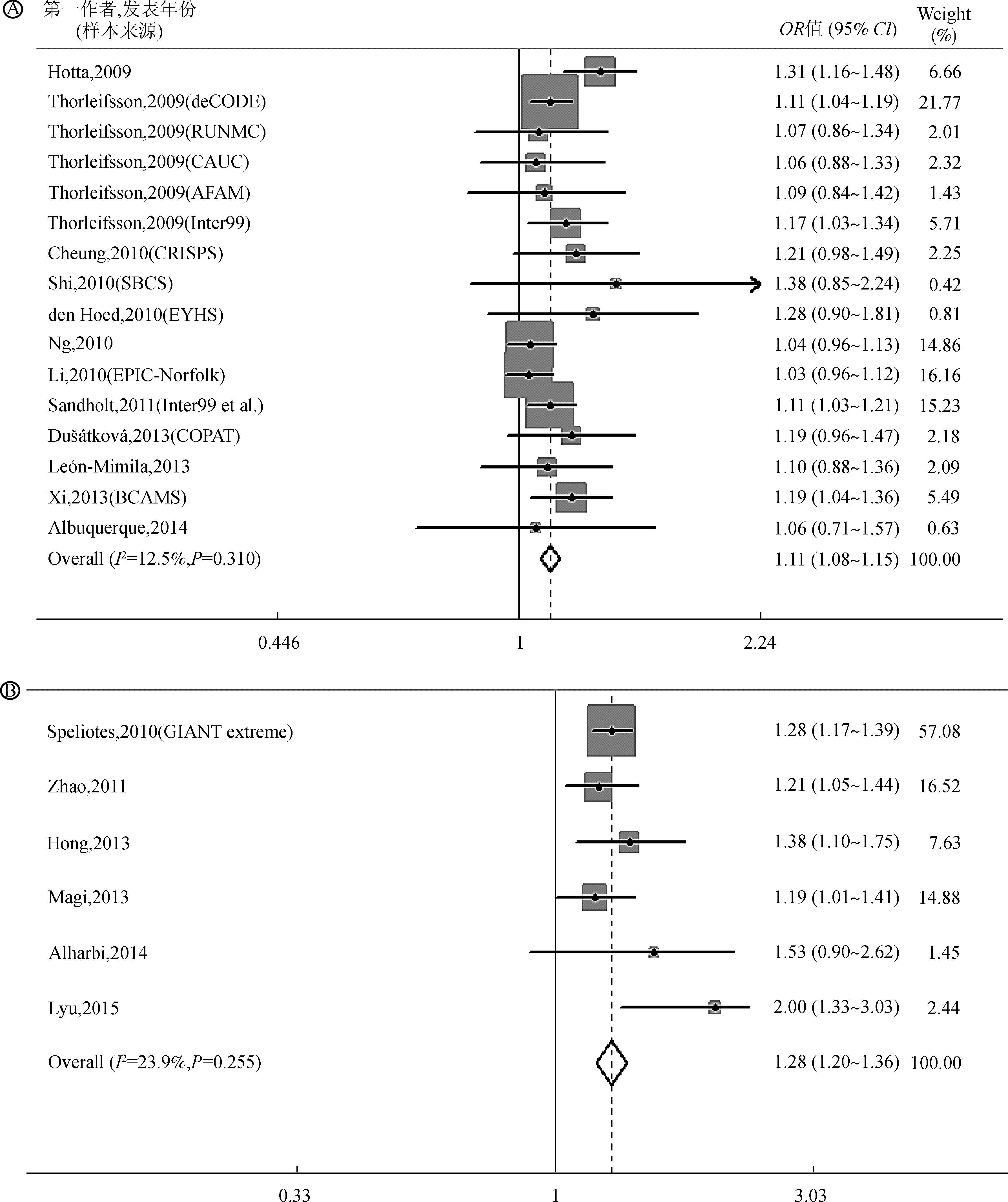
3. SEC16B基因多态性与肥胖关联:Meta分析显示,rs10913469位点C等位基因可增加肥胖的罹患风险,合并OR=1.11(95%CI:1.08~1.15)。同理,rs543874-G亦增加肥胖罹患风险,合并OR=1.28(95%CI:1.20~1.36)。分别对2个位点所有纳入研究进行异质性检验,结果提示纳入研究之间无显著异质性(rs10913469:I2=12.5%,P=0.310;rs543874:I2=23.9%,P=0.255)。见图 3。
|
| 图 3 rs10913469(A)和rs543874(B)位点与肥胖关联Meta分析森林图(加性遗传模型) |
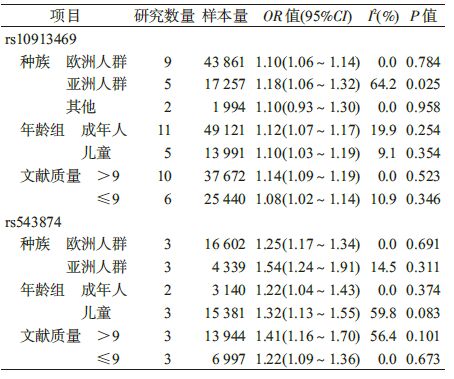
4. 亚组分析:不同种族及年龄组人群中SEC16B基因多态性对肥胖的效应大小可能存在差异,所以对肥胖性状进行了亚组分析。按种族进行亚组分析显示,欧洲人群、亚洲人群以及其他种族人群rs10913469-C等位基因均增加肥胖发生风险,但亚洲人群各研究间具有异质性;rs543874-G等位基因在欧洲人群、亚洲人群均增加肥胖发生风险,并且亚组内纳入研究间未观察到异质性。按年龄组进行亚组分析,成年人和儿童rs10913469-C、rs543874-G均增加肥胖发生风险,且亚组内各研究间未观察到异质性。按文献质量进行亚组分析显示,rs10913469、rs543874位点在高质量文献和低质量文献中均与肥胖发生风险显著相关,不同亚组内未观察到异质性(表 2)。
5. 发表偏倚和敏感性分析:对rs10913469、rs543874位点与BMI和肥胖关联的Meta分析进行发表偏倚的统计学检验,发现Begg’s检验和Egger’s检验均P>0.05,漏斗图对称,无明显发表偏倚,即入选研究具有较好的代表性。在rs10913469和rs543874与BMI和肥胖关联的Meta分析中,分别从各自的文献群中,依次剔除每一篇文献再重新进行综合效应估计,发现每次估计的综合效应均与未剔除文献之前所估计的综合效应非常接近,且结论一致,说明本研究的合并结果稳定性较好。
讨 论在遗传易感性研究中,若研究位点效应等位基因频率(EAF)在不同种族差异过大,则说明遗传效应的种族差异过于显著,一般不适宜综合定量分析。经检索HapMap数据库,亚洲、欧洲和非洲人群rs10913469位点的效应等位基因均为C,EAF分别是0.211、0.275和0.275;rs543874位点的效应等位基因均为G,EAF分别是0.222、0.267和0.225。可见,不同种族人群rs10913469、rs543874位点EAF接近,适宜综合定量分析。
本研究首次通过Meta分析评估SEC16B基因多态性与不同种族人群BMI和肥胖的关系。研究显示,在加性遗传模型下,rs10913469和rs543874均与BMI相关,合并 β值(95%CI)分别为0.04(0.03~0.05)和0.03(0.02~0.04); rs10913469和rs543874也均与肥胖相关,合并OR值(95%CI)分别为1.11(1.08~1.15)和1.28(1.20~1.36)。本研究分析位点rs10913469、rs543874是SEC16B基因最重要的2个多态性位点,其他业已报道的与BMI存在关联位点多与之存在连锁不平衡; 在不同种族人群中,连锁不平衡系数(r2)大部分≥0.7,即rs10913469和rs543874位点对于SEC16B基因多态性具有较好的代表性。因此,本研究显示SEC16B基因多态性与人类BMI和肥胖存在相关性。
基因多态性对肥胖的效应受种族和年龄的影响。在不同种族人群中,rs10913469和rs543874与肥胖关联程度不同。本研究亚洲人群的效应值大于欧洲人群,提示SEC16B基因多态性可能对于亚洲人群肥胖具有较高的发病风险。本文纳入6篇中国汉族人群基因多态性与肥胖关联研究[7-8, 10, 17, 23, 31],其中本团队前期研究发现rs10913469位点与肥胖具有关联性(OR=1.19,95%CI:1.04~1.36)[17];Hong等[23](OR=1.38,95%CI:1.10~1.75)和Lyu等[31](OR=2.00,95%CI:1.33~3.03)研究发现rs543874与肥胖相关;其余中国汉族人群研究则未发现显著关联。结果不一致原因可能与地域、环境因素等有关,进而影响易感基因的表达。此外,人群年龄构成也可影响结果,上述3项研究人群是儿童青少年或成年早期,其余文献以中年人为主,前者受环境影响较小,因此可更准确评估基因多态性与性状间的关联性。按照年龄组进行亚组分析显示,rs10913469和rs543874与肥胖的关联效应在儿童组(rs10913469:OR=1.10,95%CI:1.03~1.19;rs543874:OR=1.32,95%CI:1.13~1.55)与成年人组(rs10913469:OR=1.12,95%CI:1.07~1.17;rs543874:OR=1.22,95%CI:1.04~1.43)均有意义,且亚组内各研究间均未观察到异质性。因此,本次Meta分析显示,rs10913469 和rs543874与儿童和成年人肥胖罹患风险正相关。鉴于目前肥胖的基因多态性研究普遍缺乏饮食情况等环境因素,而对肥胖发病遗传机制的种族和年龄差异,还需开展包括环境和遗传因素的大规模研究予以验证。
SEC16B基因的编码产物包括长链蛋白(Sec16L)和短链蛋白(Sec16S),二者表达于各种组织器官[34],Sec16L和Sec16S在内质网至高尔基体通路中相关蛋白的转运及输出过程发挥重要作用[34-36],所以SEC16B基因可能影响脂肪酶的合成和转录,进而抑制脂肪的分解,导致肥胖发生。此外,SEC16B基因通过下丘脑等组织调节食欲相关多肽的分泌[37],影响食物的摄取量[6],最终也可能导致肥胖。但目前具体的代谢通路以及调节机制还不清楚。
本次Meta分析评估了SEC16B基因多态性与亚洲、欧洲和其他种族人群BMI和肥胖的关系。纳入研究间无明显异质性,结果可信度较高。并且纳入文献质量评价较好,漏斗图、Begg’s检验、Egger’s检验结果显示无明显发表偏倚,经过依次剔除某个文献再重新合并计算,结果非常接近,未改变结论,说明本研究的合并结果稳定性较好。各研究间亚组分析无明显异质性,未改变结论,表明本研究总体质量较好。但本文也存在局限性,如SEC16B基因多态性与BMI和肥胖的关联除了遗传因素,也受环境因素的影响,而纳入研究很少提及暴露的环境因素信息;基因-基因交互作用对遗传效应也可能有影响。
综上所述,SEC16B基因多态性与不同种族人群BMI和肥胖存在关联,rs10913469位点C等位基因和rs543874位点G等位基因可增加肥胖罹患风险。
| [1] | Finucane MM, Stevens GA, Cowan MJ, et al. National,regional,and global trends in body-mass index since 1980:systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants[J]. Lancet , 2011, 377 (9765) : 557–567 DOI:10.1016/S0140-6736(10)62037-5 |
| [2] | Xi B, Wang CY, Wu LJ, et al. Influence of physical inactivity on associations between single nucleotide polymorphisms and genetic predisposition to childhood obesity[J]. Am J Epidemiol , 2011, 173 (11) : 1256–1262 DOI:10.1093/aje/kwr008 |
| [3] | 赵小元, 张美仙, 程红, 等. 肥胖相关基因多态性对儿童期肥胖发生风险及持续状态的影响[J]. 中华流行病学杂志 , 2013, 34 (6) : 560–565 DOI:10.3760/cma.j.issn.0254-6450.2013.06.005 Zhao XY, Zhang MX, Cheng H, et al. Risk of obesity-related gene polymorphism on the incidence and durative of childhood obesity[J]. Chin J Epidemiol , 2013, 34 (6) : 560–565 DOI:10.3760/cma.j.issn.0254-6450.2013.06.005 |
| [4] | Thorleifsson G, Walters GB, Gudbjartsson DF, et al. Genome-wide association yields new sequence variants at seven loci that associate with measures of obesity[J]. Nat Genet , 2009, 41 (1) : 18–24 DOI:10.1038/ng.274 |
| [5] | Speliotes EK, Willer CJ, Berndt SI, et al. Association analyses of 249796 individuals reveal 18 new loci associated with body mass index[J]. Nat Genet , 2010, 42 (11) : 937–948 DOI:10.1038/ng.686 |
| [6] | Hotta K, Nakamura M, Nakamura T, et al. Association between obesity and polymorphisms in SEC16B,TMEM18,GNPDA2,BDNF,FAIM2 and MC4R in a Japanese population[J]. J Hum Genet , 2009, 54 (12) : 727–731 DOI:10.1038/jhg.2009.106 |
| [7] | Cheung CYY, Tso AWK, Cheung BMY, et al. Obesity susceptibility genetic variants identified from recent genome-wide association studies:implications in a Chinese population[J]. J Clin Endocrinol Metab , 2010, 95 (3) : 1395–1403 DOI:10.1210/jc.2009-1465 |
| [8] | Shi JJ, Long JR, Gao YT, et al. Evaluation of genetic susceptibility loci for obesity in Chinese women[J]. Am J Epidemiol , 2010, 172 (3) : 244–254 DOI:10.1093/aje/kwq129 |
| [9] | den Hoed M, Ekelund U, Brage S, et al. Genetic susceptibility to obesity and related traits in childhood and adolescence:Influence of loci identified by genome-wide association studies[J]. Diabetes , 2010, 59 (11) : 2980–2988 DOI:10.2337/db10-0370 |
| [10] | Ng MCY, Tam CHT, So WY, et al. Implication of genetic variants near NEGR1,SEC16B,TMEM18,ETV5/DGKG,GNPDA2,LIN7C/BDNF,MTCH2,BCDIN3D/FAIM2,SH2B1,FTO,MC4R,and KCTD15 with obesity and type 2 diabetes in 7705 Chinese[J]. J Clin Endocrinol Metab , 2010, 95 (5) : 2418–2425 DOI:10.1210/jc.2009-2077 |
| [11] | Li SX, Zhao JH, Luan JA, et al. Cumulative effects and predictive value of common obesity-susceptibility variants identified by genome-wide association studies[J]. Am J Clin Nutr , 2010, 91 (1) : 184–190 DOI:10.3945/ajcn.2009.28403 |
| [12] | Sandholt CH, Vestmar MA, Bille DS, et al. Studies of metabolic phenotypic correlates of 15 obesity associated gene variants[J]. PLoS One , 2011, 6 (9) : e23531 DOI:10.1371/journal.pone.0023531 |
| [13] | Hotta K, Kitamoto T, Kitamoto A, et al. Computed tomography analysis of the association between the SH2B1 rs7498665 single-nucleotide polymorphism and visceral fat area[J]. J Hum Genet , 2011, 56 (10) : 716–719 DOI:10.1038/jhg.2011.86 |
| [14] | Dorajoo R, Blakemore AIF, Sim X, et al. Replication of 13 obesity loci among Singaporean Chinese,Malay and Asian-Indian populations[J]. Int J Obes , 2012, 36 (1) : 159–163 DOI:10.1038/ijo.2011.86 |
| [15] | Dušátková L, Zamrazilová H, Sedláčková B, et al. Association of obesity susceptibility gene variants with metabolic syndrome and related traits in 1443 Czech adolescents[J]. Folia Biol (Praha) , 2013, 59 (3) : 123–133 |
| [16] | León-Mimila P, Villamil-Ramírez H, Villalobos-Comparán M, et al. Contribution of common genetic variants to obesity and obesity-related traits in mexican children and adults[J]. PLoS One , 2013, 8 (8) : e70640 DOI:10.1371/journal.pone.0070640 |
| [17] | Xi B, Shen Y, Reilly KH, et al. Sex-dependent associations of genetic variants identified by GWAS with indices of adiposity and obesity risk in a Chinese children population[J]. Clin Endocrinol , 2013, 79 (4) : 523–528 DOI:10.1111/cen.12091 |
| [18] | Martínez-García F, Mansego ML, Rojo-Martínez G, et al. Impact of obesity-related genes in Spanish population[J]. BMC Genet , 2013, 14 : 111 DOI:10.1186/1471-2156-14-111 |
| [19] | Albuquerque D, Nóbrega C, Rodríguez-López R, et al. Association study of common polymorphisms in MSRA,TFAP2B, MC4R,NRXN3,PPARGC1A,TMEM18,SEC16B,HOXB5 and OLFM4 genes with obesity-related traits among Portuguese children[J]. J Hum Genet , 2014, 59 (6) : 307–313 DOI:10.1038/jhg.2014.23 |
| [20] | Zhao JH, Bradfield JP, Zhang HT, et al. Role of BMI-associated loci identified in GWAS meta-analyses in the context of common childhood obesity in European Americans[J]. Obesity , 2011, 19 (12) : 2436–2439 DOI:10.1038/oby.2011.237 |
| [21] | Hong KW, Oh B. Recapitulation of genome-wide association studies on body mass index in the Korean population[J]. Int J Obes , 2012, 36 (8) : 1127–1130 DOI:10.1038/ijo.2011.202 |
| [22] | Okada Y, Kubo M, Ohmiya H, et al. Common variants at CDKAL1 and KLF9 are associated with body mass index in east Asian populations[J]. Nat Genet , 2012, 44 (3) : 302–306 DOI:10.1038/ng.1086 |
| [23] | Hong J, Shi J, Qi L, et al. Genetic susceptibility,birth weight and obesity risk in young Chinese[J]. Int J Obes , 2013, 37 (5) : 673–677 DOI:10.1038/ijo.2012.87 |
| [24] | Mägi R, Manning S, Yousseif A, et al. Contribution of 32 GWAS-Identified common variants to severe obesity in European adults referred for bariatric surgery[J]. PLoS One , 2013, 8 (8) : e70735 DOI:10.1371/journal.pone.0070735 |
| [25] | Gong J, Schumacher F, Lim U, et al. Fine Mapping and Identification of BMI Loci in African Americans[J]. Am J Hum Genet , 2013, 93 (4) : 661–671 DOI:10.1016/j.ajhg.2013.08.012 |
| [26] | Graff M, Ngwa JS, Workalemahu T, et al. Genome-wide analysis of BMI in adolescents and young adults reveals additional insight into the effects of genetic loci over the life course[J]. Hum Mol Genet , 2013, 22 (17) : 3597–3607 DOI:10.1093/hmg/ddt205 |
| [27] | Murphy RA, Nalls MA, Keller M, et al. Candidate gene association study of BMI-related loci,weight,and adiposity in old age[J]. J Gerontol A Biol Sci Med Sci , 2013, 68 (6) : 661–666 DOI:10.1093/gerona/gls227 |
| [28] | Monda KL, Chen GK, Taylor KC, et al. A meta-analysis identifies new loci associated with body mass index in individuals of African ancestry[J]. Nat Genet , 2013, 45 (6) : 690–696 DOI:10.1038/ng.2608 |
| [29] | Berndt SI, Gustafsson S, Mägi R, et al. Genome-wide meta-analysis identifies 11 new loci for anthropometric traits and provides insights into genetic architecture[J]. Nat Genet , 2013, 45 (5) : 501–512 DOI:10.1038/ng.2606 |
| [30] | Alharbi KK, Richardson TG, Khan IA, et al. Influence of adiposity-related genetic markers in a population of Saudi Arabians where other variables influencing obesity may be reduced[J]. Dis Markers , 2014, 2014 : 758232 DOI:10.1155/2014/758232 |
| [31] | Lyu D, Zhang DD, Wang H, et al. Genetic variations in SEC16B,MC4R,MAP2K5 and KCTD15 were associated with childhood obesity and interacted with dietary behaviors in Chinese school-age population[J]. Gene , 2015, 560 (2) : 149–155 DOI:10.1016/j.gene.2015.01.054 |
| [32] | Little J, Higgins JPT, Ioannidis JPA, et al. STrengthening the REporting of Genetic Association studies (STREGA):an extension of the STROBE statement[J]. Ann Intern Med , 2009, 150 (3) : 206–215 DOI:10.7326/0003-4819-150-3-200902030-00011 |
| [33] | Cole TJ, Bellizzi MC, Flegal KM, et al. Establishing a standard definition for child overweight and obesity worldwide:international survey[J]. BMJ , 2000, 320 (7244) : 1240 DOI:10.1136/bmj.320.7244.1240 |
| [34] | Bhattacharyya D, Glick BS. Two mammalian Sec16 homologues have nonredundant functions in endoplasmic reticulum (ER) export and transitional ER organization[J]. Mol Biol Cell , 2007, 18 (3) : 839–849 DOI:10.1091/mbc.E06-08-0707 |
| [35] | Watson P, Townley AK, Koka P, et al. Sec16 defines endoplasmic reticulum exit sites and is required for secretory cargo export in mammalian cells[J]. Traffic , 2006, 7 (12) : 1678–1687 DOI:10.1111/j.1600-0854.2006.00493.x |
| [36] | Yonekawa S, Furuno A, Baba T, et al. Sec16B is involved in the endoplasmic reticulum export of the peroxisomal membrane biogenesis factor peroxin 16(Pex16) in mammalian cells[J]. Proc Natl Acad Sci USA , 2011, 108 (31) : 12746–12751 DOI:10.1073/pnas.1103283108 |
| [37] | Willer CJ, Speliotes EK, Loos RJF, et al. Six new loci associated with body mass index highlight a neuronal influence on body weight regulation[J]. Nat Genet , 2009, 41 (1) : 25–34 DOI:10.1038/ng.287 |
 2016, Vol. 37
2016, Vol. 37