文章信息
- 汪启兵, 许凡萍, 魏超贤, 彭娟, 董旭东 .
- Wang Qibing, Xu Fanping, Wei Chaoxian, Peng Juan, Dong Xudong .
- 人体内自由基的研究进展
- Research progress on free radicals in human body
- 中华流行病学杂志, 2016, 37(8): 1175-1182
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(8): 1175-1182
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.08.024
-
文章历史
收稿日期: 2016-01-21
2. 650500 昆明理工大学环境科学与工程学院
2. Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China
自由基(free radicals)是指含有不成对电子的离子、原子、原子团或分子。正常情况下,人体内自由基的产生和清除处于动态平衡状态,是人体内不可或缺的物质,在有氧呼吸电子传递、细胞信号传导[1]和基因调控[2]、诱导细胞增殖和凋亡、维持内环境稳态、维持个体的正常生长发育及抵抗细菌、病毒和癌症等方面起着重要作用。然而,当肌体损伤引发炎症反应、发生病变或受到外界环境因素影响导致人体内自由基平衡被打破时,多余的自由基就会攻击生物膜,引发一系列的自由基链反应,引起体内蛋白质、酶、脂质和核酸的氧化损伤,影响体内正常的新陈代谢,从而引发疾病[3]。自由基既能在人体的生理、病理条件下产生,也能通过其氧化应激作用影响人体的生理病理过程,它是人体内最直接、最有效的杀手[4]。本文综述了人体内常见自由基的种类、寿命、来源、检测方法、与环境污染物和人类健康的关系及其清除机制,总结近年人体内自由基研究的缺陷与不足,以期为今后的研究提供指导意义。
1. 人体内自由基的种类、寿命:人体内自由基主要包括半醌类自由基,氧自由基,碳、氮、硫中心自由基,其中最常见、所占比例最大(95%以上)、研究最多的是氧自由基,包括超氧阴离子自由基(O2·-)、羟自由基(·OH) 、氢过氧自由基(HO2·)和脂氧自由基(LO·)、脂过氧自由基(LOO·)、一氧化氮自由基(NO·)等[5]。其中NO·和一氧化氮阳离子(NO+)、一氧化氮阴离子(NO-)、过氧亚硝酸盐离子(ONOO-)等含氮的高活性物质又称为活性氮(reactive nitrogen species,RNS),而过氧化氢(H2O2)、单线态氧(1O2)、次氯酸(HOCl)及其他含氧自由基等性质活泼的含氧物质又统称为活性氧(reactive oxygen species,ROS)[6]。
羟自由基(·OH)是已知的人体内活性最强、寿命最短的自由基,其寿命大约是10-9 s[4, 7],超氧阴离子自由基(O2·-)是人体内最早发现、最“原始”的自由基,其他大部分自由基均由其歧化或与其他物质反应生成[8],其寿命大约是10-6 s,单线态氧有两种存在形态,一种寿命约为4.2 μs,一种寿命不足10-10 s[9]。HO2·的寿命可达17 s[10],半醌自由基、苯氧自由基、环戊二烯基自由基等寿命相对较长,可达几十分钟至几十天,因其寿命长,进入人体后能引发自由基链反应,产生二次自由基,被称为环境持久性自由基[11-13]。其他自由基普遍具有反应活性高、寿命短、传统方法难测定的特点,因此大多数自由基的寿命尚不清楚。
2. 人体内自由基的来源:人体内自由基可分为内源性自由基和外源性自由基。内源性自由基主要来源于线粒体有氧呼吸电子传递途径、NADPH氧化酶途径、黄嘌呤-黄嘌呤氧化酶途径、精氨酸-NO合成酶途径和功能紊乱的内皮NO合成酶途径等[14]。此外,体内的过氧化物酶体、吞噬细胞等也会产生自由基[10],当人体内部发生炎症反应、缺血、心肌梗死,以及脑血栓发作、过量运动、长时间处在富氧、缺氧环境、不健康饮食习惯、心里因素等都会导致自由基过量产生[15]。外源性自由基主要来自于环境污染(如光化学污染、大气颗粒物、环境烟草烟雾、环境持久性自由基、重金属、过渡金属、工业溶剂、农药等)和药物使用(硝酸甘油、扑热息痛、氟烷、部分抗癌剂、抗菌剂等)。此外,吸烟、酗酒、长时间日晒、辐射及紫外照射等也会打破体内氧化/抗氧化平衡,产生氧化应激[10]。
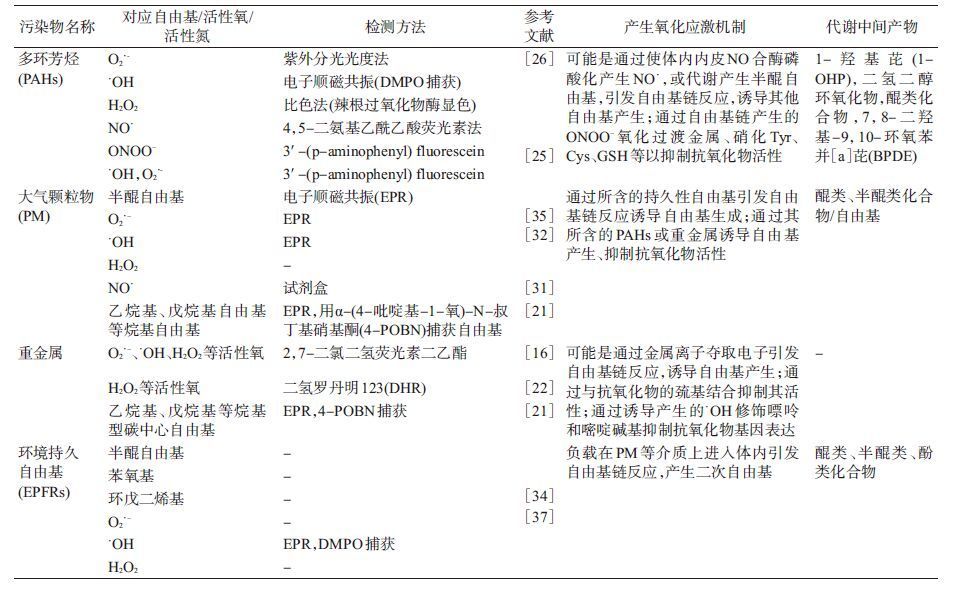
3. 自由基与环境污染物间的关系:
(1)自由基与重金属的关系:重金属是环境中广泛存在的污染物,动物实验和人体内的研究均发现重金属暴露可诱导体内乙烷基自由基、戊烷基自由基等碳中心自由基和O2·-、·OH、H2O2等ROS的产生[16-22],抑制谷胱甘肽S-转移酶(GST)、过氧化氢酶(CAT)、谷胱甘肽(GSH)等抗氧化物的活性和GST、CAT等抗氧化物的基因表达[23]。但重金属诱导自由基产生、抑制抗氧化物基因表达的机制尚不清楚。而重金属能与酶的巯基结合[16],则可能是其抑制抗氧化酶活性的原因之一。然而,并不是所有浓度的重金属都能抑制抗氧化酶的活性,诱导产生氧化应激。Singh等[19]研究胎盘中铅(Pb)、镉(Cd)、铁(Fe)、锌(Zn)、铜(Cu)等重金属与氧化应激及早产间的关系时,发现早产组中脂质过氧化物丙二醛(MDA)和Pb、Cd含量明显高于正常组,而GSH和Fe、Zn、Cu水平则显著低于正常组,说明Pb、Cd能诱导氧化应激产生,而适当高浓度的Zn、Cu则可能有助于防御氧化应激。这可能是由于超氧化物歧化酶1(铜锌超氧化物歧化酶,SOD1)需要适量的Cu、Zn以维持酶活性的原因。
(2)自由基与多环芳烃的关系:多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是一类具有代表性和持久污染能力的环境污染物,由于其能在各种介质中迁移,使其广泛存在于水、土壤、沉积物和空气等环境介质及蔬菜、茶叶、咖啡、水产品、烧烤及油炸食品和人体中。大多数PAHs都属致癌物质,多环芳烃致癌的第一步是形成PAH-DNA加合物,PAH-DNA加合物的形成过程涉及到自由基的产生和清除。研究发现PAHs进入体内后能抑制抗氧化物的活性、诱导肌体产生O2·-、·OH、NO·、ONOO-、H2O2等ROS或RNS[24-27]。这可能是由于部分PAHs(如苯并[a]芘,BaP)暴露可使某些细胞内皮一氧化氮合酶(eNOS)部分位点的丝氨酸、苏氨酸残基磷酸化,NO合成量增加[25],而NO容易被体内的O2或O2·-氧化生成ONOO-,ONOO-一方面能引发自由基链反应,进一步诱导NO·、·OH 、O2·-等ROS或RNS产生,另一方面可以氧化过渡金属[28],硝化酪氨酸(Tyr)、半胱氨酸(Cys)、谷胱甘肽(GSH)及赖氨酸(Lys)、组氨酸(His)、精氨酸(Arg)等芳香族氨基酸[29]。Tyr是酶正常发挥功能和信号传导的介质[30],GSH是非酶抗氧化物,过渡金属是部分金属酶的催化中心,Cys、Lys则是大部分酶的活性中心氨基酸。这可能是PAHs抑制抗氧化物活性的原因之一。同时,PAHs在人体内可经细胞色素P450(CYP450)酶系代谢生成酚类或醌类化合物,这些化合物不稳定,容易失去电子或基团生成半醌自由基,引发自由基链反应产生O2·-、·OH、ONOO-等自由基及其衍生物。
(3)自由基与大气颗粒物的关系:大气颗粒物(particulate matters,PM)是空气污染的主要成分和指标,大量研究发现PM暴露可诱导肌体产生半醌自由基、·OH、O2·-等氧自由基和乙烷基自由基、戊烷基自由基等碳中心自由基,抑制相关抗氧化物活性,从而产生氧化应激[22, 31-34]。PM诱导自由基产生、抑制抗氧化物活性可能是由于其含有半醌自由基、苯氧自由基、环戊二烯基自由基等环境持久性自由基(EPFRs),EPFRs可诱导产生二次自由基[35-36]。也可能是由于其主要成分为PAHs和重金属[37-38],PAHs和重金属可诱导自由基产生、抑制抗氧化物活性。
除此之外,广泛应用于电子、医疗产品及指甲油、香水等个人保健产品和商业产品中的塑料增塑剂邻苯二甲酸酯(盐)类化合物,广泛运用于香水、香皂、化妆品中的合成麝香类化合物(SMCs),杀虫剂、抗菌剂、电子垃圾产品中的多氯联苯(PCBs)、多溴联苯(PBBs)、多溴联苯醚(PBDEs),以及有机氯农药(OCPs)等污染物进入体内也会诱导氧化应激的产生[39-45],但对其机制研究较少。本文总结了部分具有代表性环境污染物与自由基的关系,详见表 1。
4. 人体内自由基的检测方法:由于自由基反应活性高、寿命短、人体内组分复杂,人体内自由基检测较为困难。目前人体内自由基的检测方法主要分为间接检测法和直接检测法。
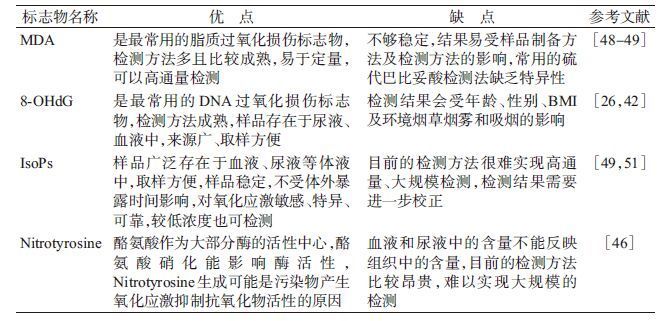
(1)间接检测法:间接检测法是人体内自由基检测的常用方法,主要包括检测人体内自由基清除酶的活性或/和人体内自由基与蛋白质、脂质、核酸等生物大分子反应生成的中间产物含量及总抗氧化能力(TAC)等来间接的反映人体内自由基的含量。人体内自由基清除酶(抗氧化酶)主要包括超氧化物歧化酶(SOD)、CAT、及谷胱甘肽过氧化物酶(GSH-Px)、GST、谷胱甘肽还原酶(Gred)等[32, 46]。其中,SOD催化超氧阴离子自由基(O2·-)歧化为过氧化氢(H2O2)、单线态氧(1O2)等ROS,而CAT和GSH-Px协同催化H2O2分解成H2O和O2。人体内自由基与生物大分子反应的中间产物主要包括MDA、8-羟基-2’-脱氧鸟苷(8-OHdG)、氧化低密度脂蛋白(OxLDL)、异前列腺素(IsoPs)、硝基酪氨酸(Nitrotyrosine)、硫-亚硝基-半胱氨酸(S-nitroso-cysteine)、硫-亚硝基-谷胱甘肽(S-nitroso-glkuujutathione)、羰基蛋白等。其中,丙二醛是脂质过氧化作用中产生的一种剧毒物质,它能使Lys残基与Lys残基发生交联反应生成Lys-Lys交叉链[47],能结合细胞膜上的蛋白质、酶或者受体使其功能发生改变最终导致细胞损伤,甚至坏死。是目前反映肌体氧化损伤最具代表性的指标,可作为氧化应激的生物标志物[48-49],但其不够稳定、特异性受检测方法影响[49-50]。8-OHdG存在于血液、尿液中,取样方便,是广泛使用的DNA氧化损伤标志物,但会受年龄、BMI和吸烟等因数的影响[25, 42]。OxLDL、Nitrotyrosine、S-nitroso-cysteine和S-nitroso-glutathione则是蛋白质氧化损伤的标志物。脂质过氧化损伤标志物IsoPs具有敏感、特异、可靠、化学性质稳定,样本暴露不受影响,检测限低等优点,可作为脂质过氧化的可靠指标,但目前的检测方法无法实现高通量检测[49, 51]。本文归纳总结了部分常用生物大分子氧化标志物的优缺点,详见表 2。
(2)直接检测法:人体内自由基的直接检测法主要包括电极法,毛细管电泳法[7],荧光、紫外分光光度法[16, 25],电子自旋共振法(electron apin resonance,ESR)又称电子顺磁共振法(electron paramagnetic resonance,EPR)等。电极法成本高、操作困难、广谱性差,使用少。毛细管电泳法报道较少,且是通过检测自由基与水杨酸等化合物反应的产物来间接检测自由基。荧光、紫外分光光度法主要是通过自由基与荧光素或其他物质反应,引起颜色变化,然后通过吸光度来间接反映自由基浓度,目前主要用来检测O2·-、NO·、ONOO-、H2O2 等自由基或ROS、RNS。EPR法主要用来检测·OH 、半醌自由基、烷基自由基等自由基,使用相对广泛[6, 22, 31, 35, 52-53],但仪器昂贵,需要溶解性好、反应活性高、捕获能力强、毒性低、生成物稳定的自由基捕获剂,目前常用的自由基捕获剂有水杨酸、二甲基亚砜(DMSO)、苯基叔丁基氮氧化合物(PBN)、1-氧基-4-吡啶基-N-叔丁基氮氧化合物(POBN)、5,5-二甲基吡咯啉-1-氧化物(DMPO)、3,3,5,5-四甲基 1-吡咯啉-N-氧化物(TEMPO)等。
5. 自由基与人体健康的关系:自由基是一把双刃剑,适量的自由基及其衍生物具有调节血管舒张、监测氧分压、促进红细胞生成素产生、保障不同生理状态下细胞信号在细胞膜受体间的传递、维持人体正常新陈代谢等功能[3]。然而,当体内自由基产生过多或/和清除过少时都会打破人体内自由基平衡,使多余的自由基攻击人体内的生物膜,造成体内脂质、蛋白质、核酸、酶等生物大分子的氧化损伤,破坏细胞结构和功能完整,从而影响人体正常新陈代谢、产生疾病。目前已证实自由基氧化损伤与衰老及多种疾病相关。
(1)自由基与神经退行性疾病:神经退行性疾病是指由慢性进行性神经组织退行性变性而引发的疾病,病理表现为脑和/或脊髓发生神经元退行变性、丢失。神经退行性疾病主要包括帕金森病(Parkinson’s disease,PD)、阿尔茨海默病(Alzheimer’s disease,AD)、肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)、亨廷顿病(Huntington disease,HD)和中风等。神经退行性疾病的发病受遗传、环境等多因素的影响,但研究发现自由基增多、脂质、蛋白质、核酸过氧化、线粒体功能紊乱、钙稳态失调、氧化应激增强是其发病的主要原因。一方面,是由于脑的结构和功能导致,脑体积小、质量轻(约1 300 g)、耗氧量大(约消耗人体总耗氧量20%~30%的氧)、抗氧化酶含量低,不饱和脂肪酸、氧化还原过渡金属含量高[10, 54],使其成为自由基/ROS或RNS攻击的重要靶器官;另一方面,自由基或其衍生物可以氧化神经元细胞膜上的磷脂和其他不饱和脂肪酸、降低细胞膜上结合酶的活性和损伤膜受体,导致细胞膜的膜电位降低、刚性增强、流动性减弱,对钠、钙等离子的渗透性增强,使细胞膜的脂质-蛋白质或蛋白质-蛋白质发生交联[54]。钙离子渗透性增强使细胞内钙离子浓度升高,胞内钙离子浓度的增高不但可以激活胞内钙离子依赖酶,进一步诱导O2·-、NO等ROS或RNS的生成,产生氧化应激,而且还能诱导线粒体产生活性氧,氧化损伤线粒体DNA,使线粒体结构和功能损伤,最终导致神经元细胞发生退行性病变或凋亡,引发神经退行性疾病。
(2)自由基与心脑血管疾病:血管壁富含内皮细胞、平滑肌细胞和巨噬细胞,是体内自由基/ROS或RNS的重要来源,同时也是自由基/ROS或RNS攻击的潜在目标。当自由基产生/清除不平衡时,多余的自由基就会攻击血管内皮细胞膜,使血管壁弹性减弱、刚性增强、血管内皮功能紊乱,导致血管扩张因子NO生物利用度降低、白细胞黏附、血小板黏附和聚集并减少内膜增生,进一步增强氧化应激、破坏血管结构和功能完整性、引发心血管疾病。同时,多余的自由基还会氧化血液中的脂质,抑制前列环素合成,进一步加强血小板聚集黏附,从而导致动脉粥样硬化、高血压、缺血性心脏病等心脑血管疾病的发生[55-56]。
(3)自由基与癌症:自由基/ROS一方面可以修饰、删除DNA碱基,使染色体重排,使DNA碱基发生羟化、甲基化、颠换、缺失等,导致某些基因丧失功能、错误复制或表达;另一方面,自由基/ROS可以修饰、改变蛋白质的结构和功能,使DNA修复系统丧失功能,从而使错误的基因表达,这可能激活原癌基因、抑制肿瘤抑制基因,引发癌症[57]。目前已证实自由基或氧化应激与膀胱癌、前列腺癌、肺癌、乳腺癌等癌症疾病息息相关[10, 57]。
(4)自由基与生育及病理妊娠:研究发现,氧化应激能使男性精子数量减少、活性降低,影响男性的生殖能力[58]。同时,还会影响卵巢的内分泌功能,影响卵母细胞的发育、成熟、卵泡闭锁,参与窦卵泡的凋亡,影响卵母细胞的质量[59-61],影响卵母细胞的受精和胚胎着床,影响体外受精-胚胎移植(IVF-ET)的成功率。引发不明原因的不孕、多囊卵巢综合征、子宫内膜异位症等与生育相关的疾病[30, 62]。同时,氧化应激还与自然流产、复发流产、子痫前期、妊娠期高血压、糖尿病等妊娠并发症和胎儿早产、低出生体重、胎儿器官发育迟缓/畸形、胎儿生长受限、巨大儿等不良出生结局息息相关[63-64]。Lane等[65]的研究还发现,母亲-胎儿间的氧化损伤密切相关,且胎儿体内(脐血)的脂质过氧化物含量显著高于母体含量,说明氧化损伤信息可能在母胎间传递,而且,氧化损伤的程度在母体和胎儿是不同的。该研究同时关注了脂质、蛋白质、核酸氧化损伤的生物标志物在母亲-胎儿间的经胎盘传递,但由于其研究DNA氧化损伤标志物的含量时受样本量的影响,只检测了胎盘中的8-OHdG含量,缺乏母血-胎盘-脐血的配对样本。不能很好的说明氧化损伤信息(尤其是遗传信息)在母胎间的传递。
此外,研究表明自由基或氧化应激还与糖尿病,系统性红斑狼疮,骨质增生异常综合症,风湿性关节炎、白内障、哮喘、小儿肺炎,缺血再灌注损伤等疾病相关[10, 66-69]。
虽然,目前对自由基及其所产生的氧化应激与人体健康方面的研究已取得了一定的成果,自由基/氧化应激引发衰老、心血管疾病、神经退行性疾病的可能途径也相对明了,但也还存在一些不足,主要表现为自由基/氧化应激与人体健康方面的大部分研究还停留在用已发生的病变或不良反应来逆向的推测其与自由基或氧化应激的关系,而并不是用自由基/氧化应激的产生机制、可能引发的反应、造成的损伤来正向的推测其健康风险,且大部分研究只定性,没定量。图 1总结了自由基/氧化应激破坏细胞结构和功能完整的可能途径及其对人体健康的影响。

|
| 图 1 自由基/氧化应激破坏细胞结构和功能完整的可能途径及其对人体健康的影响 |
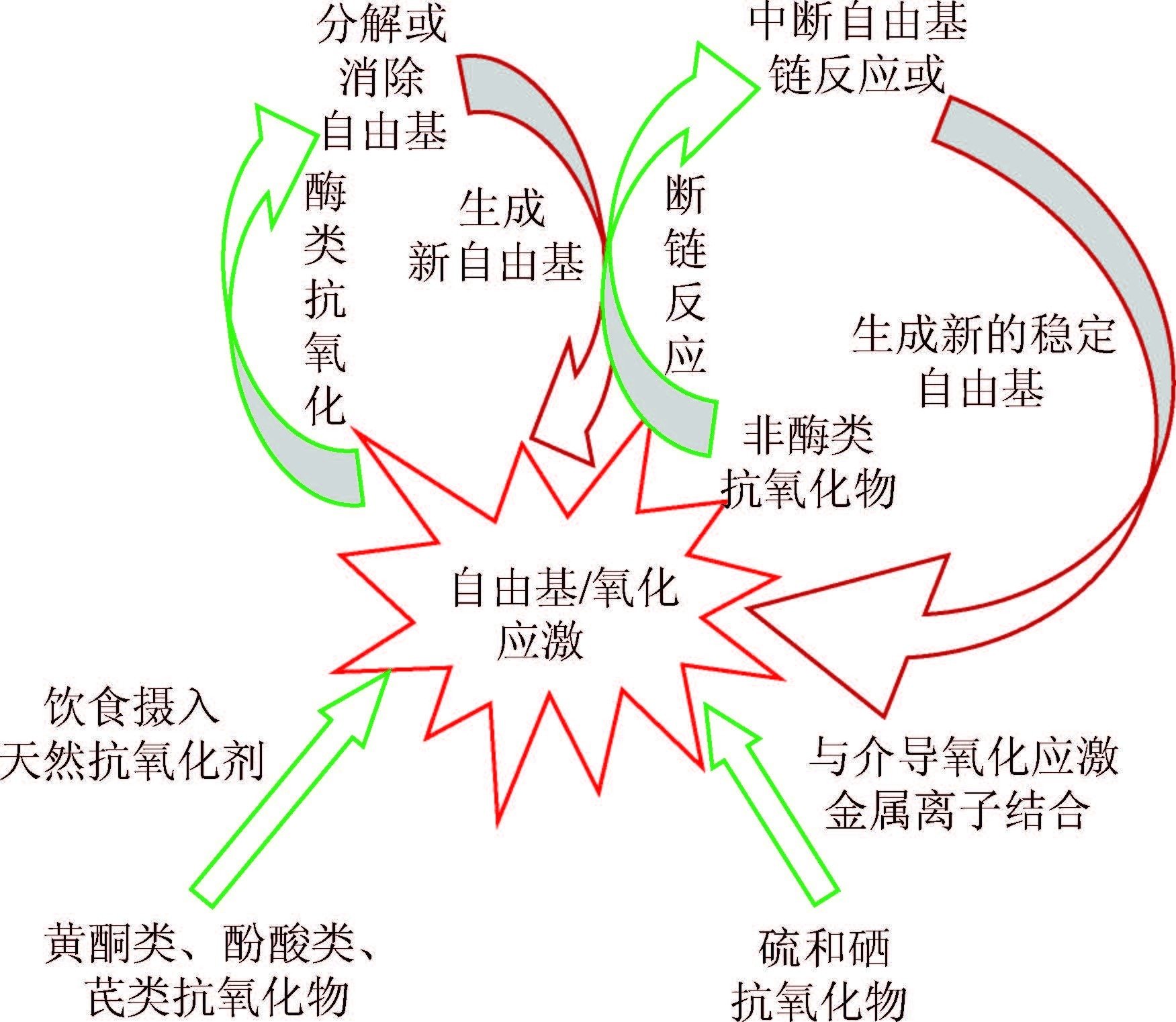
6. 自由基的清除途径及机制:当人体内自由基产生过多和/或清除过少时都会导致 “多余”的自由基产生,这些“多余”的自由基由体内的抗氧化物将其清除,以降低其对人体的危害。人体内的抗氧化物主要分为酶类抗氧化物和非酶类抗氧化物,酶类抗氧化物(又称大分子抗氧化物)主要包括SOD、CAT、GSH-Px和GST,非酶类抗氧化物又称为小分子抗氧化物,主要包括维生素C、维生素E、类胡萝卜素、β胡萝卜素、谷胱甘肽、褪黑色素和硒等。酶类抗氧化物在铜、锌、锰、铁等辅因子的协助下通过分解或消除自由基以达到抗氧化的目的,此过程反应复杂、需多步才能完成,其间可能会引发自由基链反应,产生新的自由基或氧化物[29]。非酶类抗氧化物主要通过单电子转移(SET)、顺序质子损失电子转移(SPLET)等氧化还原反应来打断自由基链反应以达到清除自由基的目的,反应过程简单、清除步骤少,但其间也可能会产生一些诸如苯氧阴离子自由基之类的活性低、寿命长、稳定性强的自由基[29, 70-72],同时,含硫和硒的抗氧化物还能通过与铁离子、铜离子等金属离子结合来抑制金属离子介导的氧化应激,从而起抗氧化的作用,但抗氧化能力强弱受其化学结构的影响[73]。此外,除了体内本身含有的酶类和非酶类抗氧化物外,人体还可以通过饮食摄入黄酮类、酚酸类、芪类等天然抗氧化物来抗击氧化损伤[74]。图 2总结了人体内自由基/氧化应激清除的主要途径和常见机制。
|
| 图 2 人体内自由基/氧化应激清除的主要途径和常见机制 |
7. 结语与展望:人体内自由基的研究已超过半个世纪,目前人体内常见的自由基种类、检测方法及其与部分疾病的关系和自由基保健食品、自由基清除药品(天然产物)的研究已相对成熟,但也还存在以下问题和不足:
(1)自由基/氧化应激与人体健康的关系研究还主要停留在用已发生的病变或不良反应来反推其与自由基/氧化应激的关系,缺少从自由基/氧化应激的产生、作用机制和可能造成的危害来预测其可能产生的健康风险,且缺乏自由基/氧化应激与健康风险间的定量关系研究。
(2)人体内自由基检测的常用方法是间接检测法,间接检测法不能直接测定人体内的自由基含量,只能通过检测人体内相关抗氧化酶的活性或其与生物大分子反应生成的中间产物来间接衡量人体内自由基的含量,而人体内清除自由基的抗氧化剂除了酶类,还有非酶类,酶类和非酶类抗氧化剂在清除自由基上,各自的贡献率如何,只检测抗氧化酶的活性是否能准确的反应自由基含量,或体内抗氧化酶的活性和自由基浓度的相关性是多少,哪一种或几种抗氧化酶的活性更能反映自由基的含量水平等都还有待进一步的研究。
(3)肌体动用体内抗氧化酶来清除O2·-自由基时,先由SOD将O2·-歧化为H2O2,再由CAT和GSH-Px将H2O2分解为H2O和O2以到达清除自由基的目的,此过程中是否存在限速的关键酶,在CAT和GSH-Px协同将H2O2分解为H2O和O2的过程中谁起主导作用,在H2O2浓度低时谁先启动,以及在什么条件下才会使CAT和GSH-Px不能完全分解H2O2,而使H2O2与体内的过渡金属发生芬顿反应生成·OH等也尚不清楚。
(4)研究发现PAHs、重金属、PM等进入体内都会诱导自由基产生、抑制抗氧化物活性或抗氧化物相关基因的表达,但机制却不详,已知·OH可以修饰嘌呤碱基和嘧啶碱基,造成DNA链损伤或断裂[63]。重金属抑制抗氧化物基因的表达是否是先诱导体内·OH生成,再由·OH修饰嘌呤碱基和/或嘧啶碱基,造成DNA链损伤或断裂从而抑制基因表达。以及环境污染物种类众多,各污染物进入体内后是否有对应的特异标志物,特意标志物是什么,也还有待研究。
(5)自由基是人体内最直接、最高效的杀手,研究显示编码维生素C转运蛋白的基因的多态性和谷胱甘肽S-转移酶的基因多态性均与人体内维生素C的含量有关[75],编码抗氧化物的等位基因的多态性与中枢神经系统 SOD、 CAT、 GSH-Px 和谷胱甘肽转移酶活性异常有关[76],而体内自由基的浓度又与维生素C、SOD、CAT、GSH-Px 和GST的活性相关,基因可以遗传,婴儿体内的自由基浓度是否与父母基因型有关,氧化损伤信息在母婴间如何传递等也有待研究。
综上,虽然人体内自由基的研究也具备一定的规模,某些方面也相对饱和,但也还存在一些缺陷和不足。在将来的研究中,研究自由基/氧化应激的来源、种类、作用机制和可能造成的危害来预测、评估其健康风险,建立自由基/氧化应激类型、强度与机体病变及不良反应间的定性、定量关系,以及自由基的靶向治疗、原位检测,自由基氧化损伤信息在母婴间的传递等可能具有广阔前景和深远意义。
| [1] | Thannickal VJ, Fanburg BL. Reactive oxygen species in cell signaling[J]. Am J Physiol Lung Cell Mol Physiol , 2000, 279 (6) : L1005–1028 |
| [2] | White AA, Crawford KM, Patt CS, et al. Activation of soluble guanylate cyclase from rat lung by incubation or by hydrogen peroxide[J]. J Biol Chem , 1976, 251 (23) : 7304–7312 |
| [3] | Dröge W. Free radicals in the physiological control of cell function[J]. Physiol Rev , 2002, 82 (1) : 47–95 DOI:10.1152/physrev.00018.2001 |
| [4] | Cheng FC, Jen JF, Tsai TH. Hydroxyl radical in living systems and its separation methods[J]. J Chromatogr B , 2002, 781 (1/2) : 481–496 DOI:10.1016/S1570-0232(02)00620-7 |
| [5] | Nemzer B, Chang T, Xie ZH, et al. Decrease of free radical concentrations in humans following consumption of a high antioxidant capacity natural product[J]. Food Sci Nutr , 2014, 2 (6) : 647–654 DOI:10.1002/fsn3.146 |
| [6] | Buettner GR. Moving free radical and redox biology ahead in the next decade(s)[J]. Free Radic Biol Med , 2015, 78 : 236–238 DOI:10.1016/j.freeradbiomed.2014.10.578 |
| [7] | Wang QJ, Ding F, Zhu NN, et al. Determination of hydroxyl radical by capillary zone electrophoresis with amperometric detection[J]. J Chromatogr A , 2003, 1016 (1) : 123–128 DOI:10.1016/S0021-9673(03)01294-9 |
| [8] | McCord JM, Fridovich I. The utility of superoxide dismutase in studying free radical reactions.Ⅰ. Radicals generated by the interaction of sulfite,dimethyl sulfoxide,and oxygen[J]. J Biol Chem , 1969, 244 (22) : 6056–6063 |
| [9] | Rodgers MAJ. Solvent-induced deactivation of singlet oxygen:additivity relationships in nonaromatic solvents[J]. J Am Chem Soc , 1983, 105 (20) : 6201–6205 DOI:10.1021/ja00358a001 |
| [10] | Phaniendra A, Jestadi DB, Periyasamy L. Free radicals:properties,sources,targets,and their implication in various diseases[J]. Indian J Clin Biochem , 2015, 30 (1) : 11–26 DOI:10.1007/s12291-014-0446-0 |
| [11] | Truong H, Lomnicki S, Dellinger B. Potential for misidentification of environmentally persistent free radicals as molecular pollutants in particulate matter[J]. Environ Sci Technol , 2010, 44 (6) : 1933–1939 DOI:10.1021/es902648t |
| [12] | Gehling W, Dellinger B. Environmentally persistent free radicals and their lifetimes in PM2.5[J]. Environl Sci Technol , 2013, 47 (15) : 8172–8178 DOI:10.1021/es401767m |
| [13] | Vejerano E, Lomnicki S, Dellinger B. Formation and stabilization of combustion-generated environmentally persistent free radicals on an Fe(Ⅲ)2O3/silica surface[J]. Environ Sci Technol , 2011, 45 (2) : 589–594 DOI:10.1021/es102841s |
| [14] | Li HG, Horke S, Förstermann U. Vascular oxidative stress,nitric oxide and atherosclerosis[J]. Atherosclerosis , 2014, 237 (1) : 208–219 DOI:10.1016/j.atherosclerosis.2014.09.001 |
| [15] | Cooper CE, Vollaard NBJ, Choueiri T, et al. Exercise,free radicals and oxidative stress[J]. Biochem Soc Trans , 2002, 30 (2) : 280–285 DOI:10.1042/bst0300280 |
| [16] | Agrawal S, Flora G, Bhatnagar P, et al. Comparative oxidative stress,metallothionein induction and organ toxicity following chronic exposure to arsenic,lead and mercury in rats[J]. Cell Mol Biol (Noisy-Le-Grand) , 2014, 60 (2) : 13–21 DOI:10.14715/cmb/2014.60.2.3 |
| [17] | Espín S, Martínez-López E, León-Ortega M, et al. Oxidative stress biomarkers in Eurasian eagle owls (Bubo bubo) in three different scenarios of heavy metal exposure[J]. Environ Res , 2014, 131 : 134–144 DOI:10.1016/j.envres.2014.03.015 |
| [18] | Rendón-Ramírez AL, Maldonado-Vega M, Quintanar-Escorza MA, et al. Effect of vitamin E and C supplementation on oxidative damage and total antioxidant capacity in lead-exposed workers[J]. Environ Toxicol Pharmacol , 2014, 37 (1) : 45–54 DOI:10.1016/j.etap.2013.10.016 |
| [19] | Singh L, Agarwal P, Anand M, et al. Toxic and essential metals in placenta and its relation with lipid peroxides/glutathione status in pre-term and full-term deliveries[J]. Asian J Med Sci , 2015, 7 (1) : 34–39 DOI:10.3126/ajms.v7i1.12808 |
| [20] | Guerrero-Castilla A, Olivero-Verbel J, Marrugo-Negrete J. Heavy metals in wild house mice from coal-mining areas of Colombia and expression of genes related to oxidative stress,DNA damage and exposure to metals[J]. Mutat Res Genet Toxicol Environ Mutagen , 2014, 762 : 24–29 DOI:10.1016/j.mrgentox.2013.12.005 |
| [21] | Kadiiska MB, Mason RP, Dreher KL, et al. In vivo evidence of free radical formation in the rat lung after exposure to an emission source air pollution particle[J]. Chem Res Toxicol , 1997, 10 (10) : 1104–1108 DOI:10.1021/tx970049r |
| [22] | Morcillo P, Esteban Má, Cuesta A. Heavy metals produce toxicity,oxidative stress and apoptosis in the marine teleost fish SAF-1 cell line[J]. Chemosphere , 2016, 144 : 225–233 DOI:10.1016/j.chemosphere.2015.08.020 |
| [23] | Kar R, Garg S, Halder S, et al. Cadmium exposure induces oxidative stress by decreasing expression of antioxidant enzymes in mice liver[J]. Int J Clin Biochem Res , 2015, 2 (2) : 89–96 |
| [24] | Kamal A, Qamar K, Gulfraz M, et al. PAH exposure and oxidative stress indicators of human cohorts exposed to traffic pollution in Lahore city (Pakistan)[J]. Chemosphere , 2015, 120 : 59–67 DOI:10.1016/j.chemosphere.2014.05.021 |
| [25] | Bölck B, Ibrahim M, Steinritz D, et al. Detection of key enzymes,free radical reaction products and activated signaling molecules as biomarkers of cell damage induced by benzo[J]. Toxicol Vitro , 2014, 28 (5) : 875–884 DOI:10.1016/j.tiv.2014.03.010 |
| [26] | Kho Y, Lee EH, Chae HJ, et al. 1-Hydroxypyrene and oxidative stress marker levels among painting workers and office workers at shipyard[J]. Int Arch Occup Environ Health , 2015, 88 (3) : 297–303 DOI:10.1007/s00420-014-0955-4 |
| [27] | Penning TM, Ohnishi ST, Ohnishi T, et al. Generation of reactive oxygen species during the enzymatic oxidation of polycyclic aromatic hydrocarbon trans-dihydrodiols catalyzed by dihydrodiol dehydrogenase[J]. Chem Res Toxicol , 1996, 9 (1) : 84–92 DOI:10.1021/tx950055s |
| [28] | Agarwal A, Gupta S, Sharma RK. Role of oxidative stress in female reproduction[J]. Reprod Biol Endocrinol , 2005, 3 : 28 DOI:10.1186/1477-7827-3-28 |
| [29] | Nimse SB, Pal D. Free radicals,natural antioxidants,and their reaction mechanisms[J]. RSC Adv , 2015, 5 (35) : 27986–28006 DOI:10.1039/c4ra13315c |
| [30] | Agarwal A, Aponte-Mellado A, Premkumar BJ, et al. The effects of oxidative stress on female reproduction:a review[J]. Reprod Biol Endocrinol , 2012, 10 : 49 DOI:10.1186/1477-7827-10-49 |
| [31] | Li RJ, Kou XJ, Xie LZ, et al. Effects of ambient PM2.5 on pathological injury,inflammation,oxidative stress,metabolic enzyme activity,and expression of c-fos and c-jun in lungs of rats[J]. Environ Sci Pollut Res Int , 2015, 22 (24) : 20167–20176 DOI:10.1007/s11356-015-5222-z |
| [32] | Dellinger B, Pryor WA, Cueto R, et al. Role of free radicals in the toxicity of airborne fine particulate matter[J]. Chem Res Toxicol , 2001, 14 (10) : 1371–1377 DOI:10.1021/tx010050x |
| [33] | Balakrishna S, Lomnicki S, McAvey KM, et al. Environmentally persistent free radicals amplify ultrafine particle mediated cellular oxidative stress and cytotoxicity[J]. Part Fibre Toxicol , 2009, 6 : 11 DOI:10.1186/1743-8977-6-11 |
| [34] | Khachatryan L, McFerrin CA, Hall RW, et al. Environmentally persistent free radicals (EPFRs)[J]. Environ Sci Technol , 2014, 48 (16) : 9220–9226 DOI:10.1021/es501158r |
| [35] | Squadrito GL, Cueto R, Dellinger B, et al. Quinoid redox cycling as a mechanism for sustained free radical generation by inhaled airborne particulate matter[J]. Free Radic Biol Med , 2001, 31 (9) : 1132–1138 DOI:10.1016/S0891-5849(01)00703-1 |
| [36] | Gehling W, Khachatryan L, Dellinger B. Hydroxyl radical generation from environmentally persistent free radicals (EPFRs) in PM2.5[J]. Environ Sci Technol , 2014, 48 (8) : 4266–4272 DOI:10.1021/es401770y |
| [37] | Ma MY, Li SY, Jin HR, et al. Characteristics and oxidative stress on rats and traffic policemen of ambient fine particulate matter from Shenyang[J]. Sci Total Environ , 2015, 526 : 110–115 DOI:10.1016/j.scitotenv.2015.04.075 |
| [38] | Lu SL, Yi F, Hao XJ, et al. Physicochemical properties and ability to generate free radicals of ambient coarse,fine,and ultrafine particles in the atmosphere of Xuanwei,China,an area of high lung cancer incidence[J]. Atmos Environ , 2014, 97 : 519–528 DOI:10.1016/j.atmosenv.2013.11.047 |
| [39] | Hauser R, Meeker JD, Singh NP, et al. DNA damage in human sperm is related to urinary levels of phthalate monoester and oxidative metabolites[J]. Hum Reprod , 2007, 22 (3) : 688–695 DOI:10.1093/humrep/del428 |
| [40] | Guz J, Gackowski D, Foksinski M, et al. Comparison of oxidative stress/DNA damage in semen and blood of fertile and infertile men[J]. PLoS One , 2013, 8 (7) : e68490 DOI:10.1371/journal.pone.0068490 |
| [41] | Zhang YH, Zheng LX, Chen BH. Phthalate exposure and human semen quality in Shanghai:a cross-sectional study[J]. Bio Environ Sci:BES , 2006, 19 (3) : 205–209 |
| [42] | Guo Y, Weck J, Sundaram R, et al. Urinary concentrations of phthalates in couples planning pregnancy and its association with 8-hydroxy-2'-deoxyguanosine,a biomarker of oxidative stress:longitudinal investigation of fertility and the environment study[J]. Environ Sci Technol , 2014, 48 (16) : 9804–9811 DOI:10.1021/es5024898 |
| [43] | Parolini M, Magni S, Traversi I, et al. Environmentally relevant concentrations of galaxolide (HHCB) and tonalide (AHTN) induced oxidative and genetic damage in Dreissena polymorpha[J]. J Hazard Mater , 2015, 285 : 1–10 DOI:10.1016/j.jhazmat.2014.11.037 |
| [44] | He XB, Jing YQ, Wang JH, et al. Significant accumulation of persistent organic pollutants and dysregulation in multiple DNA damage repair pathways in the electronic-waste-exposed populations[J]. Environ Res , 2015, 137 : 458–466 DOI:10.1016/j.envres.2014.11.018 |
| [45] | Karaca M, Varışlı L, Korkmaz K, et al. Organochlorine pesticides and antioxidant enzymes are inversely correlated with liver enzyme gene expression in Cyprinus carpio[J]. Toxicol Lett , 2014, 230 (2) : 198–207 DOI:10.1016/j.toxlet.2014.02.013 |
| [46] | Johnston PC, McCance DR, Holmes VA, et al. Placental antioxidant enzyme status and lipid peroxidation in pregnant women with type 1 diabetes:the effect of vitamin C and E supplementation[J]. J Diabetes Complications , 2016, 30 (1) : 109–114 DOI:10.1016/j.jdiacomp.2015.10.001 |
| [47] | Uchida K. Role of reactive aldehyde in cardiovascular diseases[J]. Free Radic Biol Med , 2000, 28 (12) : 1685–1696 DOI:10.1016/S0891-5849(00)00226-4 |
| [48] | Nourazarian AR, Kangari P, Salmaninejad A. Roles of oxidative stress in the development and progression of breast cancer[J]. Asian Pac J Cancer Prev , 2014, 15 (12) : 4745–4751 DOI:10.7314/APJCP.2014.15.12.4745 |
| [49] | Ho E, Galougahi KK, Liu CC, et al. Biological markers of oxidative stress:applications to cardiovascular research and practice[J]. Redox Biol , 2013, 1 (1) : 483–491 DOI:10.1016/j.redox.2013.07.006 |
| [50] | Minami Y, Kawai M, Migita TC, et al. free radical formation after intensive exercise in thoroughbred skeletal muscles[J]. J Eq Sci , 2011, 22 (2) : 21–28 DOI:10.1294/jes.22.21 |
| [51] | Smith KA, Shepherd J, Wakil A, et al. A comparison of methods for the measurement of 8-isoPGF2α:a marker of oxidative stress[J]. Ann Clin Biochem , 2011, 48 (Pt 2) : 147–154 DOI:10.1258/acb.2010.010151 |
| [52] | Lai CS, Komarov AM. Spin trapping of nitric oxide produced in vivo in septic-shock mice[J]. FEBS Lett , 1994, 345 (2/3) : 120–124 DOI:10.1016/0014-5793(94)00422-6 |
| [53] | Cynshi O, Takashima Y, Katoh Y, et al. Action of phenolic antioxidants on various active oxygen species[J]. J Biolumin Chemilumin , 1995, 10 (5) : 261–269 DOI:10.1002/bio.1170100502 |
| [54] | Sultana R, Perluigi M, Butterfield DA. Lipid peroxidation triggers neurodegeneration:a redox proteomics view into the Alzheimer disease brain[J]. Free Radic Biol Med , 2013, 62 : 157–169 DOI:10.1016/j.freeradbiomed.2012.09.027 |
| [55] | Singh R, Devi S, Gollen R. Role of free radical in atherosclerosis,diabetes and dyslipidaemia:larger-than-life[J]. Diabetes Metab Res Rev , 2015, 31 (2) : 113–126 DOI:10.1002/dmrr.2558 |
| [56] | Puddu P, Puddu GM, Cravero E, et al. The relationships among hyperuricemia,endothelial dysfunction,and cardiovascular diseases:molecular mechanisms and clinical implications[J]. J Cardiol , 2012, 59 (3) : 235–242 DOI:10.1016/j.jjcc.2012.01.013 |
| [57] | Lagouge M, Larsson NG. The role of mitochondrial DNA mutations and free radicals in disease and ageing[J]. J Intern Med , 2013, 273 (6) : 529–543 DOI:10.1111/joim.12055 |
| [58] | Aigerim S, Valentina K, Bayan Y, et al. PP6-Assessment of changes in biochemical indices of free radical oxidation in the semen of men living in the Aral Sea region[J]. Free Radic Biol Med , 2015, 86 (1) : S21 |
| [59] | Luderer U. Ovarian toxicity from reactive oxygen specie[J]. Vitam Horm , 2014, 94 : 99–127 DOI:10.1016/B978-0-12-800095-3.00004-3 |
| [60] | Tamura H, Takasaki A, Miwa I, et al. Oxidative stress impairs oocyte quality and melatonin protects oocytes from free radical damage and improves fertilization rate[J]. J Pineal Res , 2008, 44 (3) : 280–287 DOI:10.1111/j.1600-079X.2007.00524.x |
| [61] | Das S, Chattopadhyay R, Ghosh S, et al. Reactive oxygen species level in follicular fluid-embryo quality marker in IVF?[J]. Hum Reprod , 2006, 21 (9) : 2403–2407 DOI:10.1093/humrep/del156 |
| [62] | Agarwal A, Gupta S, Sharma R. Oxidative stress and its implications in female infertility-a clinician's perspective[J]. Reprod Biomed Online , 2005, 11 (5) : 641–650 DOI:10.1016/S1472-6483(10)61174-1 |
| [63] | Salminen LE, Paul RH. Oxidative stress and genetic markers of suboptimal antioxidant defense in the aging brain:a theoretical review[J]. Rev Neurosci , 2014, 25 (6) : 805–819 DOI:10.1515/revneuro-2014-0046 |
| [64] | Gupta S, Agarwal A, Banerjee J, et al. The role of oxidative stress in spontaneous abortion and recurrent pregnancy loss:a systematic review[J]. Obstet Gynecol Surv , 2007, 62 (5) : 335–347 DOI:10.1097/01.ogx.0000261644.89300.df |
| [65] | Lane M, Zander-Fox DL, Robker RL, et al. Peri-conception parental obesity,reproductive health,and transgenerational impacts[J]. Trends Endocrinol Metab , 2015, 26 (2) : 84–90 DOI:10.1016/j.tem.2014.11.005 |
| [66] | Imanishi H, Misawa S, Takino T, et al. Role of free radical reactions in myelodysplastic syndrome[J]. J Clin Biochem Nut , 1988, 5 (1) : 75–79 DOI:10.3164/jcbn.5.75 |
| [67] | Greig FH, Kennedy S, Spickett CM. Physiological effects of oxidized phospholipids and their cellular signaling mechanisms in inflammation[J]. Free Radic Biol Med , 2012, 52 (2) : 266–280 DOI:10.1016/j.freeradbiomed.2011.10.481 |
| [68] | 王爱珍. 自由基清除剂在小儿肺炎治疗中的临床观察[J]. 临床医药文献杂志:电子版 , 2015, 2 (23) : 4741,4744 Wang AZ. Analysis of the clinical application of free radical scavenger in the treatment of children with pneumonia[J]. J Clin Med:Elec Vers , 2015, 2 (23) : 4741,4744 |
| [69] | Lejay A, Fang F, John R, et al. Ischemia reperfusion injury,ischemic conditioning and diabetes mellitus[J]. J Mol Cell Cardiol , 2016, 91 : 11–22 DOI:10.1016/j.yjmcc.2015.12.020 |
| [70] | Rossner Jr P, Milcova A, Libalova H, et al. Biomarkers of exposure to tobacco smoke and environmental pollutants in mothers and their transplacental transfer to the foetus. Part Ⅱ. Oxidative damage[J]. Mutat Res , 2009, 669 (1/2) : 20–26 DOI:10.1016/j.mrfmmm.2009.04.010 |
| [71] | Yancheva D, Velcheva E, Glavcheva Z, et al. Insights in the radical scavenging mechanism of syringaldehyde and generation of its anion[J]. J Mol Struct , 2016, 1108 : 552–559 DOI:10.1016/j.molstruc.2015.12.054 |
| [72] | álvarez-Diduk R, Galano A, Tan DX, et al. The key role of the sequential proton loss electron transfer mechanism on the free radical scavenging activity of some melatonin-related compounds[J]. Theor Chem Acc , 2016, 135 : 38 DOI:10.1007/s00214-015-1785-5 |
| [73] | Pérez-González A, Alvarez-Idaboy JR, Galano A. Free-radical scavenging by tryptophan and its metabolites through electron transfer based processes[J]. J Mol Mod , 2015, 21 : 213 DOI:10.1007/s00894-015-2758-2 |
| [74] | Cao H, Xie YX, Chen XQ. Type 2 diabetes diminishes the benefits of dietary antioxidants:Evidence from the different free radical scavenging potential[J]. Food Chem , 2015, 186 : 106–112 DOI:10.1016/j.foodchem.2014.06.027 |
| [75] | Michels AJ, Hagen TM, Frei B. Human genetic variation influences vitamin C homeostasis by altering vitamin C transport and antioxidant enzyme function[J]. Ann Rev Nut , 2013, 33 : 45 DOI:10.1146/annurev-nutr-071812-161246 |
| [76] | Allamaneni SSR. Oxidants and antioxidants in human fertility[J]. Middle East Fertil Soc J , 2004, 9 (3) : 187–197 |
 2016, Vol. 37
2016, Vol. 37