文章信息
- 郑敏娜, 宁铁林, 高永军, 赵璇, 李龙, 程绍辉 .
- Zheng Minna, Ning Tielin, Gao Yongjun, Zhao Xuan, Li Long, Cheng Shaohui .
- 天津市2015年HIV流行和传播的分子流行病学特征分析
- Molecular epidemiology and transmission of HIV in Tianjin, 2015
- 中华流行病学杂志, 2016, 37(8): 1142-1147
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(8): 1142-1147
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.08.018
-
文章历史
收稿日期: 2016-05-09
2. 300132 天津市红桥区疾病预防控制中心性病艾滋病预防控制所
2. Department for AIDS/STD Control and Prevention, Hongqiao Districtal Center for Disease Control and Prevention, Tianjin 300132, China
近年来,我国HIV/AIDS病例数逐年上升,HIV感染途径也逐渐变化。异性传播和男男同性传播是HIV感染的主要途径,其中男男同性传播呈快速上升趋势。新的重组毒株不断出现,耐药毒株流行,大大增加了HIV传播的风险。2015年1-10月天津市新报告HIV/AIDS有560例,较2014年的413例增长35.59%。为此本研究应用分子生物学技术探索天津市HIV流行株亚型分布、重组和耐药株传播和流行趋势。
材料与方法1. 样本及其处理:2015年天津市艾滋病确证中心实验室新确认的未经抗病毒治疗且CD4+T淋巴细胞计数≥200个/μl的HIV感染者共505例,其中按不同感染途径分层随机抽样,共抽取样本77例,在知情同意的情况下,采集EDTA抗凝全血4~8 ml,离心分离血浆分装后,-80 ℃保存备用。
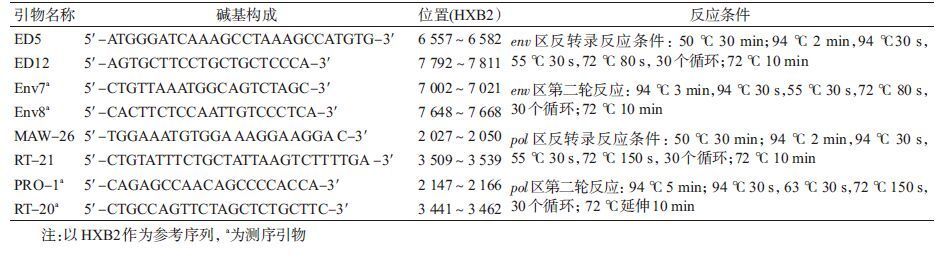
2. 核酸提取和基因序列扩增:采用德国Qiagen公司Viral RNA Extraction Kit提取感染者血浆中的病毒RNA,大连宝生物工程有限公司One-step RNA PCR Kit(AMV)反转录RT-PCR和巢式PCR扩增HIV-1的env和pol基因区,引物和反应条件见表 1。PCR产物经1%琼脂糖凝胶电泳,QIAGEN公司QIAquick gel extraction kit切胶纯化,使用ABI PRISM 3730XL进行测序。
3. 序列分析:从Los Alamos Database HIV数据库中下载各亚型的参考序列,Vector NTI 8.0软件包中Contig Express软件和BioEdit软件对原始序列进行拼接、比对和质量控制,Mega 6.0软件进行Neighbor-Joining系统进化分析(Bootstrap分析重复1 000次),可疑样本重新采血检测以排除实验污染的可能性。美国洛斯阿拉莫斯国家实验室HIV核酸序列库(http://www.HIV.lanl.gov)的BLAST工具进行亚型和序列比对分析。对各亚型进化树内的传播对进行分析,Bootstrap值≥80%提示有可疑传播关系,Bootstrap值<80%但在一个独立的分支上判定为无法确定传播关系,两条序列不聚集且被其他序列分开则判定为无传播关系[1],并结合后期流行病学调查进行综合分析。以HXB2做参考株,jpHMM-HIV在线软件(http://www.HIV.lanl.gov)进行HIV序列重组断点分析。经整理合格的pol基因用美国斯坦福大学HIV耐药数据库中的Calibrated Population Resistance(CPR)工具进行传播性耐药分析,并将序列提交Stanford HIV Drug Resistance Database (http://hivdb.Stan-ford.edu)进行亚型耐药分析。
4. 统计学分析:SPSS软件进行统计学分析,χ2检验比较不同传播途径的亚型分布差异,P<0.05判断为差异具有统计学意义。
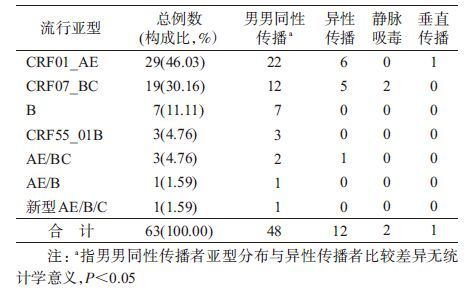
结 果1. 样本特征和亚型分布:77例HIV感染者中,最终扩增得到57条pol区和58条env区基因序列,两区结果综合分析后,共获得63份样本的亚型信息(其中52例样本均扩增出两区;5例只扩出pol区;6例只扩出env区)。男性占96.10%(74/77),女性占3.90%(3/77);年龄12~58岁,平均(33±10)岁;未婚者占54.55%(42/77);高中以上文化程度者占74.03%(57/77);汉族占89.61%(69/77);感染途径为男男同性传播占76.62%(59/77),异性传播占18.18%(14/77),静脉吸毒占3.90%(3/77),垂直传播占1.30%(1/77)。
HIV流行株亚型依次为CRF01_AE占46.03%(29/63),CRF07_BC占30.16%(19/63),B亚型占11.11%(7/63),CRF55_01B亚型占4.76%(3/63)其他独特型二代重组亚型(URF)占7.94%(5/63)。URF包括3例AE/BC、1例AE/B和1例新型重组亚型AE/B/C(表 2)。所有感染者中除7例为B亚型毒株外其他均为重组毒株,重组毒株的构成比为88.89%(56/63)。不同感染途径的亚型分布特点为:48例MSM中,以CRF01_AE为主占45.84%(22/48),其次为CRF07_BC占25.00%(12/48),B亚型占14.58%(7/48),CRF55_01B亚型占6.25%(3/48),URF占8.33%(4/48);12例异性传播感染者中CRF01_AE占50.00%(6/12)、CRF07_BC占41.67%(5/12)和URF占8.33%(1/12),无B和CRF55_01B亚型,与MSM的亚型分布的差异无统计学意义(P>0.05);2例静脉吸毒感染者均为CRF07_BC亚型;1例垂直传播途径感染者为CRF01_AE。
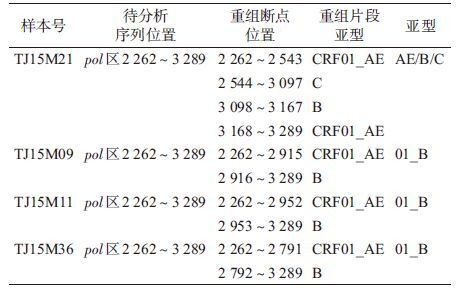
2. URF的重组特点:8例URF中,MSM共7例(CRF55_01B 3例,AE/BC 2例,AE/B 1例及AE/B/C新型重组1例);异性传播途径感染者中AE/BC重组1例。重组断点分析结果显示,3例AE/BC重组者pol区为CRF07_BC,env区为CRF01_AE ,两区内均未发现重组断点;1例AE/B 重组者pol区为CRF01_AE,env区为B亚型,两区内均未发现重组断点;3例01_B亚型的pol区发生了CRF01_AE和B亚型重组,env区为未发生重组的CRF01_AE,且TJ15M09和TJ15M11的重组断点基本一致;1例新型重组亚型TJ15M21的pol区出现了AE、B和C亚型的重组,env区为未发生重组的CRF07_BC(表 3)。
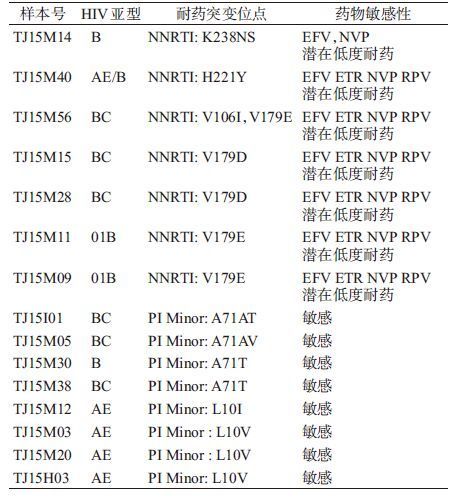
3. 耐药毒株流行情况:根据WHO公布的2009版监测性耐药突变名录(http://cpr.standford.edu/cpr.cgi),共发现3例监测性耐药突变感染者,其突变位点均为L100I,传播耐药率为5.3%(3/57),略高于WHO提出的5%的中度流行警戒线[2],属于中度流行。应用美国斯坦福大学HIV基因型耐药分析数据库(http://sierra2.stanford.edu/sierra/servlet/JSierra)对其他耐药突变位点进一步分析显示(表 4),非核苷酸反转录酶抑制剂(NNRTI)耐药突变者7例,为EFV/ETR/NVP/RPV潜在低度耐药,依次为V179E 3例(CRF55_01B亚型2例和CRF07_BC亚型1例)、V179D 2例(CRF07_BC亚型)、K238NS 1例(B亚型)、和H221Y 1例(AE/B);蛋白酶抑制剂(PI)次要突变者8例,4例L10I/V突变者(均为CRF01_AE亚型),4例A71AT/AV/T突变者(均为CRF07_BC或B亚型),未发现对PI耐药。
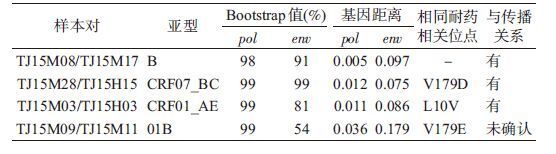
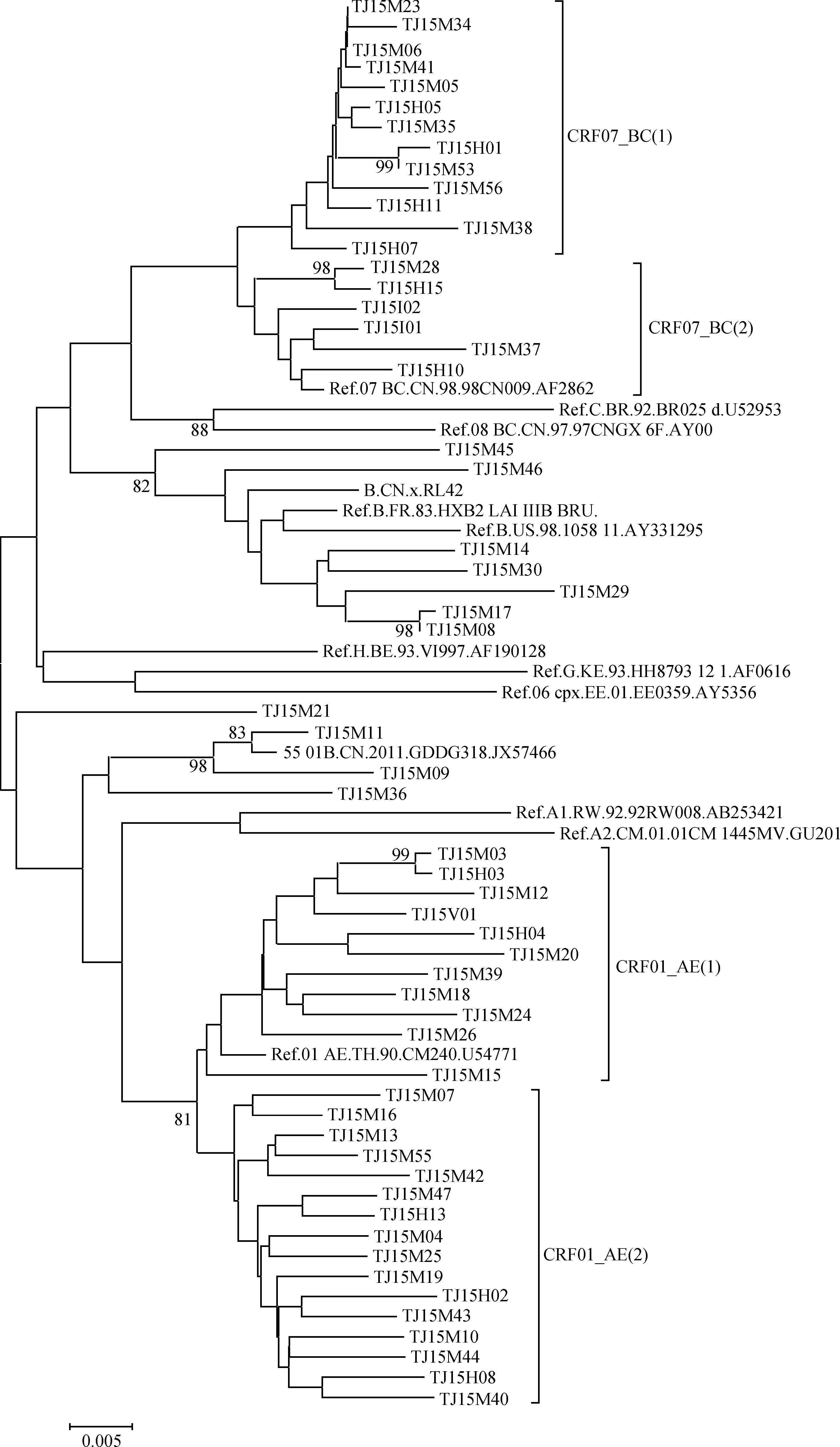
4. 进化及传播关系:CRF01_AE主要分为2簇,均呈相对散在分布,以同性和异性传播者为主,CRF01_AE(1)内有1个可疑传播对(TJ15M03/TJ15H03);CRF07_BC亚型分为2簇,均以性传播为主,静脉吸毒者均聚集在CRF07_BC(2),2簇各有可疑传播对1对(TJ15H01/TJ15M53和TJ15M28/TJ15H15);B亚型呈高度聚集,均为男男同性传播,内有1个可疑传播对(TJ15M08/TJ15M17);01_B亚型仅有的3例聚集,均为MSM,内有1个可疑传播对(TJ15M09/TJ15M11)。见图 1。
|
| 图 1 2015年天津市HIV流行株pol区序列Neighber-Joining进化树分析 |
pol区Bootstrap值≥80%可疑传播对分析结果显示(表 5),TJ15H01/TJ15M53的env区未发生聚集而排除传播关系,TJ15M09/TJ15M11的pol区具有相同的NNRTI耐药位点,但由于env区Bootstrap值过低因此无法确定传播关系。3对TJ15M08/TJ15M17、TJ15M28/TJ15H15和TJ15M03/TJ15H03样本其pol区Bootstrap值均≥98%,env区均Bootstrap值≥80%,pol区平均基因距离为0.009,env区为0.086,耐药突变位点情况一致,且经后期调查发现每对内的感染者均维持超1年以上的同伴关系,可确认有传播关系。其中TJ15M28/TJ15H15中的TJ15M28是在TJ15H15感染后3个月发现的;其他两对中TJ15M08和TJ15M03确认HIV阳性后分别在第一时间对同伴TJ15M17和TJ15H03进行告知,经检测证实TJ15M17和TJ15H03的HIV感染,因此对内感染者确证时间不超过10 d。
本研究显示,天津市HIV感染者流行的亚型依次为CRF01_AE占46.03%(29/63),CRF07_BC占30.16%(19/63),B亚型占11.11%(7/63),CRF55_01B亚型占4.76%(3/63),其他CRF占7.94%(5/63)。性传播以CRF01_AE和CRF07_BC重组亚型为主,同性和异性传播的亚型分布无明显差别;静脉吸毒者均为CRF07_BC亚型;1例垂直传播者为CRF01_ AE。首次发现URF共8例,其中3例CRF55_01B亚型、2例AE/BC重组、1例AE/B重组和1例新型的AE/B/C重组亚型均为MSM;1例AE/BC重组为异性传播途径感染者。除MSM中有7例为B亚型外,其他途径感染者均为重组亚型毒株感染,天津市HIV感染者中重组毒株的构成比为88.89%,其中URF占12.70%,流行形势严峻。
二代重组毒株是多种毒株共感染或超感染的产物,是复杂的免疫环境中优势选择的结果,较单一的基因亚型或重组亚型的适应性更强,更容易在人群中传播[3-4]。亚型重组断点分析结果显示,首次发现的4例区内重组样本的重组断点均出现在pol区而env区未发生重组,提示pol区较env区可能更易发生重组。3例MSM的CRF55_01B亚型毒株pol区发生了CRF01_AE和B亚型重组,大大增加了新型二代重组毒株的传播风险。
目前天津市HIV抗病毒治疗仍以一线治疗方案为主。本研究发现,天津市HIV感染者传播耐药率为5.3%(3/57),略高于WHO提出的5%的中度流行警戒线,属于中度流行,3个SDRM感染者的突变位点均为NNRTI的L100I。其他耐药突变位点分析中发现,7例样本有NNRTI类潜在低度耐药,未发现NRTI和PI主要突变位点。研究还发现携带NNRTI类突变K238NS和V179D/E的毒株均为B亚型或含有B亚型序列的重组毒株;一些PI次要突变对PI主要耐药位点具有重要的协同作用,如L10I/V、A71V/T等[5-6],本研究中8例PI辅助性耐药突变的感染者,携带L10I/V突变者均为CRF01_AE亚型,携带A71V/T突变者均为B亚型或含有B亚型序列的重组毒株,从毒株的亚型和耐药突变特点来看,NNRTI耐药突变和PI次要突变位点可能与其亚型有关。
本研究分析TJ15M08/TJ15M17、TJ15M28/TJ15H15和TJ15M03/TJ15H03样本对结果显示,pol区Bootstrap值均≥98%和env区Bootstrap值均≥80%以上的传播对结合流行病学调查可确认其传播关系。这3对样本的pol区平均基因距离为0.009,env区为0.086,与2015年文献报道的家庭内传播结果(pol区平均基因距离为0.010)基本一致[7],考虑到3个传播对均涉及MSM人群,且该人群性行为活跃,其毒株变异率可能会受到行为学因素的影响,因此其具体标准有待加大样本量后进行深入研究。进化分析中发现,有传播关系的TJ15M03/TJ15H03 和TJ15M28/ TJ15H15样本对,其TJ15H03和TJ15H15经后期调查证实为男男性传播。相反TJ15M18/ TJ15M24前期调查认定为同伴关系,但进化分析后pol区Bootstrap值为55%且env区未发生聚集,因此排除其传播关系。TJ15M09/TJ15M11中2名MSM均为CRF55_01B亚型,具有相同的NNRTI耐药位点且pol区Bootstrap值均≥80%,但由于其env区Bootstrap值过低无法确定传播关系,调查也未发现直接或间接传播关系,该毒株很可能已在MSM中传播,其来源有待进一步研究。
综上所述,2015年天津市HIV感染者重组毒株不断增加并广泛流行,以同性和异性传播为主,性传播者中HIV新型二代重组和耐药毒株不断产生并在不同人群和不同地区间传播,应引起高度重视。
| [1] | Eshleman SH, Hudelson SE, Redd AD, et al. Analysis of genetic linkage of HIV from couples enrolled in the HIV Prevention Trials Network 052 trial[J]. J Infect Dis , 2011, 204 (12) : 1918–1926 DOI:10.1093/infdis/jir651 |
| [2] | 刘大锦, 冯孟贤, 刘民. 中国未接受抗病毒治疗的人类免疫缺陷病毒/获得性免疫缺陷综合征(HIV/AIDS)人群HIV原发耐药的Meta分析[J]. 北京大学学报 , 2015, 47 (3) : 474–482 DOI:10.3969/j.issn.1671-167X.2015.03.020 Liu DJ, Feng MX, Liu M. Primary drug resistance of human immunodeficiency virus (HIV)among the treatment-naive individuals with HIV in China:a meta-analysis[J]. J Peking Univ (Health Sci) , 2015, 47 (3) : 474–482 DOI:10.3969/j.issn.1671-167X.2015.03.020 |
| [3] | Feng Y, Li XG, Zang XH, et al. Identification of a novel HIV-1 second-generation recombinant form (CRF01_AE/CRF07_BC) in Jilin,China[J]. AIDS Res Hum Retroviruses , 2014, 30 (8) : 819–822 DOI:10.1089/AID.2014.0071 |
| [4] | Wu JJ, Meng ZF, Xu JQ, et al. New emerging recombinant HIV-1 strains and close transmission linkage of HIV-1 strains in the Chinese MSM population indicate a new epidemic risk[J]. PLoS One , 2013, 8 (1) : e54322 DOI:10.1371/journal.pone.0054322 |
| [5] | Chang MW, Torbett BE. Accessory mutations maintain stability in drug-resistant HIV-1 protease[J]. J Mol Biol , 2011, 410 (4) : 756–760 DOI:10.1016/j.jmb.2011.03.038 |
| [6] | Clutter DS, Sánchez PR, Rhee SY, et al. Genetic variability of HIV-1 for drug resistance assay development[J]. Viruses , 2016, 8 (2) : 48 DOI:10.3390/v8020048 |
| [7] | 董哲, 熊润松, 梁富雄. RNA与前病毒DNA进化分析技术在判定HIV-1传播关系中的作用比较[J]. 中国病毒病杂志 , 2015, 5 (4) : 269–276 DOI:10.16505/j.2095-0136.2015.04.008 Dong Z, Xiong RS, Liang FX, et al. Comparison of RNA and proviral DNA phylogenetic analysis in the evaluation of HIV-1 transmission[J]. Chin J Viral Dis , 2015, 5 (4) : 269–276 DOI:10.16505/j.2095-0136.2015.04.008 |
 2016, Vol. 37
2016, Vol. 37