文章信息
- 陈伟, 张怡, 朱颖, 杨洋, 龚雅洁, 缪小平, 钟荣 .
- Chen Wei, Zhang Yi, Zhu Ying, Yang Yang, Gong Yajie, Miao Xiaoping, Zhong Rong .
- p53靶基因结合区遗传变异与中国人群乳腺癌遗传易感性的关联研究
- Association between genetic variants in p53 binding sites and risks of breast cancer in Chinese population
- 中华流行病学杂志, 2016, 37(8): 1063-1068
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(8): 1063-1068
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.08.002
-
文章历史
收稿日期: 2016-03-22
2. 519000 珠海市慢性病防治中心预防保健部
2. Department of Preventive Health Care, Zhuhai Center for Chronic Disease Control, Zhuhai 519000, China
乳腺癌是女性中最常见的一种恶性肿瘤[1],根据国际癌症研究机构的数据显示,2012年,中国人群乳腺癌的发病率和死亡率在经年龄标准化之后分别为22.1/10万和5.4/10万[2]。p53作为目前最重要的一种肿瘤抑制因子之一,被发现与包括乳腺癌在内的很多疾病的发病风险相关[3]。作为转录因子,p53主要通过与靶基因上特异性的DNA序列相结合,对靶基因转录进行调控发挥肿瘤抑制作用[4]。因此,位于p53靶基因上结合区的遗传变异很可能通过改变p53的结合力来影响相应靶基因的转录,从而在乳腺癌易感性中发挥重要作用[5]。
染色质免疫共沉淀(chromatin immune precipitation,ChIP)与新一代测序技术(sequencing)相结合的ChIP-seq技术的出现,使得研究者在全基因组水平上寻找转录因子结合位点成为可能[6]。考虑到p53在乳腺癌发生发展中的作用,以及p53通路在不同组织中发挥作用的组织特异性,本研究通过公共数据库下载乳腺癌细胞系p53 ChIP-seq数据和各种生物信息学方法,筛选p53靶基因结合区功能性遗传变异并通过大样本关联研究,揭示筛选的单核苷酸多态性(SNP)与乳腺癌发病风险之间的关系。
对象与方法1. 研究对象:共纳入1 274例乳腺癌病例和1 255名健康女性对照,所有研究对象均为汉族,来自于湖北省武汉市及其周边地区,且研究对象相互之间没有任何血缘关系。收集时间为2009年6月至2013年6月,均在武汉协和医院连续收集。其中部分样本已在其他研究中阐述[7-8]。病例为经过组织病理学诊断确认的新发病例,在血样标本收集之前,病例未进行任何放射治疗和化学药物治疗,对病例的年龄和其他病理类型没有限制。病例的主要排除标准:有既往肿瘤史,肿瘤是从其他部位的原发肿瘤转移而来。对照组与病例组通过年龄(±5岁)进行频数匹配,对照排除标准:患有其他肿瘤,以及有其他任何系统较为严重的疾病。在研究对象收集期间,所有的对象均获悉研究目的并且签署知情同意书,在获得知情同意书之后,开始收集研究对象2 ml的外周静脉血和相应的人口学资料(包括基本年龄、籍贯、吸烟、饮酒及是否绝经等信息)。将从来不吸烟,或者吸烟少于1年且平均每天吸烟少于1支者定义为不吸烟,否则即为吸烟。每周至少饮酒2次,且持续时间超过1年,定义为饮酒,否则定义为不饮酒。本研究通过华中科技大学同济医学院伦理委员会批准。
2. 特异性遗传变异的筛选:Nikulenkov等[9]利用ChIP-seq技术,在MCF-7乳腺癌细胞系中获得了大量的p53靶基因及其结合区域。本研究首先下载作者提供的p53 ChIP-seq数据集,取3组实验组和对照组数据的交集;在p53结合峰内寻找结合基序并与NCBI dbSNP数据库比对,获得中国汉族人群中最小等位基因频率(minor allele frequency,MAF)>0.05的遗传变异信息;利用Match软件预测筛选的遗传变异是否影响p53的结合。通过多种生物信息学方法,共筛选到5个SNP位点,其中rs6127003和rs56284136由于在其上下游10 kb范围内未发现有任何基因存在,因此这2个位点没有纳入后续的研究中,本次研究最终共纳入3个位点,分别为位于BCAS1基因上的rs3787547、rs290392和位于VMP1(vacuole membrabe protein 1)基因上的rs1295925(表 1)。
3. 基因分型:使用天根生化科技(北京)有限公司血液基因组DNA提取试剂盒提取研究对象的基因组DNA。采用TaqMan(7900HT Fast Real-Time PCR System,美国ABI公司)基因分型系统对位点进行基因分型。基因分型采用盲法进行,即不知道样本是病例组还是对照组,同时选取5%的随机样本进行质量控制,最后,所有位点的基因分型应答率均在95%以上。
4. 统计学分析:采用Pearson χ2检验和t检验分别对病例组和对照组中的分类变量和连续性变量进行差异性比较。应用拟合优度 χ2检验对对照组中各个遗传变异的基因型进行H-W遗传平衡检验。各个位点基因型频率在病例组和对照组的分布差异采用 χ2检验,同时采用非条件logistic回归模型计算校正年龄、绝经状况、吸烟和饮酒状况之后的OR值及其95%CI,分析各SNP位点对乳腺癌发病风险的作用。由于本研究涉及多个SNP位点,在进行多重假设检验时可能会导致假阳性发生率增加,因此采用错误发生率(FDR)对多重检验进行校正。在SPSS 12.0软件中完成各种统计学分析,所有检验均为双侧,P<0.05为差异有统计学意义。
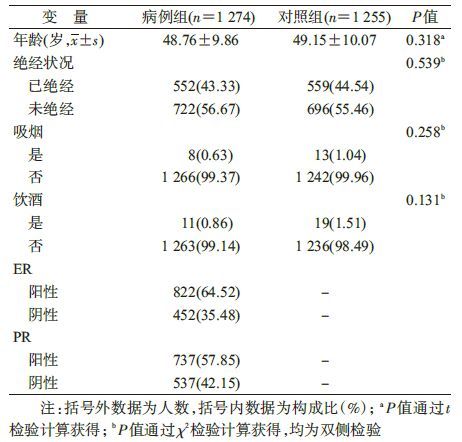
结 果1. 一般人口学特征:病例组与对照组年龄差异无统计学意义(表 2),其中病例组年龄为(48.76 ±9.86)岁,对照组的平均年龄为(49.15±10.07)岁。在病例组中,分别有722例(56.67%)未绝经和552 例(43.33%)已绝经女性;在对照组中,未绝经女性为696例(55.46%),已绝经女性为559例 (44.54%),两组比较,绝经状况差异无统计学意义(P=0.539)。吸烟和饮酒在病例组和对照组的分布均差异无统计学意义,其对应P值分别为0.258和0.131。在病例组中,有822例病例被诊断为雌激素受体(ER)阳性,有452例病例被诊断为ER阴性,分别占所有病例的64.52%和35.48%;737例孕激素受体(PR)阳性,537例PR阴性,分别占所有病例的57.85%和42.15%。
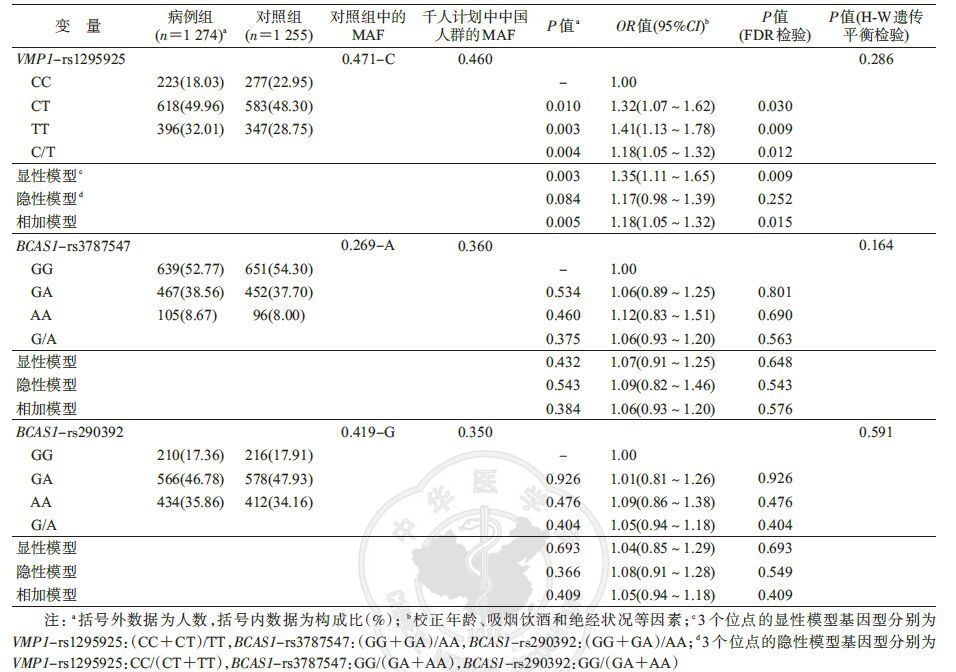
2. p53靶基因结合区SNP与乳腺癌易感性关联分析:3个位点的应答率均≥95%,且3个位点的基因型在对照组中均符合H-W遗传平衡,拟合优度检验P值分别为0.286、0.164和0.591。在3个位点中,位于VMP1基因上的rs1295925在病例组和对照组中的频数分布差异有统计学意义,其与乳腺癌发病高度相关,校正年龄、绝经状况和吸烟饮酒后,携带rs1295925-CT基因型和TT基因型的个体与携带rs1295925-CC基因型的个体相比,患乳腺癌的风险显著增加,其OR值(95%CI)分别为1.32(1.07~1.62)和1.41(1.13~1.78)。此外该位点的显性模型和相加模型也显示与乳腺癌发病风险相关(OR=1.35,95%CI:1.11~1.65和OR=1.18,95%CI:1.05~1.32)。等位基因型比较也得到该位点与乳腺癌易感性的阳性结果,其对应P值为0.004(OR=1.18,95%CI:1.05~1.32)。而另外2个位点rs3787547和rs290392在病例组和对照组中的频数分布差异无统计学意义,未发现与乳腺癌发病风险相关的证据。对P值进行了FDR多重检验校正之后,rs1295925仍然被与乳腺癌的发病风险相关,提示该位点可能是乳腺癌的遗传易感危险因素(表 3)。
根据乳腺癌病例的ER和PR状况对3个SNP位点与乳腺癌的发病风险进行分层分析,将病例分为ER+/PR+和ER-PR-两个亚组,结果显示,rs1295925与ER-PR-乳腺癌亚组的发病风险相关,同样校正年龄、绝经状况和吸烟饮酒因素后,携带rs1295925-CT和rs1295925-TT基因型的个体与携带rs1295925-CC基因型的个体相比,其患乳腺癌的风险分别增加了69%和79%,其对应的OR值分别为1.69(95%CI:1.22~2.34)和1.79(95%CI:1.26~2.53),rs1295925与ER+/PR+乳腺癌亚组则只有临界相关,且关联无统计学意义,携带CT基因型和TT基因型的个体分别与携带CC基因型个体相比,其对应的P值分别为0.077和0.072。提示rs1295925与ER-PR-乳腺癌亚组的关联比ER+/PR+亚组强。另外2个位点rs3787547和rs290392分层分析时仍未显示与乳腺癌亚组发病相关(表 4)。
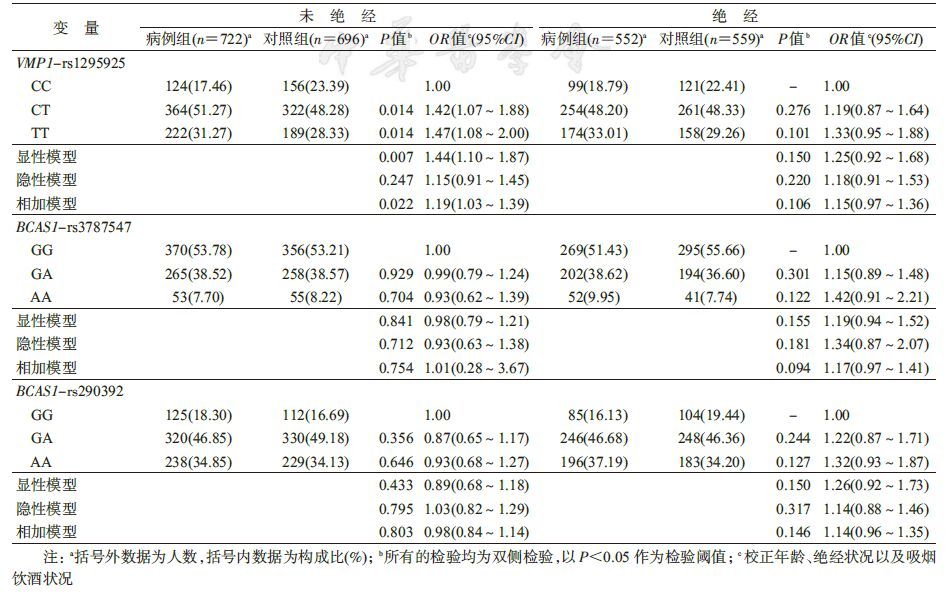
同时根据研究对象的绝经状况进行分层分析,未绝经和绝经后两部分的异质性检验,P=0.800,提示不同的绝经状况下,rs1295925位点对乳腺癌的发病风险影响一致。未绝经者携带rs1295925- CT和rs1295925-TT基因型的个体其患乳腺癌的风险分别是携带rs1295925-CC基因型的个体的1.42和1.47倍。而在已绝经人群中,未rs1295925与乳腺癌有统计学意义的关联。另外5个位点仍未显示与乳腺癌相关(表 5)。
本研究首先采用生物信息学分析筛选位于p53结合区域并可能影响p53结合的多态位点,然后通过大样本病例-对照关联研究,分析筛选的遗传变异与乳腺癌发病风险的关系,结果显示,位于VMP1基因上的rs1295925位点与中国人群乳腺癌的发病风险相关,而另外2个位于BCAS1基因上的rs290392和rs3787547则并没有显示与乳腺癌发病风险的关联。分层分析时发现,rs1295925与乳腺癌的相关性在未绝经人群中有统计学意义,而在已绝经人群中无统计学意义,未绝经和已绝经两部分的异质性检验结果显示不同的绝经状况下,rs1295925位点对乳腺癌的发病风险影响一致,且未绝经人群中的OR值比没有进行分层分析时更大,提示rs1295925和绝经状况之间存在一定的联合效应。此外,根据ER和PR进行分层分析,结果显示,ER-PR-乳腺癌的发病风险与rs1295925有统计学关联,而ER+/PR+乳腺癌发病风险与rs1295925的相关性无统计学关联,提示rs1295925可能在ER-PR-乳腺癌中发挥作用比在ER+/PR+乳腺癌中的作用更强。
VMP1基因是一种应激可诱导基因[10],其编码的液泡包膜蛋白是细胞自噬的重要调控因子[11-12]。自噬在决定细胞命运上发挥重要作用,它可以减少一些老化、功能低的细胞器,循环利用细胞成分并对细胞应激做出反应。正常的VMP1蛋白表达量为维持正常组织稳态和完整性所必须[13]。目前,大量研究表明,VMP1涉及许多肿瘤的发生发展。在肝癌中,VMP1的表达下调,同时与预后差相关。此外,VMP1的表达与肝癌的转移负性相关[14]。在胰腺癌中,VMP1的表达则被发现比正常胰腺组织的表达上调,同时其高表达与预后差相关[15]。在乳腺癌细胞系中,有研究者发现,在侵袭性乳腺癌细胞中VMP1的表达要低于非侵袭性乳腺癌细胞[16]。本研究通过利用公共数据库中的ChIP-seq数据,通过前期的生物信息学分析,结果显示,VMP1基因是p53转录因子的靶基因,该基因上的rs1295925位于p53转录结合区域,且其突变可能会影响p53的结合并最终导致不同的肿瘤易感性。本研究显示,rs1295925-T等位基因会增加乳腺癌的发病风险。研究发现p53肿瘤抑制作用可能涉及非常多的通路途径,其中一条途径就是可能影响细胞的自噬过程,在核内和核外可能会通过调节下游不同的靶基因,而促进或抑制细胞的自噬。有研究发现,在细胞核内时,p53通常可以激活自噬的发生,而在细胞核外的细胞质中,p53可以抑制细胞的自噬水平,通过定位差异表现出对自噬的双重调节作用[17]。因此rs1295925对乳腺癌遗传易感性的影响可能通过p53影响VMP1基因的表达水平并最终影响细胞的自噬,同时改变机体的一些生理生化过程。但是rs1295925位点如何影响乳腺癌的易感性则需要进一步的生物学机制研究去阐明。
本研究存在局限性。本研究是典型的基于医院的病例-对照研究,且在资料收集过程中有些数据未收集全(如初潮年龄),因此难以避免存在偏倚;其次阳性位点rs1295925对乳腺癌发病风险影响的生物学机制需要功能实验进行验证,从而使研究结果更加具有说服力。
本研究首先利用生物信息学的方法,在乳腺癌细胞系中筛选可能影响p53结合的功能性遗传变异,然后采用大样本病例-对照研究方法,分析p53靶基因结合区域上的遗传变异与中国人群乳腺癌发病风险的关系。关联研究显示,位于VMP1基因上的rs1295925与中国人群乳腺癌的发病风险高度相关,其T等位基因会增加乳腺癌的发病风险。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin , 2011, 61 (2) : 69–90 DOI:10.3322/caac.20107 |
| [2] | Ferlay J,Soerjomataram I,Ervik M,et al. Cancer incidence and mortality worldwide:IARC Cancer Base No. 11[R]. Lyon,France:GLOBOCAN,2012. |
| [3] | Gasco M, Shami S, Crook T. The p53 pathway in breast cancer[J]. Breast Cancer Res , 2002, 4 (2) : 70–76 DOI:10.1186/bcr426 |
| [4] | Harris SL, Levine AJ. The p53 pathway:positive and negative feedback loops[J]. Oncogene , 2005, 24 (17) : 2899–2908 DOI:10.1038/sj.onc.1208615 |
| [5] | Zeron-Medina J, Wang XT, Repapi E, et al. A polymorphic p53 response element in KIT ligand influences cancer risk and has undergone natural selection[J]. Cell , 2013, 155 (2) : 410–422 DOI:10.1016/j.cell.2013.09.017 |
| [6] | Tran NTL, Huang CH. A survey of motif finding Web tools for detecting binding site motifs in ChIP-Seq data[J]. Biol Direct , 2014, 9 : 4 DOI:10.1186/1745-6150-9-4 |
| [7] | Chen W, Song HP, Zhong R, et al. Risk of GWAS-identified genetic variants for breast cancer in a Chinese population:a multiple interaction analysis[J]. Breast Cancer Res Treat , 2013, 142 (3) : 637–644 DOI:10.1007/s10549-013-2775-8 |
| [8] | Chen W, Li JY, Liu C, et al. A functional p53 responsive polymorphism in KITLG,rs4590952,does not affect the risk of breast cancer[J]. Sci Rep , 2014, 4 : 6371 DOI:10.1038/srep06371 |
| [9] | Nikulenkov F, Spinnler C, Li H, et al. Insights into p53 transcriptional function via genome-wide chromatin occupancy and gene expression analysis[J]. Cell Death Differ , 2012, 19 (12) : 1992–2002 DOI:10.1038/cdd.2012.89 |
| [10] | Dusetti NJ, Jiang YF, Vaccaro MI, et al. Cloning and expression of the rat vacuole membrane protein 1(VMP1),a new gene activated in pancreas with acute pancreatitis,which promotes vacuole formation[J]. Biochem Biophys Res Commun , 2002, 290 (2) : 641–649 DOI:10.1006/bbrc.2001.6244 |
| [11] | Ropolo A, Grasso D, Pardo R, et al. The pancreatitis-induced vacuole membrane protein 1 triggers autophagy in mammalian cells[J]. J Biol Chem , 2007, 282 (51) : 37124–37133 DOI:10.1074/jbc.M706956200 |
| [12] | Vaccaro MI, Ropolo A, Grasso D, et al. A novel mammalian trans-membrane protein reveals an alternative initiation pathway for autophagy[J]. Autophagy , 2008, 4 (3) : 388–390 DOI:10.4161/auto.5656 |
| [13] | Molejon MI, Ropolo A, Vaccaro MI. VMP1 is a new player in the regulation of the autophagy-specific phosphatidylinositol 3-kinase complex activation[J]. Autophagy , 2013, 9 (6) : 933–935 DOI:10.4161/auto.24390 |
| [14] | Guo L, Yang LY, Fan C, et al. Novel roles of Vmp1:inhibition metastasis and proliferation of hepatocellular carcinoma[J]. Cancer Sci , 2012, 103 (12) : 2110–2119 DOI:10.1111/cas.12025 |
| [15] | Gilabert M, Vaccaro MI, Fernandez-Zapico ME, et al. Novel role of VMP1 as modifier of the pancreatic tumor cell response to chemotherapeutic drugs[J]. J Cell Physiol , 2013, 228 (9) : 1834–1843 DOI:10.1002/jcp.24343 |
| [16] | Sauermann M, SahinÖ, Sültmann H, et al. Reduced expression of vacuole membrane protein 1 affects the invasion capacity of tumor cells[J]. Oncogene , 2008, 27 (9) : 1320–1326 DOI:10.1038/sj.onc.1210743 |
| [17] | Tasdemir E, Maiuri MC, Galluzzi L, et al. Regulation of autophagy by cytoplasmic p53[J]. Nat Cell Biol , 2008, 10 (6) : 676–687 DOI:10.1038/ncb1730 |
 2016, Vol. 37
2016, Vol. 37