文章信息
- 叶莉霞, 付朝伟, 江峰, 孟炜.
- Ye Lixia, Fu Chaowei, Jiang Feng, Meng Wei.
- 锌指蛋白基因IKZF3多态性与中国长江以南汉族人群系统性红斑狼疮的病例对照研究
- Association between IKZF3 gene polymorphisms and systemic lupus erythematosus in Han ethnic group in southern China: a case-control study
- 中华流行病学杂志, 2016, 37(7): 996-1002
- Chinese Journal of Epidemiology, 2016, 37(7): 996-1002
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.018
-
文章历史
- 投稿日期: 2015-12-23
2. 315010 浙江省宁波市疾病预防控制中心免疫预防所
2. Institute of Immunological Prevention, Ningbo Prefecture Center for Disease Control and Prevention, Ningbo 315010, China
系统性红斑狼疮(SLE)系以多器官受累,多组织损害,高水平的自身抗体为特征的慢性全身性自身免疫性疾病[1, 2]。目前全球发病率为20/10万~150/10万[3],以女性为主,亚洲地区人群的发病率较欧洲地区人群为高,且症状更为严重,其血清自身抗体水平更高[4, 5],在我国是现阶段重要的公共卫生问题[6]。
IKZF3基因位于染色体17q21区域,包含9个外显子。其编码的Aiolos蛋白,是锌指蛋白家族成员。锌指蛋白家族是一组重要的转录因子,对T、B淋巴细胞以及自然杀伤细胞的发育具有重要作用。其中Aiolos蛋白对B淋巴细胞的活化起着至关重要的作用[7]。近年来,IKZF3基因被发现是多种免疫相关疾病的候选基因[8, 9, 10]。美国近期一项研究认为IKZF3多态性可能与SLE有关[11]。目前国内也有一项病例对照研究提示IKZF3 rs907091可能与SLE有关[12]。但国内外尚未见探讨IKZF3 多个单核苷酸多态性(SNP)位点与SLE发病以及临床表型关系的研究。为此本研究以中国长江以南地区汉族人群为研究对象,探讨IKZF3多个SNP位点对SLE发病和临床表型的影响。
对象与方法1. 研究对象:病例组213例,源自苏州大学第一附属医院、复旦大学附属中山医院、杭州市第三人民医院2005年10月至2009年6月住院及门诊SLE病例,均经专业皮肤科医生按照美国风湿病学会(ACR)1997年修订标准诊断[13];对照组为同一时期在该医院体检、不患任何自身免疫疾病的人群共234例。所有纳入对象均为独立个体,无血缘关系,排除合并发生其他免疫相关疾病者。本研究通过复旦大学伦理委员会审查,调查对象均签署知情同意书。
2. SNP位点的选择:根据HapMap dbSNP数据库(www.hapmap.ncbi.nlm.nih.gov),采用HaploView 4.2软件,在IKZF3基因的上游4 000 bp到下游1 500 bp之间选择标签SNP(tagSNPs)rs907091、rs114509391、rs9909593、rs9635726。同时通过文献查阅,还发现rs1453559与免疫相关疾病哮喘有相关性,因此也将该位点纳入本研究。根据HapMap数据,5个SNP位点满足在中国人群的最小等位基因频率(MAF)均>0.05。
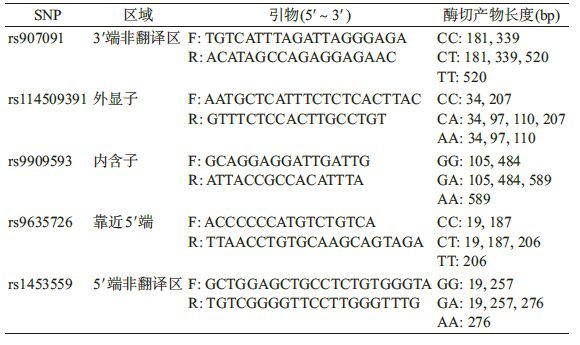
3. 研究方法:采用结构式问卷,由经过统一培训的调查员进行面对面调查,内容包括一般人口学资料和既往环境暴露史,并利用医院的病例管理系统收集临床表型和免疫学表型资料。采集研究对象的外周静脉血5 ml,用EDTA抗凝,保存在-80 ℃冰箱;酚氯仿法提取DNA,分装后采用聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)方法对IKZF3基因rs907091(C/T)、rs114509391(C/A)、rs9909593(G/A)、rs9635726(C/T)、rs1453559(G/A)位点进行基因分型。各位点的上下游引物、限制性内切酶以及酶切产物见表1。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,退火(退火温度依次为52 ℃、51.5 ℃、53.5 ℃、50 ℃、59 ℃)反应30 s,72 ℃反应30 s,循环33次;循环后,72 ℃延伸10 min。扩增产物使用限制性内切酶(依次为MspⅠ、DdeⅠ、BlpⅠ、HindⅡ和KpnⅠ)酶切,37 ℃水浴6 h;酶切产物于2.5%琼脂糖凝胶电泳成像并判断分型。
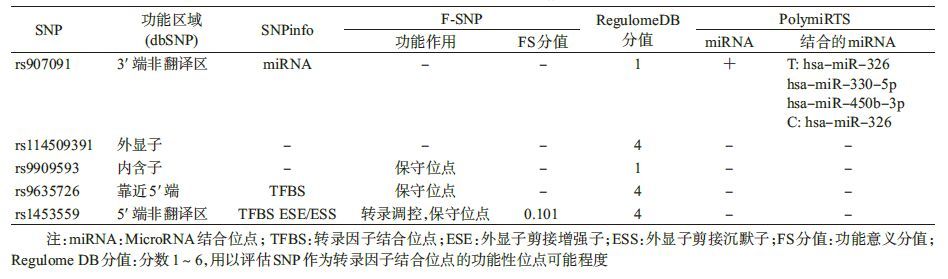
4. 生物信息学分析:采用F-SNP、RegulomeDB、SNPinfo和PolymiRTS等多种综合生物信息数据库,对IKZF3基因的5个SNP位点进行潜在功能预测。①F-SNP(http://compbio.cs.queensu.ca/F-SNP/):对基因多态位点在剪接、转录、翻译及翻译后水平的潜在功能进行预测[14]。②RegulomeDB(http://regulome.stanford.edu/):整合ENCODE和其他数据库资源的分析结果,通过决策树方法对SNP引起的各种基因功能改变进行定量评估和危险度分级。RegulomeDB分值(1~6分),分值越低,表示该SNP越有可能位于功能区域[15]。③SNPinfo(http://snpinfo.niehs.nih.gov/snpinfo/snpfunc.htm):利用对预测功能性位点的两个等位基因不同效应的计算、实验结果、流行病学资料以及GWAS的结果和连锁不平衡信息来对SNP位点进行优化,进一步对疾病致病位点进行精细定位[16]。④PolymiRTS:整合了SNP、整合序列多态性、表型和表达微阵列数据,对预测3′端SNP位点是否是microRNA 目标位点[17]。
5. 统计学分析:采用直接计数法计算基因型和等位基因频率,采用Plink 1.07软件,对各位点基因型进行Hardy-Weinberg(H-W)遗传平衡检验,进行不同遗传模型下(相加、隐性、显性模型)单因素、多因素logistic回归分析,研究IKZF3多态性与SLE之间的关系,并计算5个SNP位点的连锁不平衡情况分析(r2值)。在单纯病例研究中,采用多因素logistic回归分析,使用Stata 12.0软件,研究基因多态性与临床表型(包括器官损伤和血清免疫学指标)之间的相关性。采用HaploView 4.2软件和Plink 1.07软件进行连锁分析和单倍型分析。所有统计学检验均为双侧检验,P<0.05为差异有统计学意义。
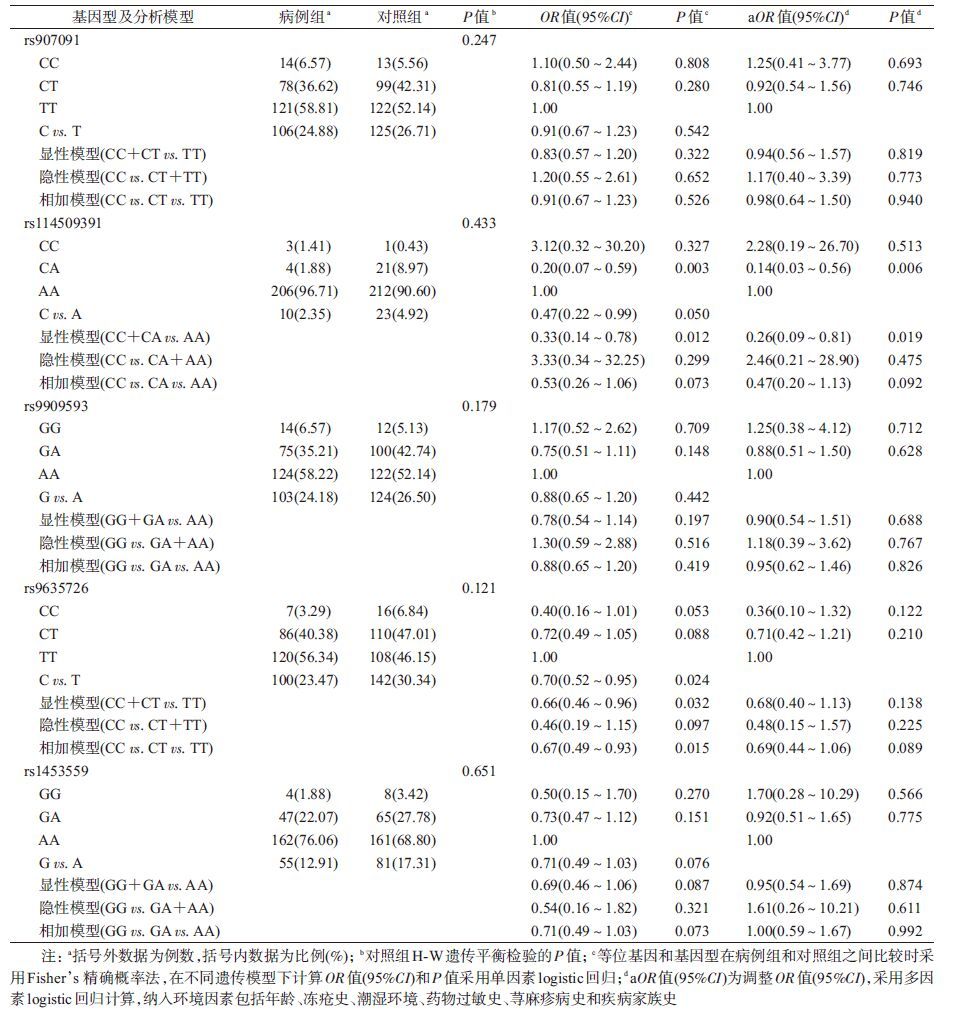
结 果1. 基本情况: 病例组女性200例(93.90%,200/213),对照组女性227例(97.01%,227/234),两组间性别分布差异无统计学意义( χ2=2.53,P=0.108);病例组平均年龄(35.35±11.85)岁,对照组平均年龄(33.17±11.25)岁,差异无统计学意义(t=-1.93,P=0.053)。共对183例病例(85.92%)和184例对照(78.63%)进行环境因素调查,其中冻疮史、居住环境潮湿、紫外线暴露史、药物过敏史、带状疱疹病史、荨麻疹病史和家族疾病史的分布,病例组高于对照组,差异有统计学意义(P<0.05),见表2。考虑到可能存在失访偏倚,对纳入环境因素调查人群和总研究人群的SNP基因型分布进行 χ2检验,结果显示两者分布的差异无统计学意义(P>0.05),提示纳入环境因素调查的人群对总研究人群有很好的代表性。所有SNP基因型分布均符合H-W遗传平衡(表3),提示样本具有很好的代表性。
2. IKZF3基因多态性和SLE易感性相关性:
(1) 基因型及等位基因频率分布:IKZF3基因5个SNP位点的基因型及MAF分布见表3。rs114509391、rs9635726两位点基因型和MAF分布在病例组和对照组间的差异有统计学意义。对于 rs114509391,最小等位基因C的频率病例组低于对照组;基因型分布上,杂合子CA的频率病例组低于对照组,在显性模型下病例组和对照组的分布差异也有统计学意义(表3)。rs9635726的最小等位基因C频率病例组低于对照组;基因型分布上,加性和显性模型均显示,CC、CT基因型的频率病例组高于对照组。rs907091、rs9909593和rs1453559的基因型及MAF分布在病例组和对照组之间的差异无统计学意义(P>0.05)。
(2) 多因素logistic回归分析:环境因素中可能存在潜在混杂因素,因此在相加、隐性、显性模型下,采用多因素logistic回归模型,调整年龄、性别和有统计学意义的危险环境因素(包括冻疮史、居住环境潮湿、药物过敏史、荨麻疹病史和家族疾病史),分析IKZF3基因多态性与SLE易感性的相关性(表3)。结果显示,rs114509391位点的基因型在病例组和对照组中分布的差异有统计学意义,携带CA基因型的个体较携带AA基因型的个体患SLE的风险下降,显性模型也有统计学意义。其他4个SNP位点在所有的遗传模型下均未发现有统计学意义的关联。
随后根据临床表型进行分层分析。证实rs114509391、rs9635726两位点与SLE易感性的相关性。提示rs9909593、rs907091可能也与SLE存在相关性。抗SSB抗体阳性患者与对照组相比,携带rs9909593位点GG和GA基因型的个体,较AA基因型的个体而言,患SLE的风险降低(显性模型:OR=0.31,95%CI:0.11~0.87,P=0.026);抗dsDNA抗体阴性患者与对照组相比,携带rs907091位点CC基因型的个体,较携带CT、TT基因型的个体,患SLE的风险增加(隐性模型:OR=3.75,95%CI:1.08~12.99,P=0.037)。
3. IKZF3基因多态性与SLE临床表型相关性:采用多因素logistic回归模型和单纯病例研究设计,在调整年龄、性别和有统计学意义的危险环境因素(包括冻疮史、居住环境潮湿、药物过敏史、荨麻疹病史和家族疾病史)后,比较某个临床表型阳性和阴性的患者,进一步对IKZF3多态性与SLE的临床表型(包括器官损伤和血清免疫学指标)的相关性进行了分析。结果显示,对于rs907091位点的基因型分布在有/无肾脏损害患者之间的差异有统计学意义(加性模型:OR=0.59,95%CI:0.35~0.98,P=0.043),携带等位基因C的患者较等位基因T者,出现肾脏损害的风险降低;携带rs907091位点CC、CT基因型的患者出现抗SSB抗体阳性的风险,较TT基因型的患者降低(显性模型:OR=0.41,95%CI:0.18~0.96,P=0.040)。此外,对于rs9909593位点,携带GG、GA基因型的患者出现抗SSB抗体阳性的风险也较AA基因型患者下降(显性模型:OR=0.37,95%CI:0.16~0.88,P=0.025)。
4. 连锁不平衡和单倍型分析:连锁不平衡分析显示,rs907091与rs9909593之间存在连锁不平衡(r2>0.8),其他各SNP位点之间的r2值均<0.6(图1)。在5个SNP的单倍型分析中,调整年龄、性别和有统计学意义的危险环境因素(包括冻疮史、居住环境潮湿、药物过敏史、荨麻疹病史和家族疾病史)后发现,单倍型TCATT(rs907091-rs114509391-rs9909593- rs9635726-rs1453559)在病例组的频率为2.04%,低于对照组的5.16%(P=0.027)。

|
| 图1 IKZF3基因连锁不平衡分析 注:方块中的值为2个SNP位点间的r2值(0~100),其颜色越深代表r2值越大 |
5. 生物信息学分析:采用多种SNP功能预测网站,预测IKZF3基因5个SNP位点潜在功能(表4)。结果提示,rs907091是位于3′端非翻译区的MicroRNA结合位点,可结合hsa-miR-326、hsa-miR-330-5p和hsa-miR-450b-3p;RegulomeDB评分为1f,在人类外周血B细胞、T细胞起到强转录因子的作用。rs114509391是外显子,编码锌指蛋白Aiolos 亚型8;根据NCBI的蛋白数据库,该蛋白是调节B淋巴细胞增殖和分化的重要转录因子。rs9909593虽然是内含子,但是其RegulomeDB评分为1f,提示该位点是可能影响绑定与目标基因表达的功能位点,在人类外周血B细胞、T细胞和自然杀伤细胞均是起到了基因增强子的作用;并且rs9909593是一个保守位点,有较大的遗传学意义。rs9635726、rs1453559均为转录调控因子,且为保守位点,有遗传学意义;rs1453559的变异可能影响分子的剪接,从而改变其多种剪接方式的表达水平;rs9635726、rs1453559的Regulome DB评分均为4,在人类外周血B细胞、T细胞中是活跃的转录起始位点(TSS)。
SLE是一种由遗传因素和环境因素共同作用导致的复杂多因素疾病,其病因至今仍不明确。其中组织和器官的损伤,大量自身抗体产生、补体激活、免疫复合物沉积是其主要特征[1, 18]。
IKZF3基因是IKAROS家族转录因子,调节B淋巴细胞的发育和分化。动物实验研究提示,缺乏IKZF3基因的小鼠会出现B细胞功能障碍、自身抗体生产、组织损伤以及SLE症状[19]。此外,有研究表明,SLE患者Aiolos mRNA表达降低,且与SLE活动指数呈一定相关性[20]。提示IKZF3基因可能是SLE的候选基因。近年美国一项IKZF3多态性与SLE发病相关性研究认为IKZF3基因的rs9913957、rs8076347和rs8079075位点在亚洲人群中均无多态性[11]。近期Cai 等[12]在中国人群中的研究提示IKZF3基因的rs907091位点与SLE易感性相关。
本研究关联分析显示,IKZF3的rs114509391位点与SLE的发病有较强的关联性。但生物信息学分析显示,rs114509391是外显子,编码锌指蛋白Aiolos 亚型8,该蛋白在多项研究中被证实是调节B淋巴细胞增殖和分化的重要转录因子[21, 22],而B细胞通路是SLE的重要致病机制之一[23, 24]。分层分析进一步提示rs9635726、rs9909593两位点可能与SLE的发病也存在关联。在Cai 等[12]的研究中也发现了rs9909593位点与SLE存在关联,与本研究结果一致。生物信息学分析进一步提示rs9909593虽是内含子,但影响绑定和目标基因的表达,在B、T细胞中起到基因增强子的作用;而rs9635726是转录调控因子,在B、T细胞中是活跃的转录起始位点。本研究与Cai等[12]的研究结果不一致的是,并未发现rs907091与SLE的发病存在相关性。然而,生物信息学分析结果提示rs907091是MicroRNA结合位点,其结合的miR-326被报道可能在多发性硬化症这种自身免疫性疾病中起到重要作用[25, 26],提示rs907091可能在SLE的病理过程中起到一定作用。临床表型关联性研究中发现rs907091与肾脏损害和抗SSB抗体产生有关,也佐证了rs907091在SLE病理过程的作用。此外本研究还显示rs9909593位点与抗SSB抗体产生相关,可能是由于该位点作为基因增强子,在B细胞通路和抗体产生中起到了作用。单倍型分析显示,单倍型TCATT在病例组的频率较对照组低,可能是一个保护性因素。
总之,本研究通过病例对照研究设计,描述了对IKZF3基因不同功能区域的5个SNP位点与SLE的发病和临床表型间的关系。rs114509391、rs9635726和rs9909593可能与SLE易感性相关,rs9909593、rs907091与SLE的临床表型相关。但本研究仍存在不足。如研究对象仅为单一地区的汉族人群,由于民族、地域的差异,可能在其他人群中无法重复本文结果,有些关联尚与其他研究存在不一致;究其原因,可能是由于OR值较接近1,需要更大的样本量之故。所以今后有待于在不同民族、大样本人群中进一步验证。
| [1] Ghodke-Puranik Y,Niewold TB. Immunogenetics of systemic lupus erythematosus:a comprehensive review[J]. J Autoimmun,2015,64:125-136. DOI:10.1016/j.jaut.2015.08.004. |
| [2] Frieri M. Mechanisms of disease for the clinician:systemic lupus erythematosus[J]. Ann Allergy Asthma Immunol,2013,110(4):228-232. DOI:10.1016/j.anai.2012.12.010. |
| [3] Tsokos GC. Systemic lupus erythematosus[J]. N Engl J Med,2011,365(22):2110-2121. DOI:10.1056/NEJMra1100359. |
| [4] Rider V,Abdou NI. Gender differences in autoimmunity:molecular basis for estrogen effects in systemic lupus erythematosus[J]. Int Immunopharmacol,2001,1(6):1009-1024. DOI:10.1016/S1567-5769(01)00046-7. |
| [5] Jakes RW,Bae SC,Louthrenoo W,et al. Systematic review of the epidemiology of systemic lupus erythematosus in the Asia-Pacific region:prevalence,incidence,clinical features,and mortality[J]. Arthritis Care Res,2012,64(2):159-168. DOI:10.1002/acr.20683. |
| [6] 曹平,赵玉,王静. 系统性红斑狼疮分子病因研究进展[J]. 中国免疫学杂志,2013,29(6):657-661,664. DOI:10.3969/j.issn.1000-484X.2013.06.022. Cao P,Zhao Y,Wang J. Advances in molecular genetic studies of systemic lupus erythematosus[J]. Chin J Immunol,2013,29(6):657-661,664. DOI:10.3969/j.issn.1000-484X.2013.06.022. |
| [7] Cortés M,Georgopoulos K. Aiolos is required for the generation of high affinity bone marrow plasma cells responsible for long-term immunity[J]. J Exp Med,2004,199(2):209-219. DOI:10.1084/jem.20031571. |
| [8] Qiu R,Zhang H,Zhao H,et al. Genetic variants on 17q21 are associated with ankylosing spondylitis susceptibility and severity in a Chinese Han population[J]. Scand J Rheumatol,2013,42(6):469-472. DOI:10.3109/03009742.2013.786755. |
| [9] Kurreeman FAS,Stahl EA,Okada Y,et al. Use of a multiethnic approach to identify rheumatoid-arthritis-susceptibility loci,1p36 and 17q12[J]. Am J Hum Genet,2012,90(3):524-532. DOI:10.1016/j.ajhg.2012.01.010. |
| [10] Marinho S,Custovic A,Marsden P,et al. 17q12-21 variants are associated with asthma and interact with active smoking in an adult population from the United Kingdom[J]. Ann Allergy Asthma Immunol,2012,108(6):402-411.e9. DOI:10.1016/j.anai.2012.03.002. |
| [11] Lessard CJ,Adrianto I,Ice JA,et al. Identification of IRF8,TMEM39A,and IKZF3-ZPBP2 as susceptibility loci for systemic lupus erythematosus in a large-scale multiracial replication study[J]. Am J Hum Genet,2012,90(4):648-660. DOI:10.1016/j.ajhg.2012.02.023. |
| [12] Cai XZ,Qiao Y,Diao C,et al. Association between polymorphisms of the IKZF3 gene and systemic lupus erythematosus in a Chinese Han population[J]. PLoS One,2014,9(10):e108661. DOI:10.1371/journal.pone.0108661. |
| [13] Hochberg MC. Updating the American college of rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum,1997,40(9):1725. |
| [14] Lee PH,Shatkay H. F-SNP:computationally predicted functional SNPs for disease association studies[J]. Nucleic Acids Res,2008,36(Database issue):D820-824. DOI:10.1093/nar/gkm904. |
| [15] Boyle AP,Hong EL,Hariharan M,et al. Annotation of functional variation in personal genomes using RegulomeDB[J]. Genome Res,2012,22(9):1790-1797. DOI:10.1101/gr.137323.112. |
| [16] Xu ZL,Taylor JA. SNPinfo:integrating GWAS and candidate gene information into functional SNP selection for genetic association studies[J]. Nucleic Acids Res,2009,37(Web Server issue):W600-605. DOI:10.1093/nar/gkp290. |
| [17] Bao L,Zhou M,Wu LG,et al. PolymiRTS Database:linking polymorphisms in microRNA target sites with complex traits[J]. Nucleic Acids Res,2007,35(Database issue):D51-54. DOI:10.1093/nar/gkl797. |
| [18] Pan HF,Ye DQ,Li XP. Type 17 T-helper cells might be a promising therapeutic target for systemic lupus erythematosus[J]. Nat Rev Rheumatol,2008,4(7):352-353. DOI:10.1038/ncprheum0815. |
| [19] Sun J,Matthias G,Mihatsch MJ,et al. Lack of the transcriptional coactivator OBF-1 prevents the development of systemic lupus erythematosus-like phenotypes in Aiolos mutant mice[J]. J Immunol,2003,170(4):1699-1706. DOI:10.4049/jimmunol. 170.4.1699. |
| [20] 杨莹,陈晓红,刘样满,等. SLE患者外周血单个核细胞中Aiolos mRNA的表达[J]. 中国皮肤性病学杂志,2013,27(4):331-333,336. Yang Y,Chen XH,Liu YM,et al. The expression of Aiolos mRNA in peripheral blood mononuclear cells (PBMCs)of SLE patients[J]. Chin J Derm Venereol,2013,27(4):331-333,336. |
| [21] Caballero R,Setien F,Lopez-Serra L,et al. Combinatorial effects of splice variants modulate function of Aiolos[J]. J Cell Sci,2007,120(15):2619-2630. DOI:10.1242/jcs.007344. |
| [22] Liippo J,Nera KP,Veistinen E,et al. Both normal and leukemic B lymphocytes express multiple isoforms of the human Aiolos gene[J]. Eur J Immunol,2001,31(12):3469-3474. DOI:10.1002/1521-4141(200112)31:12 <3469::AID-IMMU3469 >3. 0.CO;2-G. |
| [23] Liu XG,Hou M. Immune thrombocytopenia and B-cell-activating factor/a proliferation-inducing ligand[J]. Semin Hematol,2013,50 Suppl 1:S89-99. DOI:10.1053/j.seminhematol.2013.03.021. |
| [24] Hepburn AL,Narat S,Mason JC. The management of peripheral blood cytopenias in systemic lupus erythematosus[J]. Rheumatology,2010,49(12):2243-2254. DOI:10.1093/rheumatology/keq269. |
| [25] Zahednasab H,Balood M. The role of miR-326 and miR-26a in MS disease activity[J]. Gene,2014,548(1):158. DOI:10.1016/j.gene.2014.07.014. |
| [26] Fenoglio C,Ridolfi E,Galimberti D,et al. MicroRNAs as active players in the pathogenesis of multiple sclerosis[J]. Int J Mol Sci,2012,13(10):13227-13239. DOI:10.3390/ijms131013227. |
 2016, Vol. 37
2016, Vol. 37