文章信息
- 赵璇, 程绍辉, 郑敏娜, 李龙, 朱静瑾, 宁铁林.
- Zhao Xuan, Cheng Shaohui, Zheng Minna, Li Long, Zhu Jingjin, Ning Tielin.
- 病毒载量检测对HIV抗体确证实验结果不确定样本的辅助诊断研究
- Study of auxiliary diagnostic value of viral load test for samples with indeterminate HIV antibody detection results
- 中华流行病学杂志, 2016, 37(7): 992-995
- Chinese Journal of Epidemiology, 2016, 37(7): 992-995
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.017
-
文章历史
- 投稿日期: 2016-01-21
《全国艾滋病检测技术规范(2009年版)》中,HIV确证用免疫印迹试验(Western blot,WB)。WB的结果有3种:HIV抗体阳性、阴性和不确定。按照技术规范要求,HIV抗体不确定的样本需结合流行病学资料,在4周后随访检测。随访期间带型有进展但不满足阳性标准的,应继续随访到8周,周期共2个月[1]。而HIV感染的窗口期一般为2~3个月,最长6个月。有队列研究表明,急性期HIV传播能力是其他阶段的26倍[2]。近期研究显示在HIV检测中推荐核酸检测,特别是在急性感染期和晚期,可以减少病毒在高危人群中的传播风险,保证供血安全[3, 4, 5, 6, 7]。本研究通过测定病毒载量是否可以辅助诊断HIV抗体不确定样本进行研究。
本研究在天津市MSM中选择32例抗体不确定的样本作为研究对象,测定其HIV-1病毒载量,并随访进行HIV确证实验,将确证结果与病毒载量结果进行比对,对病毒载量检测的早期诊断价值进行判定。根据检测结果及流行病学情况对感染者及时用药,控制病情,以防止其在社会上继续传播。
对象与方法1. 研究对象:2015年天津市共送检确证样本1 323例,其中阳性963例,阴性226例,不确定134例;在不确定样本中,MSM人群来源样本32例,均选入本研究。
2. 研究方法:天津市所有送检样本按照全国艾滋病检测技术规范,使用HIV抗原抗体(Ag/Ab)诊断试剂盒进行复检实验及WB确证实验。当发现抗体不确定样本时,24 h内进行第一次病毒载量检测,若检测结果>5 000拷贝/ml,48 h内进行第二次采血,进行CD4+T淋巴细胞(CD4)检测及第二次病毒载量检测。如果结果仍>5 000 拷贝/ml,提示为HIV早期感染期,结合其流行病学资料及临床症状等,进行早期药物治疗,在4周后进行WB检测。如果第一次检测结果<5 000 拷贝/ml,但大于检测限(50拷贝/ml),48 h内第二次采血进行病毒载量检测并进行随访。如果第一次检测结果未到检出限,则报告本次试验结果未检出。
复检采用HIV抗原抗体(Ag/Ab)诊断试剂盒(北京万泰生物药业股份有限公司),具体操作参照试剂说明书。确证实验采用HIV-1+2型抗体免疫印迹试剂盒(MP生物医学亚太私人有限公司),具体操作参照试剂说明书。病毒载量检测采用HIV定量检测试剂盒(法国生物梅里埃公司),具体操作参照试剂盒说明书。CD4检测采用美国BD公司生产的FACSCalibur流式细胞仪与四色试剂: CD3FITC/ CD8PE/CD45PerCP/CD4APC。
WB确证实验结果判定标准:①至少有2条 env带(gp41和gp160/gp120)出现,或至少1条env带和p24带同时出现;②符合试剂盒提供的阳性判定标准。HIV抗体不确定是指出现HIV抗体特异带,但不足以判定阳性。HIV抗体阴性是指无HIV抗体特异带出现。病毒载量>5 000 拷贝/ml提示为HIV早期感染[8],最低检测限为50拷贝/ml。
3. 统计学分析:全部数据核实后,采用EpiData软件,双盲录入数据后,进行一致性比较和修改错误录入数据,直到两个数据库达到一致性。统计学分析采用SAS 9.3软件。采用一元线性回归分析病毒载量值和CD4值、CD4 ∶ CD8比值之间的关系。在α=0.05 的水平下,P<0.05 表示差异有统计学意义。
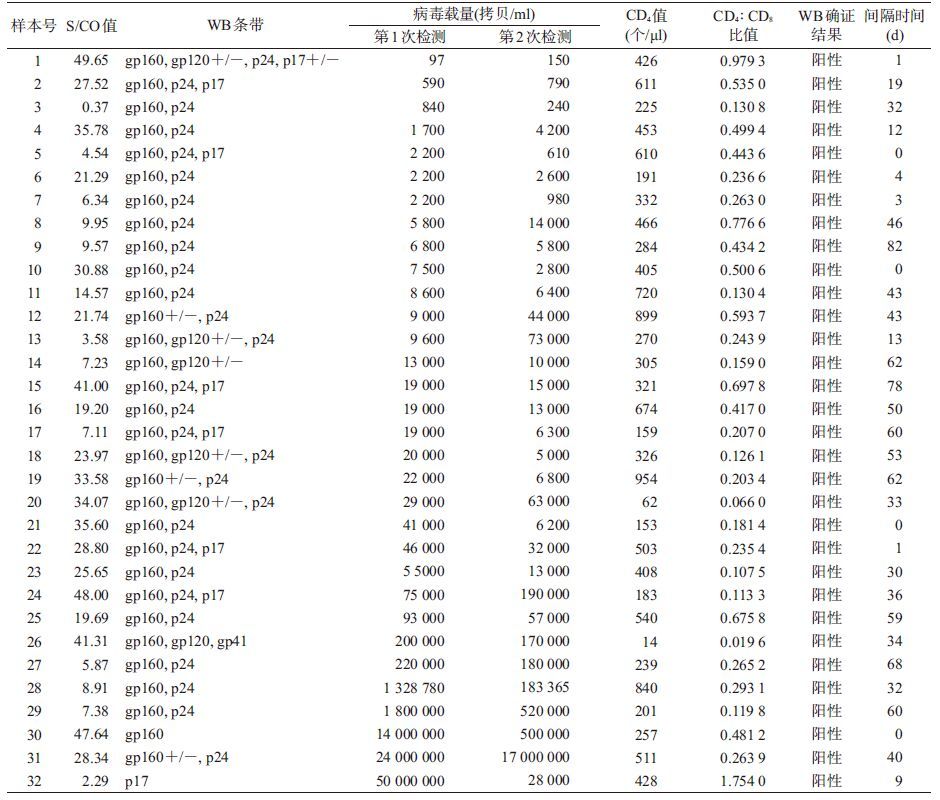
结 果1. 不确定样本ELISA的S/CO值分布:32例不确定样本S/CO值阴性1例,1~10间11例,>10共20例,见表1。
2. 不确定样本WB带型分布及随访转归:32例不确定样本中31例有gp160条带,占96.9%,28例有p24条带,占87.5%,4周后经随访确证,均转为阳性,见表1。
3. 不确定样本ELISA、WB及两次病毒载量分布情况: 32例不确定样本中,有7例两次病毒载量结果均<5 000 拷贝/ml,其中3例两次病毒载量结果均<1 000 拷贝/ml,有1例样本病毒载量值最低,为97 拷贝/ml,经1个月后随访确证为阳性。有1例样本的病毒载量结果一次>5 000 拷贝/ml,一次<5 000 拷贝/ml,24例样本的两次病毒载量结果均>5 000 拷贝/ml,见表1。
4. 不确定样本CD4值及CD4 ∶ CD8比值分布情况:32例不确定样本CD4值0~200个/μl共6例,200~500个/μl共16例,>500个/μl共9例;CD4 ∶ CD8结果<0.1共2例,0.1~0.2共8例,0.2~0.4共9例,0.4~0.9共12例,>1共1例,见表1。
病毒载量值与CD4值,CD4 ∶ CD8比值相关性分析:取自变量为病毒载量值,因变量为CD4值、CD4 ∶ CD8比值,回归方程显著性检验F值分别为0.15和0.14,参数检验中t值分别为0.39和0.38,P值分别为0.696 9和0.708 7。结果显示,病毒载量值与CD4值或CD4 ∶ CD8比值之间不存在线性相关关系。
5. 不确定样本两次病毒载量检测时间与WB检测阳转时间间隔:<5 d共6例,10~20 d共3例,20~30 d共2例,30~40 d共6例,40~50 d共5例,50~60 d共5例,>60 d共5例。见表1。
讨 论在HIV抗体不确定样本ELISA 实验中,1例样本的ELISA实验结果阴性,样本在初筛检测时为弱阳性,所以被纳入本研究。21例样本的S/CO值>10,32例样本在之后1~2个月的随访中抗体全部阳转,提示在对男男性行为高危人群检测时,如果该地区没有核酸检测的条件,高S/CO值可作为辅助WB不确定样本判定的参考。
本研究中,HIV抗体不确定样本的WB条带主要为p24和gp160。有数据显示,在HIV-1感染的血清阳转期,p24 出现的概率为38%[9]。提示来自MSM人群的样本,其WB不确定结果为p24、gp160和其他条带时,应高度怀疑为HIV早期感染。在判断这类样本时要慎重对待,有条件的要检测核酸。根据高危行为的相关数据,采取阳性咨询的倾向并提供及时的随访复查,建议缩短随访时间,2周后随访。目前,用于急性HIV感染检测的生物标记物的核酸检测的窗口期为9~11 d[8]。较三代ELISA抗体检测和四代ELISA抗原抗体检测窗口期分别缩短了约12 d和5 d[10]。因此,使用核酸检测,可以明显提高检测敏感性。由于急性感染期HIV以指数形式增长,其病毒载量值可高达106拷贝/ml,形成高病毒血症。有研究表明56%~92%的新感染是由处在这个时期的感染者传播的[11]。因此,及时发现处于急性期的感染者,能够有效降低传播危险。
有研究表明“HIV 抗体不确定”样本的检出数量和比例越来越高[12],很多感染者尤其是MSM人群,在感染初期,可能不清楚自己的感染情况,并从事高危行为[5]。本研究结果显示从两次病毒载量检测>5 000 拷贝/ml到确证阳性间隔最长可达到80 d,这段时间的延迟会增加传播风险及献血风险。本研究采取的策略可以缩短不确定样本随访日期0~80 d,及早进行抗病毒治疗。而早期抗病毒治疗对于控制病毒传播是非常重要的。在瑞士的一项研究中表明停止MSM人群早期抗病毒治疗会出现大量新发感染者,说明目前预防措施并不完善[13]。对患者来说,及早抗病毒治疗能够降低HIV感染后患者的死亡率,促进免疫功能重建,明显降低体内病毒载量。
欧洲地区新的检测规范规定不确定样本如果检测到HIV-1 RNA,经过1~2周需重新采血检测,如果病毒载量<1 000 拷贝/ml,不能作为判定感染的依据[14]。而本研究有3例样本两次病毒载量值均<1 000 拷贝/ml,低于急性期感染的一般水平[15],但经随访均转为阳性,提示不能忽视低拷贝样本,国外研究发现较高的CD4计数水平及较高的CD4 ∶ CD8比值与低HIV RNA水平相关。与本研究结果不符,本研究结果显示,CD4计数水平高低、CD4 ∶ CD8比值与HIV RNA水平高低并无相关性。另外有报道发现人白细胞抗原(HLA)-C、B水平、丙型肝炎抗体阳性和特异配体杀伤细胞免疫球蛋白样受体(KIR)等位基因变异[16, 17, 18, 19, 20, 21]均与低水平HIV RNA相关,有待进一步研究。
本研究中134例抗体不确定样本,其中32例来源于MSM人群,HIV感染率为4%,而其他102例样本均来源于临床,WB实验出现条带多为非特异性反应,所以未纳入本研究。
本研究存在不足之处:CD4计数水平、CD4 ∶ CD8与病毒载量水平无相关性,可能是样本量较少引起的,需要扩大样本量进行检测。
利益冲突 无
| [1] 中国疾病预防控制中心. 全国艾滋病检测技术规范(2009年修订版)[Z]. 2009. Chinese Center for Disease Control and Prevention. National guideline for detection of HIV/AIDS (2009)[Z]. 2009. |
| [2] Hollingsworth TD,Anderson RM,Fraser C. HIV-1 transmission,by stage of infection[J]. J Infect Dis,2008,198(5):687-693. DOI:10.1086/590501. |
| [3] Tang JW,Wong BCK,Lam E,et al. Failure to confirm HIV infection in two end-stage HIV/AIDS patients using a popular commercial line immunoassay[J]. J Med Viro,2008,80(9):1515-1522. DOI:10.1002/jmv.21248. |
| [4] Patel P,Bennett B,Sullivan T,et al. Rapid HIV screening:missed opportunities for HIV diagnosis and prevention[J]. J Clin Viro,2012,l54(1):42-47. DOI:10.1016/j.jcv.2012.01.022. |
| [5] Masciotra S,Smith AJ,Youngpairoj AS,et al. Evaluation of the CDC proposed laboratory HIV testing algorithm among men who have sex with men (MSM)from five US metropolitan statistical areas using specimens collected in 2011[J]. J Clin Virol,2013,58 Suppl 1:e8-12. DOI:10.1016/j.jcv.2013.09.002. |
| [6] Krajden M,Cook D,Mak A,et al. Pooled nucleic acid testing increases the diagnostic yield of acute HIV infections in a high-risk population compared to 3rd and 4th generation HIV enzyme immunoassays[J]. J Clin Virol,2014,61(1):132-137. DOI:10.1016/j.jcv.2014.06.024. |
| [7] Li JJ,Zhang HM,Shen ZY,et al. Screening for acute HIV infections and estimating HIV incidence among female sex workers from low-grade venues in Guangxi,China[J]. PLoS One,2014,9(6):e99522. DOI:10.1371/journal.pone.0099522. |
| [8] Han XX,Xu JJ,Chu ZX,et al. Screening acute HIV infections among Chinese men who have sex with men from voluntary counseling & testing centers[J]. PLoS One,2011,6(12):e28792. DOI:10.1371/journal.pone.0028792. |
| [9] Busch MP,Satten GA,Herman SA,et al. HIV plasma RNA for confirmation of HIV p24 Ag/anti-HIV reactivity in seroconverting (SC)donors[J]. Transfusion,1996,36:37-44. |
| [10] Yazdanpanah Y,Sloan CE,Charlois-Ou C,et al. Routine HIV screening in France:clinical impact and cost-effectiveness[J]. PLoS One,2010,5(10):e13132. DOI:10.1371/journal.pone. 0013132. |
| [11] Wawer MJ,Gray RH,Sewankambo NK,et al. Rates of HIV-1 transmission per coital act,by stage of HIV-1 infection,in Rakai,Uganda[J]. J Infect Dis,2005,191(9):1403-1409. DOI:10. 1086/429411. |
| [12] Liu MQ,Zhu ZR,Kong WH,et al. High rate of missed HIV infections in individuals with indeterminate or negative HIV western blots based on current HIV testing algorithm in China[J]. J Med Virol,2016. DOI:10.1002/jmv.24490. |
| [13] Rieder P,Joos B,von Wyl V,et al. HIV-1 transmission after cessation of early antiretroviral therapy among men having sex with men[J]. AIDS,2010,24(8):1177-1183. DOI:10.1097/QAD.0b013e328338e4de. |
| [14] Gökengin D,Geretti AM,Begovac J,et al. 2014 European guideline on HIV testing[J]. Int J STD AIDS,2014,25(10):695-704. DOI:10.1177/0956462414531244. |
| [15] Fiebig EW,Wright DJ,Rawal BD,et al. Dynamics of HIV viremia and antibody seroconversion in plasma donors:implications for diagnosis and staging of primary HIV infection[J]. AIDS,2003,17(13):1871-1879. DOI:10.1097/00002030-200309050-00005. |
| [16] Kulkarni S,Savan R,Qi Y,et al. Differential microRNA regulation of HLA-C expression and its association with HIV control[J]. Nature,2011,472(7344):495-498. DOI:10.1038/nature09914. |
| [17] Martin MP,Qi Y,Gao XJ,et al. Innate partnership of HLA-B and KIR3DL1 subtypes against HIV-1[J]. Nat Genet,2007,39(6):733-740. DOI:10.1038/ng2035. |
| [18] McLaren PL,Coulonges C,Ripke S,et al. Association study of common genetic variants and HIV-1 acquisition in 6300 infected cases and 7200 controls[J]. PLoS Pathog,2013,9(7):e1003515. DOI:10.1371/journal.ppat.1003515. |
| [19] Pereyra F,Jia XM,McLaren PJ,et al. The major genetic determinants of HIV-1 control affect HLA classⅠpeptide presentation[J]. Science,2010,330(6010):1551-1557. DOI:10.1126/science.1195271. |
| [20] Thomas R,Apps R,Qi Y,et al. HLA-C cell surface expression and control of HIV/AIDS correlate with a variant upstream of HLA-C[J]. Nat Genet,2009,41(12):1290-1294. DOI:10.1038/ng.486. |
| [21] Law MG,Achhra A,Deeks SG,et al. Clinical and demographic factors associated with low viral load in early untreated HIV infection in the INSIGHT Strategic Timing of AntiRetroviral Treatment (START)trial[J]. HIV Med,2015,16 Suppl 1:S37-45. DOI:10.1111/hiv.12232. |
 2016, Vol. 37
2016, Vol. 37