文章信息
- 李巧玲, 丁玲, 南晶, 刘春亮, 杨作凯, 陈芳, 梁雅丽, 王金桃.
- Li Qiaoling, Ding Ling, Nan Jing, Liu Chunliang, Yang Zuokai, Chen Fang, Liang Yali, Wang Jintao.
- 叶酸与甲基-CpG-结合蛋白2基因表达在宫颈癌变中的关系及交互作用
- Relationship and interaction between folate and expression of methyl-CpG-binding protein 2 in cervical cancerization
- 中华流行病学杂志, 2016, 37(7): 985-991
- Chinese Journal of Epidemiology, 2016, 37(7): 985-991
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.016
-
文章历史
- 投稿日期: 2016-01-15
叶酸具有参与和调节DNA甲基化的生物学功能,叶酸缺乏与DNA甲基化异常均与宫颈癌的发生密切相关[1, 2]。国内外和本课题组前期研究结果均提示,叶酸缺乏可增加宫颈癌及其癌前病变的患病风险[3, 4]。叶酸缺乏导致甲基化模式紊乱,特别是引起抑癌基因启动子区CpG岛的甲基化[5],提示叶酸与抑癌基因的甲基化过程有关。甲基-CpG-结合蛋白2(MeCP2)是DNA甲基化CpG岛结合蛋白(MBD)家族中的重要一员,可与甲基化的DNA特异性结合,广泛参与抑癌基因甲基化导致的转录沉默过程[6]。有研究报道在结肠黏液性腺癌、乳腺癌、前列腺癌等多种肿瘤中存在MeCP2表达的异常。本课题组前期体外细胞干预实验结果显示,随着叶酸水平的升高,宫颈癌细胞中MeCP2蛋白和mRNA表达均呈下降趋势[7]。但基于人群研究的结果未见报道,叶酸与MeCP2在宫颈癌变过程中的关系尚不明确。为此本研究以不同宫颈病变患者为研究对象,通过检测血清叶酸和红细胞叶酸水平以及MeCP2蛋白和mRNA的表达量,综合分析叶酸与MeCP2在宫颈病变中的作用和相互关系,以期为宫颈癌的病因研究提供新的理论依据。
对象与方法1. 研究对象:选取2009年9月至2010年12月在山西省肿瘤医院、山西医科大学第二医院、介休市妇幼保健院和太原市妇幼保健院经病理学确诊的宫颈鳞状细胞癌(SCC)患者41例,宫颈上皮内瘤样变(CIN)患者71例(34例CIN1,37例CIN2+)以及61名宫颈正常(NC)妇女为研究对象。所有研究对象均排除营养性巨幼细胞贫血、溶血性疾病、白血病、消化道疾病、其他肿瘤患者以及3个月内B族维生素使用者,并在知情同意情况下进入研究。
2. 资料收集:应用结构式问卷收集研究对象的人口学特征、生殖情况、生活习惯、妇科病史、肿瘤家族史等资料。采集全部研究对象于入院后、系统治疗前清晨空腹静脉血(抗凝血和非抗凝血)5 ml,对非抗凝血进行离心处理分离血清,置于-80 ℃冰箱贮存待检。同时收集全部研究对象宫颈组织标本(手术或活组织检查),立即放入液氮罐,低温运至实验室后放入-80 ℃冰箱贮存待检。
3. 实验方法: (1)PCR检测HPV:采用酚-氯仿蛋白酶K法从宫颈组织中提取DNA,参照本实验室前期建立的PCR扩增方法检测 HPV感染状况[8]。
(2)Western blot法检测宫颈组织中MeCP2蛋白表达水平:取冻存宫颈组织(10~50 mg),加入适量WIP裂解液和PMSF的混合液,冰浴中匀浆,充分裂解。参照本实验室前期建立的方法检测MeCP2蛋白表达水平[9]。MeCP2一抗为1 ∶ 2 000稀释的兔抗人单克隆抗体(Abcam Inc.,British),内参蛋白(β-actin)为1 ∶ 1 000稀释的兔抗人 β-肌动蛋白抗体。在相对分子质量53×103和43×103处分别获得MeCP2和β-actin特异性抗体结合蛋白条带。利用Quantity One软件分析各条带的A值,将目的条带与β-actin条带A值的比值作为MeCP2蛋白的相对表达量。
(3)荧光定量PCR检测宫颈组织中MeCP2 mRNA 表达量:取冻存的宫颈组织约20 μg,剪碎后放入EP管中,加入1 ml的RNAisoTM Plus(日本TaKaRa公司),使用组织匀浆机充分粉碎,提取总RNA(Trizol法)。参照本实验室前期建立的方法[10],获得MeCP2的特异性扩增曲线和溶解曲线。以MeCP2 Ct值/β-actin Ct值表示MeCP2 mRNA相对表达量,Ct值是扩增产物的荧光信号到达阈值时所经过的循环次数,Ct值越小,荧光达到阈值的循环数越少,Ct比值越小,对应的mRNA表达水平越高,反之亦然。
(4)微生物法测定血清叶酸和红细胞与叶酸水平:用1%抗坏血酸溶液处理血清和全血样本,-20 ℃保存。参照本实验室前期建立的方法[11],将干酪乳酸杆菌L-casei(ATCC7469,中国科学院菌种保藏中心)接种于装有乳酸杆菌肉汤培养基的试管中,增菌纯化后用5 ml生理盐水悬浮,制成菌悬液。在无菌操作条件下向每支已灭菌的标准叶酸空白管、标准系列管[叶酸浓度(ng/ml)为0.01、0.02、0.04、0.08、0.12、0.14、0.16、0.20、0.30、0.40]和样品管接种50 μl菌悬液,混匀,留一支标准管不接种,用于测定A值时调零。37 ℃避光孵育24 h,置于721-分光光度计(λ=660 mm)比浊,测定标准叶酸空白管、标准管和样品管的A值。以标准系列管中叶酸含量为横坐标,A值为纵坐标,绘制叶酸标准曲线,由标准曲线查出该试管的血清叶酸和全血叶酸浓度。血清和红细胞叶酸含量按公式计算:血清叶酸浓度(ng/ml)=样本血清叶酸浓度×50,红细胞叶酸浓度(ng/ml)=[样本全血叶酸浓度×100-样本血清叶酸浓度×50]/红细胞压积。
4. 统计学分析:采用SPSS 20.0软件进行相关资料的Kruskal-Wallis H检验、 χ2检验、 χ2趋势检验、Spearman秩相关分析、因素与宫颈疾病之间关联强度(OR值及其95%CI)分析。采用广义多因子降维(GMDR)软件进行交互作用评价[12]。检验水准α=0.05。
结 果1. 人口学特征及相关因素分析:NC、CIN1、CIN2+、SCC组的年龄中位数(最小至最大年龄)分别为41(27~57)、43(29~63)、46(29~64)、50(36~70)岁。各组间在民族、出生地、居住地、婚姻状况、吸烟、饮酒、经期性生活、产次、肿瘤家族史等方面的差异均无统计学意义(P>0.05),但在HPV感染( χ2=17.73,P<0.001)、年龄( χ2=21.15,P=0.012)、文化程度( χ2=65.80,P<0.001)、人工流产史( χ2=9.39,P=0.025)、妇科病史( χ2=54.62,P<0.001)、洗阴频率( χ2=57.80,P<0.001)、孕次( χ2=16.09,P=0.011)、职业( χ2=16.30,P<0.001)、性生活后清洗( χ2=18.13,P<0.001)、月经初潮年龄( χ2=17.49,P=0.008)等方面差异均有统计学意义。
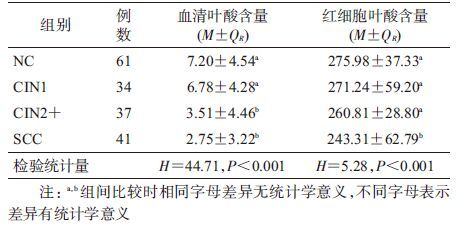
2. 叶酸与宫颈病变的关系:血清叶酸和红细胞叶酸水平均不服从正态分布,经Kruskal-Wallis H检验,血清叶酸(H=44.71,P<0.001)与红细胞叶酸水平(H=5.28,P<0.001)在不同宫颈病变组间差异均有统计学意义,且血清叶酸与红细胞叶酸呈正相关(r=0.270,P<0.001)。调整检验水准为α=0.008 3(α=0.05/比较次数=0.05/6),采用Bonferroni法两两比较后发现,血清叶酸水平在SCC组和CIN2+组均低于CIN1组和NC组,差异有统计学意义,但SCC组与CIN2+组,CIN 1组与NC组间的差异均无统计学意义,红细胞叶酸在SCC组与NC、CIN1或CIN2+组的差异均有统计学意义,而NC、CIN1或CIN2+组间差异均无统计学意义(表1)。
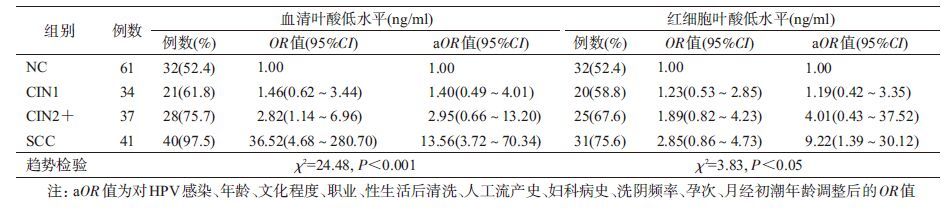
进一步以NC组血清叶酸和红细胞叶酸水平的P50值(7.20 ng/ml和275.98 ng/ml)作为叶酸低水平的分界点进行定性分析,以NC组为对照进行OR值和调整(a)OR值及其95%CI的计算,结果显示,随着宫颈病变程度的加重,血清叶酸(趋势检验 χ2=24.48,P<0.001)与红细胞叶酸水平(趋势检验 χ2=3.83,P<0.05)均呈逐渐降低趋势(表2)。
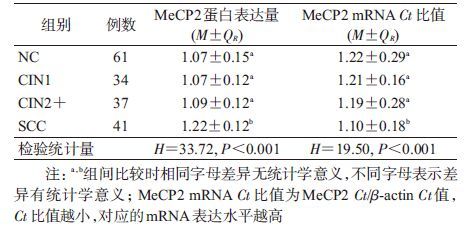
3. MeCP2与宫颈病变的关系:MeCP2蛋白与mRNA表达量均为非正态分布,经Kruskal-Wallis H 检验,MeCP2蛋白(H=33.72,P<0.001)与mRNA(H=19.50,P<0.001)表达量在不同宫颈病变组间差异均有统计学意义。采用Bonferroni法,以调整检验水准α=0.008 3(α=0.05/比较次数=0.05/6)两两比较后发现,MeCP2蛋白与mRNA表达量在SCC组与NC、CIN1或CIN2+组的差异均有统计学意义,而NC、CIN1或CIN2+组间差异均无统计学意义(表3)。
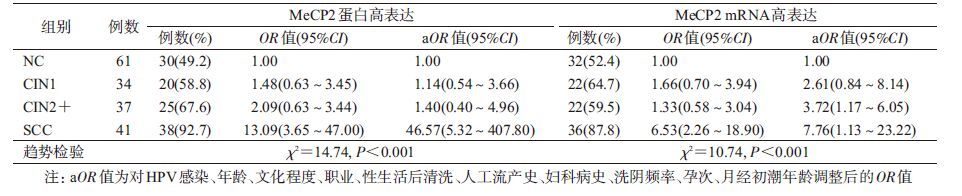
进一步以NC组的MeCP2蛋白和mRNA表达量的P50值(1.07和1.22)作为MeCP2高表达的分界点进行定性分析,以NC组为对照进行OR值和aOR值及其95%CI的计算。结果显示,随着宫颈病变程度的进展,MeCP2蛋白(趋势检验 χ2=14.74,P<0.001)和mRNA(趋势检验 χ2=10.74,P<0.001)表达量均呈逐渐升高趋势(表4)。
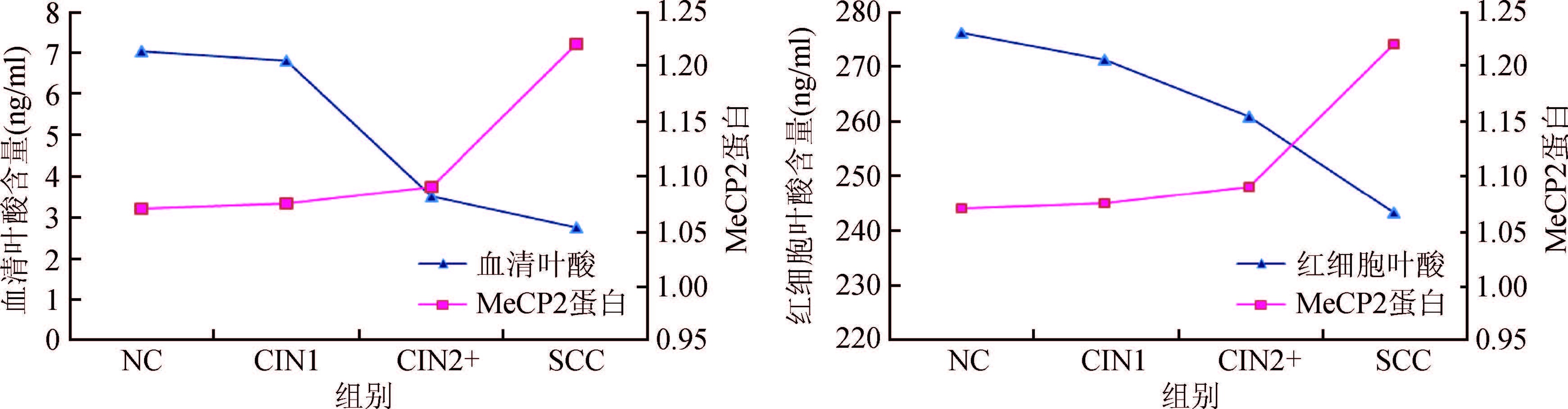
4. 叶酸与MeCP2蛋白在宫颈癌变中的相关关系:采用Spearman秩相关分析显示,血清叶酸水平与MeCP2蛋白表达量(r=-0.226,P=0.003),红细胞叶酸水平与MeCP2蛋白表达量(r=-0.164,P=0.004)均呈负相关(图1)。而叶酸与MeCP2 mRNA相关分析未显示有统计学意义。
|
| 图1 不同宫颈病变组血清叶酸、红细胞叶酸平均水平与MeCP2蛋白平均表达量的关系 |
5. 叶酸与MeCP2在各宫颈病变组中交互作用的GMDR分析:血清叶酸与红细胞叶酸是衡量机体叶酸营养状况最常用的两项指标,尽管两者存在相关,但血清叶酸是衡量机体近期叶酸水平的有效指标,红细胞叶酸主要反应机体叶酸的长期稳定状态;基因表达是从DNA→mRNA→蛋白的连续过程,mRNA和蛋白分别是基因转录和翻译水平的产物,蛋白水平和mRNA水平表达不一定一致。
GMDR具有分析相关变量克服共线性问题的优势,而且该模型不需要指定交互作用模式(线性或非线性模型,加法还是乘法模型),基于此,本研究采用GMDR模型进行交互作用评价。
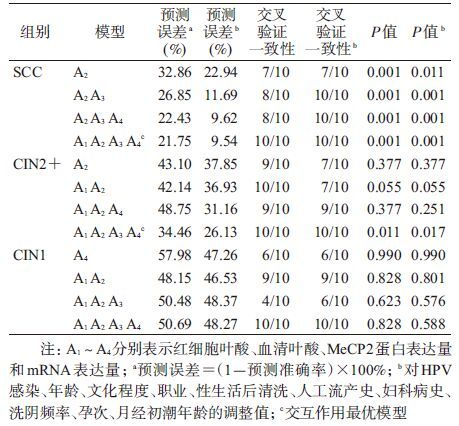
以NC组叶酸水平的P50值和MeCP2表达量的P50值分别作为叶酸低水平及MeCP2高表达的界值,将叶酸低水平赋值为1,高水平赋值为0,MeCP2蛋白和mRNA低表达赋值为0,高表达赋值为1,宫颈病变结局赋值为0或1,即NC组赋值为0,CIN1、CIN2+和SCC组赋值为1。以NC组为对照,将血清叶酸、红细胞叶酸、MeCP2蛋白和MeCP2 mRNA四个因素纳入GMDR模型,通过GMDR提供的logistic回归将影响宫颈癌变的混杂因素作为协变量加以控制,以预测误差最低和交叉验证一致性最高且置换检验有统计学意义(P<0.05)的模型为GMDR分析的最佳交互作用模型。结果显示,在SCC组和CIN2+组,交互作用最佳模型均为血清叶酸缺乏、红细胞叶酸缺乏、MeCP2蛋白高表达和MeCP2 mRNA高表达之间的交互作用,预测误差分别为21.75%和34.46%,交叉验证一致性均达到了10/10,且置换检验均有统计学意义(P<0.05),在调整影响宫颈癌变的协变量后这种效应更为明显,预测误差降低为9.54%和21.63%。在CIN1组未发现类似交互作用存在(P>0.05),见表5。
宫颈癌是仅次于乳腺癌的全球第二高发妇科恶性肿瘤[13],其发生是由癌前病变逐步演变为癌的连续过程,通常为CIN1-CIN2-CIN3-宫颈原位癌-宫颈早期浸润癌-宫颈浸润癌[14, 15]。HPV反复或持续感染是宫颈癌发生的主要而非唯一因素[16, 17, 18],寻找其他致癌因子或协同HPV致癌因素成为多数学者关注的焦点。作为表观遗传的核心内容,DNA甲基化被认为是在肿瘤发生过程中重要的早期事件,在多种肿瘤发生中起到重要作用。研究显示,DNA甲基化水平和模式的紊乱普遍存在于各种癌症的发生发展过程中[2, 19, 20]。叶酸作为甲基基团的主要供体参与了DNA的甲基化过程[21],缺乏时可影响基因组的甲基化状态,参与肿瘤的发生[3, 5]。本课题组在国内首次报道了叶酸与宫颈癌的关系,研究显示随着叶酸水平降低,患宫颈癌的危险性增加[4]。本次研究采用微生物法同时检测了宫颈病变患者的血清叶酸和红细胞叶酸水平,结果显示,血清叶酸和红细胞叶酸之间呈正相关,从NC、CIN1、CIN2+到SCC组,两者均逐渐降低,随着叶酸水平的降低,宫颈癌患病风险增加,经校正影响宫颈癌变的其他因素后,这种效应仍然存在,再次验证了叶酸缺乏可增加宫颈癌发生风险的结论。同时提示合理补充叶酸对于有效降低宫颈癌及其癌前病变的发病风险可能具有重要意义,当然对于叶酸补给的具体剂量尚需依据人群的不同情况予以深入探讨和确定。
在DNA甲基化阻遏基因表达的过程中,DNA甲基化CpG岛结合蛋白(MBD)起着重要作用。MeCP2是第一个被发现的可以特异性识别DNA甲基化的MBD家族成员,MeCP2通过与甲基化的CpG残基区结合,形成稳定的转录抑制复合体,该复合体造成染色质的重构、浓缩,导致基因表达沉默 ,这被认为是甲基化长期沉默的原因[22, 23]。Xu等[24]和Müller等[25]在乳腺癌研究中发现,肿瘤组织中MeCP2的表达高于非肿瘤组织。Bernard等[26]的研究显示MeCP2可以促进前列腺癌细胞的生长。Song等[27]研究表明,相对于正常及其他肿瘤组织,MeCP2在结肠黏液性腺瘤,尤其是侵袭性结直肠癌组织中异常高表达。本研究采用Western blot和荧光定量PCR对MeCP2基因表达量的研究结果显示,随着宫颈病变程度的加重,MeCP2蛋白和mRNA的表达量均逐渐增加,提示MeCP2表达异常增高,可增加宫颈癌及其癌前病变的风险,尤其在宫颈上皮内瘤变阶段即有MeCP2蛋白及mRNA的异常升高,对宫颈癌变具有一定的预警意义。
叶酸缺乏导致甲基化模式紊乱,突出表现为基因组整体的低甲基化及抑癌基因CpG岛的高甲基化[28]。在小鼠叶酸和甲基缺乏性饮食诱导的肝癌模型研究中发现,在癌变早期就出现了MeCP2蛋白表达的增加[29]。本实验室前期采用体外干预实验表明,随着叶酸水平的升高,C33A和Caski宫颈癌细胞中MeCP2蛋白与mRNA表达均逐渐下降,提示补充叶酸可逆转MeCP2蛋白及mRNA的异常高表达[7]。基于此,本研究进一步对不同级别宫颈病变患者叶酸与MeCP2关系的研究显示,随着宫颈病变程度的加重,叶酸含量呈降低趋势,而MeCP2表达水平呈上升趋势,两者之间存在负相关关系。
logistic回归模型是流行病学研究中常用的分析影响因素作用的方法,该方法利用纳入乘积项的方法分析因素间交互作用,如有统计学意义表示存在相乘交互作用,但乘积项无统计学意义并不表示相加或生物学交互作用的有或无,而且实际分析中还可能遇到有相乘交互作用但不一定有相加交互作用的情况[30]。GMDR是近年来新发展的能够同时检测并刻画影响疾病的多基因联合作用的方法,该法并不需要指定交互作用模式(线性或非线性模型,加法或乘法模型),该模型的优势是通过将变量从n个维度减少到1个维度发现高阶的交互作用,而且还能分析相关的变量克服共线性的问题[31],此外GMDR模型能够纳入协变量,从而控制协变量引起的干扰。基于GMDR模型分析显示,在SCC组和CINⅡ/Ⅲ组,血清叶酸缺乏、红细胞叶酸缺乏、MeCP2蛋白高表达和MeCP2 mRNA高表达之间存在交互作用,预测误差分别为21.75%和34.46%,交叉验证一致性均达到了10/10,且置换检验均有统计学意义(P<0.05),调整影响宫颈病变的协变量后这种效应更为明显,预测误差降低为9.54%和21.63%。结果提示,机体叶酸缺乏与MeCP2高表达同时存在时,可增加宫颈癌及癌前病变发生的风险,尤其在宫颈癌变进展的后期更为明显,但其详细机制有待深入研究。
本研究从人群研究的角度揭示了叶酸缺乏与MeCP2基因的转录水平和蛋白水平功能活跃在宫颈病变的恶性演进中均具有重要作用,当叶酸缺乏与MeCP2高表达同时存在时,其作用具有协同效应。结合叶酸干预实验,提出在宫颈病变过程中,叶酸缺乏可能引起基因组的甲基化状态紊乱,进而导致 MeCP2高表达促进了宫颈病变进展的可能分子机制,为寻找宫颈癌及其癌前病变干预和治疗的生物靶点开拓了新的思路。
利益冲突 无
| [1] Pathak S,Bhatla N,Singh N. Cervical cancer pathogenesis is associated with one-carbon metabolism[J]. Mol Cell Biochem,2012,369(1/2):1-7. DOI:10.1007/s11010-012-1362-3. |
| [2] Mersakova S,Nachajova M,Szepe P,et al. DNA methylation and detection of cervical cancer and precancerous lesions using molecular methods[J]. Tumor Biol,2016,37(1):23-27. DOI:10.1007/s13277-015-4197-1. |
| [3] Wang JT,Ding L,Jiang SW,et al. Folate deficiency and aberrant expression of DNA methyltransferase 1 were associated with cervical cancerization[J]. Curr Pharm Des,2014,20(11):1639-1646. DOI:10.2174/13816128113199990543. |
| [4] 王金桃,马晓晨,程玉英,等. 叶酸与宫颈癌关系的病例对照研究[J]. 中华流行病学杂志,2006,27(5):424-427. Wang JT,Ma XC,Cheng YY,et al. A case-control study on the association between folate and cervical cancer[J]. Chin J Epidemiol,2006,27(5):424-427. |
| [5] Bai LX,Wang JT,Ding L,et al. Folate deficiency and FHIT hypermethylation and HPV 16 infection promote cervical cancerization[J]. Asian Pac J Cancer Prev,2014,15(21):9313-9317. DOI:10.7314/APJCP2014.15.21.9313. |
| [6] 王汉姣,吴建兵,邱小华,等. 肺癌A549细胞中RNAi抑制MeCP2表达的实验研究[J]. 现代肿瘤医学,2010,18(4):631-634. DOI:10.3969/j.issn.1672-4992.2010.04.01. Wang HJ,Wu JB,Qiu XH,et al. Experimental study of RNA inference targeting MeCP2 in lung carcinoma cell line A549[J]. J Mod Oncol,2010,18(4):631-634. DOI:10.3969/j.issn.1672-4992.2010.04.01. |
| [7] 白兰,王金桃,丁玲,等. 叶酸对子宫颈癌细胞甲基-CpG-结合蛋白质2表达及细胞增殖抑制的作用[J]. 肿瘤研究与临床,2012,24(9):603-606,609. DOI:10.3760/cma.j.issn.1006-9801. 2012.09.008. Bai L,Wang JT,Ding L,et al. Folate inhibits methyl-CpG-binding protein 2 expression and cervical cancer cell proliferation[J].Cancer Res Clin,2012,24(9):603-606,609. DOI:10.3760/cma.j.issn.1006-9801.2012.09.008. |
| [8] 王金桃,高尔生,程玉英,等. 内源性雌、孕激素与人乳头瘤病毒在宫颈癌发生中的协同作用研究[J]. 中华流行病学杂志,2005,26(5):370-373. Wang JT,Gao ES,Cheng YY,et al. Analysis on synergistic action between estrogen,progesterone and human papillomaviruses in cervical cancer[J]. Chin J Epidemiol,2005,26(5):370-373. |
| [9] 王金桃,霍晓旭,丁玲,等. 叶酸与DNA甲基转移酶1在宫颈癌及癌前病变中的作用[J]. 中华流行病学杂志,2011,32(6):617-621. DOI:10.3760/cma.j.issn.0254-6450.2011.06.019. Wang JT,Huo XX,Ding L,et al. Effect of folic acid and DNA methyltransferase 1 on cervical cancer and its precancerous lesion[J]. Chin J Epidemiol,2011,32(6):617-621. DOI:10.3760/cma.j.issn.0254-6450.2011.06.019. |
| [10] 王金桃,吴婷婷,白兰,等. 叶酸对DNMT1和MeCP2在宫颈癌细胞中表达调节的实验研究[J]. 中华流行病学杂志,2013,34(2):173-177. DOI:10.3760/cma.j.issn.0254-6450.2013.02.016. Wang JT,Wu TT,Bai L,et al. Effect of folate in modulating the expression of DNA methyltransferase 1 and methyl-CpG-bingding protein 2 in cervical cancer cell lines[J]. Chin J Epidemiol,2013,34(2):173-177. DOI:10.3760/cma.j.issn.0254-6450.2013.02.016. |
| [11] 孙雪松,丁玲,陈芳,等. 叶酸缺乏及其与HPV16感染的交互效应对宫颈癌变的影响[J]. 中华流行病学杂志,2014,35(4):437-441. DOI:10.3760/cma.j.issn.0254-6450.2014.04.021. Sun XS,Ding L,Chen F,et al. Effects of folate deficiency with HPV16 infection on cervix cancerization[J]. Chin J Epidemiol,2014,35(4):437-441. DOI:10.3760/cma.j.issn.0254-6450.2014. 04.021. |
| [12] 陈卿,唐迅,胡永华. 应用广义多因子降维法分析数量性状的交互作用[J]. 中华流行病学杂志,2010,31(8):938-941. DOI:10.3760/cma.j.issn.0254-6450.2010.08.024. Chen Q,Tang X,Hu YH. Detecting interaction for quantitative trait by generalized multifactor dimensionality reduction[J]. Chin J Epidemiol,2010,31(8):938-941. DOI:10.3760/cma.j.issn.0254-6450.2010.08.024. |
| [13] Arbyn M,Castellsagué X,de Sanjosé S,et al. Worldwide burden of cervical cancer in 2008[J]. Ann Oncol,2011,22(12):2675-2686. DOI:10.1093/annonc/mdr015. |
| [14] 林小娟,赵霞. 人乳头瘤病毒感染与宫颈上皮内瘤变[J]. 实用妇产科杂志,2013,29(3):167-170. DOI:10.3969/j.issn.1003-6946.2013.03.004. Lin XJ,Zhao X. Human papillomavirus infection and cervical intraepithelial neoplasia[J].J Pract Obstet Gynecol,2013,29(3):167-170. DOI:10.3969/j.issn.1003-6946.2013.03.004. |
| [15] 张新武. 宫颈癌常用筛查技术应用现状[J]. 武警医学,2009,20(10):939-941. DOI:10.3969/j.issn.1004-3594.2009.10.032. Zhang XW. Cervical cancer screening commonly used technical application situation[J]. Med J Chin People's Armed Police Forces,2009,20(10):939-941. DOI:10.3969/j.issn.1004-3594.2009.10.032. |
| [16] Guan P,Howell-Jones R,Li N,et al. Human papillomavirus types in 115,789 HPV-positive women:a meta-analysis from cervical infection to cancer[J]. Int J Cancer,2012,131(10):2349-2359. DOI:10.1002/ijc.27485. |
| [17] Guzmán-Olea E,Bermúdez-Morales VH,Peralta-Zaragoza O,et al. Molecular mechanism and potential targets for blocking HPV-Induced lesion development[J]. J Oncol,2012,2012:278312. DOI:10.1155/2012/278312. |
| [18] Yang HP,Zuna RE,Schiffman M,et al. Clinical and pathological heterogeneity of cervical intraepithelial neoplasia grade 3[J]. PLoS One,2012,7(1):e29051. DOI:10.1371/journal.pone. 0029051. |
| [19] Lu Q,Ma DH,Zhao SP. DNA methylation changes in cervical cancers[J]. Methods Mol Biol,2012,863:155-176. DOI:10. 1007/978-1-61779-612-8_9. |
| [20] Georgia S,Kanji M,Bhusshan A. DNMT1 represses p53 to maintain progenitor cell survival during pancreatic organogenesis[J]. Genes Dev,2013,27(4):372-377. DOI:10.1101/gad. 207001.112. |
| [21] Rochtus A,Jansen K,van Geet C,et al. Nutri-epigenomic studies related to neural tube defects:does folate affect neural tube closure via changes in DNA methylation?[J]. Mini Rev Med Chem,2015,15(13):1095-1102. DOI:10.2174/1389557515666150909144828. |
| [22] 康慧杰,王金桃,高晨菲,等. DNA甲基转移酶1与甲基-CpG-结合蛋白2异常表达在宫颈病变中的作用及相互关系[J]. 中华流行病学杂志,2013,34(12):1223-1227. DOI:10.3760/cma.j.issn.0254-6450.2013.12.016. Kang HJ,Wang JT,Gao CF,et al. Effect of DNA methyltransferase 1 and methyl-CpG-binding protein 2 abnormal expression on cervical lesions and related interaction[J]. Chin J Epidemiol,2013,34(12):1223-1227. DOI:10.3760/cma.j.issn. 0254-6450.2013.12.016. |
| [23] Bogdanović O,Veenstra GJ. DNA methylation and methyl-CpG Binding proteins:developmental requirements and function[J]. Chromosoma,2009,118(5):549-565. DOI:10.1007/s00412-009-0221-9. |
| [24] Xu XM,Jin HY,Liu LY,et al. The expression patterns and correlations of claudin-6,methy-CpG binding protein 2,DNA methyltransferase 1,histone deacetylase 1,acetyl-histone H3 and acetyl-histone H4 and their clinicopathological significance in breast invasive ductal carcinomas[J]. Diagn Pathol,2012,7(1):33. DOI:10.1186/1746-1596-7-33. |
| [25] Müller HM,Fiegl H,Goebel G,et al. MeCP2 and MBD2 expression in human neoplastic and non-plastic breast tissue and its association with oestrogen receptor status[J]. Br J Cancer,2003,89(10):1934-1939. DOI:10.1038/sj.bjc.6601392. |
| [26] Bernard D,Gil J,Dumont P,et al. The methyl-CpG binding protein MeCP2 is required for prostate cancer cell growth[J]. Oncogene,2006,25(9):1358-1366. DOI:10.1038/sj.onc. 1209179. |
| [27] Song N,Li K,Wang Y,et al. Lentivirus-mediated knockdown of MeCP2 inhibits the growth of colorectal cancer cells in vitro[J]. Mol Med Rep,2016,13(1):860-866. DOI:10.3892/mmr. 2015.4612. |
| [28] Li Y,Pan P,Qiao P,et al. Downregulation of N-myc downstream regulated gene 1 caused by the methylation of CpG islands of NDRG1 promoter promotes proliferation and invasion of prostate cancer cells[J]. Int J Oncol,2015,47(3):1001-1008. DOI:10.3892/ijo.2015.3086. |
| [29] Ghoshal K,Li X,Datta J,et al. A folate-and methyl-deficient diet alters the expression of DNA methyltransferases and methyl CpG binding proteins involved in epigenetic gene silencing in livers of F344 rats[J]. J Nutr,2006,136(6):1522-1527. |
| [30] 邱宏,余德新,王晓蓉,等. Logistic回归模型中交互作用的分析及评价[J]. 中华流行病学杂志,2008,29(9):934-937. Qiu H,Yu DX,Wang XR,et al. Study on the interaction under logistic regression modeling[J]. Chin J Epidemiol,2008,29(9):934-937. |
| [31] Beretta L,Cappiello F,Moore JH,et al. Ability of epistatic interactions of cytokine single-nucleotide polymorphisms to predict susceptibility to disease subsets in systemic sclerosis patients[J]. Arthritis Care Res,2008,59(7):974-983. DOI:10.1002/art.23836. |
 2016, Vol. 37
2016, Vol. 37