文章信息
- 姚仕堂, 姚媛, 时允, 李品银, 许元武, 杨文芹, 章银娣, 尹春英, 寸柳青, 翟志坚, 何纳, 段松.
- Yao Shitang, Yao Yuan, Shi Yun, Li Pinyin, Xu Yuanwu, Yang Wenqin, Zhang Yindi, Yin Chunying, Cun Liuqing, Zhai Zhijian, He Na, Duan Song.
- 云南省德宏州2012-2014年成年艾滋病患者抗病毒治疗耐药发生及影响因素研究
- Drug resistance and influencing factors in adult AIDS patients receiving antiretroviral treatment in Dehong, Yunnan province
- 中华流行病学杂志, 2016, 37(7): 949-954
- Chinese Journal of Epidemiology, 2016, 37(7): 949-954
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.009
-
文章历史
- 投稿日期: 2016-01-15
2. 200032上海, 复旦大学公共卫生学院流行病学教研室、公共卫生安全教育部重点实验室;
3. 678400 芒市人民医院;
4. 678600 瑞丽市人民医院;
5. 678700 陇川县人民医院;
6. 679300 盈江县人民医院;
7. 678400 芒市, 德宏州人民医院;
8. 679200 梁河县人民医院;
9. 678300 盈江县中医院;
10. 678500 畹町医院
2. Department of Epidemiology and Key Laboratory of Public Health Safety of Ministry of Education, School of Public Health, Fudan University, Shanghai 200032, China;
3. Mangshi City People's Hospital, Mangshi 678400, China;
4. Ruili City People's Hospital, Ruili 678600, China;
5. Longchuan County People's Hospital, Longchuan 678700, China;
6. Yingjiang County People's Hospital, Yingjiang 679300, China;
7. Dehong Prefecture People's Hospital, Mangshi 678400, China;
8. Lianghe County People's Hospital, Lianghe 679200, China;
9. Yingjiang County Hospital of Traditional Chinese Medicine, Yingjiang 678300, China;
10. Wanding Hospital, Wanding 678500, China
抗反转录病毒治疗(antiretroviral treatment,ART)或简称抗病毒治疗能有效抑制艾滋病患者体内HIV复制,降低病死率,延长患者生命[1]。云南省德宏州自2004年起为艾滋病患者提供免费抗病毒治疗,取得了良好的效果[2],但广泛开展的抗病毒治疗也会导致HIV耐药突变和耐药株的发生,从而影响抗病毒治疗效果。现有的耐药研究多为横断面研究[3, 4],队列研究较为欠缺,为了解德宏州接受抗病毒治疗的艾滋病患者耐药的发生情况,于2012-2014年对德宏州内接受抗病毒治疗的成年艾滋病患者开展了相关队列研究。
对象与方法1. 研究对象:截止2012年12月31日,德宏州年龄≥15岁成年艾滋病患者抗病毒治疗满半年及以上并进行病毒载量检测的患者有3 964例,其中,血浆病毒载量≥1 000 拷贝/ml的有402例,均根据《国家免费艾滋病抗病毒药物治疗手册》的要求进行了耐药检测,198例显示耐药。将血浆病毒载量<1 000拷贝/ml和血浆病毒载量≥1 000拷贝/ml做了耐药检测后显示不耐药的共计3 715例患者纳入研究对象。抗病毒治疗入选标准和治疗方案均参照《国家免费艾滋病抗病毒药物治疗手册》,所有患者均签署抗病毒治疗知情同意书,药品为国家免费提供。
2. 研究方法:①队列随访:采用队列研究方法,分别在随访12个月及24个月时采集研究对象静脉血10 ml 开展CD4+T淋巴细胞(CD4)计数和血浆HIV病毒载量检测。CD4计数和HIV病毒载量分别采用BD公司FACS Calibur流式细胞仪及美国拜耳公司的分支DNA(bDNA)方法及配套试剂盒进行检测并严格按照说明书操作。② HIV耐药检测:对研究对象中血浆HIV病毒载量≥1 000拷贝/ml的血液样本集中进行耐药检测,采用使用德国Roche公司试剂盒(High pure viral nucleic acid kit)从 200 μl血浆中抽提出HIV RNA,应用巢式RT-PCR进行扩增得到HIV-1 pol基因片段,将PCR产物送至华大基因公司完成产物纯化及基因测序,再对基因序列进行拼接和校正,将序列提交到美国斯坦福大学的 HIV 耐药数据库,进行耐药性分析,参照 WHO 耐药突变位点列表(2009年)[5]确定耐药突变位点以及 HIV 毒株对抗病毒药物的敏感性。耐药的判定:只要有一种药物发生耐药均判定为耐药,潜在耐药归为不耐药。
3. 统计学分析:采用EpiData 3.1软件建立数据库,应用SPSS 22.0软件整理和分析数据。按照寿命表方法采用校正公式q=d/(N0-c/2)计算新发耐药率,d为观察期内新发耐药病例数,N0为期初观察对象数,c为观察期内中途删失例数,本研究将观察期内失访、死亡、无病毒载量结果的病例均定义为删失数据。在单因素分析的基础上,通过多因素logistic逐步回归分析耐药发生的影响因素,以P<0.05为差异有统计学意义。
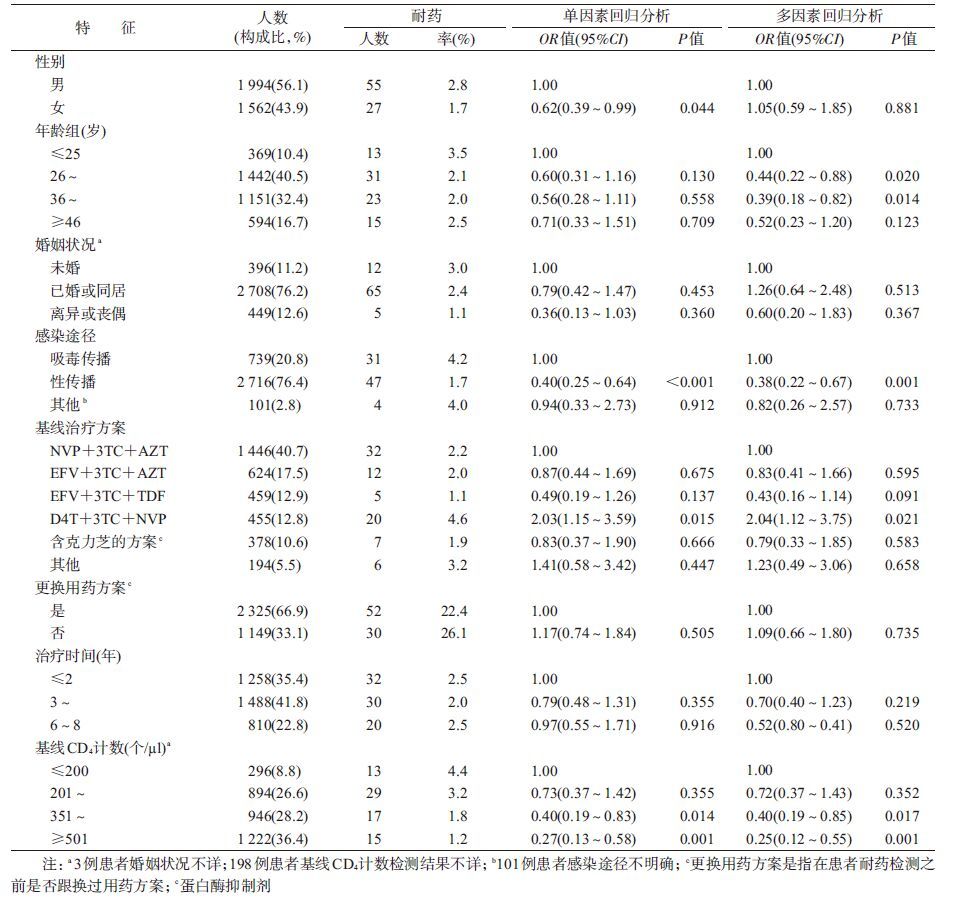
结 果1. 人口学特征:3 715例纳入队列研究的患者中,男性(56.6%)、26~45岁(72.6%)、已婚(76.0%)、性传播途径感染(75.3%)占多数。治疗方案以奈韦拉平(NVP)+拉米夫定(3TC)+齐多夫定(AZT)相对较多(38.2%)。其中基线血浆HIV病毒载量≥1 000拷贝/ml者153例,<1 000拷贝/ml者3 562例(表1)。
2. 耐药发生率及其影响因素:3 715例研究对象在第12个月共失访159人,失访率为4.3%,其中死亡33人(20.8%)、失访(失去联系)82人(51.6%)、停药23人(14.5%)、抽血失败21人(13.2%);第24个月共失访208人,失访率为5.8%,其中死亡50人(24.0%)、失访(失去联系)104人(50.0%)、停药20人(9.6%)、抽血失败34人(16.3%)。随访期间至少接受过一次HIV病毒载量检测的患者共3 556例(95.7%),其中至少出现一次病毒载量≥1 000拷贝/ml者253例(7.1%),均接受耐药检测,其中211例(83.4%)成功进行了耐药相关基因位点突变检测并有82例(38.9%)出现对抗病毒药物不同程度的耐药。2013年新发耐药52例,总人群新发耐药率为1.43/100人年;2014年新发耐药30例,总人群新发耐药率为0.88/100人年;整个队列的2年随访期间总新发耐药率为1.13/100人年。
单因素logistic回归分析结果显示,患者耐药发生与性别(女性vs.男性:OR=0.62,95%CI:0.39~0.99,P=0.044)、感染途径(吸毒途径传播vs.性传播:OR=0.40,95%CI:0.25~0.64,P<0.001)、基线治疗方案(D4T+3TC+NVP vs. NVP+3TC+AZT,OR=2.03,95%CI:1.15~3.59,P=0.015)和基线CD4计数(351~500个/μl vs. ≤200个/μl,OR=0.40,95%CI:0.19~0.83,P=0.014;≥501个/μl vs. ≤200个/μl:OR=0.27,95%CI:0.13~0.58,P=0.001)有统计学关联。
多因素logistic回归分析结果显示,耐药发生与年龄组(26~35岁vs.≤25岁:OR=0.44,95%CI:0.22~0.88,P=0.020;36~45岁vs. ≤25岁:OR=0.39,95%CI:0.18~0.82,P=0.014)、感染途径(性传播vs. 吸毒传播:OR=0.38,95%CI:0.22~0.67,P=0.001)、基线治疗方案(D4T+3TC+NVP vs.NVP+3TC+AZT,OR=2.04,95%CI:1.12~3.75,P=0.021)、基线CD4计数(351~500个/μl vs. ≤200个/μl:OR=0.40,95%CI:0.19~0.85,P=0.017;≥501个/μl vs. ≤200个/μl:OR=0.25,95%CI:0.12~0.55,P=0.001)有统计学关联(表2),即年龄≤25岁、吸毒传播、基线治疗方案为D4T+3TC+NVP和基线CD4计数≤200个/μl者耐药发生率比年龄>25岁、性传播、基线治疗方案为NVP+3TC+AZT和基线CD4≥351个/μl者高。
3. 耐药患者HIV基因亚型:82例新发耐药者中出现了11种HIV基因亚型,分别为26例CRF_BC亚型(31.7%)、18例CRF01_AE亚型(22.0%)、16例C亚型(19.5%)、4例CRF_01BC亚型(4.9%)、4例CRF08_BC亚型(4.9%)、2例CRF07_BC(2.4%)、1例CRF_01B亚型(1.2%)和1例B亚型(1.2%)、8例CRF_BC/B′亚型混合(9.8%),1例CRF_BC/CRF_01B亚型混合(1.2%)和1例CRF_BC/C亚型混合(1.2%)。其中CRF_BC/B′亚型、CRF_BC/CRF_01B亚型和CRF_BC/C亚型为混合病毒亚型的耐药者。
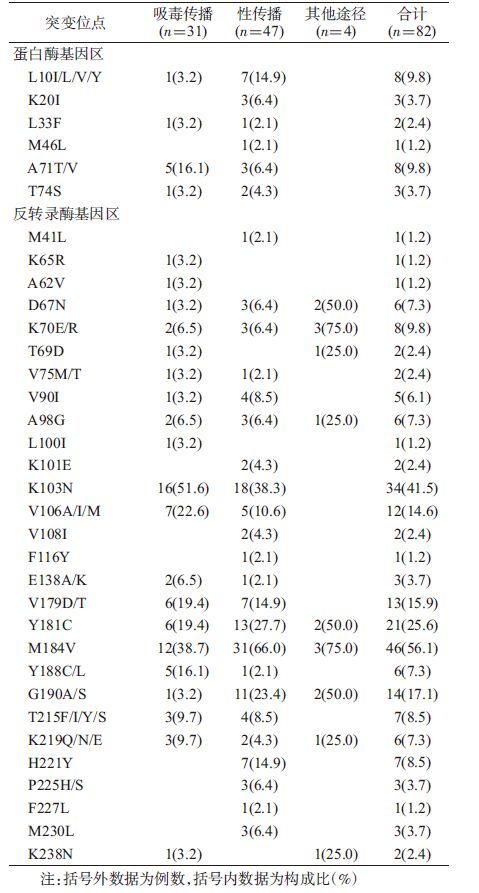
4. 耐药患者耐药突变位点及药物耐药情况:突变频率最高的NRTIs相关耐药突变位点为M184V(56.1%),其次是K70E/R(9.8%)。突变频率最高的NNRTIs相关耐药突变位点是K103N(41.5%),其次是Y188C(25.6%)和G190A/S(17.1%)。表3详细列出了不同感染途径的耐药患者的耐药突变位点。由表3可见,经吸毒途径感染患者中发生突变率较高的蛋白酶抑制剂(Protease inhibitors,PIs)相关耐药位点为A71T/V(16.1%),NRTI相关耐药位点为M184V(38.7%),NNRTI相关耐药突变位点为K103N(51.6%)和V106A/I/M(22.6%);通过性传播途径感染患者发生突变率较高,PIs相关耐药位点为L10I/L/V/Y(14.9%),NRTIs相关耐药位点为M184V(66.0%),NNRTIs相关耐药突变位点为K103N(38.3%)和Y181C(27.7%);而其他途径感染人群未发现PIs有关耐药位点(表3)。
发生耐药的82例患者中有3例(0.37%)仅对PI类药物耐药,其中1例耐药突变位点为M46L,2例突变位点为T74S,3例均表现为对奈菲那韦(NFV)的低度耐药。3例(0.37%)仅对NRTI耐药,其中2例突变位点为M184V,1例突变位点为M184V+T74S,3例均表现为3TC和恩曲他滨(FTC)的高度耐药和阿巴卡韦(ABC)的低度耐药。29例(35.4%)仅对NNRTI类药物耐药。47例(57.3%)同时对NRTI和NNRTI类药物耐药。
耐药患者中出现耐药频率最高的NRTI类药物为3TC(59.8%)、FTC(59.8%)和ABC(59.8%)。3TC和FTC主要表现为高度耐药,ABC主要表现为低度耐药。出现耐药频率最高的NNRTI类药物为奈韦拉平(NVP)和依非韦伦(EFV),均为91.5%,且均表现为高度耐药。
讨 论本研究以云南省德宏州抗病毒治疗半年以上并在2012年病毒载量<1 000 拷贝/ml和≥1 000 拷贝/ml耐药检测结果显示不耐药的成年患者为研究对象,采用队列研究方法,观察2012-2014年共计24个月内新发耐药情况。研究发现在病毒载量≥1 000拷贝/ml患者中耐药比例为38.9%。低于该地区2009年、2010年[6]两年监测病毒载量≥1 000拷贝/ml患者中的耐药比例。云南省其他地区类似研究中,Li等[7]报告在云南省2010-2011年病毒载量≥1 000拷贝/ml的已治疗患者中耐药比例为45.1%;Yang等[8]报告云南省红河县2011-2012年病毒载量≥1 000拷贝/ml的已治疗患者中耐药比例为47.2%,均高于本研究。研究人群中两次耐药检测显示,新发耐药率分别为1.43/100人年和0.88/100人年,队列2年随访期间新发耐药率为1.13/100人年,与国内外其他类似队列研究(新发耐药率分别为2.0%、9.9/100人年、0.96/100人年)相比[8, 9, 10],处于较低水平。
多因素分析显示,耐药发生率在年轻患者和吸毒患者中相对较高,可能与年轻患者和吸毒患者中服药依从性较差有关[11, 12]。用药方案为D4T+3TC+NVP 的患者耐药发生率较高,由于D4T药物毒性较大,故从2012年初开始,D4T被逐渐取缔,所以本研究用药方案为D4T+3TC+NVP的患者耐药发生率较高可能与D4T药物毒性较大有关;基线CD4水平低的患者耐药发生率较高,CD4水平与患者免疫力有关,CD4水平较低的患者免疫力较差,体内HIV抑制效果较差,血浆病毒载量较高,耐药发生也随之增高,已有研究也表明,CD4水平低是发生耐药的危险因素[11]。
本研究中新发耐药患者的亚型主要以CRF_BC亚型为主,其次为CRF01_AE亚型,本研究所在地区处于中缅边界,与国内其他地区相比[13, 14, 15],患者HIV亚型复杂,并有多种重组亚型,与该地区前期的调查结果基本一致[4]。
本研究中共发现82例耐药患者,其中M184V和K103N分别为突变频率最高的NRTI和NNRTI相关耐药突变位点。M184V常在使用 3TC和FTC的患者中出现,并且会导致对ABC等药物的低度耐药[16]。K103N常在使用NVP和EFV患者中出现,导致其对NVP和EFV敏感度不同程度的降低[17]。患者对NRTI和NNRTI类药物耐药,这与所研究地区用药方案即2 NRTIs+1 NNRTI有关,与我国其他类似用药方案地区耐药研究结果一致[18, 19]。值得注意的是,虽然PI类药物在所研究地区并未大范围使用,但是本研究中有相当一部分患者出现了PI类药物耐药相关位点,并且有3例患者对NFV表现为低度耐药,后续治疗中如使用PI类药物应注意其药物敏感性,根据治疗情况调整治疗方案,以达到最好的治疗效果。
本研究存在不足:①两年队列中存在一部分失访患者,失访原因有死亡、失去联系、停药、抽血失败,死亡患者多为用药后病毒抑制情况不好,这类患者更易有耐药突变;失去联系、停药、拒绝抽血的患者多数服药依从性也较差,因此本研究报告的新发耐药情况在一定程度上可能被低估;②服药依从性是影响耐药突变的重要因素,本研究未涉及这一因素,后续将进一步开展此项调查。
综上所述,云南省德宏州参加抗病毒治疗的成年艾滋病患者新发耐药率处于较低水平,但是提示随着抗病毒治疗的扩大和持续推进,需要特别对年龄较小和吸毒传播者加强依从性教育,密切监测耐药的发生,以达到最好的抗病毒治疗效果。
利益冲突 无
| [1] Seyler C,Anglaret X,Dakoury-Dogbo N,et al. Medium-term survival,morbidity and immunovirological evolution in HIV-infected adults receiving antiretroviral therapy,Abidjan,Côte d'Ivoire[J]. Antivir Ther,2003,8(5):385-393. |
| [2] 姚仕堂,段松,项丽芬,等. 云南省德宏州3103例艾滋病患者抗病毒治疗后生存分析[J]. 中华流行病学杂志,2010,31(11):1215-1218. DOI:10.3760/cma.j.issn.0254-6450.2010.11.003. Yao ST,Duan S,Xiang LF,et al. Survival analysis on 3103 HIV/AIDS patients receiving antiretroviral treatment in Dehong prefecture,Yunnan province[J]. Chin J Epidemiol,2010,31(11):1215-1218. DOI:10.3760/cma.j.issn.0254-6450.2010.11.003. |
| [3] 陈敏,马艳玲,楚承霞,等. 昆明市2010年HIV-1耐药传播警戒线调查[J]. 中华流行病学杂志,2012,33(1):75-77. DOI:10.3760/cma.j.issn.0254-6450.2012.01.017. Chen M,Ma YL,Chu CX,et al. Survey on the transmission of HIV drug resistance in Kunming,Yunnan province in 2010[J]. Chin J Epidemiol,2012,33(1):75-77. DOI:10.3760/cma.j.issn.0254-6450.2012.01.017. |
| [4] 姚仕堂,杨锦,周琳,等. 云南省德宏州抗病毒治疗艾滋病患者血浆病毒载量及耐药研究[J]. 中华流行病学杂志,2014,35(4):411-416. DOI:10.3760/cma.j.issn.0254-6450.2014.04.015. Yao ST,Yang J,Zhou L,et al. Study on HIV viral load in plasma and drug resistance among AIDS patients receiving antiretroviral treatment in Dehong prefecture,Yunnan province[J]. Chin J Epidemiol,2014,35(4):411-416. DOI:10.3760/cma.j.issn.0254-6450.2014.04.015. |
| [5] Bennett DE,Camacho RJ,Otelea D,et al. Drug resistance mutations for surveillance of transmitted HIV-1 drug-resistance:2009 update[J]. PLoS One,2009,4(3):e4724. DOI:10.1371/journal.pone.0004724. |
| [6] 姚仕堂,马艳玲,许元武,等. 云南省德宏州艾滋病患者抗病毒治疗后HIV耐药突变率及其影响因素研究[J]. 中华疾病控制杂志,2012,16(12):1019-1023. Yao ST,Ma YL,Xu YW,et al. Mutation rate and risk factors of HIV resistance among AIDS patients receiving antiretroviral treatment in Dehong prefecture,Yunnan province[J]. Chin J Dis Control Prev,2012,16(12):1019-1023. |
| [7] Li HP,Zhong M,Guo W,et al. Prevalence and mutation patterns of HIV drug resistance from 2010 to 2011 among ART-failure individuals in the Yunnan province,China[J]. PLoS One,2013,8(8):e72630. DOI:10.1371/journal.pone.0072630. |
| [8] Yang CX,Yang SM,Li JJ,et al. Genetic diversity and drug resistance among antiretroviral treatment-failed individuals from 2010 to 2012 in Honghe,China[J]. AIDS Res Hum Retroviruses,2015,31(8):822-829. DOI:10.1089/aid.2014. 0348. |
| [9] Ruan YH,Xing H,Wang X,et al. Virologic outcomes of first-line HAART and associated factors among Chinese patients with HIV in three sentinel antiretroviral treatment sites[J]. Trop Med Int Health,2010,15(11):1357-1363. DOI:10.1111/j.1365-3156.2010.02621.x. |
| [10] Lima VD,Harrigan PR,Sénécal M,et al. Epidemiology of antiretroviral multiclass resistance[J]. Am J Epidemiol,2010,172(4):460-468. DOI:10.1093/aje/kwq101. |
| [11] Hanson DL,Adjé-Touré C,Talla-Nzussouo N,et al. HIV type 1 drug resistance in adults receiving highly active antiretroviral therapy in Abidjan,Côte d'Ivoire[J]. AIDS Res Hum Retroviruses,2009,25(5):489-495. DOI:10.1089/aid.2008.0273. |
| [12] Fielding KL,Charalambous S,Stenson AL,et al. Risk factors for poor virological outcome at 12 months in a workplace-based antiretroviral therapy programme in South Africa:a cohort study[J]. BMC Infect Dis,2008,8(1):93. DOI:10.1186/1471-2334-8-93. |
| [13] Hua J,Lin H,Ding Y,et al. HIV drug resistance in newly diagnosed adults in a rural prefecture of eastern China[J]. Epidemiol Infect,2015,143(3):663-672. DOI:10.1017/S0950268814001174. |
| [14] Zhang JF,Guo ZH,Yang JZ,et al. Genetic diversity of HIV-1 and transmitted drug resistance among newly diagnosed individuals with HIV infection in Hangzhou,China[J]. J Med Virol,2015,87(10):1668-1676. DOI:10.1002/jmv.24223. |
| [15] Zhao K,Kang WZ,Liu QQ,et al. Genotypes and transmitted drug resistance among treatment-naive HIV-1-infected patients in a northwestern province,China:trends from 2003 to 2013[J]. PLoS One,2014,9(10):e109821. DOI:10.1371/journal.pone. 0109821. |
| [16] Kulkarni R,Babaoglu K,Lansdon EB,et al. The HIV-1 reverse transcriptase M184I mutation enhances the E138K-associated resistance to rilpivirine and decreases viral fitness[J]. J Acquir Immune Defic Syndr,2012,59(1):47-54. DOI:10.1097/QAI. 0b013e31823aca74. |
| [17] Melikian GL,Rhee SY,Varghese V,et al. Non-nucleoside reverse transcriptase inhibitor (NNRTI)cross-resistance:implications for preclinical evaluation of novel NNRTIs and clinical genotypic resistance testing[J]. J Antimicrob Chemother,2014,69(1):12-20. DOI:10.1093/jac/dkt316. |
| [18] Zhang F,Haberer J,Wei H,et al. Drug resistance in the Chinese National Pediatric Highly Active Antiretroviral Therapy Cohort:implications for paediatric treatment in the developing world[J]. Int J STD AIDS,2009,20(6):406-409. DOI:10.1258/ijsa.2008. 008357. |
| [19] Zhao Y,Mu WW,Harwell J,et al. Drug resistance profiles among HIV-1-infected children experiencing delayed switch and 12-month efficacy after using second-line antiretroviral therapy:an observational cohort study in rural China[J]. J Acquir Immune Defic Syndr,2011,58(1):47-53. DOI:10.1097/QAI.0b013e318229f2a2. |
 2016, Vol. 37
2016, Vol. 37