文章信息
- 方任飞, 李静湖, 张杰, 高双庆, 潘昱廷, 詹思延.
- Fang Renfei, Li Jinghu, Zhang Jie, Gao Shuangqing, Pan Yuting, Zhan Siyan.
- 基于处方序列对称分析的他汀类药物肝脏安全性研究
- Association between statins use and liver injury based on prescription sequence symmetry analysis
- 中华流行病学杂志, 2016, 37(7): 935-939
- Chinese Journal of Epidemiology, 2016, 37(7): 935-939
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.006
-
文章历史
- 投稿日期: 2016-02-29
2. 100013 北京, 中国医疗保险研究会;
3. 100013 北京北方医药健康经济研究中心
2. China Health Insurance Research Association, Beijing 100013, China;
3. Beijing Medical Health Economics Research Centre of North China, Beijing 100021, China
药品上市后的安全性评价是药物安全监测的重要组成部分[1]。但是国内传统的自发呈报存在很大的不可控性[2],上报质量难以保证,“漏报”情况严重;而且这种被动监测无法明确用药人群,即分母的数量,因而无法计算不良反应发生率。注册登记、集中监测等研究耗费大量人力物力,研究周期长,难以保证药物安全评价对于时效性的要求。新时期下,利用大数据技术为药品不良反应监测开辟了新的途径[3]。美国等发达国家的相关科研项目(包括OMOP)在利用电子医疗记录开展药物安全性研究方面提供了宝贵的经验和参考[4]。
Petri等[5]1988年提出的处方序列对称分析(Prescription sequence symmetry analysis,PSSA)是一种基于大数据和电子处方数据库的信号挖掘方法。PSSA利用目标药物和标签药使用的时序性对称关系发掘药物安全性的潜在关联。该方法使用变量少,在对分析代码和数据库进行标准化后仅需要数小时就可以得到关联信号。近年来,国外多个大型医保数据库利用PSSA发现了一些药品安全性信号[6],并通过一系列模拟数据等验证性试验证明了该方法具备快速、准确、低成本等优点。
国内目前尚无利用PSSA进行药物安全性研究的实例。他汀类药物的使用者和潜在使用者都极具规模,因而其用药安全问题不容忽视。他汀类药物对于肝脏的影响主要体现在使血清ALT升高[7, 8]、血清胆红素升高[8]和其他肝功能指标异常。Meta分析研究也显示阿托伐他汀增加肝功能异常的风险[9]。因此,在阿托伐他汀、辛伐他汀等他汀的说明书上已经警示了肝功异常的风险。
本研究旨在通过PSSA对他汀类药物的肝损不良反应进行研究,验证该信号检测方法在我国医疗保险数据库的可行性并为类似研究提供方法参考。
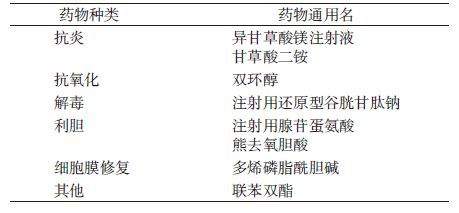
资料与方法1. 资料来源:从2013年全国城镇职工和居民医疗保险数据库的655万余人中提取规定时间范围内使用他汀类药物的人群约41万,在该人群中进一步提取同时使用了特定保肝类药物的人群2.3万人。保肝药的确定以中华医学会2014年发布的《肝脏炎症及其防治专家共识》为基础,结合相关科室主任(专家)和一线药师最终选定的保肝药作为标签药,包括6个大类(表1)。最终信号检测模型将研究人群根据用药时间间隔(60 d)和洗脱期(1个月)确定为5 649人。在该数据库中提取该研究人群唯一识别码、性别、年龄、用药名称和时间等变量,并提取每名患者首次使用他汀类药物和保肝药物的具体时间。本研究对患者信息进行了匿名化处理,并通过北京大学生物医学伦理委员会的伦理审查(批号:IRB00001052-15045)。使用SAS 9.3软件进行统计学分析。
2. 研究方法:
(1)序列比的计算:PSSA的基本思路是使用标签药代替肝损不良反应[10]。本研究中他汀类药物为指示药A,治疗肝损害的药物及保肝药为标签药B。在数据库中明确一段时间内同时使用A、B两种药物的人群为研究对象。如果A药引起不良反应,随后使用B药进行治疗,那么先使用A药的人数会多于先使用B药的人数,从而产生一个不对称的分布信号。在纳入人群中,根据两种药物首次用药时间的先后对两组选定的药物按使用次序进行分组。确定了两组的人数后计算比值,得到粗的序列比(the crude sequence ratio,CSR),反映了两种药物的不对称程度。

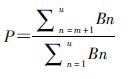
全部A→B的概率为a,当所有观察时间内都是以P为概率的时候,以每天服用B的患者对上式进行加权:
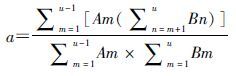
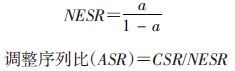
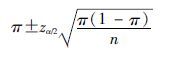
(2)间隔期和洗脱期选择:他汀类药物的使用时间和保肝药物的使用时间间隔要控制在目标药物产生预期不良反应的合理时间区间内。本研究中,他汀类药物产生肝脏相关不良反应的时间为60 d以内[12]。本研究对不同间隔期分别进行了信号检测,以验证假设。
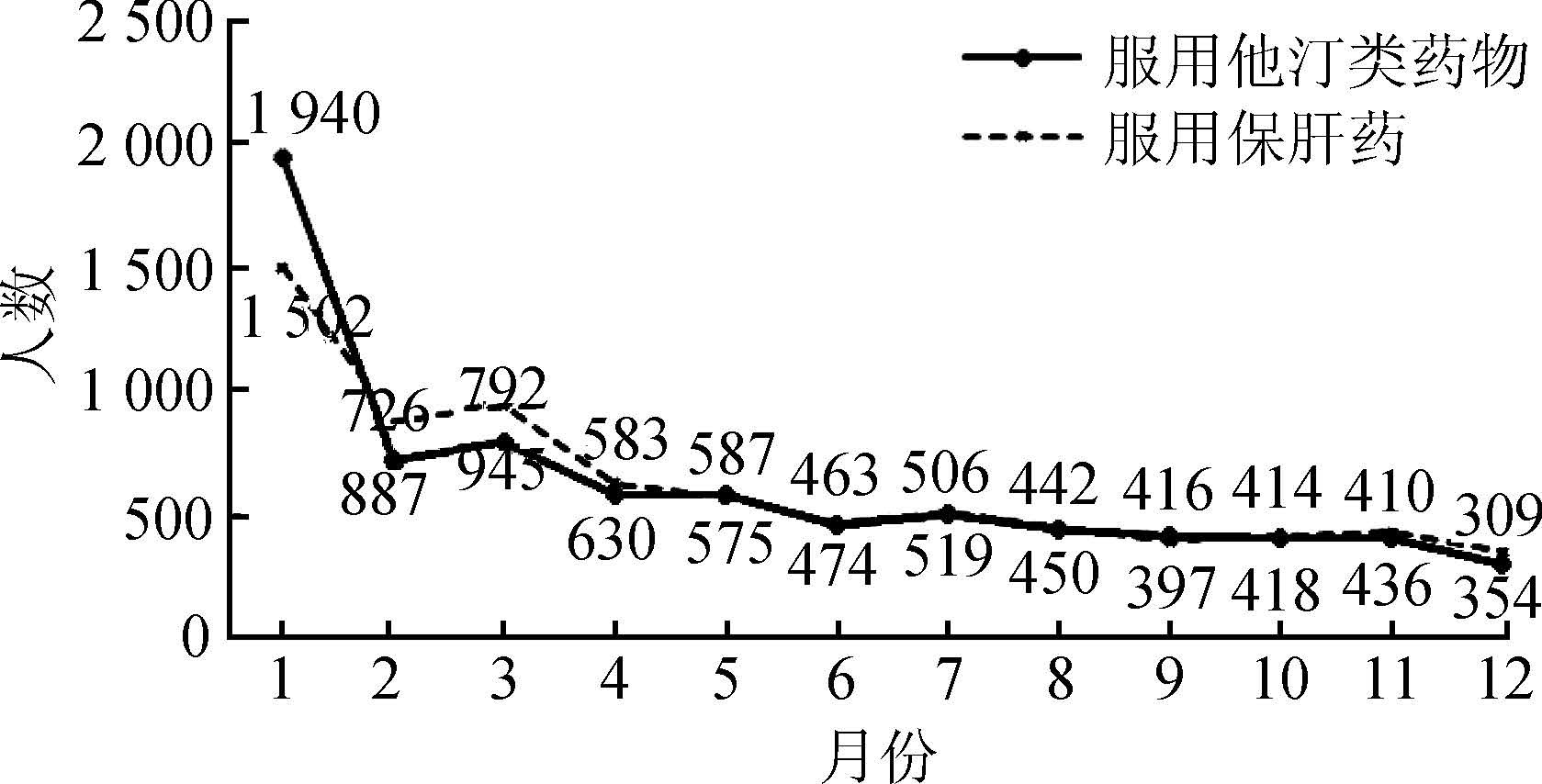
由于本研究选择患者的首次用药记录进行信号检测。因此,需要排除在研究期间内纳入的非首次用药记录,即排除既往用药患者在研究时间范围内的纳入。研究者将每月的首次用药记录人数进行记录并做图。在纳入研究的起始阶段,包含了首次用药患者记录和既往用药患者在研究期间内的首次记录,因而数量较大。随着时间推移,既往患者逐渐被排除,而仅剩下相对稳定的首次用药患者,因而曲线趋于平稳。研究则选择曲线平台期作为研究期间,选择数量下滑阶段作为洗脱期。
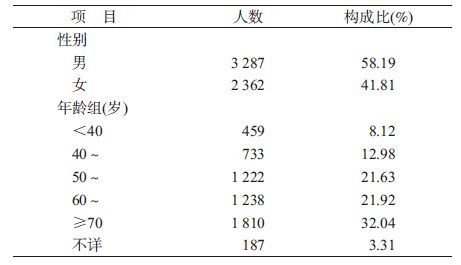
结 果1. 一般情况:研究对象纳入流程见图1。共纳入5 649人,男性3 287人(58.19%),女性2 362人(41.81%)。年龄以50岁及以上的中老年为主体,占78.90%(表2)。

|
| 图1 研究对象纳入流程 |
2. 研究参数的确定:
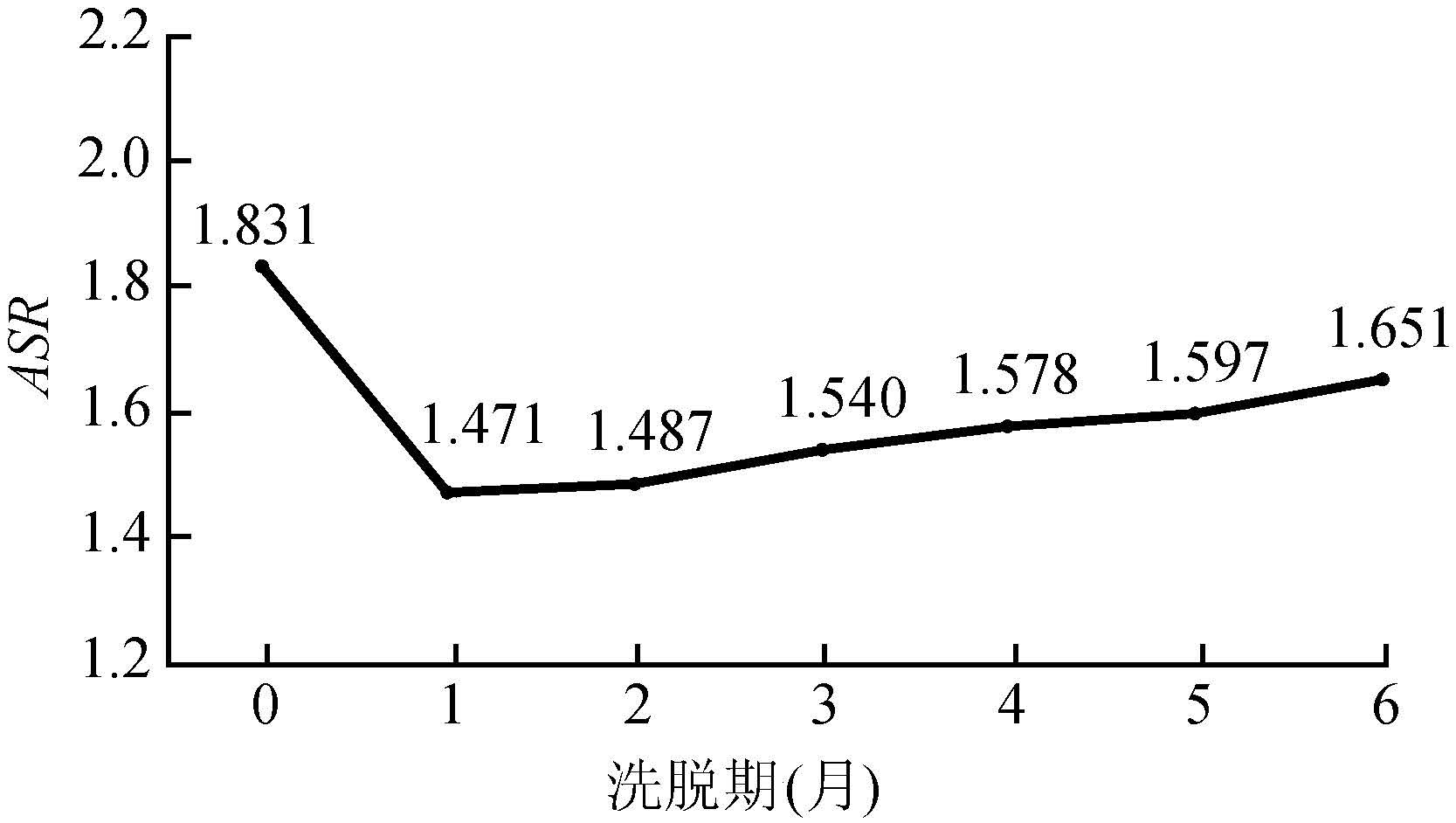
(1)洗脱期的确定:两种药物在第一个月的首次用药患者记录数量都较大。进入第二个月后,人数显著下降并进入平台期。因此可以考虑以第一个月为洗脱期,纳入研究起点时间从第二个月开始(图2)。研究团队对不同洗脱期进行了敏感性分析,结果显示没有洗脱期时,ASR为1.831;当洗脱期为1个月时,ASR为1.471,当洗脱期为2个月时,ASR为1.487,ASR进入相对稳定的阶段(图3)。
|
| 图2 他汀类药物及保肝药物首次用药人数的时间分布 |
|
| 图3 他汀类药物首次用药患者数量时间分布 |
(2)间隔期的选择:根据不同的间隔日期计算ASR,当间隔期控制在30 d内时,信号较为强烈,15~30 d的ASR为1.584。随着时间推移,信号逐渐降低。到180 d时ASR为1.011(图4)。结合临床实践,选择60 d作为用药间隔期较为合适。
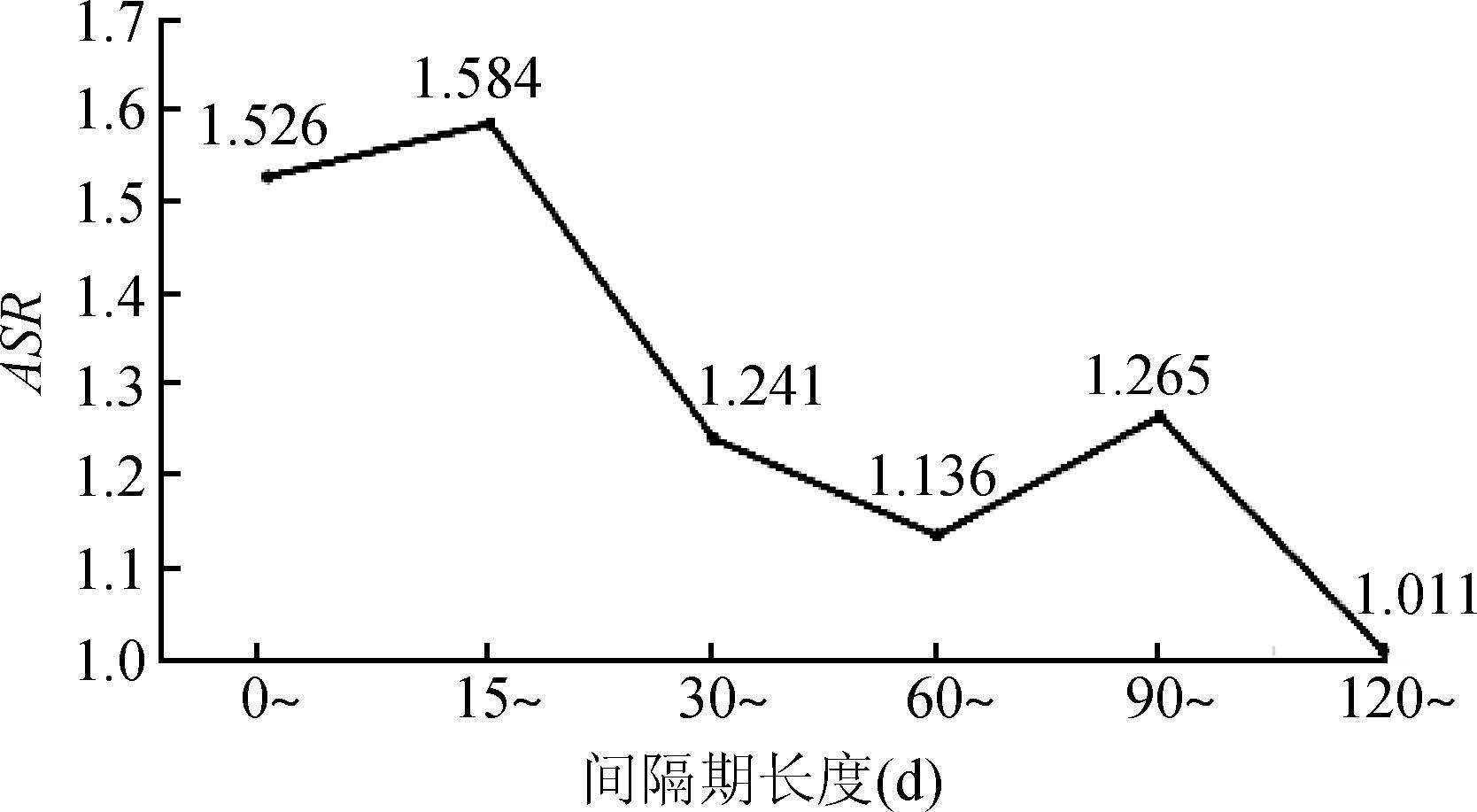
|
| 图4 他汀类药物及保肝药物不同用药间隔日期的ASR |
3. 不同他汀类药物肝脏安全性信号:根据先服用他汀类药物还是先服用保肝类药物的人数和服用的时间间隔做图,结果显示,二者的分布并不对称,先服用他汀类药物的群体略多于先服用保肝药的群体(图5)。时间间隔越短,人数越多。随着时间推移,二者的相关性减弱。调整权重的序列比,结果显示,以全部他汀类药物为研究对象,检测出阳性信号,ASR为1.471(95%CI:1.395~1.550),见表2,图6。以单个类别他汀类药物为研究对象,阿托伐他汀和辛伐他汀存在阳性信号,ASR分别为1.419(95%CI:1.335~1.508)和1.307(95%CI:1.164~1.467)。其他3种他汀类药物(瑞舒伐他汀、氟伐他汀和普伐他汀)未出现阳性信号,其中瑞舒伐他汀的ASR为0.901(95%CI: 0.803~1.007)。

|
| 图5 他汀类药物使用人数分布 |

|
| 图6 不同类别他汀类药物ASR森林图 |
本研究显示他汀类药物尤其是阿托伐他汀和辛伐他汀与肝脏损害之间有关,进一步验证了关于他汀类药物导致的肝脏安全性的问题。他汀类药物主要经过肝脏代谢,其肝脏损害的作用临床表现较多[13]。一项全球性大型的Meta分析证实阿托伐他汀或辛伐他汀显著地增加了肝功能异常的发生风险[14]。并有研究表明阿托伐他汀的风险大于辛伐他汀所致的肝脏风险,与本研究结果一致[15]。瑞舒伐他汀的亲水性较强,在肝脏中通过CYP酶的代谢少,肝脏代谢负担小[16]。多中心的大样本研究显示瑞舒伐他汀导致的急性肝脏损伤明显低于其他他汀类药物[17]。本研究中也显示了瑞舒伐他汀相对较低的ASR。对于他汀类药物导致肝损发生的时间,各研究观点不一,从数天到3个月不等。本研究通过信号分析显示,他汀类药物导致肝损的强阳性信号主要集中在30 d以内,超过60 d的信号逐渐趋于1。因此推测这类肝损可能主要是药物所致的急性肝脏损伤。
使用PSSA需要排除非首次用药患者。因此采用了通行的Waiting-time法确定洗脱期[10],即对每月首次用药患者的人数进行做图,找出平台期。此外本研究还对不同的洗脱期下的信号结果进行了敏感性分析,均发现将1个月作为洗脱期较为合理。在研究对象不同的研究中,需要单独考虑不同药物的洗脱期,以避免由于纳入过多非首次用药患者而对结果产生影响。
传统的观察性流行病学研究需要对性别、年龄、患者本身的行为习惯等因素进行控制以避免混杂影响因果关联。但是在PSSA中,这些因素并不影响两种药物使用的先后顺序,因而大大简化了PSSA的操作流程。PSSA实际上是一种简化的自身对照的病例系列研究[18],对于传统的影响流行病学的因素并不敏感。而真正影响该信号检测方法的是患者行为的时间变化趋势。本研究已经按照国际通行方法对比值进行了加权,有模拟数据的研究对方法进行了验证[19],结果表明上述加权方案可以有效地调整由于时间变化趋势导致的比值不稳定的现象。
PSSA从应用至今研究了从心血管药物到精神病类药物等大范围的目标药物,并验证了一批有明确证据的药物-不良反应事件对,显示该信号检测方法的有效性。随着国际学术组织的大力推广和该方法的自身优势,越来越多的药物研究人员尝试使用该方法进行安全性信号挖掘工作。但是,PSSA本身也存在一定的局限性:数据源受限,PSSA需要患者连续、完整的医疗记录以避免出现医疗记录不全而产生的假阳性或者假阴性信号。目前绝大多数研究采用的是当地的医疗保险数据库。我国这类数据库的开放程度有限并且不能提供患者多年的连续追踪数据,而普通的单中心电子医疗数据的数据量难以完成信号检测工作,样本量偏小容易导致结果的把握度不够甚至无法产生信号。阻碍了该方法的进一步拓展和推广;该方法使用标签药来代替不良反应,因而需要该药物可能导致的不良反应有特定的药物治疗方案。若治疗采取的应对措施特异性较差或者没有对应的药物治疗方案,则不适用该方法。对于不同不良反应的信号检出的真实性取决于使用该标签药物对不良反应进行替代的有效程度。
利益冲突 无
| [1] 柯昌毅. 我国药品上市后安全性再评价研究进展[J]. 中国药房,2010,21(21):2001-2003. Ke CY. Research progress of Chinese drug post-marketing safety revaluation[J]. China Pharm,2010,21(21):2001-2003. |
| [2] 陶庆梅,詹思延. 处方序列分析与处方序列对称分析在药物流行病学中的应用[J]. 药物流行病学杂志,2012,21(10):517-519. Tao QM,Zhan SY. The application of prescription sequence analysis and prescription sequence symmetry analysis in epidemiology[J]. Chin J Pharmacoepidemiol,2012,21(10):517-519. |
| [3] 王大猷. 药品不良反应监测的定义和范畴研究[J]. 中国药物警戒,2014,11(12):732-738. Wang DY. Study on definition and scope of adverse drug reaction surveillance[J]. Chin J Pharmacovigil,2014,11(12):732-738. |
| [4] 周晓枫,刘青,蔡兵,等. 全球上市后药品主动监测系统概况[J]. 药物流行病学杂志,2012,21(7):338-342. Zhou XF,Liu Q,Cai B,et al. Overview of post-marketing drug active surveillance system worldwide[J]. Chin J Pharmacoepidemiol,2012,21(7):338-342. |
| [5] Petri H,De Vet HCW,Naus J,et al. Prescription sequence analysis:a new and fast method for assessing certain adverse reactions of prescription drugs in large populations[J]. Stat Med,1988,7(11):1171-1175. DOI:10.1002/sim.4780071110. |
| [6] 方任飞,潘昱廷,詹思延. 处方序列对称分析研究现状的文献计量分析[J]. 药物流行病学杂志,2016,25(2):108-112,118. Fang RF,Pan YT,Zhan SY. Analysis of the bibliometric of prescription sequence symmetry analysis[J]. Chin J Pharmacoepidemiol,2016,25(2):108-112,118. |
| [7] 陈锐,王昊天. 他汀类药物安全性研究进展[J]. 中国循环杂志,2012,27(2):158-160. DOI:10.3969/j.issn.1000-3614.2012.02. 025. Chen R,Wang HT. Research progress of statins safety[J]. Chin Circul J,2012,27(2):158-160. DOI:10.3969/j.issn.1000-3614. 2012.02.025. |
| [8] 他汀类药物安全性评价工作组. 他汀类药物安全性评价专家共识[J].中华心血管病杂志,2014,42(11):890-894. DOI:10.3760/cma.j.issn.0253-3758.2014.11.002. Statins safety evaluation work group. Expert consensus in statins safety evaluation[J]. Chin J Cardiol,2014,42(11):890-894. DOI:10.3760/cma.j.issn.0253-3758.2014.11.002. |
| [9] 田景平,温泽淮,郭新峰,等. 脂必泰与阿托伐他汀比较治疗高脂血症疗效及安全性的系统评价[J]. 中国循证医学杂志,2013,13(9):1116-1122. DOI:10.7507/1672-2531.20130191. Tian JP,Wen ZH,Guo XF,et al. Effectiveness and safety of Zhibitai versus atorvastatin for hyperlipidemia:a systematic review[J]. Chin J Evid-based Med,2013,13(9):1116-1122. DOI:10.7507/1672-2531.20130191. |
| [10] Hallas J. Evidence of Depression provoked by cardiovascular medication:a prescription sequence symmetry analysis[J].Epidemiology,1996,7(5):478-484. |
| [11] Takada M,Fujimoto M,Yamazaki K,et al. Association of statin use with sleep disturbances:data mining of a spontaneous reporting database and a prescription database[J]. Drug Saf,2014,37(6):421-431. DOI:10.1007/s40264-014-0163-x. |
| [12] 邓华,雷招宝. 他汀类药物引起的肝损害[J]. 药物不良反应杂志,2012,14(2):88-92. DOI:10.3969/j.issn.1008-5734.2012. 02.007. Deng H,Lei ZB. Statin-induced liver injury[J]. Adv Drug React J,2012,14(2):88-92. DOI:10.3969/j.issn.1008-5734.2012.02. 007. |
| [13] 温冬华. 他汀类药物的不良反应及其防治[J]. 医药导报,2013,32(6):818-820. DOI:10.3870/yydb.2013.06.044. Wen DH. Statins drug adverse reaction and its prvention and treatment[J]. Her Med,2013,32(6):818-820. DOI:10.3870/yydb.2013.06.044. |
| [14] Silva M,Matthews ML,Jarvis C,et al. Meta-analysis of drug-induced adverse events associated with intensive-dose statin therapy[J]. Clin Ther,2007,29(2):253-260. DOI:10.1016/j.clinthera.2007.02.008. |
| [15] Björnsson E,Jacobsen EI,Kalaitzakis E. Hepatotoxicity associated with statins:reports of idiosyncratic liver injury post-marketing[J]. J Hepatol,2012,56(2):374-380. DOI:10.1016/j.jhep.2011.07.023. |
| [16] 温金华,袁钊,熊玉卿. 瑞舒伐他汀药代动力学及与其他药物的相互作用研究进展[J]. 中国临床药理学与治疗学,2011,16(11):1309-1314. Wen JH,Yuan Z,Xiong YQ. Study on pharmacokinetics of rosuvastatin and its drug interactions with other drugs[J]. Chin J Clin Pharmacol Ther,2011,16(11):1309-1314. |
| [17] Rodríguez LAG,Herings R,Johansson S. Use of multiple international healthcare databases for the detection of rare drug-associated outcomes:a pharmacoepidemiological programme comparing rosuvastatin with other marketed statins[J]. Pharmacoepidemiol Drug Saf,2010,19(12):1218-1224. DOI:10.1002/pds.2032. |
| [18] Maclure M,Fireman B,Nelson JC,et al. When should case-only designs be used for safety monitoring of medical products?[J]. Pharmacoepidemiol Drug Saf,2012,21 Suppl 1:S50-61. DOI:10.1002/pds.2330. |
| [19] Pratt NL,Ilomäki J,Raymond C,et al. The performance of sequence symmetry analysis as a tool for post-market surveillance of newly marketed medicines:a simulation study[J]. BMC Med Res Methodol,2014,14(1):66. DOI:10.1186/1471-2288-14-66. |
 2016, Vol. 37
2016, Vol. 37