文章信息
- 陈茹, 王晶, 唐少文, 吕晓珍, 张渊, 武珊珊, 夏愔愔, 詹思延.
- Chen Ru, Wang Jing, Tang Shaowen, Lyu Xiaozhen, Zhang Yuan, Wu Shanshan, Xia Yinyin, Zhan Siyan.
- 抗结核治疗队列人群药物性肝损害的易感基因多态性研究
- Study on polymorphisms of genes with susceptibility to drug induced liver injury in a cohort receiving anti-tuberculosis treatment
- 中华流行病学杂志, 2016, 37(7): 925-929
- Chinese Journal of Epidemiology, 2016, 37(7): 925-929
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.07.004
-
文章历史
- 投稿日期: 2016-03-02
2. 3010 墨尔本, 澳大利亚墨尔本大学儿科系, 默多克儿童研究中心;
3. 211166 南京医科大学公共卫生学院流行病学系;
4. 100191 北京大学精神卫生研究所临床研究室;
5. L8S4K1 汉密尔顿, 加拿大麦克马斯特大学临床流行病与卫生统计学系;
6. 100050 北京, 首都医科大学附属北京友谊医院, 国家消化中心;
7. 102206 北京, 中国疾病预防控制中心结核病控制中心
2. Department of Paediatrics, The University of Melbourne, and Murdoch Children Research Institute, Melbourne 3010, Australia;
3. Department of Epidemiology, School of Public Health, Nanjing Medical University, Nanjing 211166, China;
4. Clinical Research Division, Peking University Institute of Mental Health, Beijing 100191, China;
5. Department of Clinical Epidemiology and Biostatistics, McMaster University, Hamilton L8 S4 K1, Canada;
6. Beijing Friendship Hospital, Capital Medical University, and National Clinical Research Center of Digestive Diseases, Beijing 100050, China;
7. Center for Tuberculosis Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
结核病治疗目前主要采用DOTS(Directly Observed Treatment,Short-course)策略,其核心治疗措施是标准短程化疗,即采用异烟肼、利福平、吡嗪酰胺、乙胺丁醇和链霉素等药物,进行为期6~8个月的治疗[1]。而长时间多种抗结核药的联合使用可能使患者出现各种药物不良反应,其中以抗结核药肝损害(anti-tuberculosis drug induced liver injury,ATLI)最为重要,它可能使病例治疗中断、疗程改变、不规范服药甚至导致治疗失败。ATLI的发生机制复杂且个体差异较大。一般来说,抗结核药在肝脏的整个过程涉及到Ⅰ相代谢(氧化、还原和水解等反应)、Ⅱ相代谢(与葡萄醛酸、谷胱甘肽等的结合反应)以及Ⅲ相代谢(转运蛋白的转运作用)[2]。药物代谢过程的任一环节发生异常均可导致毒性代谢产物的蓄积继而引起肝损害。此外,药物或其代谢产物可能激发机体的免疫系统诱发免疫介导性肝损害[3]。目前相关研究一般仅涉及1个或2个功能基因的多态性,而药物在体内的代谢异常复杂,常涉及到多个生物通路。本研究拟筛选与抗结核药物所致肝损害相关的Ⅰ、Ⅱ、Ⅲ相代谢相关基因以及下游免疫相关基因,从药物代谢和转运以及免疫反应等多个角度探讨基因多态性与ATLI的关系,为结核病患者的个体化治疗和临床合理用药提供科学依据。
对象与方法1. 研究对象:来自“中国结核病防治规划抗结核病药品不良反应研究(ADASC)”所建的队列[4]。该研究于2007年10月至2008年6月期间,采用分层、整群、概率比例抽样方法,选取南、北方4个省份52个县4 488名新诊涂阳肺结核病例纳入研究,跟踪随访其抗结核短程化疗全过程,并观察其不良反应的发生情况。以随访队列中产生的ATLI病例为病例组。ATLI的诊断参考肝损害国际共识会议(International Consensus Meeting,ICM)标准[5],主要依据是血清ALT>2倍上限,或AST和总胆红素(TBIL)联合升高,且其中之一升高>2倍上限,并排除了HBsAg阳性、既往肝胆病史、饮酒(白酒≥3 次/周)以及现患相关疾病(糖尿病、高血压、肝胆疾病等)的病例。按照个体匹配的原则,在未发生任何不良反应的患者中根据ATLI病例选择年龄相差5岁之内、同性别、相同的初复治类型、同民族和同一地区的患者作为对照,以1 ∶ 4的比例纳入对照组。
2. 研究方法:
(1)基因位点选择:根据美国国立生物技术信息中心(NCBI)的单核苷酸多态性(SNP)数据库并结合既往文献报道,筛选相关基因非编码区5′-UTR、上游启动子区、3′-UTR的多态性位点,外显子错义突变的SNP和影响mRNA剪接的内含子区域的SNP作为候选功能SNP。对于无既往相关研究的基因,筛选标签SNP作为补充。利用HapMap数据库(http://hapmap.ncbi.nlm.nih.gov/)所提供的中国汉族人群基因型数据的信息,运用Haploview 4.1软件构建单倍型区段,以r2=0.80 和最小等位基因频率(MAF)>0.10为界值,通过 Tagger pairwise算法筛选标签SNP。
(2)基因多态性检测:对采集的血样进行DNA提取,SNP检测采用中通量TaqMan基因分型系统技术,检测仪器为美国ABI公司PRISM 7900HT序列分析系统。在每批反应设置空白样品和已知基因型样品作为阴阳对照,基因型分析由ABI公司的SDS软件完成。
3. 统计学分析:采用x±s或M(QR)对连续型变量的特征进行描述,组间比较采用成组t检验或非参数检验。采用频数和百分数对分类变量的特征进行描述,组间比较采用 χ2检验。采用拟合优度 χ2检验计算对照组的基因型分布是否符合Hardy-Weinberg(H-W)遗传平衡,验证研究所选人群的遗传平衡性。关联分析分为两步:首先,利用Lasso(Least absolute shrinkage and selection operator)回归方法进行SNP的筛选,之后,采用条件logistic回归对筛选的SNP位点分析其基因多态性和ATLI的关联性,以OR值及其95%CI表示,同时验证Lasso回归的结果。Lasso算法由Tibshirani[6]最先提出并逐渐完善,其原理是在最小二乘回归的基础上增加一个惩罚项,在约束各个回归数的绝对值之和小于某个常数的条件下,最小化回归方程的残差平方和。惩罚项的设定可以压缩模型系数,通过将一些无意义或意义很小的自变量的系数压缩至0,筛选出更有意义的自变量,从而较好地解决回归分析中多重共线性问题。其公式:
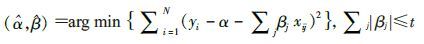
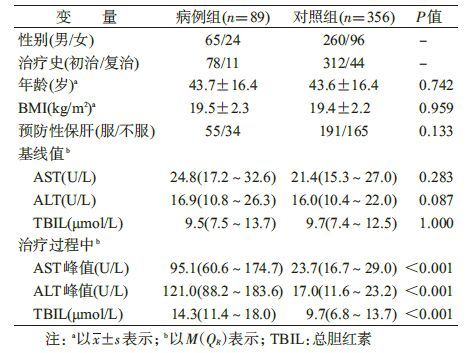
1. 一般特征:共纳入89名ATLI病例与356名匹配的对照,两组一般特征见表1。两组人群在年龄、体重、BMI、服药方式和预防性保肝等方面差异无统计学意义。在治疗前,病例组和对照组的基线ALT、AST和TBIL水平差异无统计学意义。但是,在治疗过程的中,病例组的ALT、AST和TBIL峰值均高于对照组,差异有统计学意义(P<0.001)。
2. 基因位点选择:通过筛选,最终纳入代谢和转运基因以及免疫相关基因33个,共检测位点75个,基因(位点个数)见表2。
3. 基因型检测:445份血样经DNA提取后采用TaqMan分型,所有SNP位点成功分型率均在95%以上。除CYP2E1基因rs915908、CYP7A1基因rs1457043、ABCB1基因rs10261685外均符合H-W遗传平衡,提示研究对象具有较好的人群代表性。
4. 关联分析:
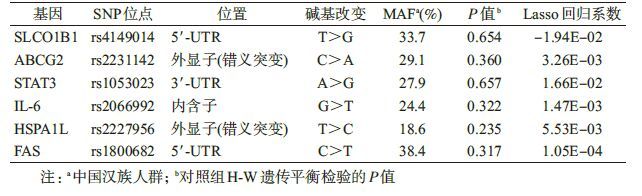
(1)Lasso回归:对纳入的75个位点构建Lasso回归模型,采用10倍交叉验证法选择回归系数,共筛选出6个基因位点,包括转运基因位点SLCO1B1rs4149014和ABCG2rs2231142,以及免疫通路上的HSPA1L rs2227956、STAT3 rs1053023、IL-6 rs2066992和FAS rs1800682,各SNP的基本信息见表3。
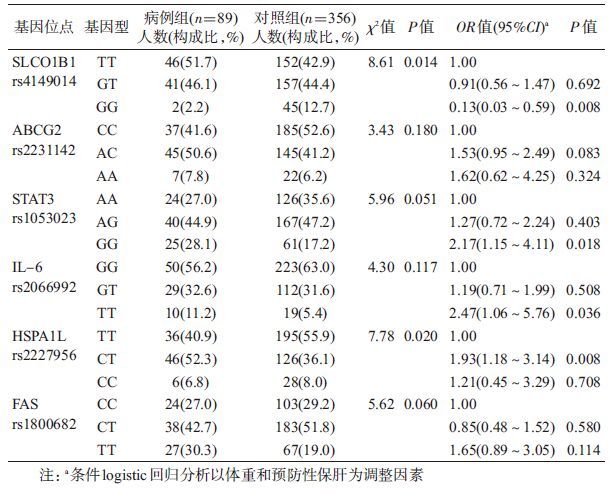
(2)基因型分布比较: χ2检验的结果显示,SLCO1B1 rs4149014和HSPA1L rs2227956位点在病例组和对照组中的分布差异有统计学意义(P<0.05),ABCG2 rs2231142、STAT3 rs1053023、IL-6 rs2066992、FAS rs1800682在两组间分布差异无统计学意义(表4)。
(3)logistic回归:在调整体重和预防性保肝药的因素后,SLCO1B1、STAT3、IL-6和HSPA1L基因多态性与ATLI的关联有统计学意义,其中,SLCO1B1 rs4149014位点GG基因型携带者发生抗结核药致肝损害的风险低于TT基因型携带者,STAT3 rs1053023位点GG基因型携带者,IL-6 rs2066992位点TT基因型携带者和HSPA1L rs2227956位点CT基因型携带者发生抗结核药致肝损害的风险高于相应的野生纯合子基因型(AA、GG和TT基因型),差异有统计学意义(P<0.05),见表4。
本研究以与肝损害密切相关的药物代谢、转运和免疫通路为基础,检测了33个基因的遗传多态性与ATLI发生的关联,结合Lasso回归和条件logistic回归的结果,发现了4个ATLI的易感基因,包括转运基因SLCO1B1和免疫相关基因STAT3、IL-6和HSPA1L4。
SLCO1B1基因编码的有机阴离子转运蛋白(organic anion transporting polypeptide 1B1,OATP1B1)是肝脏重要转运蛋白之一。既往对SLCO1B1基因多态性与ATLI关联的研究不多且结果不一致。Kim等[7]在韩国人群开展的匹配病例对照研究发现,SLCO1B1多态性和ATLI之间不存在统计学意义的关联,李灵敏等[8]报告在中国西南地区人群中,SLCO1B1基因521T>C(rs4149056) 位点与ATLI存在相关性,张金玲等[9]在另一中国人群的研究则未发现SLCO1B1基因388A/G (rs2306283)与ATLI的关联。本研究结果显示,ATLI的发生与rs4149056和rs2306283位点无关联,但与rs4149014位点存在统计学意义的关联。本研究结果与既往研究均不一致,其原因可能包括目标人群的不同(韩国人群[7]和中国人群[8, 9]在SLCO1B1基因多态性位点的基因型频率上存在差异)、肝损害类型的不同(Kim等[7]的研究纳入的是单纯肝细胞损害型,而李灵敏等[8]、张金玲等[9]的研究以及本研究均纳入了三种类型的肝损害)和研究设计的不同(Kim等[7]、张金玲[9]的研究和本研究都采用了匹配的病例对照研究设计,而李灵敏等[8]的研究没有进行匹配)。本研究首次报告的易感基因位点rs4149014位于SLCO1B1的启动子区域,目前仅有Lin等[10]报告该位点与维吾尔族人群的高血压有关,对于该位点的功能仍有待进一步研究。
IL-6/STAT3通路是肝脏再生分子调节的重要通路,在肝脏再生过程中发挥关键性的作用。其中,IL-6是一种多功能的细胞因子,能参与机体炎症、免疫调节、造血、神经调节、肝脏代谢等过程[11]。在肝脏,IL-6能够促进肝细胞急性相蛋白的合成,参与炎症反应过程,增强机体的防御能力。Carr等[12]在高加索人群中开展了队列研究,探讨IL-6基因多态性与他克林(治疗老年痴呆的药物)导致肝损伤的关系,结果显示,rs2066992位点的多态性与药物性肝损害的发生有统计学关联,与本研究的结果一致。而STAT3则在细胞因子的信号转导中起着关键作用,并参与细胞生长、分化、增生及凋亡抑制等生理功能的调控[13, 14]。本研究首次在人群中检测并发现了STAT3基因多态性位点rs1053023与ATLI的关联,动物实验表明STAT3具有促进肝细胞再生作用[15, 16],为该结果提供了合理的生物学解释。目前认为IL-6/STAT3通路可以诱导其下游靶基因如Bcl-2、Bcl-xl、FLIP等活化,进而阻断Fas/FasL诱导的细胞凋亡途径,起到保护肝脏的作用[17]。
热休克蛋白(heat shock protein,HSP)是机体在应激条件下合成的蛋白质,能在多种应激条件下发挥保护作用。其中,HSP70是热休克蛋白家族中重要的一员,被称为主要热休克蛋白[18]。既往动物研究发现IL-6可以通过上调HSP的表达起到保护肝细胞的作用[19]。本研究检测了与血清HSP70水平密切相关的基因位点HSPA1L rs2227956[20, 21],结果显示HSPA1L基因多态性与ATLI有统计学关联。在氟氯西林导致的肝损害中也发现了相同的阳性位点[22],但主要归因于其与附近的HLA-B基因(B*57:01)存在连锁不平衡,提示未来研究可以关注HLA Ⅰ类和Ⅱ类区域的基因多态性与ATLI的关系。
本研究从药物代谢和转运以及免疫反应等多个角度全面探讨了基因多态性与ATLI的关系,采用巢式病例对照设计和1 ∶ 4匹配的方法有效地控制了一些潜在混杂并提高了研究的统计学效能。利用Lasso回归和logistic回归相结合的方法进行易感基因位点的筛选。Lasso回归可以同时分析所有位点的数据,减少由于多次比较而产生假阳性结果的可能性,从而提高变量筛选的效率和准确性。考虑到Lasso回归只能给出有偏倚的估计,研究进一步采用logistic回归计算关联的大小。
本研究存在不足。如研究样本量相对较小,缺失碱性磷酸酶数据而未能考虑肝损害的不同类型,以及由于联合用药无法判断引发肝损害的具体药物。
综上所述,本研究利用ADACS队列资料,筛选出4个中国抗结核治疗人群ATLI患者遗传易感性位点,为进一步研究ATLI的发病机制、实现ATLI的早期预防与个体化治疗提供了科学依据。
利益冲突 无
| [1] Dye C,Garnett GP,Sleeman K,et al. Prospects for worldwide tuberculosis control under the WHO DOTS strategy[J]. Lancet,1998,352(9144):1886-1891. DOI:10.1016/S0140-6736(98)03199-7. |
| [2] Corsini A,Bortolini M. Drug-induced liver injury:the role of drug metabolism and transport[J]. J Clin Pharmacol,2013,53(5):463-474. DOI:10.1002/jcph.23. |
| [3] Tujios S,Fontana RJ. Mechanisms of drug-induced liver injury:from bedside to bench[J]. Nat Rev Gastroenterol Hepatol,2011,8(4):202-211. DOI:10.1038/nrgastro.2011.22. |
| [4] Xia YY,Hu DY,Liu FY,et al. Design of the anti-tuberculosis drugs induced adverse reactions in China National Tuberculosis Prevention and Control Scheme Study (ADACS)[J]. BMC Public Health,2010,10(1):267. DOI:10.1186/1471-2458-10-267. |
| [5] Bénichou C. Criteria of drug-induced liver disorders. Report of an international consensus meeting[J]. J Hepatol,1990,11(2):272-276. DOI:10.1016/0168-8278(90)90124-A. |
| [6] Tibshirani R. Regression shrinkage and selection via the lasso:a retrospective[J]. J Roy Stat Soc Ser B (Stat Methodol),2011,73(3):273-282. DOI:10.1111/j.1467-9868.2011.00771.x. |
| [7] Kim SH,Kim SH,Lee JH,et al. Polymorphisms in drug transporter genes (ABCB1,SLCO1B1 and ABCC2)and hepatitis induced by antituberculosis drugs[J]. Tuberculosis,2012,92(1):100-104. DOI:10.1016/j.tube.2011.09.007. |
| [8] 李灵敏,陈磊,陈文生. OATP1B1基因多态性与抗结核药物肝损害的关联研究[J]. 中华临床医师杂志:电子版,2013,7(24):11376-11379. DOI:10.3877/cma.j.issn.1674-0785.2013.24.066. Li LM,Chen L,Chen WS. The relationship between OATP1B1 genetic polymorphisms and susceptibility to antituberculosis drug induced hepatotoxicity[J]. Chin J Clin:Electr Ed,2013,7(24):11376-11379. DOI:10.3877/cma.j.issn.1674-0785.2013.24. 066. |
| [9] 张金玲,朱学彬,李世明,等. SLCO1B1/ABCB1基因多态性与抗结核药物性肝损伤的相关性分析[J]. 中华疾病控制杂志,2013,17(6):469-472. Zhang JL,Zhu XB,Li SM,et al. Study on the relationship between polymorphisms in drug transporter genes (SLCO1B1,ABCB1)and anti-tuberculosis drug induced hepatic injury[J].Chin J Dis Control Prev,2013,17(6):469-472. |
| [10] Lin R,Wang XF,Zhou WC,et al. Association of polymorphisms in the solute carrier organic anion transporter family member 1B1 gene with essential hypertension in the Uyghur population[J]. Ann Hum Genet,2011,75(2):305-311. DOI:10.1111/j.1469-1809.2010.00622.x. |
| [11] Akira S. IL-6-regulated transcription factors[J]. Int J Biochem Cell Biol,1997,29(12):1401-1418. DOI:10.1016/S1357-2725(97)00063-0. |
| [12] Carr DF,Alfirevic A,Tugwood JD,et al. Molecular and genetic association of interleukin-6 in tacrine-induced hepatotoxicity[J]. Pharmacogenet Genom,2007,17(11):961-972. DOI:10.1097/FPC.0b013e3282f00919. |
| [13] O'shea JJ,Notarangelo LD,Johnston JA,et al. Advances in the understanding of cytokine signal transduction:the role of Jaks and STATs in immunoregulation and the pathogenesis of immunodeficiency[J]. J Clin Immunol,1997,17(6):431-447. DOI:10.1023/A:1027388508570. |
| [14] Kong XN,Horiguchi N,Mori M,et al. Cytokines and STATs in liver fibrosis[J]. Front Physiol,2012,3:69. DOI:10.3389/fphys.2012.00069. |
| [15] Li W,Liang XP,Kellendonk C,et al. STAT3 contributes to the mitogenic response of hepatocytes during liver regeneration[J]. J Biol Chem,2002,277(32):28411-28417. DOI:10.1074/jbc.M202807200. |
| [16] Huda KAS,Guo L,Haga S,et al. Ex vivo adenoviral gene transfer of constitutively activated STAT3 reduces post-transplant liver injury and promotes regeneration in a 20% rat partial liver transplant model[J]. Transpl Int,2006,19(5):415-423. DOI:10.1111/j.1432-2277.2006.00285.x. |
| [17] Taub R. Hepatoprotection via the IL-6/Stat3 pathway[J]. J Clin Invest,2003,112(7):978-980. DOI:10.1172/JCI19974. |
| [18] Bajramović JJ,Bsibsi M,Geutskens SB,et al. Differential expression of stress proteins in human adult astrocytes in response to cytokines[J]. J Neuroimmunol,2000,106(1/2):14-22. DOI:10.1016/S0165-5728(99)00260-X. |
| [19] Masubuchi Y,Bourdi M,Reilly TP,et al. Role of interleukin-6 in hepatic heat shock protein expression and protection against acetaminophen-induced liver disease[J]. Biochem Biophys Res Commun,2003,304(1):207-212. DOI:10.1016/S0006-291X(03)00572-2. |
| [20] Afzal AR,Mandal K,Nyamweya S,et al. Association of Met439Thr substitution in heat shock protein 70 gene with postoperative atrial fibrillation and serum HSP70 protein levels[J]. Cardiology,2008,110(1):45-52. DOI:10.1159/000109406. |
| [21] Ucisik-Akkaya E,Davis CF,Gorodezky C,et al. HLA complex-linked heat shock protein genes and childhood acute lymphoblastic leukemia susceptibility[J]. Cell Stress Chaperon,2010,15(5):475-485. DOI:10.1007/s12192-009-0161-6. |
| [22] Daly AK,Donaldson PT,Bhatnagar P,et al. HLA-B*5701 genotype is a major determinant of drug-induced liver injury due to flucloxacillin[J]. Nat Genet,2009,41(7):816-819. DOI:10.1038/ng.379. |
 2016, Vol. 37
2016, Vol. 37