文章信息
- 夏芳, 徐元宏, 汪学龙.
- Xia Fang, Xu Yuanhong, Wang Xuelong.
- 梅毒螺旋体抗体血清学检测方法的临床应用价值探讨
- Analysis on the clinical value of methods used for the detection of treponema pallidum antibody
- 中华流行病学杂志, 2016, 37(6): 863-867
- Chinese Journal of Epidemiology, 2016, 37(6): 863-867
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.06.024
-
文章历史
- 投稿日期: 2016-2-24
2. 238100 安徽省马鞍山市含山县人民医院检验科;
3. 230022 合肥, 安徽医科大学第一附属医院检验科
2. Laboratory Department, the People's Hospital of Hanshan County, Ma'anshan 238100, China;
3. The First Affiliated Hospital of Anhui Medical University, Hefei 230022, China
近年来梅毒发病率呈增长趋势,各期梅毒的临床表现复杂多样,可造成人体多器官和神经的损害,产生多种症状与体征,梅毒抗体血清学检测已成为临床上诊断梅毒感染的主要依据之一[1]。通过梅毒抗体检测,可及早发现和控制潜在传染源,对患者采取必要的隔离与防护措施,建立以切断传播途径为主的预防控制措施,控制感染与交叉感染[2]。人体感染梅毒螺旋体后产生两种抗体,一是非特异反应素(抗脂质抗体),可通过快速血浆反应素环状卡片试验(Rapid plasma reagin,RPR)或甲苯胺红不加热血清试验(Toluidine red unheated serum test,TRUST)等检测;二是梅毒螺旋体特异性抗体(Treponema pallidum antibody,TP-Ab),可用明胶颗粒凝集试验(Treponema pallidum particle agglutination assay,TPPA)、ELISA和化学发光微粒子免疫分析法(Chemiluminescent microparticle immunoassay,CMIA)等检测;快速筛检法有梅毒螺旋体抗体胶体金法和乳胶法(TP-AD)等检测[3]。本研究旨在比较ELISA、CMIA、TPPA、TP-AD和TRUST 5种方法对梅毒抗体检测的结果,评价其临床应用价值。
资料与方法1. 研究对象:2014年1月至2015年5月在安徽医科大学第一附属医院就诊的皮肤科患者、住院输血前、手术前感染性疾病筛查患者,均为临床确诊的梅毒患者,共计160例,其临床诊断标准和分期参照原卫生部的《梅毒诊断标准(中华人民共和国卫生行业标准) WS 273-2007》。其中男性93例,女性67例,年龄15~87岁,一期梅毒患者32例,二期梅毒患者57例,三期梅毒患者8例,隐性梅毒感染者63例,选取同期来本院就诊的非梅毒患者共200例作为对照组,其中男性109例,女性91例,年龄18~85岁。对研究对象空腹采集静脉血进行试验室检测。
2. 仪器和试剂:瑞士Tecan公司Infinite F50酶标仪,郑州基波新科技有限公司全自动快速立式洗板机JB-Ⅰ型,全自动微粒子化学发光仪i2000及配套的梅毒螺旋体抗体试剂盒购自美国雅培公司,ELISA梅毒螺旋体抗体诊断试剂盒购自上海科华试剂有限公司,TPPA试剂盒购自日本富士瑞必欧株式会社,TP-AD试剂盒购自杭州艾博生物有限公司,TRUST试剂盒购自上海荣盛生物有限公司。
3. 检测方法:采集研究对象清晨空腹静脉血,分离血清(3 000 r/min,离心5 min),均严格按照试剂盒说明书方法用ELISA、TPPA、TP-AD和TRUST分别于24 h内检测,部分血清-20 ℃冰箱保存,解冻后进行CMIA试验。① TPPA:血清样品25 μl在微孔板样品稀释液倍比稀释,加入试剂,混匀、加盖,室温2 h后判定结果。阳性判定标准:加入致敏粒子产生凝集反应出现环状粒子环最大稀释度(最终稀释倍数≥1:80)的反应图像判定为阳性。ELISA法:样品吸光度与临界值比值,即S/CO 值≥1.0 判定为阳性。CMIA法:标本化学发光反应物的相对光强度(RLU)和临界值(cut off RLU)比值,即S/CO 值≥1.0 判定为阳性,CMIA 从测试到结果判读均为仪器全自动完成,④ TP-AD阳性判定:检测区(T)和质控区(C)均出现红色条带,0~30 min内判断。⑤ TRUST定性试验:血清和试剂各50 μl混合以呈现明显红色凝聚物为阳性反应;定量实验:将待检血清用生理盐水做倍比稀释,加入试剂,以呈现明显凝集反应的最高稀释度作为该血清的凝集效价。ELISA、CMIA和TP-AD分别联合TRUST法,3组实验中2组阳性则为联合实验阳性。敏感度=梅毒患者真阳性例数/梅毒患者总例数;特异度=非梅毒患者真阴性例数/非梅毒患者总例数。
4. 统计学分析:采用SPSS 16.0软件进行统计学分析,5种方法比较采用R×C表的 χ2检验,两两比较采用R×C表的分割 χ2检验,ELISA、CMIA法的S/CO 值计量资料以(x±s)表示,采用t检验,治疗前后TRUST及滴度分组分析采用 χ2检验,以P<0.05为差异有统计学意义。ELISA梅毒螺旋体抗体诊断试剂盒(上海科华试剂有限公司),TPPA试剂盒(日本富士瑞必欧株式会社),TP-AD试剂盒(杭州艾博生物有限公司),TRUST试剂盒(上海荣盛生物有限公司)。
结 果1. 5种方法的敏感度、特异度分析:160例确诊梅毒病例组用5种方法的敏感度和特异度:TPPA为100.00%和99.50%、CMIA为99.38%和99.00%、ELISA为98.12%和99.00%、TP-AD为94.38%和94.50%、TRUST为85.62%和95.50%。约登指数依次为TPPA>CMIA>ELISA>TP-AD>TRUST,见表 1。
2. 不同分期梅毒患者梅毒螺旋体阳性率:TRUST对潜伏期和一期梅毒患者梅毒螺旋体抗体检测的阳性率低于TPPA、ELISA、CMIA和TP-AD,差异有统计学意义(均P<0.05)。5种方法对二期、三期梅毒患者检测的阳性率差异无统计学意义(均P>0.05)。TPPA、ELISA、CMIA对各期梅毒患者检测的阳性率差异无统计学意义(均P>0.05),见表 2。
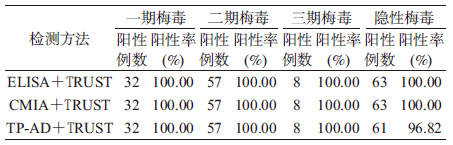
3. TRUST与3种方法联合对不同梅毒分期患者检测的阳性率:ELISA或CMIA联合TRUST法对各期梅毒患者阳性率均为100.00%,TP-AD联合TRUST法阳性率为96.82%,见表 3。
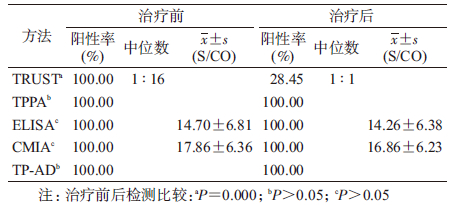
4. 5种方法对梅毒患者治疗前后检测的阳性率:对121例梅毒患者治疗前和临床规范治疗3个月后的患者用5种方法进行血清学检测,TRUST滴度试验在治疗前后中位数分别为1:16和1:1,阳性率分别是100.00%和26.45%,治疗前后阳性率的差异有统计学意义(χ2=137.626,P=0.000);TPPA、ELISA、CMIA、TP-AD 在治疗前后检测结果的差异无统计学意义(P>0.05),阳性率均为100.00%;ELISA和CMIA在治疗前后检测的S/CO值数据均符合正态分布(Z值分别为0.878、1.017、0.843和0.847,P值分别为0.424、0.252、0.476和0.470),方差齐同(F值分别为0.089和0.001,P值分别为0.766和0.979),ELISA和CMIA在治疗前后检测的S/CO值差异无统计学意义(P值分别为0.081和0.237),见表 4。
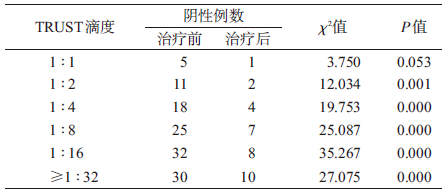
5. 梅毒患者治疗监测的TRUST滴度分析:TRUST滴度1:1时治疗前后检测结果的差异无统计学意义(P=0.053),其余滴度治疗前后检测结果的差异有统计学意义(P<0.01),见表 5。
TPPA是公认的梅毒确认试验[1]。本研究显示,其敏感度和特异度分别为100.00%和99.50%,与既往研究一致[4]。老年人由于慢性病史等其他口腔螺旋体感染可出现1.00%的假阳性,梅毒在低危人群中可有0.10%的假阳性,与已有研究结果相符[5]。但TPPA检测需多步稀释,价格昂贵,操作较繁琐,耗时较长(至少2 h),结果依赖肉眼判断而存在主观判断的误差且不易保存,对操作人员要求也高,不适合批量样品的筛选,限制其临床广泛应用[6]。
ELISA可利用酶标仪判读S/CO值、原始结果易于保存和查询、重复性好等优点,适用于临床批量标本的梅毒抗体筛查,是临床实践中广泛应用的确认方法[7]。本研究中梅毒患者经ELISA检测假阴性率为1.88%,血清经稀释后重新检测仍为阴性,但经其他4种方法检测为阳性,提示不是钩状效应的影响。ELISA虽对仪器要求不高,但耗时较长(至少2.5 h)及操作较繁琐,且血清中存在非特异性抗体、窗口期、钩状效应等导致假阳性或假阴性[8]。本研究显示,如采用ELISA初筛可漏检,采用TRUST和ELISA两种方法联合检测可提高梅毒检出率,其任一试验阳性标本通过TPPA检测,可提高检测的可信度。
CMIA能自动、快速检测血清TP-Ab,为高通量检测(每小时可测200个标本),适合大批量样本筛查,与已有研究结果一致[9]。与ELISA法相比,CMIA更为可靠、灵敏、准确、快速,将来有可能取代ELISA[10]。
TP-AD快速检测法操作简单,但受温度和时间的影响较大,敏感性和特异性较低,且无法实现自动化,可用作临床急诊手术、输血前等快速初筛,但仍需确认试验[11]。
TP-Ab阳性不能作为观察临床疗效的指标和判定梅毒活动与否,本研究显示4种TP-Ab试验治疗前后阳性率差异均无统计学意义。TP-Ab产生早,一般在潜伏期或在感染2周左右产生,其阳性包含有感染过梅毒后已恢复的人群中IgG抗体和隐性梅毒感染人群,梅毒感染后3~4周后产生抗类脂质抗体,在梅毒感染的不同时期阳性率差异较大,需要联合TRUST定量滴度试验,判定患者是否处于梅毒活动期及疗效监测。本研究提示,非梅毒者经TRUST检测4.50% 呈阳性,已有研究也显示,在孕妇、老年人、自身免疫性疾病患者中,有TRUST生物学假阳性反应[12]。TRUST对潜伏期梅毒和一期梅毒患者检测的阳性率低于其他4种检测方法,5种方法对二期梅毒和三期梅毒检测结果的差异无统计学意义,与相关研究结果一致[4]。梅毒患者经过3个月规范治疗后,71.55%患者体内的梅毒螺旋体会受到抑制甚至清除,但仍有28.45%的患者中非特异反应素可以持续低滴度阳性,称为“血清固定”,可能为患者细胞免疫功能受到抑制,从而影响梅毒螺旋体的彻底清除[13]。
梅毒螺旋体血清学检测应考虑成本、易用性、适用性、样本量因素[14]。为提高临床检出阳性率,最好采用2种以上方法检测,ELISA或CMIA联合TRUST可作为梅毒初筛试验的可靠方法。为提高临床可信度,二者中任一阳性需经TPPA复检,TRUST结合临床症状以确诊梅毒活动期、疗效观察,TP-AD法可用作急诊的筛查,但需作确诊试验。
利益冲突 无| [1] 汪光蓉,李维丽,王强,等. 化学发光法检测梅毒螺旋体特异抗体S/CO低值标本的复检结果分析[J]. 中国皮肤性病学杂志,2014,28(6):637-639. DOI:10.13735/j.cjdv.1001-7089.2014. 0637. Wang GR,Li WL,Wang Q,et al. Analysis of second measurement results of samples with a low S/CO ratio of syphilis antibody detected by chemiluminescent assay[J]. Chin J Derm Venereol,2014,28(6):637-639. DOI:10.13735/j.cjdv.1001-7089. 2014. 0637. |
| [2] 高阳,芦璐,刘新凤. 住院患者输血前感染性指标检测分析[J]. 中华医院感染学杂志,2014,24(1):197-199. DOI:10.11816/cn.ni.2014-131396. Gao Y,Lu L,Liu XF. Detection of infectious indicators of hospitalized patients before blood transfusion[J]. Clin J Nosocomiol,2014,24(1):197-199. DOI:10.11816/cn.ni. 2014-131396. |
| [3] Binnicker MJ,Jespersen DJ,Rollins LO. Treponema-specific tests for serodiagnosis of syphilis:comparative evaluation of seven assays[J]. J Clin Microbiol,2011,49(4):1313-1317. DOI:10.1128/JCM.02555-10. |
| [4] 温洁新,杨雪梅,刘丽娟,等. 梅毒血清学试验方法诊断评价[J]. 中华医院感染学杂志,2015,25(22):5142-5143,5151. DOI:10.11816/cn.ni.2015-134619. Wen JX,Yang XM,Liu LJ,et al. Effects of serologic tests on diagnosis of syphilis[J]. Clin J Nosocomiol,2015,25(22):5142-5143,5151. DOI:10.11816/cn.ni.2015-134619. |
| [5] 李彦,李振鲁,杨雪源. 老年患者梅毒感染分析[J]. 中华医院感染学杂志,2014,24(8):1958-1959,1977. DOI:10.11816/cn.ni.2014-134577. Li Y,Li ZL,Yang XY. Positive analysis on senile syphilis serology infections[J]. Clin J Nosocomiol,2014,24(8):1958-1959,1977. DOI:10.11816/cn.ni.2014-134577. |
| [6] 张晓红,张倩,周学红,等. 化学发光法检测梅毒特异性抗体在临床筛查试验中的应用评价[J]. 中华检验医学杂志,2014,37(10):780-783. DOI:10.3760/cma.j.issn.1009-9158.2014.10.022. Zhang XH,Zhang Q,Zhou XH,et al. Evaluation of the chemiluminescence immunoassay for diagnosis of syphilis in the clinical screening test[J]. Chin J Lab Med,2014,37(10):780-783. DOI:10.3760/cma.j.issn.1009-9158.2014.10.022. |
| [7] 李志艳,刘平,高健,等. 梅毒螺旋体抗体筛查方法的比较性研究[J]. 中华检验医学杂志,2012,35(12):1176-1179. DOI:10.3760/cma.j.issn.1009-9158.2012.12.027. Li ZY,Liu P,Gao J,et al. Comparative study of five analytical methods for screening of antibodies against Treponema pallidum[J]. Chin J Lab Med,2012,35(12):1176-1179. DOI:10.3760/cma.j.issn.1009-9158.2012.12.027. |
| [8] Liu C,Ou QS,Chen HJ,et al. The diagnostic value and performance evaluation of five serological tests for the detection of Treponema pallidum[J]. J Clin Lab Anal,2014,28(3):204-209. DOI:10.1002/jcla.21667. |
| [9] 马红霞,周运恒,杨蔺,等. 不同的梅毒血清学试验方法检测1808例血清标本结果分析[J]. 第二军医大学学报,2011,32(12):1350-1352. DOI:10.3724/SP.J.1008.2011.01350. Ma HX,Zhou YH,Yang L,et al. Different serological tests for syphilis in 1,808 specimens[J]. Acad J Sec Milit Med Univ,2011,32(12):1350-1353. DOI:10.3724/SP.J.1008.2011.01350. |
| [10] Li LX,Cai B,Tao CM,et al. Performance evaluation of CLIA for Treponema pallidum specific antibodies detection in comparison with ELISA[J]. J Clin Lab Anal,2015. DOI:10.1002/jcla.21839.[Epub ahead of print]. |
| [11] 尹静,徐贵江,刘艳. 4种梅毒血清学检测方法的临床应用及评价[J]. 国际检验医学杂志,2014,35(23):3244-3245,3248. DOI:10.3969/j.issn.1673-4130.2014.23.040. Yin J,Xu GJ,Liu Y. Clinical application and evaluation of 4 kinds of siphilis serological detection method[J]. Int J Lab Med,2014,35(23):3244-3245,3248. DOI:10.3969/j.issn.1673-4130. 2014.23.040. |
| [12] Liu C,Ou QS,Chen HJ,et al. The diagnostic value and performance evaluation of five serological tests for the detection of Treponema pallidum[J]. J Clin Lab Anal,2014,28(3):204-209. DOI:10.1002/jcla.21667. |
| [13] 朱春玲,侯远沛,彭素真,等. 梅毒患者243例相关抗体检测结果分析[J]. 中国皮肤性病学杂志,2014,28(11):1142-1158. DOI:10.13735/j.cjdv.1001-7089.2014.1142. Zhu CL,Hou YP,Peng SZ,et al. Analysis of serological test results in 243 patients with syphilis[J]. Chin J Dermatovenereol,2014,28(11):1142-1158. DOI:10.13735/j.cjdv.1001-7089. 2014.1142. |
| [14] Li ZY,Wang ML,Liu P,et al. Consistency between Treponema pallidum particle agglutination assay and architect chemiluminescent microparticle immunoassay and characterization of inconsistent samples[J]. J Clin Lab Anal,2015,29(4):281-284. DOI:10.1002/jcla.21765. |
 2016, Vol. 37
2016, Vol. 37