文章信息
- 刘学智, 南晶, 李娟, 李颖, 丁玲, 王金桃.
- Liu Xuezhi, Nan Jing, Li Juan, Li Ying, Ding Ling, Wang Jintao.
- FHIT基因甲基化及蛋白表达与HPV16感染在宫颈癌变中的交互效应
- Interaction between fragile histidine triad methylation, protein expression and human papillomavirus 16 infection in cervical carcinogenesis
- 中华流行病学杂志, 2016, 37(6): 858-862
- Chinese Journal of Epidemiology, 2016, 37(6): 858-862
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.06.023
-
文章历史
- 投稿日期: 2016-1-13
高危型HPV16感染是宫颈癌的主要病因[1]。但在感染者中,只有20%发展为非典型增生,而这些癌前病变中也只有1/5发展为宫颈癌[2],提示HPV感染并非宫颈癌发生的唯一因素。脆性组氨酸三联体(FHIT)横跨脆性位点FRA3B,该位点包含HPV16 DNA整合的部位,提示FHIT基因可能为HPV感染致癌提供了生物学基础,而HPV的整合也可能导致FHIT基因功能的缺失或失活[3]。已有研究提示,宫颈癌中FHIT蛋白表达降低可能与FHIT基因甲基化有关[4, 5],且FHIT基因异常表达可能是HPV16作用的直接结果[6],但是FHIT基因甲基化和异常表达与HPV16感染在宫颈病变中的相互关系目前尚未阐明。为此本研究分析不同宫颈癌变患者中FHIT基因甲基化和蛋白表达水平,并探讨其与HPV16感染的交互效应,为宫颈癌变分子致癌机制研究提供依据。
对象与方法1. 研究对象:选择2009年9月至2011年3月在山西省肿瘤医院、山西医科大学第二医院妇科、太原市妇幼保健院和介休市妇幼保健院就诊的新发宫颈鳞状细胞癌(SCC)100例,宫颈上皮内瘤样变(CIN)142例(72例CIN1,70例CIN2+)和正常宫颈(NC)妇女108例为研究对象。均为病理学确诊,未进行放疗、化疗等治疗,并排除其他肿瘤者。采用统一的结构式问卷,由培训合格的调查人员进行面对面调查。主要包括一般人口学特征、生活饮食习惯以及生殖情况。同时采集全部研究对象的手术或活检宫颈组织标本,于-80 ℃冰箱保存待检。研究通过山西医科大学伦理委员会审查并获得研究对象知情同意。
2. 研究方法:
(1)PCR检测宫颈组织HPV16 DNA:采用酚-氯仿法提取宫颈组织DNA,按照本研究前期报道的方法进行HPV16 DNA的扩增,确定高危型HPV16感染状态[7]。
(2)甲基化特异性PCR(MSP)法检测FHIT基因甲基化状况:采用酚-氯仿抽提法提取宫颈组织的总DNA。参照本研究前期建立的方法检测FHIT基因甲基化状况[8]。FHIT基因的甲基化引物:上游5′-TTG GGG CGC GGG TTT GGG TTT TTA CGC-3′,下游5′-CGT AAA CGA CGC CGA CCC CAC TA-3′;非甲基化引物:上游5′-TTG GGG TGT GGG TTT GGG TTT TTA TG-3′,下游:5′-CAT AAA CAA CAC CAA CCC CAC TA-3′。对PCR扩增产物行2%琼脂糖凝胶电泳,在VILBER CV-A50C凝胶成像仪下观察,于74 bp处分别获得FHIT基因甲基化和未甲基化条带。
(3)Western Blot法检测FHIT蛋白的表达水平:取冻存宫颈组织50 mg,加适量WIP裂解液和PMSF的混合液,冰浴中匀浆,充分裂解。12 000 r/min离心,取上清,参照本研究前期建立方法检测FHIT蛋白表达水平[9]。一抗为1:800 兔抗人FHIT单克隆抗体,在相对分子质量43 KD和16.8 KD处分别获得内参照蛋白β-actin和FHIT蛋白条带。利用Quantity One软件分析条带的吸光度值(A值),以目的条带与内参β-actin条带的A值之比作为FHIT蛋白的相对表达量。
3. 统计学分析:利用SPSS 20.0软件进行相关资料的t检验、方差分析、Kruskal-Wallis检验、 χ2检验,计算因素与宫颈癌变之间关联强度指标(OR值及其95%CI)。应用相加效应模型进行交互作用评价,并计算交互作用相对超额危险度(RERI)、交互作用归因比(AP)和交互作用指数(SI)进行交互作用的定量分析。以P<0.05判断为差异有统计学意义。
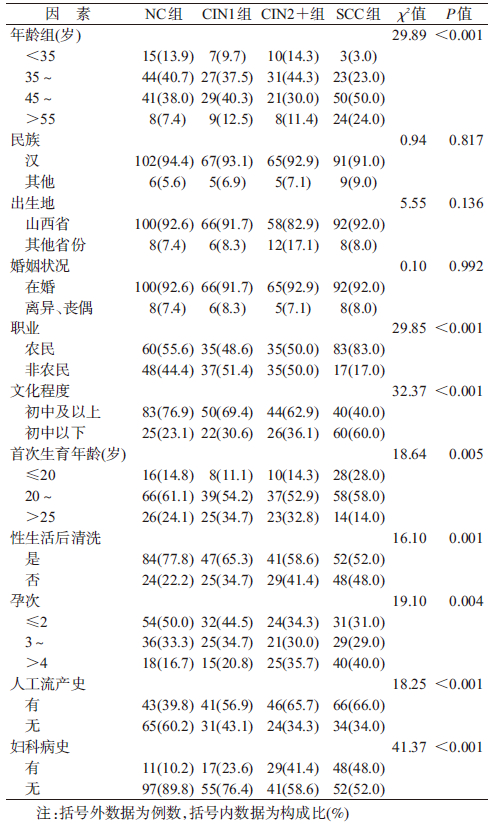
结 果1. 人口学特征及相关因素:NC、CIN1、CIN2+和SCC组年龄M值分别为47.81(30~69)、48.75(33~67)、45.62(34~75)和49.11(34~75)岁。各组间在民族、出生地、婚姻状况等方面的差异均无统计学意义(P>0.05),而在年龄、职业、首次生育年龄、个人卫生习惯、文化程度、孕产次、人工流产史、妇科病史等方面的差异均有统计学意义(P<0.05),见表 1。
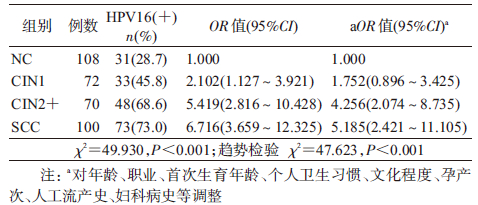
2. HPV16感染与宫颈癌变的关系:将HPV16 E6/E7 DNA任一阳性界定为HPV16阳性,对不同宫颈病变组HPV16感染状况分析。结果显示,HPV16感染率在CIN1(45.8%)、CIN2+(68.6%)和SCC(73.0%)组均高于NC组(28.7%),差异均有统计学意义,且随着宫颈病变的进展,HPV16感染率及OR值逐渐升高(趋势检验 χ2=47.623,P<0.001),见表 2。
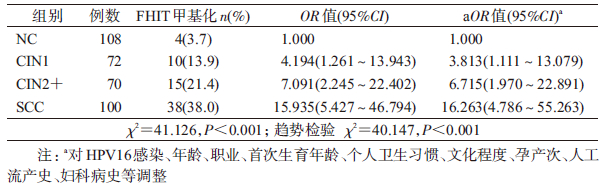
3. FHIT基因甲基化与宫颈癌变的关系:对不同宫颈病变组FHIT基因甲基化状态分析显示,FHIT基因甲基化率在CIN1(13.9%)、CIN2+(21.4%)和SCC(38.0%)组均高于NC组(3.7%),差异均有统计学意义,且随着宫颈病变程度加重,FHIT基因甲基化率及OR值呈升高趋势(趋势检验 χ2=40.147,P<0.001),见表 3。
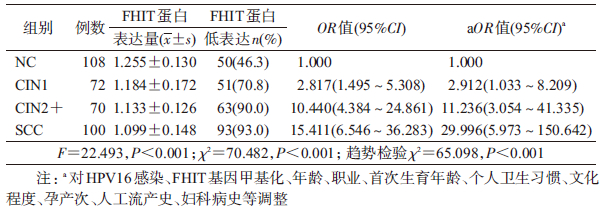
4. FHIT蛋白表达与宫颈癌变的关系:FHIT蛋白表达在CIN1、CIN2+和SCC组均低于NC组,差异均有统计学意义。进一步以NC组FHIT蛋白表达量的50%点值(1.255)为界,将≤1.255作为低蛋白表达进行分析。结果显示,随着宫颈病变程度的加重,FHIT蛋白低表达率及OR值逐渐升高(趋势检验 χ2=65.098,P<0.001),见表 4。
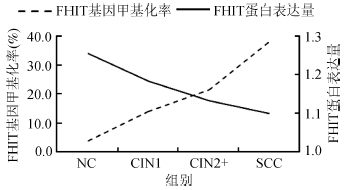
5. FHIT基因甲基化与FHIT蛋白表达在不同宫颈病变组中的变化趋势:随着宫颈病变程度的加重,FHIT基因甲基化率逐渐升高,而FHIT蛋白表达量逐渐降低(图 1)。
|
| 图 1 FHIT基因甲基化与FHIT蛋白表达在不同宫颈病变组中的变化趋势 |
6. FHIT基因甲基化、蛋白表达与HPV16感染的交互效应:考虑到HPV16感染为宫颈癌的主要致病因素,进一步应用相加效应模型分析FHIT基因甲基化与HPV16感染,以及FHIT蛋白低表达与HPV16感染在不同宫颈病变组中的交互作用。结果显示,FHIT基因甲基化与HPV16感染以及FHIT蛋白低表达与HPV16感染在CIN1、CIN2+和SCC组中均显示有相加交互作用,当以上两因素同时存在时,发生宫颈癌及癌前病变的风险均高于单独某因素存在时的效应。定量分析显示,随着宫颈病变程度的加重,FHIT基因甲基化与HPV16感染以及FHIT蛋白低表达与HPV16感染之间交互效应指标RERI、AP以及SI值均逐渐升高(表 5)。
宫颈癌的致病机制复杂,HPV感染,特别是高危型HPV持续感染与宫颈癌的发病密切相关,而HPV16是最常见的高危型亚型[10],全球超过一半的宫颈癌病例是由HPV16感染引起[11]。本研究显示,HPV16在宫颈癌组中感染率为73%,且随宫颈病变程度加重,HPV16感染率逐渐升高。
研究发现,高危型HPV感染者只有15%~20%发生宫颈癌,提示在宫颈癌的发生中可能还存在HPV的协同因素或其他致癌因素。FHIT基因是近年新发现的抑癌基因,其异常表达与宫颈癌的发生发展密切相关,而FHIT基因甲基化是导致自身功能失活的重要机制之一[12, 13]。目前DNA甲基化检测方法主要有MSP等[14]。本研究采用MSP法检测不同宫颈病变组FHIT基因甲基化状态,结果显示FHIT基因甲基化与蛋白表达之间呈负相关关系,随着宫颈病变的进展,FHIT基因甲基化率逐渐升高,但蛋白表达水平逐渐降低。提示FHIT基因的高甲基化和蛋白低表达均可增加宫颈癌变的风险,FHIT基因甲基化可能是FHIT蛋白表达降低的重要机制之一,特别是FHIT蛋白这一代表基因功能状态的指标,在宫颈癌前病变的早期阶段即发生了下调,提示FHIT基因甲基化与FHIT蛋白的检测对宫颈癌变的早期发现具有重要的预警意义。
FHIT基因定位于染色体3p14.2,覆盖染色体脆性位点FRA3B及HPV16 DNA整合点,提示FHIT基因可为HPV16感染并致癌提供整合位点,FHIT基因异常表达与HPV16感染可能在宫颈癌的发生发展中起协同作用。本研究前期结果显示,FHIT基因甲基化及蛋白表达异常可增加宫颈癌和癌前病变的发生风险[15],但与HPV16之间的关系尚未阐明。基于此本次研究结果显示,FHIT基因甲基化与HPV16感染以及FHIT蛋白低表达与HPV16感染在宫颈癌及癌前病变中均存在相加交互效应,在以上两因素同时存在时,宫颈癌及癌前病变的发生风险均高于单独因素存在时的效应。定量分析结果显示,随着宫颈病变程度的加重,FHIT基因甲基化及蛋白低表达与HPV16感染之间交互效应指标(RERI、AP、SI)均逐渐升高,提示FHIT基因甲基化及蛋白低表达与HPV16感染在宫颈癌及癌前病变的发生发展中具有协同作用。在HPV16感染的同时,如果出现FHIT基因甲基化或者FHIT蛋白低表达,则宫颈病变加重的风险将大大增加。因此在育龄妇女中开展TCT筛查和HPV分型检查的同时,更应该检测FHIT基因甲基化与FHIT蛋白表达水平。由于DNA的甲基化是可逆的,特别是在癌变的早期,因此在积极预防和控制HPV16感染的同时,逆转FHIT基因的甲基化状态可能是治疗宫颈癌的有效途径。Giarnieri等[16]研究也发现,在58例宫颈癌组织中HPV16感染与FHIT基因的表达呈负相关,显示FHIT基因表达异常与HPV16感染相互作用共同参与宫颈癌的发病。但也有学者认为,FHIT基因异常表达和HPV感染是参与宫颈癌发生的两个独立致病因素,HPV的整合和表达与FHIT基因表达异常无关[17]。鉴于宫颈癌发病机制的复杂性,FHIT基因异常表达与HPV16感染在宫颈癌变中协同作用的具体机制还有待深入研究。
利益冲突 无| [1] Shukla S,Mahata S,Shishodia G,et al. Functional regulatory role of STAT3 in HPV16-mediated cervical carcinogenesis[J]. PLoS One,2013,8(7):e67849. DOI:10.1371/journal.pone.0067849. |
| [2] 商宇红,魏丽惠,白丽霞,等. 雌激素受体亚型与人乳头状瘤病毒感染状态在宫颈病变进展中作用的研究[J]. 大连医科大学学报,2005,27(2):81-83. DOI:10.3969/j.issn.1671-7295.2005.02.001. Shang YH,Wei LH,Bai LX,et al. Study of ER and HPV in progression of cervical lesions[J]. J Dalian Med Univ,2005,27(2):81-83. DOI:10.3969/j.issn.1671-7295.2005.02.001. |
| [3] Wilke CM,Hall BK,Hoge A,et al. FRA3B extends over a broad region and contains a spontaneous HPV16 integration site:direct evidence for the coincidence of viral integration sites and fragile sites[J]. Hum Mol Genet,1996,5(2):187-195. DOI:10.1093/hmg/5.2.187. |
| [4] 宋春丽,张桂东,韩新彦,等. FHIT与PTEN基因在宫颈癌组织中表达及意义[J]. 中华实用诊断与治疗杂志,2013,27(9):868-872. DOI:10.11756/j.issn.1674-3474.2013.09.015. Song CL,Zhang GD,Han XY,et al. Expressions of FHIT and PTEN in cervical cancer and the clinical significance[J]. J Chin Pract Diag Thcrap,2013,27(9):868-872. DOI:10.11756/j.issn.1674-3474.2013.09.015. |
| [5] 刘瑾,魏琼. 宫颈癌中FHIT基因CpG岛甲基化检测意义[J]. 中华实用诊断与治疗杂志,2012,26(4):358-360. Liu J,Wei Q. Significance of detection of fragile histidine triad gene CpG island methylation in cervical carcinoma[J]. J Chin Pract Diag Thcrap,2012,26(4):358-360. |
| [6] 张文淼,帅茨霞,郑飞云,等. 脆性组氨酸三联体基因在宫颈癌前病变和宫颈癌中的表达及其与p53和HPV16/18的关系[J]. 中华肿瘤杂志,2006,28(6):452-455. DOI:10.3760/j.issn. 0253-3766.2006.06.014. Zhang WM,Shuai CX,Zheng FY,et al. Expression of FHIT genes in CIN and cervical carcinoma and the relationship between FHIT gene and p53 and HPV16/18[J]. Chin J Oncol,2006,28(6):452-455. DOI:10.3760/j.issn.0253-3766.2006.06.014. |
| [7] 王金桃,马晓晨,程玉英,等. 叶酸与宫颈癌关系的病例对照研究[J]. 中华流行病学杂志,2006,27(5):424-427. DOI:10.3760/j.issn.0254-6450.2006.05.016. Wang JT,Ma XC,Cheng YY,et al. A case-control study on the association between folate and cervical cancer[J].Chin J Epidemiol,2006,27(5):424-427. DOI:10.3760/j.issn.0254-6450.2006.05.016. |
| [8] 吴婷婷,王金桃,丁玲,等. 叶酸缺乏和p16基因CpG岛甲基化对宫颈癌变的作用[J]. 中华疾病控制杂志,2013,17(1):9-12. Wu TT,Wang JT,Ding L,et al. Folate deficiency and aberrant methylation of p16 CpG islands on cervical cancerand its precancerous lesions[J]. Chin J Dis Control Prev,2013,17(1):9-12. |
| [9] Wang JT,Ding L,Jiang SW,et al. Folate deficiency and aberrant expression of DNA methyltransferase 1 were associated with cervical cancerization[J]. Curr Pharm Des,2014,20(11):1639-1646. DOI:10.2174/13816128113199990543. |
| [10] de Sanjosé S,Diaz M,Castellsagué X,et al. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology:a meta-analysis[J]. Lancet Infect Dis,2007,7(7):453-459. DOI:10.1016/S1473-3099(07)70158-5. |
| [11] Xu B,Chotewutmontri S,Wolf S,et al. Multiplex identification of human papillomavirus 16 DNA integration sites in cervical carcinomas[J]. PLoS One,2013,8(6):e66693. DOI:10.1371/journal.pone.0066693. |
| [12] Huang LW,Chao SL,Chen TJ. Reduced Fhit expression in cervical carcinoma:correlation with tumor progression and poor prognosis[J]. Gynecol Oncol,2003,90(2):331-337. DOI:10.1016/S0090-8258(03)00318-4. |
| [13] Wu Y,Meng L,Wang H,et al. Regulation of DNA methylation on the expression of the FHIT gene contributes to cervical carcinoma cell tumorigenesis[J]. Oncol Rep,2006,16(3):625-629. DOI:10.3892/or.16.3.625. |
| [14] 林洁,朱益民,来茂德. DNA甲基化检测方法及其在肿瘤研究中的应用[J]. 中华病理学杂志,2009,38(2):139-141. DOI:10.3760/cma.j.issn.0529-5807.2009.02.022. Lin J,Zhu YM,Lai MD. Detection of DNA methylation and its application in tumor research[J]. Chin J Pathol,2009,38(2):139-141. DOI:10.3760/cma.j.issn.0529-5807.2009.02.022. |
| [15] 陈霄,王金桃,白丽霞,等. 宫颈癌变中叶酸缺乏与脆性组氨酸三联体基因表达异常的相互作用[J]. 中华流行病学杂志,2015,36(4):89-94. DOI:10.3760/cma.j.issn.0254-6450.2015.04.020. Chen X,Wang JT,Bai LX,et al. Interaction between folate deficiency and aberrant expression related to fragile histidine triad gene in the progression of cervical cancerization[J]. Chin J Epidemiol,2015,36(4):89-94. DOI:10.3760/cma.j.issn. 0254-6450.2015.04.020. |
| [16] Giarnieri E,Zanesi N,Bottoni A,et al. Oncosuppressor proteins of fragile sites are reduced in cervical cancer[J]. Cancer Lett,2010,289(1):40-45. DOI:10.1016/j.canlet.2009.07.017. |
| [17] Yoon SO. Abnormal fragile histidine traid (Fhit) expression in invasive cervical adenocarcinoma:association with tumor aggressiveness[J]. Hum Pathol,2007,38(2):326-331. DOI:10.1016/j.humpath.2006.08.012. |
 2016, Vol. 37
2016, Vol. 37