文章信息
- 赵嘉咏, 张胜勇, 穆玉姣, 张白帆, 夏胜利, 黄学勇, 许汴利.
- Zhao Jiayong, Zhang Shengyong, Mu Yujiao, Zhang Baifan, Xia Shengli, Huang Xueyong, Xu Bianli.
- 河南省登封市2009-2015年甲型副伤寒沙门菌耐药性及PFGE分型研究
- Drug tolerance and PFGE molecular typing of Salmonella paratyphi A isolated in Dengfeng, Henan province, 2009-2015
- 中华流行病学杂志, 2016, 37(5): 714-717
- Chinese Journal of Epidemiology, 2016, 37(5): 714-717
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.05.026
-
文章历史
- 收稿日期: 2015-10-28
2. 452470 登封市疾病预防控制中心检验科
2. Laboratory Department, Dengfeng Prefecture Center for Disease Control and Prevention, Dengfeng 452470, China
甲型副伤寒是由甲型副伤寒沙门菌引起的急性消化道传染病,临床上以持续高热、相对缓脉、特征性中毒症状、肝脾肿大、玫瑰疹与白细胞减少等为特征,肠出血、肠穿孔为主要并发症。该病终年均可发病,但以夏秋季为多。我国一般呈散在发生,可出现局部暴发或流行,是我国法定报告的乙类传染病之一[1, 2]。登封市是河南省肠道传染病及伤寒副伤寒重点监测哨点地区之一,也是河南省历年来甲型副伤寒散发和暴发病例的最主要来源地,自2007年以来,已暴发过2次(2007年与2015年)较大规模的甲型副伤寒疫情。本研究对2009-2015年分离自河南省登封市甲型副伤寒患者血培养物中的126株甲型副伤寒沙门菌进行耐药性检测与PFGE分子特征分析,为深入了解当地甲型副伤寒沙门菌的病原学、分子流行病学特征与耐药状况,指导临床合理用药和疾病防控提供依据。
对象与方法1. 菌株来源:自2009-2015年河南省发热伴出疹症候群监测系统中收集并分离于登封市248例副伤寒患者血培养物中的126株甲型副伤寒沙门菌,其中2009年22例14株,2010年107例45株,2011年23例11株,2012年64例30株,2015年32例26株。
2. 主要试剂:双相血培养瓶[贝瑞特生物技术(郑州)有限公司]、沙门菌科玛嘉鉴定培养基(法国CHROMAgar公司)、M-H琼脂及药敏纸片(英国OXOID公司)、API20E肠杆菌科细菌鉴定板条(法国BioMérieux公司)、沙门菌分型血清(丹麦SSI公司)。
3. 方法:
(1)菌株分离鉴定与血清分型:抽取临床诊断为副伤寒患者的静脉血8~10 ml,双相血培养瓶37 ℃培养4~7 d,挑取固相培养基上菌落或浑浊态培养液转种至沙门科玛嘉选择性培养基,利用API20E肠杆菌科系统进行生化鉴定、沙门菌诊断血清进行O抗原及H相(1/2相)鞭毛诱导与玻片凝集试验,根据Kauff wan-White(K-W)血清分型表确定对应血清型别[3]。
(2)药敏试验:参照WHO推荐的Kirby-Bauer法,参照美国临床实验室标准化协会2009年标准进行耐药表型判定,大肠埃希菌ATCC25922作为质控菌株[4]。
(3)PFGE分型:按照Pulse Net China网络实验室公布的沙门菌PFGE标准分型方法,沙门菌标准株H9812作为分子质量标记[5]。
4. 数据分析:用BioNumerics 6.0软件对电泳图谱进行数据分析,绘制聚类分析树状图。聚类算法为非加权配对平均法(UPGMA),电泳条带位置优化度(position tolerance)1.5%,相似度100%认定为同一PFGE带型[5]。
结 果1. 病例分析:126例甲型副伤寒患者男女比例1.4∶1(74∶52),男性多于女性;年龄分布为16~18岁19例(15.1%),19~40岁82例(65.1%),41~60岁14例(11.1%),>60岁11例(8.7%),以青壮年为主;地区分布以城区为主(79例,62.7%),职业分布广泛,其中农民71例,工人29例,学生8例,餐饮从业人员4例,其余人员14例。对所有病例在外就餐或食用外购食品情况调查,未发现共同暴露史。病例发病日期多集中于每年的5-10月。大多数病例以发热、畏寒、头痛为主。最高体温波动在38.4~41.7 ℃,热型以弛张热最多(84例,66.7%),其次为不规则热39例(30.9%);43例(34.1%)患者有腹泻、腹痛和便秘等消化道症状,绝大部分病例(118例,93.7%)无玫瑰疹、表情淡漠、相对缓脉和肝脾肿大等典型症状。
2. 菌株鉴定与血清学分型:126株沙门菌在沙门菌科玛嘉培养基上均呈紫红色、边缘整齐、光滑凸起小菌落;KIA/MIU小生化反应:发酵葡萄糖,不发酵乳糖,产酸及硫化氢,不产气;尿酶阴性,动力阳性,靛基质阴性。API20E肠杆菌科系统生化鉴定为甲型副伤寒沙门菌,可信度(ID%)为99.2%,血清抗原式为1,2,12:a:-,参照K-W沙门菌血清分型手册判定均为甲型副伤寒沙门菌。
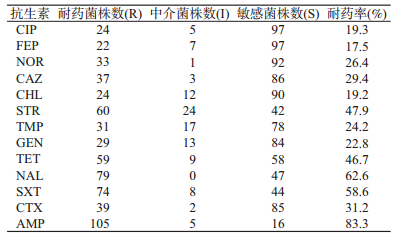
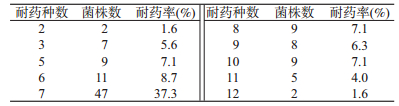
3. 药敏测试:126株甲型副伤寒沙门菌对广谱合成类青霉素氨苄西林(AMP)的耐药率为83.3%,对三代头孢类抗生素头孢他啶(CAZ)、头孢噻肟(CTX)的耐药率分别为29.4%和31.2%;对四代头孢类抗生素头孢吡肟(FEP)的耐药率为17.5%;对一代喹诺酮类抗生素萘啶酸(NAL)的耐药率为62.6%,对三代氟喹诺酮类抗生素环丙沙星(CIP)、诺氟沙星(NOR)的耐药率为19.3%和26.4%;对氨基糖苷类抗生素庆大霉素(GEN)、链霉素(STR)的耐药率为22.8%和47.9%;对氯霉素类抗生素(CHL)的耐药率为19.2%;对增效磺胺类抗生素甲氧苄氨嘧啶(TMP)与复方新诺明(SXT)的耐药率为24.2%和58.6%;对四环素(TET)的耐药率为46.7%。126株甲型副伤寒沙门菌中耐2种以上抗生素的多重耐药菌株为109株(86.5%),其中耐2~3种的为9株(7.1%),耐5~8种的为76株(60.3%),耐9~10种的为17株(13.5%),耐11~12种的为7株(5.6%);三代头孢类抗生素CAZ、CTX,一代与三代喹诺酮类抗生素NAL、CIP、NOR,氨基糖苷类抗生素STR耐药率总体呈年份上升趋势,见表 1,2。
4. PFGE分子分型:126株甲型副伤寒沙门菌经XbaⅠ酶切后共分为14种带型(PTYA1~14),带型聚类分析见图 1。各带型包含菌株数为1~98株不等(部分相同带型菌株省略),带型相似度在64.10%~100.00%之间,PTYA 1、6、9、10为其主要优势带型,其中PTYA1包含98株菌,PTY6、9、10三种带型均包含6株菌,带型相似度与PTYA1很高(95%以内)。126株甲型副伤寒沙门菌PFGE带型与耐药谱之间呈现一定的对应关系,PTYA1、PTYA6、PTYA9内与三带型间均存在耐药表型一致的菌株聚集现象,如PTYA1中14株甲副菌株耐药表型为AMP-GEN- TMP-TET-STR-NAL-SXT;8株菌耐药表型为AMP-TMP-CIP-TET-STR-NAL-CHL-NOR-SXT;PTYA6中5株菌耐药表型为AMP-GEN- TMP-TET-NAL-CHL-SXT;PTYA1与PTYA9中4株菌耐药表型均为AMP-GEN-TMP-CIP-TET- STR- NAL-CHL-NOR-SXT。在单菌株带型对应的耐药谱中,带型与耐药谱未发现一致性或高相似性,见图 1。
 |
| 图 1 河南省登封市甲型副伤寒沙门菌PFGE聚类分析 |
登封市历史上曾暴发过较大规模的甲型副伤寒疫情,波及范围广,持续时间长,罹患人数多。由于慢性带菌者的持续存在,疾病传染源的多样性及传播途径不易彻底切断和人工免疫效果欠佳等原因,新发病例与聚集性病例仍时有出现,5年来其实验室确诊的病例数已占到河南省监测病例数的92%以上。从本研究中可看到,当地甲型副伤寒患者多集中在18~40岁间的青壮年人群中,男性多于女性,职业分布广泛,发病时间集中于夏秋季,病例多集中于城区,体现了登封市近年来甲型副伤寒流行病学的基本特点和变化趋势。
临床过度治疗与抗生素滥用是造成病原菌耐药问题日益突出的主要原因。本研究显示,登封市自患者分离出的甲型副伤寒沙门菌耐药问题比较严重,其对8类13种抗生素均存在不同程度的耐药,比较严重的有青霉素类、磺胺类、四环素类、氯霉素类、氨基糖苷类以及一代喹诺酮类,对临床常用药物三代喹诺酮类药物也存在一定程度的耐药;其多重耐药情况也较为普遍,临床分离菌株普遍对2~12种抗生素耐药,且对头孢类、喹诺酮类一线常用药的耐药率呈逐年上升趋势,从临床和公共卫生角度值得高度关注。这些多重耐药表型的出现一方面归因于病原菌的自发偶发性耐药突变,但更重要的原因在于抗生素滥用产生的高选择压力和耐药基因的水平传递[6, 7]。
本研究利用PFGE技术分析了当地甲型副伤寒沙门菌全染色体“指纹图谱”特征,值得关注的是甲型副伤寒沙门菌XbaⅠ单酶切带型具有高聚集性与相似度,从溯源角度还需要采用其他技术方案进一步优化;部分伤寒副伤寒沙门菌的耐药表型与PFGE带型呈现聚类一致性,提示基于共同暴露源的菌株往往也具有相同的基因和耐药表型特征,这种特征尽管存在变异性和不确定性,但在一定范围内可以成为及早发现聚集性病例的重要参数[8, 9]。
利益冲突 无| [1] 卫生部疾病防治控制局,中国疾病预防控制中心. 伤寒、副伤寒防治手册[M]. 2版.北京:人民卫生出版社,2006. Bureau for Disease Control and Prevention,Ministry of Health of China,Chinese Center for Disease Control and prevention.The manual for the prevention and control of typhoid and fever[M]. 2nd ed. Beijing:People's Medical Publishing House,2006. |
| [2] Sood S. Breast abscess by Salmonella paratyphi:a case report and literature review[J]. J Clin Diagn Res,2015,9(9):DD03-4. DOI:10. 7860/JCDR/2015/15083.6539. |
| [3] Yan MY,Yang B,Wang ZG,et al. A large-scale community-based outbreak of paratyphoid fever caused by hospital-derived transmission in southern China[J]. PLoS Negl Trop Dis,2015,9(7):e0003859. DOI:10.1371/journal.pntd. 0003859. |
| [4] 王鸣柳,阚飙,杨进,等. 广西壮族自治区1994-2013年伤寒流行病学特征及菌株耐药分析[J]. 中华流行病学杂志,2014,35(8):930-934. DOI:10.3760/cma.j.issn.0254-6450.2014. 08.012. Wang ML,Kan B,Yang J,et al. Epidemiological characteristics of typhoid fever and antibiotic susceptibility testing of Salmonella Typhi isolates in Guangxi,1994-2013[J]. Chin J Epidemiol, 2014, 35(8):930-934. DOI:10.3760/cma.j.issn. 0254-6450.2014.08.012. |
| [5] Khan AA,Melvin CD,Dagdag EB. Identification and molecular characterization of Salmonella spp. from unpasteurized orange juices and identification of new serotype Salmonella strain S. enterica serovar tempe[J]. Food Microbiol,2007,24(5):539-543. DOI:10.1016/j.fm. 2006. 09. 002. |
| [6] Rivoal K,Protais J,Quéguiner S,et al. Use of pulsed-field gel electrophoresis to characterize the heterogeneity and clonality of Salmonella serotype Enteritidis,Typhimurium and infantis isolates obtained from whole liquid eggs[J]. Int J Food Microbiol,2009,129(2):180-186. DOI:10.1016/j.ijfoodmicro. 2008.11.021. |
| [7] Petrov P,Hendriksen RS,Kantardjiev T,et al. Occurrence and characterization of Salmonella enterica subspecies enterica serovar 9,12:l,v:-strains from Bulgaria,Denmark,and the United States[J]. Eur J Clin Microbiol Infect Dis, 2009,28(5):473-479. DOI:10.1007/s10096-008-0653-9. |
| [8] Harbottle H,White DG,McDermott PF,et al. Comparison of multilocus sequence typing,pulsed-field gel electrophoresis,and antimicrobial susceptibility typing for characterization of Salmonella enterica serotype newport isolates[J]. J Clin Microbiol,2006,44(7):2449-2457. DOI:10.1128/JCM.00019-06. |
| [9] Chiou CS,Lin JM,Chiu CH,et al. Clonal dissemination of the multi-drug resistant Salmonella enterica serovar Braenderup,but not the Serovar Bareilly,of prevalent Serogroup C1 Salmonella from Taiwan[J]. BMC Microbiol,2009,9(1):264. DOI:10.1186/1471-2180-9-264. |
 2016, Vol. 37
2016, Vol. 37