文章信息
- 冯艺, 吕静静, 刘甲野, 颜丙玉, 宋立志, 梁晓峰, 李黎, 张国民, 王富珍, 张丽, 徐爱强.
- Feng Yi, Lyu Jingjing, Liu Jiaye, Yan Bingyu, Song Lizhi, Liang Xiaofeng, Li Li, Zhang Guomin, Wang Fuzhen, Zhang Li, Xu Aiqiang.
- 乙型肝炎疫苗初次免疫正常应答和高应答新生儿在幼儿期加强免疫对免疫保护持久性影响的配对病例对照研究
- Influence of three booster doses hepatitis B vaccine on the persistence of immune-protection among infants with normal and high antibody response to primary vaccination: a matched case-control study
- 中华流行病学杂志, 2016, 37(4): 460-463
- Chinese Journal of Epidemiology, 2016, 37(4): 460-463
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.04.004
-
文章历史
- 投稿日期: 2015-08-08
2. 102206 北京, 中国疾病预防控制中心;
3. 100050 北京, 中国疾病预防控制中心免疫规划中心
2. Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. National Immunization Program, Chinese Center for Disease Control and Prevention, Beijing 100050, China
HBV母婴传播是我国慢性乙型肝炎(乙肝)最主要的原因[1],降低新生儿HBV感染率是控制我国乙肝流行的关键。目前关于新生儿乙肝疫苗初次免疫(初免)后免疫持久性和加强免疫必要性的研究较多,但多数研究中研究对象初免后的抗体应答未知,亦未设立加强免疫对照组[2, 3, 4, 5],其结论说服力较弱。为此本研究于2009年开展新生儿乙肝疫苗初免后抗体应答观察[6, 7],2014年(初免后5年)随访,对其中加强免疫者和未加强免疫者的抗体持久性和HBV感染情况进行对比,结果报告如下。
对象与方法1. 研究对象:2009年在山东省济南、潍坊、烟台、威海市使用5 μg重组乙肝疫苗(酿酒酵母)、按照“0-1-6”程序对3 983名儿童进行乙肝疫苗初免,第3剂次免后1~3个月采用化学发光微粒子免疫分析法(CMIA;美国雅培ARCHITECT-i2000免疫发光检测仪及试剂)检测抗-HBs,其中抗-HBs≥100 mIU/ml(即初免正常应答和高应答)婴儿3 241人,对其于2014年(初免后5年)随访,共随访到2 100人,随访率为64.79%。选择已随访儿童中在2~3岁时接种3剂次乙肝疫苗加强免疫者全部作为加强免疫组,共230人;按照1:1比例,从随访儿童中随机选择性别和居住乡镇与加强免疫组研究对象相同,未进行过乙肝疫苗加强免疫者作为未加强免疫组。本研究经山东省CDC医学伦理委员会同意,所有研究对象监护人均签署知情同意书。
2. 问卷调查:由经统一培训的县级CDC专业人员作为调查员,使用统一调查问卷,通过询问所有研究对象监护人获得其出生日期、性别、出生体重、分娩方式、父母HBsAg等信息;乙肝疫苗免疫史通过查阅儿童预防接种证获得;初免后抗体水平通过查阅既往研究记录获得。
3. 标本采集和检测:所有研究对象采集静脉血2~3 ml,采用CMIA检测抗-HBs和抗-HBc。抗-HBs<10 mIU/ml者采用CMIA检测HBsAg。所有检测均委托有资质的第三方医学检验公司完成。
4. 统计学分析:采用EpiData 3.1软件进行数据双录入和比对,双录入不符者对照原始调查表核对和修订。数据统计分析采用Stata 11.2软件。计量资料的比较采用配对t检验,计数资料的比较采用单因素条件logistic回归,乙肝疫苗初免5年后抗-HBs阳性率影响因素比较采用多因素logistic回归方法。抗-HBs阳性率指调查对象中抗-HBs≥10 mIU/ml者所占的比例;HBV突破性感染指HBsAg和/或抗-HBc阳性[8]。年均递减率的计算参考文献[9]。
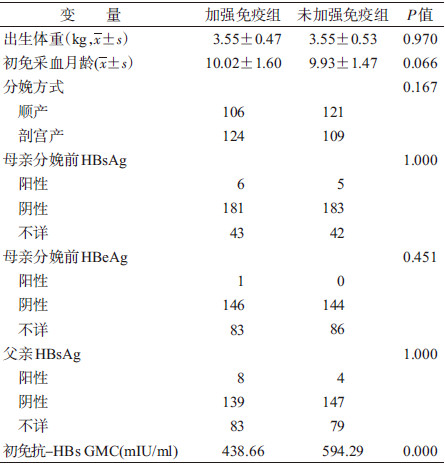
结果1. 一般情况:共调查230对儿童。加强免疫组和未加强免疫组儿童出生体重、初免采血月龄、分娩方式、母亲分娩前HBsAg/HBeAg阳性率、父亲HBsAg阳性率的差异均无统计学意义(P>0.05)。加强免疫组和未加强免疫组初免抗-HBs 的几何平均抗体浓度(GMC)分别为438.66(95%CI:394.64~487.60) mIU/ml和594.29(95%CI:527.47~669.58)mIU/ml,差异有统计学意义(t=-3.901,P<0.05)。见表 1。
2. 随访抗-HBs和突破性感染情况:随访时加强免疫组和未加强免疫组抗-HBs 的GMC分别为1 140.02(95%CI:887.46~1 464.46) mIU/ml和11.53(95%CI:8.73~15.23) mIU/ml,加强免疫组高于未加强免疫组,差异有统计学意义(t=25.29,P=0.000)。未加强免疫组初免5年间抗-HBs 的GMC年均递减率为54.55%。两组抗-HBs阳性率分别为97.39%(224/230,95%CI:94.41%~99.04%)和53.91%(124/230,95%CI:47.24%~60.48%),OR=51.00(95%CI:12.58~206.70),差异有统计学意义(P=0.000);抗-HBs<10、10~、100~和≥1 000 mIU/ml者所占的比例分别为2.61%(6/230)、6.52%(15/230)、30.87%(71/230)、60.00%(138/230)和46.09%(106/230)、36.52%(84/230)、17.39%(40/230)和0(0/230),OR=30.84(95%CI:8.05~118.24),差异有统计学意义(P=0.000)。两组随访时均无HBsAg阳性;两组HBV突破性感染率分别为0.87%(2/230)和2.17%(5/230),OR=0.4(95%CI:0.08~2.06),差异无统计学意义(P=0.273)。见表 2。HBV突破性感染者和未感染者随访时抗-HBs分别为(82.36±11.84) mIU/ml和(115.24±21.94) mIU/ml,而初免时分别为(986.93±2.36) mIU/ml和(505.41±2.42) mIU/ml。
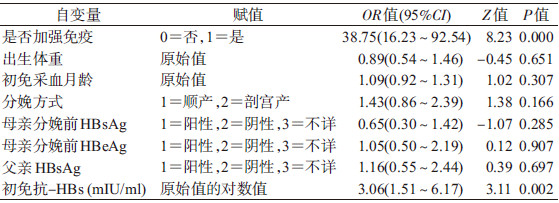
3. 抗-HBs阳性率的影响因素:以是否加强免疫、出生体重、初免采血月龄、分娩方式、母亲分娩前HBsAg/HBeAg状态、父亲HBsAg状态、初免抗-HBs为自变量,随访抗-HBs 阳性率为应变量进行多因素分析。结果显示(表 3),出生体重、初免采血月龄、分娩方式、母亲分娩前HBsAg/HBeAg、父亲HBsAg的差异均无统计学意义(P>0.05),幼儿期是否加强免疫和初免抗-HBs有统计学意义(P<0.05)。
我国于1992年开始在新生儿中普及接种乙肝疫苗,新生儿按常规免疫程序(“0-1-6”)接种3剂次5 μg重组乙肝疫苗(酿酒酵母)后,约80%产生正常应答或高应答[7, 10],而乙肝疫苗是否需要加强免疫及如何进行加强免疫尚无统一认识[9, 11, 12, 13]。因此探讨幼儿期加强免疫对新生儿乙肝疫苗接种后免疫保护持久性的影响因素,对于科学制定我国儿童乙肝疫苗免疫策略具有重要意义。
目前WHO和我国均不推荐对普通儿童在完成乙肝疫苗初免后进行加强免疫[12, 14]。本研究中加强免疫组乙肝抗体阳性率和抗体水平均显著高于未加强免疫组,多因素分析也显示加强免疫与5年随访抗体阳性率独立相关,与既往研究结果一致[15]。提示对于乙肝疫苗初免成功的新生儿,在其幼儿期进行乙肝疫苗加强免疫可有效提高乙肝疫苗接种后的抗体持久性。
判断新生儿初次免疫后是否需要加强免疫,其最直接也是最有说服力的指标是HBV感染特别是慢性感染,即HBsAg阳性率和HBV感染率是否增加。既往研究发现,少数儿童在全程接种乙肝疫苗后仍发生HBV感染甚至成为慢性携带者,称为HBV突破性感染[8]。本研究所有研究对象,包括11名母亲分娩时HBsAg阳性者和12名父亲HBsAg阳性者,在初免随访时均未出现HBsAg阳性,说明乙肝疫苗初免成功的新生儿至少在接种后5年内可以获得有效的保护,无须加强免疫。既往研究发现儿童感染HBV的危险随疫苗免疫后时间的延长而增加[8],本研究中未加强免疫组和加强免疫组HBV突破性感染率的差异无统计学意义,提示幼儿期加强免疫对预防突破性感染无统计学意义,原因可能与两组儿童距初免时间仅5年有关,加强免疫对预防感染的时间累计效果难以充分显示。因此我国许多地区在幼儿入托时习惯进行乙肝疫苗加强免疫的做法暂不予推荐。此外,本研究还发现,初免抗体水平与随访抗体阳性率独立相关,与本研究既往研究及我国其他研究组的结论一致[6, 11],提示在制定加强免疫策略时应考虑儿童初免情况。
本研究存在不足。一是研究对象加强免疫为其入托前后自费接种,未能准确采集疫苗种类、剂量及接种时间;二是本研究中父母HBsAg阳性者数量较小,且观察期仅为5年;由于儿童感染HBV主要是通过母婴传播和家庭内密切接触传播,故结论尚需进一步验证。
总之,本研究发现乙肝疫苗初免抗体为正常应答或高应答的儿童,幼儿期加强免疫可有效提高乙肝抗体持久性,但对预防HBV感染可能无明显作用。志谢 本研究得到山东省泰山学者特聘专家资金支持,现场组织实施由济南、潍坊、烟台、威海市及相关县CDC承担,谨此感谢
利益冲突 无| [1] Tong CY,Robson C,Wu Y,et al. Post-vaccination serological test results of infants at risk of perinatal transmission of hepatitis B using an intensified follow-up programme in a London centre[J]. Vaccine,2013,31(31):3174-3178. DOI:10.1016/j.vaccine. 2013.04.083. |
| [2] Poovorawan Y,Chongsrisawat V,Theamboonlers A,et al. Long-term anti-HBs antibody persistence following infant vaccination against hepatitis B and evaluation of an amnestic response:a 20-year follow-up study in Thailand[J]. Hum Vaccin Immunother,2013,9(8):1679-1684. DOI:10.4161/hv.24844. |
| [3] Spradling PR,Xing J,Williams R,et al. Immunity to hepatitis B virus(HBV) infection two decades after implementation of universal infant HBV vaccination:association of detectable residual antibodies and response to a single HBV challenge dose[J]. Clin Vaccine Immunol,2013,20(4):559-561. DOI:10. 1128/CVI.00694-12. |
| [4] 夏国良,白玉,刘克洲,等. 乙型肝炎疫苗免疫后免疫回忆应答的观察[J]. 中国计划免疫,2002,8(2):61-64. DOI:10.3969/j.issn.1006-916X.2002.02.001. Xia GL,Bai Y,Liu KZ,et al. Long-term immunological memory after hepatitis B vaccination[J]. Chin J Vac Immun,2002,8(2):61-64. DOI:10.3969/j.issn.1006-916X.2002.02.001. |
| [5] Middleman AB,Baker CJ,Kozinetz CA,et al. Duration of protection after infant hepatitis B vaccination series[J]. Pediatrics,2014,133(6):e1500-e1507. DOI:10.1542/peds. 2013-2940. |
| [6] 张丽,颜丙玉,吕静静,等. 新生儿5微克重组乙型肝炎疫苗(酿酒酵母)初次免疫低应答者不同种类、剂量和剂次乙型肝炎疫苗再免疫的血清学效果分析[J]. 中国疫苗和免疫,2013,19(3):250-254. Zhang L,Yan BY,Lv JJ,et al. Assessment on serological survey of antibody to hepatitis B virus surface antigen response to revaccination of 5μg recombinant hepatitis B vaccine derived from yeast with different type,different dosage and different schedule among low-response infants after primary vaccination[J]. Chin J Vac Immun,2013,19(3):250-254. |
| [7] 张丽,张卫,翟祥军,等. 新生儿5μg和10μg重组酵母乙型肝炎疫苗初免后抗体免疫应答比较[J]. 中华流行病学杂志,2012,33(3):305-308. DOI:10.3760/cma.j.issn.0254-6450.2012. 03.013. Zhang L,Zhang W,Zhai XJ,et al. Comparison on the antibody response after primary immunization of 5μg and 10μg hepatitis B vaccine made by recombinant DNA techniques among newborns[J]. Chin J Epidemiol,2012,33(3):305-308. DOI:10. 3760/cma.j.issn.0254-6450.2012.03.013. |
| [8] 张丽,颜丙玉,李漫时,等. 山东省儿童突破性乙型肝炎病毒感染发生率及原因初步分析[J]. 中华预防医学杂志,2013,47(10):933-939. DOI:10.3760/cma.j.issn.0253-9624.2013.10. 024. Zhang L,Yan BY,Li MS,et al. Preliminary analysis on the prevalence and causes of breakthrough hepatitis B virus infection among children in Shandong province,China[J]. Chin J Prev Med,2013,47(10):933-939. DOI:10.3760/cma.j.issn.0253-9624.2013.10.024. |
| [9] 王存祯,邢秀生,王晓芳,等. 重组乙型肝炎疫苗(酿酒酵母)免疫后15年的持久性效果研究[J]. 中国疫苗和免疫,2013,19(2):147-149,182. Wang CZ,Xing XS,Wang XF,et al. Study on antibody persistence of the neonatal after vaccinated the hepatitis B vaccine made by recombinant deoxyribonucleic acid technigues saccharomyces cerevisiae yeast for 15 years[J]. Chin J Vac Immun,2013,19(2):147-149,182. |
| [10] 郑徽,王富珍,陈园生,等. 新生儿接种重组乙型肝炎疫苗(酵母)后低无应答率及影响因素分析[J]. 中国计划免疫,2007,13(4):303-305. DOI:10.3969/j.issn.1006-916X.2007.04.004. Zheng H,Wang FZ,Chen YS,et al. Infants non-and-low response after recombinant yeast derived hepatitis B vaccinated and influencing factors analysis[J]. Chin J Vac Immun,2007,13(4):303-305. DOI:10.3969/j.issn.1006-916X.2007.04.004. |
| [11] Yao J,Shan H,Chen Y,et al. The one year effects of three doses of hepatitis B vaccine as a booster in anti-HBs-negative children 11-15years after primary immunization; China,2009-2011[J]. Hum Vaccin Immunother,2015,11(5):1114-1119. DOI:10.4161/21645515.2014.987001. |
| [12] 梁争论. 我国乙型肝炎疫苗研究和应用进展[J]. 中华微生物学和免疫学杂志,2013,33(1):11-14. DOI:10.3760/cma.j.issn. 0254-5101.2013.01.005. Liang ZL. Progress on the research and application of hepatitis B vaccine in China[J]. Chin J Microbiol Immunol,2013,33(1):11-14. DOI:10.3760/cma.j.issn.0254-5101.2013.01.005. |
| [13] Pinto M,Scheifele D. Discussing the need for an adolescent hepatitis B vaccine booster in infant vaccinees[J]. Paediatr Child Health,2014,19(8):404. |
| [14] WHO Publication. Hepatitis B vaccines:WHO position paper-recommendations[J]. Vaccine,2010,28(3):589-590. DOI:10.1016/j.vaccine.2009.10.110. |
| [15] Chan PK,Ngai KL,Lao TT,et al. Response to booster doses of hepatitis B vaccine among young adults who had received neonatal vaccination[J]. PLoS One,2014,9(9):e107163. DOI:10.1371/journal.pone.0107163. |
 2016, Vol. 37
2016, Vol. 37