文章信息
- 马山蕊, 马箐, 李纪宾, 魏文强.
- Ma Shanrui, Ma Qing, Li Jibin, Wei Wenqiang.
- 幽门螺旋杆菌感染与食管-胃交界部肿瘤关联的Meta分析
- Meta-analysis on relationship between Helicobacter pylori infection and esophagogastric junction adenocarcinoma
- 中华流行病学杂志, 2016, 37(3): 418-424
- Chinese Journal of Epidemiology, 2016, 37(3): 418-424
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.03.027
-
文章历史
- 收稿日期: 2015-08-28
2. 100021 北京, 中国癌症基金会
2. Cancer Foundation of China, Beijing 100021, China
食管-胃交界部肿瘤(贲门癌)的发病在过去的30年内全球多个国家或地区,特别是在西方发达国家有明显增高,这种升高的趋势在白人男性中十分明显[1, 2, 3]。根据肿瘤登记数据,我国食管-胃交界部肿瘤发病也显著升高,这种高发趋势在个别传统食管癌高发区尤为明显[4, 5]。近年来,多位学者结合多国研究结果,提出了食管-胃交界部肿瘤两病因假说。就全球范围来看,食管-胃交界部肿瘤的流行病学特征正好介于食管腺癌和远端非贲门胃癌之间,提示此部位肿瘤的病因可能具有异质性,一部分肿瘤的病因与食管腺癌类似(与胃食道反流相关),而另一部分则与胃癌类似[与幽门螺旋杆菌(Hp)感染导致的萎缩性胃炎相关][6, 7]。而在Hp中Cag致病岛是其主要毒力因子决定簇,Cag阳性的菌株与胃癌有更密切的关联[8]。为此,本研究旨在验证食管-胃交界部肿瘤两病因学说中Hp感染与交界部肿瘤的关联,检索各国探讨Hp感染和食管-胃交界部肿瘤病因学关联的文献,通过Meta分析对各研究结果进行系统总结,定量综合相关效应指标,评价Hp感染以及Cag致病岛与食管-胃交界部肿瘤的病因学关联。
1. 文献检索:系统检索中国期刊全文数据库(CNKI)、万方数据资源系统(Wanfang data)、维普数据库(VIP)中1980年1月至2015年4月所有Hp感染与食管-胃交界部肿瘤研究的文献。检索策略以主题词、摘要、题名(或篇名)及关键词分别进行“贲门癌/贲门肿瘤/食管胃交界部肿瘤/胃食管交界部肿瘤”+“幽门螺旋杆菌”+“病例对照/队列研究”检索。外文文献检索The Cochrane Library、PubMed、EMBase数据库中收录的1980年1月至2015年4月相关研究的外文文献。检索策略为“gastric cardia/esophagogastric junction/gastroesophageal junction”and“cancer/neoplasms/adenocarcinoma”and “Helicobacter pylori/Hp infection”、“case control study/cohort study ”。此外,辅助采用文献追溯法,尽可能查找到详尽的资料。
2. 文献筛选:文献纳入标准为①1980年1月至2015年4月国内外发表的病例对照、队列研究;②研究内容涉及Hp与食管-胃交界部肿瘤的关系;③可获得完整全文;④能提取暴露或非暴露于Hp时,对照组与食管-胃交界部肿瘤的发生情况;⑤可直接或间接计算OR值(病例对照研究)或RR值(队列研究)及95%CI等指标。文献排除标准为①横断面研究;②同一人群样本的重复研究;③综述或Meta分析、Pooled 分析等二次数据分析文献。
3. 文献质量评价标准:采用The Newcastle- Ottawa Scale(NOS)量表评价文献质量。该量表分别从研究人群的选择(4分)、组间可比性(2分)、暴露或结果评价(3分)三方面进行评价。总分共计9分,0~4分为低质量研究,5~9分为高质量研究。
4. 数据及相关信息的提取:资料提取由2名评价员按照纳入和排除标准独立完成,首先阅读题目及摘要,对于符合研究标准的文献进行全文获取和阅读分析。对有争议的文献,由双方讨论,对于未达成一致的由第三方协助解决。每篇文献记录①文献基本信息(包括发表刊物、文献标题、第一作者、发表年代、地区);②研究对象的特征(包括国家、种族);③相关测量指标(OR值或RR值及其95%CI);④各研究总样本例数及暴露或不暴露于Hp时,对照组和食管-胃交界部肿瘤的发生情况;⑤诊断信息(食管-胃交界部肿瘤或者贲门癌)。
5. 统计学分析: 数据整理和分析采用Review Manager 5.3软件。分别计算各独立研究的效应值、权重,效应值采用OR值及其95%CI。对各研究采用I2检验异质性,>50%认为存在统计学异质性。如无异质性(I2<50%),采用固定效应模型进行合并分析;若存在异质性(I2≥50%),采用随机效应模型进行合并分析,并根据可能产生异质性的因素进行亚组分析。采用逐一剔除每项研究的方法,并结合失安全系数[Nfs0.05=(ΣZ/1.64)2-K/Nfs0.01=(ΣZ/1.64)2-K,式中Z为各独立研究的z值,K为纳入研究的个数]分析敏感性。若剔除前后两次合并效应量相差不大且Nfs值较大,则研究结果越稳定,结果比较可靠。根据漏斗图及Egger回归法,检验潜在的发表偏倚。
1. 纳入文献概况:共筛出26篇文献。根据NOS评分排除5篇重复文献和8篇不能提取暴露/发病组别人数的文献,最后纳入13篇英文文献,共5 547例,食管-胃交界部肿瘤1 446例,对照组4 101例。其中有3项研究来自瑞典,澳大利亚、美国各2项,芬兰、挪威、伊朗、韩国、中国林州、中国台湾各1项(表 1和图 1)。

|
| 图 1 文献检索及筛选流程 |
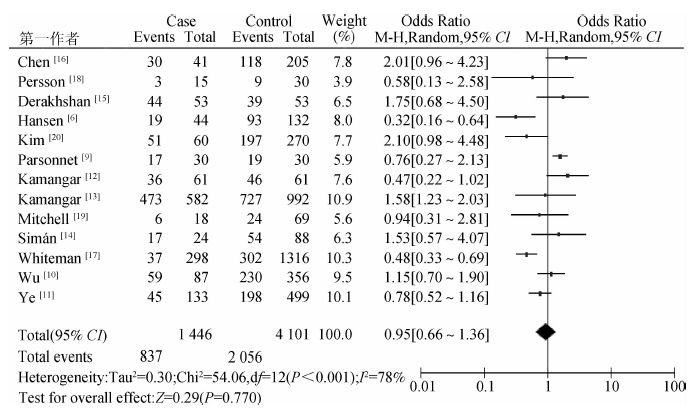
2. 食管-胃交界部肿瘤与Hp感染: 13项研究中食管-胃交界部肿瘤组Hp阳性837例,阳性率为57.88%,对照组Hp阳性率为50.13%。经I2异质性检验,各研究间异质性较大(I2=78%,P<0.010),故采用随机效应模型分析,其合并效应OR=0.95(95%CI:0.66~1.36),两组差异无统计学意义(Z=0.29,OR=0.710),异质性检验I2=78%,P<0.01。
3. 食管-胃交界部肿瘤与Hp感染亚组分析:为探讨异质性来源,按研究类型、肿瘤部位、地区分类进行亚组分析(图 2)。
|
| 图 2 Hp感染与食管-胃交界部肿瘤的Meta分析 |
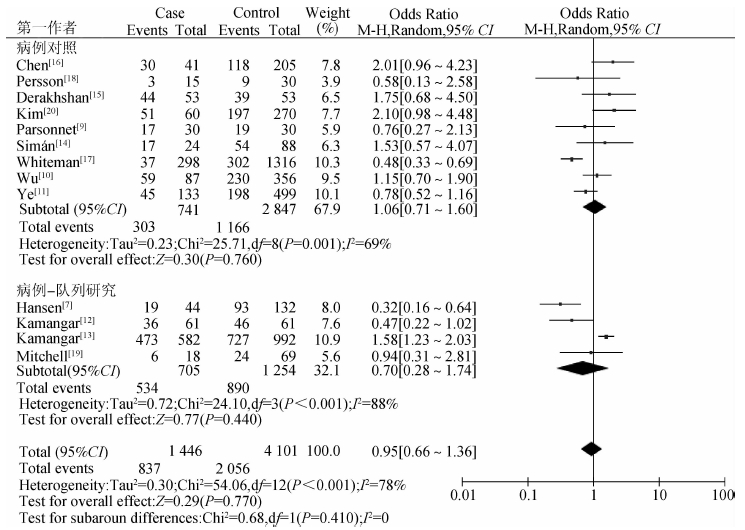
根据不同的研究类型,将食管-胃交界癌分为病例对照和病例队列研究两组,结果显示两组异质性均较大,分别为I2=69%(OR=0.001)、I2=88%(P<0.001),组内异质性显著。此外亚组分析结果显示分组无差异I2=0(OR=0.410)。见图 3。
|
| 图 3 Hp感染与食管-胃交界部肿瘤亚组分析(按研究类型分组) |
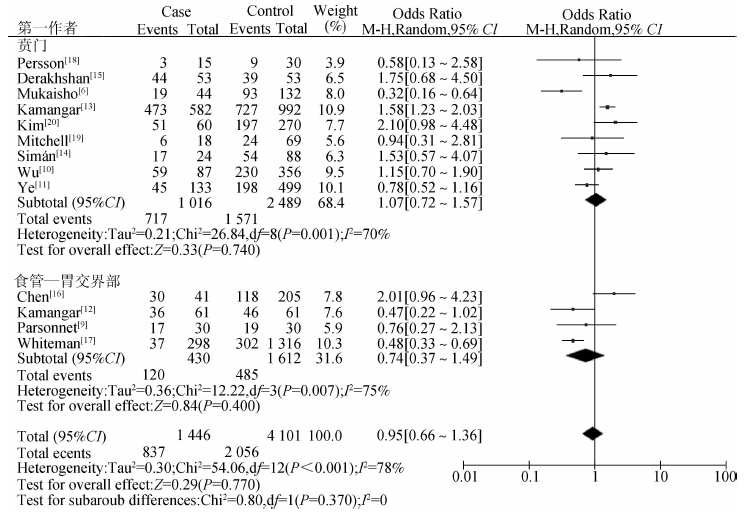
根据肿瘤部位,分为贲门和交界部两组分析,结果显示按部位分层后,各组间以及合并后差异性较大,均I2>50%,且分组无差异,I2=0(OR=0.370)。见图 4。
|
| 图 4 Hp感染与食管-胃交界部肿瘤亚组分析(按肿瘤部位分组) |
根据是否为胃癌高发地区[21],分为胃癌高发地区和低发地区两组。结果显示,胃癌高发地区Hp感染与食管-胃交界部肿瘤的关联显著(OR=1.66,95%CI:1.33~2.08,P<0.001);低发地区Hp感染与食管-胃交界部肿瘤呈负相关(OR=0.68,95%CI:0.49~0.94,OR=0.020),各地区组间的差异有统计学意义(I2=94.9%,P<0.001)。见图 5。

|
| 图 5 Hp感染与食管-胃交界部肿瘤亚组分析(按高低发病地区分组) |
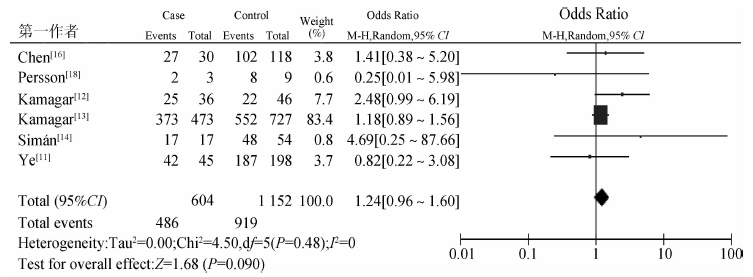
在Hp感染者中,分为病例、对照两组分析Cag致病岛与交界部肿瘤的关系。结果显示Hp阳性中,病例组Cag阳性检出率为80.50%,对照组为79.80%,合并效应的OR=1.24(95%CI:0.96~1.60),两组间的差异无统计学意义(OR=0.090)。见图 6。
|
| 图 6 Hp的Cag致病岛与食管-胃交界部肿瘤关系的Meta分析 |
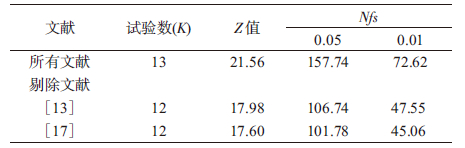
4. 敏感性分析:采用逐一剔除每项研究的方法分析敏感性,评价某项研究结果对总体结果的影响程度。结果显示,剔除小样本研究后,剩余研究的合并效应与原来总合并效应量(I2=78%,P<0.010)基本一致,每组OR值均与排除某项研究前的OR值相近,并未发现对总合并效应量影响较大的研究。而剔除大样本研究后[13, 17],总体异质性均有所下降,但仍超过67%,说明结果较为稳定。在α=0.05水平下,13项研究的Nfs0.05=149.60,且剔除研究[13, 17]后Nfs0.05均接近100,表明研究结果较为可靠。提示各研究间的样本量差异,可能是造成研究结果存在异质性的小部分原因(表 2)。
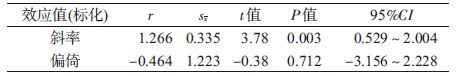
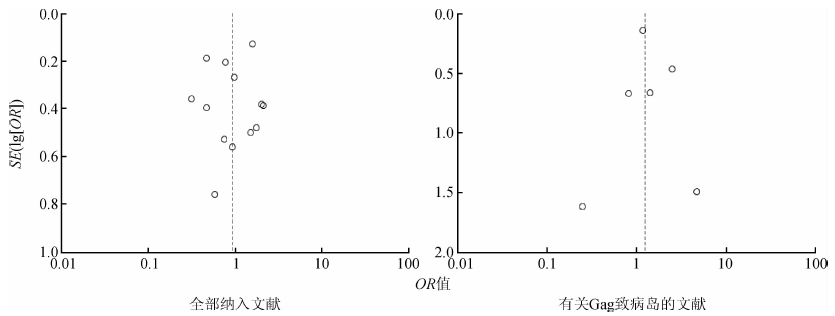
5. 发表偏倚的检测:运用Egger回归法结合漏斗图对发表偏倚进行检验。其中Egger’s 检验法OR=0.712,说明差异无统计学意义,整个研究中无明显发表偏倚。漏斗图中各研究效应的点大致呈对称的倒漏斗型分布,提示研究结果受发表偏倚影响的可能性较小(图 7和表 3)。
|
| 图 7 Hp感染与食管-胃交界部肿瘤研究文献的漏斗图 |
Hp感染被认为是导致胃癌的重要因素,亦成为食管-胃交界部肿瘤病因假说的焦点,但也有截然相反的观点。多项研究表明,Hp感染与食管-胃交界部肿瘤具有正相关性[14, 21, 22, 23]。另有研究提示Hp是食管-胃交界部肿瘤的保护因子[12, 24]。也有研究显示,贲门癌与Hp感染无关[11, 25]。本文显示食管-胃交界部肿瘤与Hp感染的合并效应OR=0.95(95%CI:0.66~1.36),差异无统计学意义;欧美地区等胃癌低发区国家显示呈负相关(OR=0.66,95%CI:0.49~0.89),亚洲地区等高发区国家呈显著正相关(OR=0.66,95%CI:0.49~0.89)。
食管-胃交界部肿瘤由于其解剖位置特殊,同时兼有胃癌和食管癌的特点,在其归属于食管癌、胃癌还是独立性疾病方面存在争议,目前世界范围内尚无统一的定义或分型标准[26, 27, 28]。而各国采用的诊断标准也有差异,我国普遍使用描述此解剖位置的肿瘤术语“贲门癌”。本文Meta分析中纳入的病例均为临床确诊的交界部肿瘤,但各文献中并未指出其采用的诊断分型标准,可能造成研究对象的部分异质性。按肿瘤部位进行亚组分析,“贲门”和“交界部”两组组内异质性较大,提示不同的诊断标准是造成异质性的部分原因。
全球胃癌发病地域分布明显,有2/3的胃癌分布在日本、中国、韩国及中南美洲、东欧和中东地区的部分地区,而北美、北欧地区及澳大利亚、新西兰和印度的发病率较低,为低发地区[29]。本文分析提示,Hp感染呈明显的地域分布,以东方国家为代表的高发区和西方国家为主的低发区结果相反,无法直接比较,还需进一步研究。若剔除高发区国家的各项研究,则按研究类型、肿瘤部位的亚组分析显示,组内异质性均显著降低或是消除,提示地域分布可能是造成异质性的主要原因。
目前研究认为Hp的致病性主要与其毒力因子有关。而作为毒力相关因子基因群集的特殊染色体区域Cag致病岛,被认为是Hp中重要的致病因素[30]。本文结果显示,Hp阳性中Cag致病岛阳性检出率较高,病例组和对照组分别为80.50%和79.80%,但Cag致病岛合并致病性不显著,原因可能是样本量差异悬殊,纳入的研究较少。
本文存在局限性。首先,纳入文献数量较少,且各研究样本量差异较大,虽然整体研究结果较为稳定,但高低发地区截然不同的结果影响亚组分析的稳定性,还需进一步研究;其次,纳入的研究主要集中在欧美地区国家,亚洲地区国家较少,如日本、韩国多篇文献因无OR值或RR值的95%CI、具体暴露/发病组别人数而未纳入本次分析;最后由于各研究的基线资料(种族、地区)、研究方法均有差异,影响本文结论的可靠性。
综上所述,本文结果提示Hp感染与食管-胃交界部肿瘤无明显关联,但在高发与低发地区的关联截然相反,且Cag致病岛在Hp感染者中检出率较高,此外Hp感染有明显的地域分布,“肿瘤部位”和“研究类型”可能是影响关联的部分因素,提示为更好比较各国Hp感染与食管-胃交界部肿瘤的数据,需制定统一的定义和标准,并将其作为独立的疾病进行深入研究。
利益冲突 无| [1] Botterweck AA,Schouten LJ,Volovics A,et al. Trends in incidence of adenocarcinoma of the oesophagus and gastric cardia in ten European countries[J]. Int J Epidemiol,2000,29(4):645-654. DOI:10.1093/ije/29.4.645. |
| [2] Tinmouth J,Green J,Ko YJ,et al. A population-based analysis of esophageal and gastric cardia adenocarcinomas in Ontario,Canada:Incidence,risk factors,and regional variation[J]. J Gastrointest Surg,2011,15(5):782-790. DOI:10.1007/s11605-011-1450-9. |
| [3] Kusano C,Gotoda T,Khor CJ,et al. Changing trends in the proportion of adenocarcinoma of the esophagogastric junction in a large tertiary referral center in Japan[J]. J Gastroenterol Hepatol,2008,23(11):1662-1665. DOI:10.1111/j.1440-1746. 2008.05572.x. |
| [4] 彭侠彪,陈万青,陈志峰,等. 中国贲门癌流行概况[J]. 中华普通外科学文献:电子版,2014,8(2):156-159. DOI:10.3877/cma.j.issn.1674-0793.2014.02.017. Peng XB,Chen WQ,Chen ZF,et al. Epidemiology of gastric cardia cancer in China[J]. Chin Arch Gen Surg:Electronic Edition,2014,8(2):156-159. DOI:10.3877/cma.j.issn.1674-0793.2014.02.017. |
| [5] 魏矿荣,陈志峰,彭侠彪,等. 食管癌高低发区贲门癌发病对比分析[J]. 现代肿瘤医学,2014,22(1):59-63. DOI:10.3969/j.issn.1672-4992.2014.01.18. Wei KR,Chen ZF,Peng XB,et al. Comparison of gastric cardiac cancer incidence between areas with low and high esophageal cancer incidence[J]. J Mod Oncol,2014,22(1):59-63. DOI:10.3969/j.issn.1672-4992.2014.01.18. |
| [6] Mukaisho KI,Nakayama T,Hagiwara T,et al. Two distinct etiologies of gastric cardia adenocarcinoma:interactions among pH,Helicobacter pylori,and bile acids[J]. Front Microbiol,2015,6:412. DOI:10.3389/fmicb.2015.00412. |
| [7] Hansen S,Vollset SE,Derakhshan MH,et al. Two distinct aetiologies of cardia cancer; evidence from premorbid serological markers of gastric atrophy and Helicobacter pylori status[J]. Gut,2007,56(7):918-925. DOI:10.1136/gut.2006. 114504. |
| [8] 陈文超,陈红庆,郭英,等. 幽门螺杆菌Cag致病岛的研究现状[J]. 热带医学杂志,2005,5(1):114-117. DOI:10.3969/j.issn. 1672-3619.2005.01.038. Chen WC,Chen HQ,Guo Y,et al. Current studies on Cag pathogenity island of Helicobacter pylori[J]. J Trop Med,2005,5(1):114-117. DOI:10.3969/j.issn.1672-3619.2005.01.038. |
| [9] Parsonnet J,Samloff IM,Nelson LM,et al. Helicobacter pylori,pepsinogen,and risk for gastric adenocarcinoma[J]. Cancer Epidemiol Biomarkers Prev,1993,2(5):461-466. |
| [10] Wu AH,Crabtree JE,Bernstein L,et al. Role of Helicobacter pylori CagA+ strains and risk of adenocarcinoma of the stomach and esophagus[J]. Int J Cancer,2003,103(6):815-821. DOI:10.1002/ijc.10887. |
| [11] Ye WM,Held M,Lagergren J,et al. Helicobacter pylori infection and gastric atrophy:Risk of adenocarcinoma and squamous-cell carcinoma of the esophagus and adenocarcinoma of the gastric cardia[J]. J Natl Cancer Inst,2004,96(5):388-396. DOI:10.1093/jnci/djh057. |
| [12] Kamangar F,Dawsey SM,Blaser MJ,et al. Opposing risks of gastric cardia and noncardia gastric adenocarcinomas associated with Helicobacter pylori seropositivity[J]. J Natl Cancer Inst,2006,98(20):1445-1452. DOI:10.1093/jnci/djj393. |
| [13] Kamangar F,Qiao YL,Blaser MJ,et al. Helicobacter pylori and oesophageal and gastric cancers in a prospective study in China[J]. Br J Cancer,2007,96(1):172-176. DOI:10.1038/sj.bjc.6603517. |
| [14] Simán JH,Engstrand L,Berglund G,et al. Helicobacter pylori and CagA seropositivity and its association with gastric and oesophageal carcinoma[J]. Scand J Gastroenterol,2007,42(8):933-940. DOI:10.1080/00365520601173863. |
| [15] Derakhshan MH,Malekzadeh R,Watabe H,et al. Combination of gastric atrophy,reflux symptoms and histological subtype indicates two distinct aetiologies of gastric cardia cancer[J]. Gut,2008,57(3):298-305. DOI:10.1136/gut.2007.137364. |
| [16] Chen MJ,Wu DC,Lin JM,et al. Etiologic factors of gastric cardiac adenocarcinoma among men in Taiwan[J]. World J Gastroenterol,2009,15(43):5472-5480. DOI:10.3748/wjg.15. 5472. |
| [17] Whiteman DC,Parmar P,Fahey P,et al. Association of Helicobacter pylori infection with reduced risk for esophageal cancer is independent of environmental and genetic modifiers[J]. Gastroenterology,2010,139(1):73-83. DOI:10.1053/j.gastro.2010.04.009. |
| [18] Persson C,Jia Y,Pettersson H,et al. H. pylori seropositivity before age 40 and subsequent risk of stomach cancer:a glimpse of the true relationship?[J]. PLoS One,2011,6(3):e17404. DOI:10.1371/journal.pone.0017404. |
| [19] Mitchell H,English DR,Elliott F,et al. Immunoblotting using multiple antigens is essential to demonstrate the true risk of Helicobacter pylori infection for gastric cancer[J]. Aliment Pharmacol Ther,2008,28(7):903-910. DOI:10.1111/j.1365-2036.2008.03792.x. |
| [20] Kim JY,Lee HS,Kim N,et al. Prevalence and clinicopathologic characteristics of gastric cardia cancer in South Korea[J]. Helicobacter,2012,17(5):358-368. DOI:10.1111/j.1523-5378. 2012.00958.x. |
| [21] Ren JS,Kamangar F,Qiao YL,et al. Serum pepsinogens and risk of gastric and oesophageal cancers in the general population nutrition intervention trial cohort[J]. Gut,2009,58(5):636-642. DOI:10.1136/gut.2008.168641. |
| [22] Pakseresht M,Forman D,Malekzadeh R,et al. Dietary habits and gastric cancer risk in north-west Iran[J]. Cancer Causes Control,2011,22(5):725-736. DOI:10.1007/s10552-011-9744-5. |
| [23] Keck JW,Miernyk KM,Bulkow LR,et al. Helicobacter pylori infection and markers of gastric cancer risk in Alaska Native persons:a retrospective case-control study[J]. Can J Gastroenterol Hepatol,2014,28(6):305-310. |
| [24] Palli D,Masala G,Giudice GD,et al. CagA+ Helicobacter pylori infection and gastric cancer risk in the EPIC-EURGAST study[J]. Int J Cancer,2007,120(4):859-867. DOI:10.1002/ijc. 22435. |
| [25] Knekt P,Teppo L,Aromaa A,et al. Helicobacter pylori IgA and IgG antibodies,serum pepsinogenⅠand the risk of gastric cancer:Changes in the risk with extended follow-up period[J]. Int J Cancer,2006,119(3):702-705. DOI:10.1002/ijc.21884. |
| [26] Bosman FT,Carneiro F,Hruban RH,et al. World Health Organization classification of tumours of the digestive system[M]. 4th ed. Lyon:IARC Press,2010. |
| [27] Siewert JR,Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction[J]. Br J Surg,1998,85(11):1457-1459. DOI:10.1046/j.1365-2168.1998.00940.x. |
| [28] Rice TW,Blackstone EH,Rusch VW. 7th Edition of the AJCC Cancer Staging Manual:Esophagus and esophagogastric junction[J]. Ann Surg Oncol,2010,17(7):1721-1724. DOI:10.1245/s10434-010-1024-1. |
| [29] Jemal A,Bray F,Center MM,et al. Global cancer statistics[J]. CA Cancer J Clin,2011,61(2):69-90. DOI:10.3322/caac.20107. |
| [30] 刘炯,徐国铭,李兆申,等. Cag致病岛在中国人感染幽门螺杆菌中的结构特征及分类价值[J]. 中华消化杂志,2001,21(8):469-472. DOI:10.3760/j.issn.0254-1432.2001.08.006. Liu J,Xu GM,Li ZS,et al. The characteristic structure and classification of Cag pathogenicity island in Chinese Helicobacter pylori strains[J]. Chin J Dig,2001,21(8):469-472. DOI:10. 3760/j.issn:0254-1432.2001.08.006. |
 2016, Vol. 37
2016, Vol. 37