文章信息
- 王闻卿, 王多春, 朱林英, 傅益飞, 郝莉鹏, 许学斌, 苏靖华, 傅慧琴, 叶楚楚, 孙乔, 郑英杰.
- Wang Wenqing, Wang Duochun, Zhu Linying, Fu Yifei, Hao Lipeng, Xu Xuebin, Su Jinghua, Fu Huiqin, Ye Chuchu, Sun Qiao, Zheng Yingjie.
- 上海市浦东新区腹泻患者气单胞菌流行特征及毒力基因研究
- Infection status and virulent genes of Aeromonas in diarrhea patients in Pudong New Area, Shanghai
- 中华流行病学杂志, 2016, 37(3): 402-405
- Chinese Journal of Epidemiology, 2016, 37(3): 402-405
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.03.023
-
文章历史
- 收稿日期: 2015-08-05
2. 102206 北京, 中国疾病预防控制中心传染病预防控制所, 传染病预防控制国家重点实验室;
3. 200136 上海市浦东新区疾病预防控制中心传染病防治与消毒管理科;
4. 200336 上海市疾病预防控制中心微生物检验科;
5. 200032 上海, 复旦大学公共卫生学院教育部公共卫生重点实验室, 复旦大学公共卫生学院卫生微生物学教研室
2. State Key Laboratory for Communicable Disease Control and Prevention, Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. Department of Infectious Disease Control and Prevention and Disinfection Management Section of Pudong New Area Center for Disease Control and Prevention, Shanghai 200136, China;
4. Department of Microbiology of Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China;
5. Key Laboratory of Public Health Safety of the Ministry of Education, Department of Public Health Microbiology, Fudan University School of Public Health, Shanghai 200032, China
气单胞菌属(Aeromonas)在食物链和自然界广泛存在,对人类和水栖、鱼介(壳)类动物均致病,可导致人类食源性疾病[1]。由于我国目前腹泻病原菌监测以肠杆菌科细菌及霍乱弧菌、副溶血弧菌等为主,气单胞菌未进入常规监测范围,因此气单胞菌的流行特征、毒力基因特征均相关资料较少。本研究依托上海市浦东新区腹泻病原谱监测项目,了解辖区内腹泻患者气单胞菌流行特征及毒力基因特征,为制定相关防控政策提供科学依据。
对象与方法1. 研究对象:来自2012年上海市浦东新区腹泻病原谱监测项目,监测点医院包括2家三级医院、7家二级医院、3家社区卫生服务中心。对24 h内粪便次数≥3次、且粪便性状有改变(稀、水样、黏脓或脓血等)的门/急诊病例,在征得知情同意的基础上,采集粪便样本进行13种腹泻病原体检测。
2. 实验室检测:气单胞菌、非伤寒沙门菌、志贺菌、致泻性大肠埃希菌(肠致病性大肠埃希菌、肠产毒性大肠埃希菌、肠黏附性大肠埃希菌、肠侵袭性大肠埃希菌)、致病性弧菌(霍乱弧菌、副溶血弧菌、拟态弧菌、河弧菌)、小肠结肠炎耶尔森菌、弯曲菌、类志贺邻单胞菌、轮状病毒、肠道腺病毒、诺如病毒、札如病毒、星状病毒等病原体检测及气单胞菌毒力基因检测方法参见文献[2, 3]。
3. 统计学分析:采用Excel 2007软件进行原始数据处理、SPSS 16.0软件进行统计学分析,率的指标采用 χ2检验和Fisher’s确切概率方法,P<0.05为差异有统计学意义。
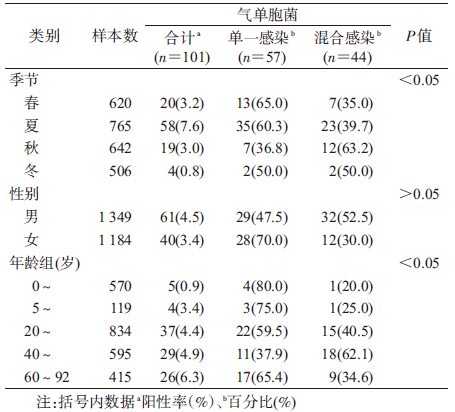
结 果1. 基本情况:共纳入患者2 533例(无重复病例),男女性别比为1.1 ∶ 1。年龄最小的1月龄,最大的92岁,平均年龄为(34.56±23.97)岁。0~4岁年龄组患者570例(22.5%),5~19岁年龄组119例(4.7%),20~39岁年龄组834例(32.9%),40~59岁年龄组595例(23.5%),60~92岁年龄组415例(16.4%)。春季(3-5月)620例(24.5%),夏季(6-8月)765例(30.2%),秋季(9-11月)642例(25.3%),冬季(1-2月及12月)506例(20.0%)。
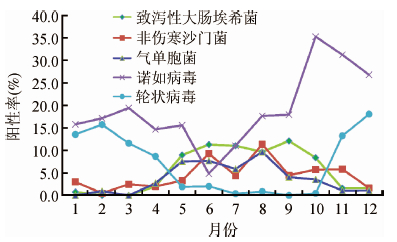
2. 腹泻病原体检出情况:共检出目标病原体1 317株,阳性率为52.0%,其中细菌性病原体561株(22.1%),以致泻性大肠埃希菌、非伤寒沙门菌、气单胞菌为主(67.2%);病毒性病原体756株(29.8%),以诺如病毒、轮状病毒为主(84.1%)。细菌性病原流行高峰期为6-9月,病毒性病原体流行高峰期为1-3月、10-12月(图 1)。
|
| 图 1 2012年上海市浦东新区腹泻患者粪便标本分离的主要病原体季节分布 |
3. 气单胞菌感染及菌株检出情况:共检出气单胞菌感染患者101例,阳性率为4.0%(101/2 533),未发现同时感染≥2种气单胞菌的患者。分离到气单胞菌101株,其中嗜水气单胞菌19株(18.8%),维隆气单胞菌温和生物变种53株(52.5%),豚鼠气单胞菌29株(28.7%)。
4. 气单胞菌与其他病原体混合感染特征:101例气单胞菌感染患者中,57例为单一气单胞菌感染,其余44例为气单胞菌与其他病原体混合感染:27例混合感染一种细菌,包括致泻性大肠埃希菌(9例),非伤寒沙门菌(6例),弯曲菌(4例),副溶血弧菌(3例),类志贺邻单胞菌(3例),耶尔森菌(2例);11例混合感染一种病毒,包括诺如病毒(8例),札如病毒(2例),轮状病毒(1例);6例同时感染3种病原体。
5. 气单胞菌感染分布:气单胞菌感染在4个季节中均有检出,夏季阳性率最高,冬季最低。不同季节间气单胞菌阳性率差异有统计学意义(χ2=45.3,ν=3,P<0.05)。混合感染在4个季节均有检出,秋季混合感染比例最高,为63.2%。男性患者气单胞菌阳性率为4.5%,女性患者气单胞菌阳性率为3.4%,差异无统计学意义(χ2=2.5,ν=1,P>0.05),但是在混合感染比例方面,男性高于女性。气单胞菌感染在不同年龄组均有检出,0~4岁组阳性率最低,60~92岁组阳性率最高,呈现由低年龄向高年龄递增趋势,不同年龄组间气单胞菌阳性率差异有统计学意义(χ2=25.5,ν=4,P<0.05)。5个年龄组中,40~59岁混合感染比例最高,为62.1%(表 1)。
6. 病例临床感染症状:101例气单胞菌感染患者以水样便为主,共71例(70.3%),其他分别为黏液便(12例),稀便(13例),糊状便(3例),蛋花样便(1例),脓血便(1例)。呕吐(20例),发热(11例),分别占气单胞菌感染患者总数的19.8%和10.9%。
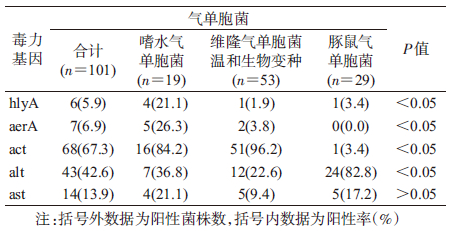
7. 气单胞菌毒力基因分布:对101株气单胞菌进行5种腹泻相关的毒力基因检测,结果显示,均有阳性菌株,95.0%(96/101)菌株检出≥1种毒力基因,其中hlyA基因阳性率为5.9%,aerA基因阳性率为6.9%,act基因阳性率为67.3%,alt基因阳性率为42.6%,ast基因阳性率为13.9%。
嗜水气单胞菌、维隆气单胞菌温和生物变种5种毒力基因均有检出,以act阳性率最高,分别为84.2%、96.2%;豚鼠气单胞菌只检出4种毒力基因,未检出aerA,以alt阳性率最高,为82.8%。嗜水气单胞菌5种毒力基因整体阳性率最高,均高于20.0%,hlyA、aerA、act、alt阳性率差异在不同气单胞菌间有统计学意义(χ2值分别为7.5、10.6、75.6、27.8,ν=2,P<0.05),ast阳性率差异在不同气单胞菌间无统计学意义(χ2=2.4,ν=2,P>0.05),见表 2。
本研究显示,中国上海市浦东新区腹泻患者气单胞菌感染阳性率为4.0%(101/2 533),高于以色列腹泻患者阳性率(1.6%)[4],这可能与上海市浦东新区的地理位置属于沿海地区(东海),水产品丰富,在居民饮食中占有较大比例有关。在2011年进行的浦东新区食源性气单胞菌污染监测中已经发现,水产品中气单胞菌的阳性率为18.9%(17/90)[5],而现阶段,食物原料在家庭厨房的交叉污染是食源性疾病粪-口传播的主要途径。2010年浙江省腹泻患者中气单胞菌感染阳性率为8.6%(205/2 392)[3],高于本研究的阳性率(χ2=45.2,ν=1,P<0.05),可能由于浙江省的调查时间为6-9月,该时间段气温普遍较高,最适宜气单胞菌的生长和繁殖,加之期间人们饮食习惯以水产品、凉拌菜为主,极易造成气单胞菌感染导致的腹泻。
本研究分离到的均为临床常见的3种气单胞菌种,以维隆气单胞菌温和生物变种为主,而在以色列,豚鼠气单胞菌为主要分离株[4],这可能与不同地理地域优势种型不同有关。
气单胞菌阳性率夏季最高,冬季最低,这是由于夏季气温最适合气单胞菌生长。0~4岁年龄组阳性率仅为0.9%,在各年龄组中最低。60~92岁年龄组阳性率最高,推测该年龄组自身免疫功能下降,暴露后容易感染导致发病。由于气单胞菌在环境中广泛存在,混合感染患者中分离到的一些气单胞菌可能仅仅是定植菌,但是也不能忽视由多种病原体共同作用导致腹泻,需要进一步的研究进行确认。
本研究中,气单胞菌感染患者粪便性状主要为水样便,少数患者出现呕吐、发热症状。尽管通常认为,气单胞菌引起的腹泻通常较为温和,但是本研究也发现1例混合感染患者出现了脓血便症状,是否与其他病原体混合感染而加大了疾病的严重程度,有待进一步研究确认。
气单胞菌携带多种与人类腹泻相关的毒力基因,Sen和Rodgers[6]运用多重PCR方法检测气单胞菌6种毒力基因,发现≥1种毒力基因阳性的菌株占97.0%,其中act基因阳性率为70.0%,alt基因和ast基因阳性率分别为43.0%和30.0%,并且不同种的气单胞菌毒力基因分布存在差异。本研究也得到相似的结果,提示气单胞菌具有较大的潜在致病力,不同种型间可能存在不同的腹泻致病机制。
本研究存在局限性。气单胞菌在人体肠道中存在一定比例的正常定植。由于未同时进行病例对照研究,故在气单胞菌与其他病原体的混合感染中,尚不能完全明确气单胞菌在其中所起的作用。
志谢 本研究获得上海市浦东新区卫生系统优秀青年医学人才培养计划(PWRq2014-26)的支持 利益冲突 无| [1] Janda JM,Abbott SL. The genus Aeromonas:taxonomy,pathogenicity,and infection[J]. Clin Microbiol Rev,2010,23(1):35-73. DOI:10.1128/CMR.00039-09. |
| [2] 傅益飞,孙乔,叶楚楚,等. 2012年上海市浦东新区急性腹泻门诊病例病原谱特征分析[J]. 疾病监测,2014,29(5):349-353. DOI:10.3784/j.issn.1003-9961.2014.05.005. Fu YF,Sun Q,Ye CC,et al. Etiology of acute diarrhea in Pudong New Area,Shanghai,2012[J]. Dis Surveill,2014,29(5):349-353. DOI:10.3784/j.issn.1003-9961.2014.05.005. |
| [3] 白永凤. 浙江地区腹泻病人气单胞菌毒力基因及抗生素敏感性研究[D]. 杭州:浙江大学,2011. Bai YF. Presence of virulence genes and antibiotic susceptibility of Aeromonas strains from diarrhoael patients in Zhejiang[D]. Hangzhou:Zhejiang University,2011. |
| [4] Senderovich Y,Ken-Dror S,Vainblat I,et al. A molecular study on the prevalence and virulence potential of Aeromonas spp. recovered from patients suffering from diarrhea in Israel[J]. PLoS One,2012,7(2):e30070. DOI:10.1371/journal.pone.0030070. |
| [5] 王闻卿,苏靖华,傅慧琴,等. 食源性气单胞菌属种水平监测和表型特征研究[J]. 中国食品卫生杂志,2014,26(1):1-5. DOI:10.13590/j.cjfh.2014.01.008. Wang WQ,Su JH,Fu HQ,et al. Monitoring and phenotype characteristics study on food borne Aeromonas species[J]. Chin J Food Hyg,2014,26(1):1-5. DOI:10.13590/j.cjfh.2014.01.008. |
| [6] Sen K,Rodgers M. Distribution of six virulence factors in Aeromonas species isolated from US drinking water utilities:a PCR identification[J]. J Appl Microbiol,2004,97(5):1077-1086. DOI:10.1111/j.1365-2672.2004.02398.x. |
 2016, Vol. 37
2016, Vol. 37