文章信息
- 肖彤洋, 赵丽丽, 刘海灿, 李马超, 赵秀芹, 万康林.
- Xiao Tongyang, Zhao Lili, Liu Haican, Li Machao, Zhao Xiuqin, Wan Kanglin.
- 结核分枝杆菌毒素-抗毒素伴侣系统基因多态性初步研究
- Polymorphisms of toxin-antitoxin-chaperone system of Mycobacterium tuberculosis complex in China
- 中华流行病学杂志, 2016, 37(3): 394-397
- Chinese Journal of Epidemiology, 2016, 37(3): 394-397
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.03.021
-
文章历史
- 收稿日期: 2015-11-13
结核分枝杆菌持留菌的存在是导致肺结核复发和耐药的重要原因[1],其产生原因认为与毒素-抗毒素系统(toxin-antitoxin system,TAs)有关[2, 3]。TAs由2个共表达的基因,即基因编码稳定的毒素蛋白(toxin)和基因编码不稳定的抗毒素蛋白(antitoxin)组成,二者通过蛋白与蛋白的相互作用形成复合体,抗毒素可中和毒素的作用,共同参与调控胞内基因表达及细胞程序性死亡等过程[4]。目前已发现的结核分枝杆菌TAs由88对编码毒素-抗毒素蛋白的基因组成,包括RelBE、MazEF、ParDE、VapBC、HigAB等家族。新近研究表明,尽管大部分TAs的编码基因具有保守性,但仍有少量编码基因在某些菌株中呈现多态性[5]。毒素-抗毒素伴侣(toxin-antitoxin- chaperone,TAC)隶属HigAB家族的一对由抗毒素HigA、毒素HigB及分子伴侣Rv1957三者共同组成的非典型TAs[编码抗毒素蛋白的基因higA(Rv1956)位于编码毒素蛋白基因higB(Rv1955)的下游,与典型TAs不同[6]]。为此本研究分析TAC系统在结核分枝杆菌不同亚型菌株中的基因多态性,并探讨其生理意义。
材料与方法1. 菌株来源:183株结核分枝杆菌临床分离株及标准菌株H37Rv均由中国疾病预防控制中心传染病预防控制所结核病室传代、培养及保存。
2. DNA模板制备:采用水煮法提取结核分枝杆菌基因组DNA。刮取罗氏培养基上新鲜菌落50~100 mg,重悬于200 μl Tris-EDTA缓冲液,置于85 ℃30 min,然后100 ℃10 min,离心收集上清,贮存于-20 ℃备用。
3. Spoligotyping分型:PCR扩增DNA间隔区(引物为DRa:5′-GGTTTTGGGTCTGACGAC-3′,DRb:5′-CCGAGAGGGGACGGAAAC-3′)。扩增产物与固定的43对寡核苷酸探针杂交,其中37个间隔区序列来源于H37Rv标准株的DR区序列,其余来源于M. bovis BCG的DR区序列[7]。
4. 药敏试验:采用比例法。培养基内4种一线药物终浓度分别为异烟肼(INH)0.2 μg/ml、利福平(RFP)40 μg/ml、链霉素(SM)4.0 μg/ml、乙胺丁醇(EMB)2.0 μg/ml。均购自美国Sigma公司。
5. TAC基因的PCR及测序:根据标准菌株H37Rv的基因序列(NC_000962.3)使用Primer 5.0软件设计引物,扩增引物序列见表 1。PCR体系总体积为25 μl,其中2×Taq PCR MasterMix 12.5 μl,无菌去离子水10.5 μl,上游引物0.5 μl,下游引物0.5 μl,基因组DNA 1.0 μl。PCR反应条件为94 ℃预变性10 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。PCR扩增阳性对照孔以H37Rv基因组DNA为模板,阴性对照孔以无菌去离子水为模板。PCR产物由北京擎科新业生物技术有限公司测序后,使用Bioedit 7.05.3软件将测序结果与标准株H37Rv序列(GenBank序列号:NC_000962)进行比对。
6. 非同义突变对蛋白结构和功能影响的预测分析:利用I-Mutant 2.0(http//folding.biofold.org/cgi-bin/i-mutant2.0.cgi)对突变位点进行蛋白功能影响的预测[8]。
7. 统计学分析:采用SAS 9.2软件进行 χ2检验分析,P<0.05认为差异有统计学意义。
结 果1. 菌株分型:183株结核分枝杆菌临床分离株包括北京家族138株和非北京家族45株(包括T、H、U、CAS、MANU2、LAM和New,分别为19、6、3、3、3、2、9株),基本涵盖我国多数地区已发现的主要基因型。
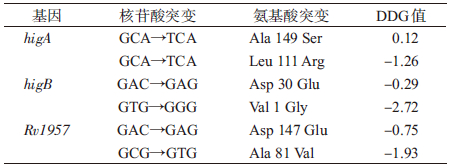
2. TAC系统基因的多态性:对于编码TAC系统的3个基因,在183株菌中有149株菌发生突变,包括6种非同义突变和2种同义突变(表 2)。同义突变均发生在higA基因中,138株北京家族菌的121位点均由CAC突变为CAT,其中2株菌的95位点由CTG突变为TTG;在higA基因的149位点发生非同义突变,即GCA突变为TCA,导致编码的氨基酸由丙氨酸(Ala)突变为丝氨酸(Ser),此类突变仅发生在11株非北京家族菌中,其中1株菌同时携带111位点的非同义突变(CTC→CGC),氨基酸由亮氨酸(Leu)变为精氨酸(Arg)。对higB基因序列分析发现,有17株北京家族菌的30位点发生非同义变(GAC→GAG),致使编码的氨基酸由天冬氨酸(Asp)突变为谷氨酸(Glu),另有1株菌携带第1位点的突变(GTG→GGG)。Rv1957基因发生81(GCG→GTG)和147(GAC→GAG)位点的非同义突变,分别见于2株不同的北京家族菌株。
3. 突变基因与耐药相关性分析:经药敏试验,183株菌包括耐药菌132株(72.13%)和敏感菌51株(27.87%)。采用 χ2检验分析突变情况,耐药株中higA基因的多态性超过敏感株,其中耐INH株(χ2=2.57,P=0.11)、耐SM株(χ2=7.58,P=0.01)、耐RFP株(χ2=6.70,P=0.01)、耐EMB株(χ2=3.93,P=0.05),higB及Rv1957的多态性在2种菌株间的差异无统计学意义(P>0.05)。
4. 突变预测分析:在检测到的6个异义突变中,有4个突变对蛋白质结构的稳定性影响较大(DDG值<0代表破坏蛋白质的稳定性,DDG值>0代表增强蛋白质的稳定性),其中有3个仅发生在北京家族菌株中(表 3)。对同义突变的密码子使用频率进行分析,编码His的野生型密码子CAC使用频率为1.49,突变后的密码子CAT使用频率为0.51,编码Leu的野生型密码子CTG使用频率为3.44,突变后的密码子TTG使用频率为1.06。
结核分枝杆菌的TAC系统是由3个基因Rv1955、Rv1956和Rv1957共同编码,分别编码毒素蛋白HigB、抗毒素蛋白HigA和分子伴侣Rv1957。基因Rv1957编码一个类似大肠埃希菌中secB的伴侣蛋白,该分子伴侣协助HigA抗毒素蛋白的正确折叠[9],从而阻止抗毒素蛋白被ClpC1 等蛋白酶降解,这种相互作用有利于抗毒素蛋白HigA中和毒素蛋白HigB。当细菌遭遇环境压力(缺氧、饥饿等)时,毒素蛋白HigB被激活,通过切割RNA酶,最终导致细菌程序性死亡或进入生长抑制状态[10]。在不利的生长压力下,细菌是死亡还是进入持留状态,可能取决于TAs的类型及毒素蛋白暴露的时间。有学者认为TAs可作为治疗结核病的新药物靶点,即通过抑制抗毒素的表达,使大量的毒素蛋白聚集,从而杀死细胞[11]。
对于同义密码子,不同生物的使用频率有很大差异,并影响其转化效率[12],目前已知晓结核分枝杆菌优先使用不同的氨基酸密码子。在138株北京型菌株中,存在两种不同类型的同义碱基替换,因此,本研究分析了TAC系统中同义替换的氨基酸密码子的使用情况。编码组氨酸(His)的野生型密码子使用频率为1.49,突变后的密码子CAT使用频率降为0.51;编码亮氨酸(Leu)的野生型密码子使用频率为3.44,突变后的密码子TTG使用频率降为1.06,这些偏爱密码子的改变可能会影响蛋白的表达。
183株菌有149株(81.42%)发生突变,其中有138株(92.62%)属于北京家族。本研究发现TAC系统中的突变,特别是异义核苷酸的改变,均造成相应氨基酸的改变,进而可能影响蛋白产物的表达。有31株菌发生异义核苷酸改变,占所有菌株的16.94%,其中64.52%(20/31)的菌株属于北京家族。在6个异义突变中,预测有4个对蛋白的影响较大,有3个仅发生在北京家族菌株中。研究中发现北京家族菌株的TAC系统与非北京家族相比,具有更高的基因多态性。已有研究表明北京家族菌株作为优势菌株,更易传播,易致病,易耐药[13, 14]。北京基因型菌株在Rv3908、mutT2和ogt三种公认的DNA突变修复基因上表现出独特的错义突变,这些突变可导致细菌突变频率增加,部分地解释了北京家族菌株快速适应环境的能力[15]。TAC系统作为一个毒力基因,在本研究中发现北京家族呈现更高的多态性水平,这可能更有利于结核分枝杆菌北京家族菌株适应不同的宿主环境。此外higA(Rv1956)基因序列比对发现,所有的北京家族菌株在第121位的组氨酸(His)存在特异性的CAC121CAT突变,这个特异性的SNP位点可以被用来鉴别北京型家族和非北京家族菌株。
TAs参与细菌的持留,而持留菌的特征之一即对药物不敏感。本文对TAC系统基因与耐药表型之间的关系进行了探索,在组成TAC系统的3个基因中,仅编码抗毒素蛋白HigA的基因多态性可能与耐药表型相关。位于higA基因的CAC121CAT突变位点在耐SM和耐RFP菌株中的突变频率高于敏感株,且差异有统计学意义(P<0.05)。结核分枝杆菌耐SM和RFP可能与higA(Rv1956)基因突变有关,且CAC121CAT突变位点是北京基因型的特异性突变位点,由此推论北京基因型菌株可能更易耐药。
综上所述,结核分枝杆菌TAC系统的基因多态性的研究为全面了解结核分枝杆菌的致病性、基因结构与功能及其分子演化奠定基础。
利益冲突 无| [1] Gomez JE,McKinney JD. M. tuberculosis persistence,latency,and drug tolerance[J]. Tuberculosis,2004,84(1/2):29-44. DOI:10.1016/j.tube.2003.08.003. |
| [2] Kondratieva T,Azhikina T,Nikonenko B,et al. Latent tuberculosis infection:What we know about its genetic control?[J]. Tuberculosis,2014,94(5):462-468. DOI:10.1016/j.tube. 2014.06.009. |
| [3] Ahidjo BA,Kuhnert D,McKenzie JL,et al. VapC toxins from Mycobacterium tuberculosis are ribonucleases that differentially inhibit growth and are neutralized by cognate VapB antitoxins[J]. PLoS One,2011,6(6):e21738. DOI:10.1371/journal.pone. 0021738. |
| [4] Hayes F. Toxins-antitoxins:Plasmid maintenance,programmed cell death,and cell cycle arrest[J]. Science,2003,301(5639):1496-1499. DOI:10.1126/science.1088157. |
| [5] Ramage HR,Connolly LE,Cox JS. Comprehensive functional analysis of Mycobacterium tuberculosis toxin-antitoxin systems:Implications for pathogenesis,stress responses,and evolution[J]. PLoS Genet,2009,5(12):e1000767. DOI:10.1371/journal.pgen.1000767. |
| [6] Sala A,Calderon V,Bordes P,et al. TAC from Mycobacterium tuberculosis:a paradigm for stress-responsive toxin-antitoxin systems controlled by SecB-like chaperones[J]. Cell Stress Chaperones,2013,18(2):129-135. DOI:10.1007/s12192-012-0396-5. |
| [7] Kamerbeek J,Schouls L,Kolk A,et al. Simultaneous detection and strain differentiation of Mycobacterium tuberculosis for diagnosis and epidemiology[J]. J Clin Microbiol,1997,35(4):907-914. |
| [8] Capriotti E,Fariselli P,Casadio R. I-Mutant 2.0:predicting stability changes upon mutation from the protein sequence or structure[J]. Nucleic Acids Res,2005,33 Suppl 2:W306-W310. DOI:10.1093/nar/gki375. |
| [9] Bordes P,Cirinesi AM,Ummels R,et al. SecB-like chaperone controls a toxin-antitoxin stress-responsive system in Mycobacterium tuberculosis[J]. Proc Natl Acad Sci USA,2011,108(20):8438-8443. DOI:10.1073/pnas.1101189108. |
| [10] Schuessler DL,Cortes T,Fivian-Hughes AS,et al. Induced ectopic expression of HigB toxin in Mycobacterium tuberculosis results in growth inhibition,reduced abundance of a subset of mRNAs and cleavage of tmRNA[J]. Mol Microbiol,2013,90(1):195-207. DOI:10.1111/mmi.12358. |
| [11] Demidenok OI,Goncharenko AV. Bacterial toxin-antitoxin systems and perspectives for their application in medicine:a review[J]. Appl Biochem Microbiol,2013,49(6):535-541. DOI:10.1134/S0003683813060070. |
| [12] Andersson GE,Sharp PM. Codon usage in the Mycobacterium tuberculosis complex[J]. Microbiology,1996,142(Pt 4):915-925. DOI:10.1099/00221287-142-4-915. |
| [13] Aguilar D,Hanekom M,Mata D,et al. Mycobacterium tuberculosis strains with the Beijing genotype demonstrate variability in virulence associated with transmission[J]. Tuberculosis,2010,90(5):319-325. DOI:10.1016/j.tube.2010. 08.004. |
| [14] van der Spuy GD,Kremer K,Ndabambi SL,et al. Changing Mycobacterium tuberculosis population highlights clade-specific pathogenic characteristics[J]. Tuberculosis,2009,89(2):120-125. DOI:10.1016/j.tube.2008.09.003. |
| [15] Ebrahimi-Rad M,Bifani P,Martin C,et al. Mutations in putative mutator genes of Mycobacterium tuberculosis strains of the W-Beijing family[J]. Emerg Infect Dis,2003,9(7):838-845. DOI:10.3201/eid0907.020803. |
 2016, Vol. 37
2016, Vol. 37