文章信息
- 周航, 李昱, 陈瑞丰, 陶晓燕, 于鹏程, 曹守春, 李丽, 陈志海, 朱武洋, 殷文武, 李玉华, 王传林, 余宏杰.
- Zhou Hang, Li Yu, Chen Ruifeng, Tao Xiaoyan, Yu Pengcheng, Cao Shouchun, Li Li, Chen Zhihai, Zhu Wuyang, Yin Wenwu, Li Yuhua, Wang Chuanlin, Yu Hongjie.
- 狂犬病预防控制技术指南(2016版)
- Technical guideline for human rabies prevention and control(2016)
- 中华流行病学杂志, 2016, 37(2): 139-163
- Chinese Journal of Epidemiology, 2016, 37(2): 139-163
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.02.001
-
文章历史
- 收稿日期: 2016-01-11
2. 100048 北京, 海军总医院;
3. 102206 北京, 中国疾病预防控制中心病毒病预防控制所;
4. 100050 中国食品药品检定研究院;
5. 100021 北京市朝阳区疾病预防控制中心;
6. 100015 首都医科大学附属北京地坛医院;
7. 100044 北京大学人民医院
2. National Institute for Viral Disease Control and Prevention;
3. Chinese Center for Disease Control and Prevention, Beijing 102206, China;Navy General Hospital, Beijing 100048, China;
4. National Instisutes for Food and Drug Control, Beijing 100050, China;
5. Chaoyang Center for Disease Control and Prevention, Beijing 100021, China;
6. Beijing Ditan Hospital Capital Medical University, Beijing 100015, China;
7. Peking University People's Hospital, Beijing 100044, China
狂犬病是由狂犬病病毒感染引起的一种动物源性传染病。狂犬病病毒主要通过破损的皮肤或黏膜侵入人体,临床表现为特异性恐风、恐水、咽肌痉挛、进行性瘫痪等。近年来,狂犬病报告死亡数一直位居我国法定报告传染病前列,给人民群众生命健康带来严重威胁。而暴露后处置是暴露后预防狂犬病的唯一有效手段。WHO认为,及时、科学和彻底的暴露后预防处置能够避免狂犬病的发生。为指导基层疾控机构做好狂犬病预防控制工作,尤其是暴露后的预防处置,降低狂犬病所致死亡,中国CDC组织专家,参考WHO和美国CDC相关技术指南,以及国内外最新研究进展,制定了《狂犬病预防控制技术指南(2016版)》(指南)。本指南适用于从事狂犬病防控工作的各级各类疾病预防控制机构、狂犬病暴露预防处置门诊、医疗机构感染科和急诊科等专业人员,并根据使用中反馈的问题和国内外狂犬病研究新进展不断更新和完善。
一、病原学和实验室诊断(一)病原学:狂犬病病毒(rabies virus,RABV)属于单负病毒目(mononegavirales)弹状病毒科(rhabdoviridae)狂犬病毒属(lyssavirus)[1]。RABV颗粒呈子弹状,长100~300 nm,直径约75 nm。病毒基因组长约12 kb,为不分节段的单股负链RNA,3′~5′端依次编码5种结构蛋白,分别为核蛋白(nucleoprotein,N)、磷蛋白(phosphoprotein,P)、基质蛋白(matrixprotein,M)、糖蛋白(glycoprotein,G)和依赖RNA的RNA多聚酶(RNA dependent RNA polymerase or large protein,L)。病毒颗粒由囊膜(envelope)和核衣壳(nucleocapsid)两部分组成,基因组RNA及外层紧密盘绕的N、P、L蛋白共同构成具有转录、翻译功能的核衣壳;颗粒外层脂质膜表面镶嵌着G蛋白以三聚体构成的纤突(spike),为病毒中和抗原及与宿主受体结合的部位,M蛋白位于外壳内侧和核衣壳之间,连接内外两部分[1, 2]。
RABV不耐高温,悬液中的病毒经56 ℃ 30~60 min或100 ℃ 2 min即失去感染力。脑组织内的RABV在常温、自溶条件下,可保持活力7~10 d,4 ℃可保存2~3周。RABV在pH 7.2~8.0较为稳定,超过pH 8.0易被灭活。RABV对脂溶剂(肥皂水、氯仿、丙酮等)、乙醇、过氧化氢、高锰酸钾、碘制剂以及季铵类化合物(如苯扎溴铵)等敏感[3]。1 ∶ 500稀释的季胺类消毒剂、45%~70%乙醇、1%肥皂水以及5%~7%碘溶液均可在1 min内灭活病毒,但不易被来苏水溶液灭活[4, 5]。
不同型别RABV的致病性不同。在犬、猫等哺乳动物中传播,也称“街毒”的病毒毒力很强,感染后一旦出现临床症状,病死率几乎100%,是世界上病死率最高的传染病;而在蝙蝠中传播的病毒毒力相对较弱。
直到20世纪50年代,RABV一直被认为是狂犬病的唯一病原[6]。通过对来自尼日利亚的与RABV有血清学相关性的病毒即LBV(Lagos bat virus)和MOKV(Mokola virus)的鉴定,以及对1970年分离自南非被蝙蝠咬伤病例的DUVV(Duvenhage virus)病毒的分析,发现RABV群的复杂性,由此出现了“狂犬病相关病毒(rabies-related virus)”和“狂犬病血清型”的术语,目前分别将RABV、LBV、MOKV、DUVV确定为4种血清型。
1950年以来在欧洲分离到的蝙蝠病毒与DUVV呈血清学相关性,应用单克隆抗体反应将欧洲蝙蝠病毒进一步分为EBLV-1(European bat lyssavirus 1)和EBLV-2(European bat lyssavirus 2)。针对狂犬病相关病毒多样性的遗传进化研究,产生了新的专业术语“基因型”,并继续发现了新的基因型,如1997年从澳大利亚果蝠中分离到的ABLV(Australian bat lyssavirus)确定为基因7型。为了更好地对日益增多的狂犬病相关病毒进行归类,国际病毒分类委员会(International Committee of Taxonomy Virus,ICTV)主持设立了狂犬病病毒属,将现存的基因型作为病毒分类的基础,并结合系统发生进化树的拓扑结构、单克隆抗体反应谱,以及生态、宿主、地理范围等特征确立了病毒种类。
2014年,ICTV最新分类结果明确了14种(species)RABV。除了上述7个基因型代表 7种不同的RABV外,21世纪新发现的另外7种病毒包括从中亚食虫蝙蝠中分离到的KHUV(Khujand virus)和ARAV(Aravan virus),从俄罗斯食虫蝙蝠中分离到的IRKV(Irkut virus)和WCBV(West Caucasian bat virus),从非洲肯尼亚食虫蝙蝠中分离到的SHIBV(Shimoni bat virus),从法国、德国食虫蝙蝠中分离到的BBLV(Bokeloh bat lyssavirus)和坦桑尼亚非洲灵猫身上分离到的IKOV(Ikoma lyssavirus)[7]。2011年从西班牙蝙蝠中分离到的LLEBV(Lleida bat lyssavirus)尚未经ICTV明确归类[1]。
(二)实验室诊断:
1. 标本采集:发病后(死亡前)可采集其唾液(间隔3~6 h,至少采集3份)、脑脊液、血清及颈后带毛囊的小块皮肤;患者死后最好采集其脑组织标本(小脑和脑干)进行实验室检测[6, 8]。
2. 检测:直接免疫荧光法(direct fluorescent antibody test,DFA)是狂犬病诊断的金标准,可以快速、敏感、特异地检测人和动物脑组织中的病毒抗原[6, 9]。临床病例活体组织标本(如颈后部皮肤毛囊)亦可进行DFA检测[6]。直接快速免疫组化法(direct rapid immunohistochemical test,DRIT)及ELISA亦可特异检测病毒抗原[6]。
病毒核酸检测可用于早期诊断,以RT-PCR(包括Real-time RT-PCR)检测体液(唾液、血清等)和脑组织等标本,但需要严格的质量控制以保证结果的准确性[6, 9]。脑组织及唾液等病毒含量高的样本还可进行病毒分离。细胞培养分离所需时间(1~2 d)远少于小鼠颅内接种分离法所需时间(10~21 d)[6, 9],且前者的生物安全风险远小于后者。
未接种过疫苗的患者,发病早期几乎没有中和抗体产生,到发病晚期(通常在临床症状出现后7~8 d),病毒在脑内大量增殖后突破血脑屏障进入血液,刺激机体产生低水平的中和抗体。通过病毒中和试验检测患者血清或脑脊液中的中和抗体,可作为狂犬病诊断的依据之一[3, 6, 9]。
WHO推荐的抗狂犬病病毒中和抗体标准检测方法包括快速荧光灶抑制试验(rapid fluorescent focus inhibition test,RFFIT)和小鼠脑内中和试验(mouse neutralization test,MNT)[3, 9]。由于RFFIT法无需使用小鼠,所用时间短(24 h),目前已被广泛采用。RFFIT法也是我国现行药典规定的检测狂犬病病毒中和抗体的标准方法之一。此外,常用的狂犬病病毒中和抗体检测方法还有荧光抗体病毒中和试验(fluorescent antibody virus neutralization test,FAVN)[6]。用ELISA测定的抗狂犬病病毒糖蛋白抗体滴度与用病毒中和试验测定的结果有一定的相关性(约80%符合率),但相应试剂盒尚未普及[3, 6]。
此外,还可以通过检测中和抗体,监测暴露前抗体背景及暴露后疫苗注射的免疫效果。WHO狂犬病专家咨询委员会认为:中和抗体水平≥0.5 IU/ml时,接种者才具备了有效的保护能力;如果发现中和抗体水平<0.5 IU/ml,应进行加强免疫,至达到有效保护水平为止[3, 6]。
二、临床学(一)发病机制:大多数人间狂犬病病例是由于被患狂犬病的动物咬伤所致,少数是由于被抓挠或伤口、黏膜被污染所致,因移植狂犬病患者捐赠的器官或组织发病也偶有报道,但病毒不能侵入没有损伤的皮肤。
嗜神经性是RABV自然感染的主要特征,病毒的复制几乎只限于神经元内。病毒最初进入伤口时,不进入血液循环(通常在血液中检测不到病毒),而是在被咬伤的肌肉组织中复制,然后通过运动神经元的终板和轴突侵入外周神经系统[10, 11, 12, 13, 14, 15]。在一些蝙蝠变异株中,由于嗜皮肤性,病毒增殖也可以发生在感觉神经[10, 13, 15]。病毒进入外周神经后,以运输小泡为载体,沿轴突以逆轴浆运动的方向向中枢神经系统“向心性”移行,而不被感觉或交感神经末梢摄取[10, 11, 12, 13]。其移行速度取决于转运方式,逆向轴突运输速度较快,可达5~100 mm/d,如一定范围内(如10 μm至2 cm)的突触同时受感染,病毒移行速度甚至会更快。
病毒在轴突移行期间不发生增殖,当到达背根神经节后,病毒即在其内大量增殖,然后侵入脊髓和整个中枢神经系统。动物实验发现,病毒从脊髓上行到脑的扩散速度非常迅速,一旦侵入脑则迅速增殖,脑干最先受累,也是感染最重的区域。
在中枢神经系统中增殖后,病毒通过在运动轴突的顺向轴浆运输“离心性”扩散进入腹侧根、被根神经节及其感觉轴突,并感染感觉轴突支配的肌梭、皮肤、毛囊及其他非神经组织,主要累及神经丛和唾液腺腺泡细胞,并经唾液腺排放到唾液中,再由咬伤伤口或被带病毒唾液污染的黏膜传播到下一个受害者。在感染末期,心、胰腺、肾上腺和胃肠道等神经外组织也同时受累。临床发病时,病毒已广泛分布于中枢神经系统及神经外的器官中。
人间狂犬病潜伏期从5 d至数年(通常2~3个月,极少超过1年),潜伏期长短与病毒的毒力、侵入部位的神经分布等因素相关。病毒数量越多、毒力越强、侵入部位神经越丰富、越靠近中枢神经系统,潜伏期就越短。此外,肌肉特异性小RNA可能通过抑制病毒在肌肉中的转录和复制影响潜伏期[6, 9],狂犬病实验感染动物(如犬)的最长潜伏期为半年。在潜伏期内,病毒主要存在于外周肌肉或神经细胞中[6, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19]。
包括人类在内的多种哺乳动物感染RABV后,随着病毒在中枢神经系统的扩散,均可引起严重的进行性脑、脊髓、脊神经根炎,病毒数量与临床症状的严重程度无关[20, 21]。人类的临床表现可分为狂躁型和麻痹型两种,临床分型可能与病毒对神经组织不同位点的特异性反应有关,而与病毒在中枢神经系统内的解剖定位无关[22, 23]。电生理学研究发现,麻痹型狂犬病的虚弱症状与外周神经轴突病变或者脑白质变性有关[24, 25]。病毒首先侵入运动神经元,这就解释了狂躁型狂犬病患者亚临床的前角细胞功能失调要早于感觉消失症状的出现,且症状首先发生在被咬伤部位附近,再逐渐发展到身体其他部位。同样的解释也适用于麻痹型狂犬病患者的前驱症状和体征。犬类麻痹型狂犬病的核磁弥散张量成像显示,脑干部位神经束的完整性受损,限制了病毒向前脑的传播。病毒的免疫逃避策略加之血脑屏障的完整性阻碍了中枢神经系统中病毒的清除。目前尚无狂犬病患者因免疫抑制或加强而死亡的证据。
如无重症监护,患者可在出现神经系统症状后1~5 d内死亡。目前对狂犬病导致死亡的病理生理学尚未阐明。尽管脑、脊髓、脊神经根的炎症广泛分布,但并没有破坏神经组织结构[26]。死因可能是由于控制循环和呼吸系统的中枢神经系统受累或功能障碍[20, 27, 28, 29]。
(二)临床表现与诊断标准:
1. 狂犬病暴露者的伤口感染:对于狂犬病暴露者而言,除了罹患狂犬病的风险外,动物咬伤还可以导致各种复杂的外科伤口、可能的严重并发症以及继发的细菌感染。致伤动物不同,所导致的伤口类型、临床特点以及预后均有所不同。例如,普通外科创伤的伤口感染率通常为5%~7%[30],而在Ⅲ级暴露中,犬咬伤伤口大部分为撕裂伤(约60%~76.5%),而猫咬伤大部分为穿刺伤(约85.3%);犬咬伤伤口平均感染率约14.8%,而猫咬伤约为26.8%;手、足部位的咬伤伤口感染率明显较其他部位要高;犬咬伤容易引起化脓性软组织感染,而猫咬伤容易引起淋巴管/淋巴结炎、丹毒等[31, 32]。引起咬伤伤口感染的细菌主要来源于动物口腔,48%的犬咬伤和63%的猫咬伤感染伤口分离出需氧和厌氧菌混合感染,犬咬伤感染伤口分离出的主要细菌是犬属巴斯菌属,而出血败血型巴斯菌属是猫咬伤感染伤口内最主要的菌种[32, 33, 34, 35, 36, 37]。灵长类咬伤感染伤口内分离的菌种包括嗜血杆菌、核粒梭形菌、微小消化链球菌、放线菌属、产碱杆菌和直肠沃林氏菌(拟杆菌属)。猪咬伤伤口分离出的菌种主要包括猪放线菌、拟杆菌属、大肠埃希菌、黄杆菌属、多杀性巴斯杆菌、变形杆菌、耐甲氧西林金黄色葡萄球菌(MRSA)等[37]。巴斯菌属、链球菌、葡萄球菌、摩拉克菌和奈瑟菌属是最常见的需氧菌;梭形杆菌属、拟杆菌属、噬卟啉拟杆菌属是最常见的厌氧菌,且其中大部分细菌为产β-内酰胺酶,甚至是MRSA,因此,在伤口感染或预防性使用抗生素时,需考虑病原菌耐药因素[38, 39, 40, 41, 42, 43]。
2. 狂犬病的临床表现:狂犬病在临床上可表现为狂躁型(约2/3的病例)或麻痹型。由犬传播的狂犬病一般表现为狂躁型,而吸血蝙蝠传播的狂犬病一般表现为麻痹型[25, 26, 27]。狂躁型患者以意识模糊、恐惧痉挛,以及自主神经功能障碍(如瞳孔散大和唾液分泌过多等)为主要特点。麻痹型患者意识清楚,但有与吉兰-巴雷综合征(Guillain-Barre syndrome,GBS)相似的神经病变症状。GBS是脊神经和周围神经的脱髓鞘疾病,又称急性特发性多神经炎或对称性多神经根炎,临床主要表现为进行性、上升性、对称性麻痹,四肢软瘫,以及不同程度的感觉障碍。与GBS不同的是,狂犬病患者一般伴有高热、叩诊肌群水肿(通常在胸部、三角肌和大腿)和尿失禁,而不伴有感觉功能受损。
根据病程,狂犬病的临床表现可分为潜伏期、前驱期、急性神经症状期(兴奋期)、麻痹期、昏迷和死亡几个阶段。但实际上发病是一个连续的临床过程,而不是简单的一系列可以独立分割的表现[6, 20]。
(1)潜伏期:从暴露到发病前无任何症状的时期,一般为1~3个月,极少数短至2周以内或长至1年以上,此时期内无任何诊断方法。
(2)前驱期:患者出现临床症状的早期,通常以不适、厌食、疲劳、头痛和发热等不典型症状开始,50%~80%的患者会在原暴露部位出现特异性神经性疼痛或感觉异常(如痒、麻及蚁行感等),可能是由于病毒在背根神经节复制或神经节神经炎所致。此时期还可能出现无端的恐惧、焦虑、激动、易怒、神经过敏、失眠或抑郁等症状。前驱期一般为2~10 d(通常2~4 d)。
(3)急性神经症状期:患者出现典型的狂犬病临床症状,有两种表现,即狂躁型与麻痹型。
狂躁型患者出现发热并伴随明显的神经系统体征,包括机能亢进、定向力障碍、幻觉、痉挛发作、行为古怪、颈项强直等。其突出表现为极度恐惧、恐水、怕风、发作性咽肌痉挛、呼吸困难、排尿排便困难及多汗流涎等。恐水、怕风是本病的特殊症状,典型患者见水、闻流水声、饮水或仅提及饮水时,均可引起严重的咽喉肌痉挛。患者虽渴极而不敢饮,即使饮后也无法下咽,常伴声嘶及脱水。亮光、噪声、触动或气流也可能引发痉挛,严重发作时尚可出现全身疼痛性抽搐。由于常有呼吸肌痉挛,故可导致呼吸困难及发绀。大多数动物狂犬病病例的机能亢进期会持续数小时至数天,人间狂犬病病例的机能亢进为间歇性,由数个持续1~5 min的兴奋期组成。患者的神志大多清楚,亢进期之间,患者一般合作,并可以进行交流。急性神经症状期的其他异常表现包括肌束震颤(尤其是暴露部位附近)、换气过度、唾液分泌过多、局部或全身痉挛,以及一些较罕见的症状,包括阴茎异常勃起或性欲增强,这些体征都与自主神经功能障碍有关。本期一般持续1~3 d。
麻痹型患者无典型的兴奋期及恐水现象,而以高热、头痛、呕吐、咬伤处疼痛开始,继而出现肢体软弱、腹胀、共济失调、肌肉瘫痪、大小便失禁等,呈现横断性脊髓炎或上升性脊髓麻痹等类GBS表现。其病变仅局限于脊髓和延髓,而不累及脑干或更高部位的中枢神经系统。
(4)麻痹期:指的是患者在急性神经症状期过后,逐渐进入安静状态的时期,此时痉挛停止,患者渐趋安静,出现弛缓性瘫痪,尤以肢体软瘫最为多见。麻痹可能是对称性或非对称性的,以被咬肢体侧更为严重;或者呈上升性,类似GBS。眼肌、颜面部肌肉及咀嚼肌也可受累,表现为斜视、眼球运动失调、下颌下坠、口不能闭、面部缺少表情等。进而患者的呼吸渐趋微弱或不规则,并可出现潮式呼吸;脉搏细数、血压下降、反射消失、瞳孔散大。临终前患者多进入昏迷状态,呼吸骤停一般在昏迷后不久即发生。本期持续6~18 h。
狂犬病的整个自然病程一般不超过5 d。死因通常为咽肌痉挛而窒息或呼吸循环衰竭[20, 27, 28, 29]。本病在临床上需与破伤风、病毒性脑膜脑炎、脊髓灰质炎、GBS等相鉴别。
3. 诊断标准:
(1)原国家卫生部2008年颁布的狂犬病诊断标准[9]:根据患者的流行病学、临床表现和实验室检查结果进行综合判断,病例确诊需要实验室证据。
① 临床诊断病例,符合下列任一项即可诊断: 典型的狂躁型狂犬病临床表现;
典型的狂躁型狂犬病临床表现; 明确的动物致伤史+典型的麻痹型狂犬病临床表现。
明确的动物致伤史+典型的麻痹型狂犬病临床表现。
② 确诊病例,临床诊断病例凡下列任一项,即可确诊: 直接荧光抗体法(或ELISA):检测患者唾液、脑脊液或颈后带毛囊的皮肤组织标本中RABV抗原阳性,或用RT-PCR检测RABV核酸阳性;
直接荧光抗体法(或ELISA):检测患者唾液、脑脊液或颈后带毛囊的皮肤组织标本中RABV抗原阳性,或用RT-PCR检测RABV核酸阳性; 细胞培养方法:从患者唾液或脑脊液等标本中分离出RABV;
细胞培养方法:从患者唾液或脑脊液等标本中分离出RABV; 脑组织检测:尸检脑组织标本,用直接荧光抗体法或ELISA检测RABV抗原阳性、RT-PCR检测RABV核酸阳性、细胞培养方法分离出RABV。
脑组织检测:尸检脑组织标本,用直接荧光抗体法或ELISA检测RABV抗原阳性、RT-PCR检测RABV核酸阳性、细胞培养方法分离出RABV。
(2)WHO的狂犬病定义[6]:
临床病例:病例具有急性神经性综合征(如脑炎),主要表现为机能亢奋(如狂躁型狂犬病)或者麻痹综合征(如麻痹型狂犬病),如果没有重症监护支持,患者通常会在首发症状出现后7~11 d内进行性发展为昏迷和死亡,常见死因为呼吸循环衰竭。
符合下列实验室标准中的一种或几种即可确诊: 存在病毒抗原;
存在病毒抗原; 细胞培养方法或实验动物接种中分离到病毒;
细胞培养方法或实验动物接种中分离到病毒; 未接种疫苗者的脑脊液或血清中存在病毒特异性抗体;
未接种疫苗者的脑脊液或血清中存在病毒特异性抗体;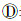 通过分子生物学方法在活体或尸检样本(如脑活检样本、皮肤、唾液、浓缩尿)中检测到病毒核酸。
通过分子生物学方法在活体或尸检样本(如脑活检样本、皮肤、唾液、浓缩尿)中检测到病毒核酸。
WHO的狂犬病病例分类:①疑似病例:符合临床病例定义的病例;②可能病例:疑似病例,同时具有与疑似狂犬病动物接触的可靠病史;③确诊病例:实验室确认的疑似病例或可能病例。
在缺少动物暴露史或临床疑似脑炎症状的情况下,如果实验室诊断检测明确,仍可进行确定性诊断。
对可能感染狂犬病的患者在采取适当预防措施情况下进行核磁共振成像检查可能有助于诊断。无论临床类型如何,当脑干、海马、下丘脑、深层和皮层下白质以及深层和皮质灰质的核磁共振T2成像出现模糊、微弱的异常高信号时,均提示可能为狂犬病。疾病晚期,当患者进入昏迷状态时,增强核磁可以清楚地显示上述改变,这些特征可用来将狂犬病与其他病毒性脑炎相区别。脑部 CT几乎没有诊断价值[44, 45, 46]。
三、 流行病学(一)疾病负担:狂犬病在全球广泛分布,除南极洲外,所有大陆均有人间狂犬病报告。进入21世纪后,狂犬病仍然是重要的公共卫生威胁,全球每年约有60 000人死于狂犬病,是致死人数最多的动物源性传染病[47, 48],每年由此引发的经济负担约为40亿美元[49]。目前,除许多太平洋岛国无狂犬病报告外,仅有澳大利亚消除了肉食动物狂犬病,西欧、加拿大、美国、日本、马来西亚和少数拉丁美洲国家消除了犬狂犬病[6, 47]。
目前,99%的人间狂犬病发生在发展中国家,主要分布在亚洲、非洲和拉丁美洲及加勒比海地区。亚洲的狂犬病病例数居全球首位,估计年死亡人数达30 000(95%CI:8 100~61 400)人[49]。印度为当前狂犬病疫情最严重的国家,据估计年狂犬病发病数为20 000~30 000例,发病率为2/10万。中国人间狂犬病发病仅次于印度,2007年疫情高峰时,年报告病例数达3 300例[50]。2004-2014年,狂犬病死亡人数一直高居我国传染病死亡数的前3位。此外,调查显示,部分地区狂犬病漏报率可能高达35%[51],提示我国狂犬病的疾病负担可能存在低估[52]。
(二)感染动物来源:狂犬病在自然界的储存宿主动物包括食肉目动物和翼手目动物,狐、狼、豺、鼬獾、貉、臭鼬、浣熊、猫鼬和蝙蝠等也是狂犬病的自然储存宿主,均可感染RABV成为传染源,进而感染猪、牛、羊和马等家畜。狂犬病易感动物主要包括犬科、猫科及翼手目动物,禽类、鱼类、昆虫、蜥蜴、龟和蛇等不感染和传播病毒。全球范围内,99%的人间狂犬病是由犬引起[7],特别是亚洲、非洲等狂犬病流行区,犬是引起人间狂犬病的最主要原因。而犬狂犬病疫情控制较好的欧洲、北美、澳大利亚及部分拉丁美洲国家的传染源为蝙蝠、狐、豺、狨猴、猫鼬和浣熊等野生动物[53, 54, 55, 56, 57]。
宿主动物中,蝙蝠较为特殊,由于蝙蝠暴露可能为极难察觉的细微咬伤或损伤[18],从而导致暴露风险大为提高。WHO及美国CDC均将蝙蝠暴露归类为严重暴露,要求将其按照Ⅲ级暴露进行处置[6, 18, 19, 22]。美国和加拿大1950-2007年间56例蝙蝠导致的人间狂犬病病例中,有明确咬伤史者仅22例(39%);与蝙蝠直接接触而无咬伤(如触摸蝙蝠)者9例(16%);有6例(11%)并无明确接触史,仅发现房间内有蝙蝠;而无直接接触者为19例(34%)[58]。
WHO指出,对北美洲和欧洲狂犬病流行地区的野生和家栖啮齿类动物的大规模检测显示,此类动物极少感染狂犬病,病毒终端溢出性感染仅为偶发事件,说明此类动物并非狂犬病的贮存宿主,也不参与该疾病的流行和传播[6, 22]。美国CDC也指出,啮齿类(尤其小型啮齿类,如花栗鼠、松鼠、小鼠、大鼠、豚鼠、沙鼠、仓鼠)和兔形目(包括家兔和野兔)极少感染狂犬病,也未发现此类动物导致人间狂犬病的证据。根据美国20年(1985-2004年)的监测,尽管在浣熊狂犬病发病地区,偶有旱獭(土拨鼠)感染狂犬病的记录,但从未在小型啮齿动物中检测到RABV,也无啮齿类或兔形目动物导致人间狂犬病病例的证据[18, 59]。
(三)我国人间狂犬病流行特征:20世纪50年代以来,我国人间狂犬病先后出现了3次流行高峰(图 1)。第一次高峰出现在20世纪50年代中期,年报告死亡数曾逾1 900人。第二次高峰出现在20世纪80年代初期,1981年全国狂犬病报告死亡7 037人,为新中国成立以来报告死亡数最高的年份。整个80年代,全国狂犬病疫情在高位波动,年报告死亡数均在4 000人以上,年均报告死亡数达5 537人[60]。第三次高峰出现在21世纪初期,狂犬病疫情在连续8年快速下降后,重新出现快速增长趋势,至2007年达到高峰,当年全国报告死亡数达3 300人。在第三次疫情高峰前后,我国采取了一系列遏制狂犬病的措施,包括落实人间狂犬病防控措施、建立狂犬病多部门防控机制、强化犬只管理和动物狂犬病防治,以及加强人用狂犬病疫苗和被动免疫制剂质量监管等[61],取得了较为显著的防治效果。自2008年起,我国狂犬病疫情出现持续回落,至2014年报告发病数已降至1 000例以下,较2007年的峰值下降了72%。

|
| 图 1 1950-2014年中国狂犬病报告发病例数 |
历史上我国所有省份均报告过人间狂犬病病例。近年狂犬病疫情主要分布在人口稠密的华南、西南、华东地区,但其他省份也时有疫情报告。1996-2008年,除西藏和青海外,其余29省均有狂犬病病例报告,报告病例数排名前10位的省份为广西、湖南、贵州、广东、江西、江苏、湖北、河南、四川和安徽,报告病例占全国总数的86.9%[62],全国发病地区分布见图 2。
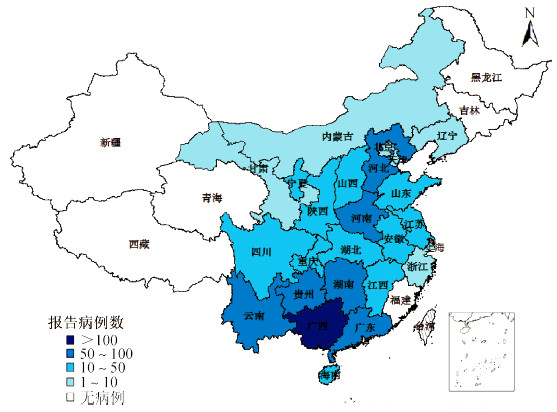
|
| 图 2 2014年我国报告狂犬病发病地区分布 |
2007年以来,狂犬病波及地区数呈下降趋势,但速度相对缓慢。2007年全国23省共993个县(区)报告病例,2014年仍有567个县(区)报告病例。2007年后,多数省份狂犬病疫情呈下降趋势,特别是疫情较重的省份下降显著,但疫情有向北和向西北地区扩展的趋势[50, 63],河北、山西、云南、陕西、海南、重庆等既往报告发病数较少的省份曾一度出现疫情上升。2012年后,各省疫情均呈持续下降趋势。
我国每个月均有狂犬病病例报告,夏秋季高发,发病高峰一般出现在8月[64]。2005-2011年监测数据分析显示,不同地区的季节性特征存在差异,纬度越高季节性越明显,病例发病的时间相对集中[65]。病例呈现“三多”的特征:农村地区病例较多,农民一般占病例总数的65%以上;男性病例数约为女性的2倍;15岁以下儿童和50岁以上人群发病较多,1996-2008年近25%的病例为15岁以下儿童[62, 66, 67]。病例主要由犬伤所致,约占90%左右;其次为猫,占5%左右,其他致伤动物包括马、松鼠、猪、蝙蝠、猴和獾等[68],但较为少见,仅占不到5%。约50%伤人动物为家养,其中绝大多数家养动物未接种动物狂犬病疫苗,流浪动物约占伤人动物总数的25%。
根据我国人用狂犬病疫苗的使用量,估计全国年暴露人口数逾4 000万[68]。部分狂犬病高发省份的监测显示,90%以上的暴露就诊人群为Ⅱ级和Ⅲ级暴露,其中Ⅲ级暴露约40%。全部暴露者中,约10%未全程接种疫苗[69, 70];Ⅲ级暴露者中,仅15%左右接受被动免疫制剂注射。绝大多数病例由街毒感染所致,但也有少量由狂犬病毒属相关病毒感染致病的报道[71]。
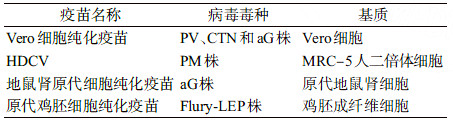
四、人用狂犬病疫苗(一)人用狂犬病疫苗的历史和现状:1882年法国路易巴斯德首次成功发明了人用狂犬病疫苗,之后经历了早期的动物神经组织疫苗、禽胚疫苗、细胞培养的粗制疫苗,发展到目前技术日趋完善的原代地鼠肾细胞、鸡胚细胞、人二倍体细胞和Vero细胞培养的纯化疫苗。早期的神经组织疫苗免疫效果不佳(全程免疫后仍有1‰的死亡病例),且疫苗接种后局部和全身反应严重,由于疫苗中含有动物脑组织的髓磷脂成分,接种后可能引起神经性麻痹反应(变态反应性脑脊髓炎)。WHO于1984年建议停止生产和使用神经组织疫苗,目前各国已陆续停止使用[3, 6, 72]。20世纪60年代起,采用细胞和组织胚胎培养技术生产的狂犬病疫苗(cell culture and embryonated egg-based rabies vaccines,CCEEV)取得了长足发展。由于采用了细胞培养和纯化技术,CCEEV避免了产品中残留动物脑组织、细胞蛋白残留等引起的不良反应,提高了疫苗效价和免疫后抗体水平,减少了注射针次,最大限度降低了免疫失败病例[3]。现已证明,CCEEV可安全有效地预防狂犬病[6]。目前广泛使用的有Vero细胞纯化疫苗、人二倍体细胞疫苗、纯化鸡胚细胞疫苗和原代地鼠肾细胞疫苗等。
人二倍体细胞疫苗(human diploid cell rabies vaccine,HDCV)为美国Wistar研究所首创,随后法国Merieux研究所1974年获得生产许可,经多中心临床人体观察,该疫苗接种后不良反应发生率低、症状轻,免疫效果好。但是人二倍体细胞增殖慢,病毒产量低,疫苗成本高,价格贵,尚不能得到广泛应用[3]。纯化Vero细胞狂犬病疫苗由法国Merieux研究所于1985年获得生产许可,人体观察不良反应轻、效果好,与HDCV有着同样的安全性和效力。而且由于培养的病毒滴度高、疫苗产量大、价格低,在世界范围得到了广泛的应用[3]。纯化鸡胚细胞疫苗和原代地鼠肾细胞疫苗根据不同厂家的临床观察,其不良反应较轻微,免疫效果、安全性和有效性均较好[73, 74]。现代生物技术的发展为新型疫苗的研究提供了更多可能性,比如重组疫苗、DNA(deoxyribonucleic acid)疫苗、多肽疫苗等。但是与纯化细胞疫苗相比,大部分没有优势,个别重组疫苗已应用于野生动物,但目前在人体的研究进展不明。例如,临床实验结果显示,含有病毒G蛋白的痘苗和金丝雀痘病毒载体疫苗接种2剂可产生中和抗体,但抗体水平低于HDCV[72]。
(二)我国人用狂犬病疫苗的历史和现状: 1980年以前,我国一直生产和使用羊脑制备的经石炭酸灭活的脑组织疫苗。1965年,我国开始研制原代地鼠肾细胞培养的原液灭活疫苗,此疫苗须加入氢氧化铝[Al(OH)3]作为佐剂以增加疫苗效力,1980年获生产许可证书,当时以Habel法测定疫苗效力,要求保护指数≥10 000,需皮下注射14针;后改用NIH法测定效价,效价定为1.3 IU/2 ml,免疫程序也改为5针法。Lin等[75]研究显示,该疫苗注射后抗体水平高于羊脑疫苗,对确诊为狂犬病的动物致伤的暴露者有保护作用。由于新疫苗效价仍较低且免疫失败病例频发,卫生部决定改进疫苗生产工艺,将疫苗培养的病毒原液超滤浓缩3~5倍以提高疫苗中抗原含量,使加入氢氧化铝佐剂后的疫苗效价能达到≥2.5 IU的标准。然而,单纯浓缩疫苗在提高效力的同时,由于杂质蛋白残留物含量相应增高,不良反应发生率升高且症状加重,严重不良反应发生率达5%~10%。此后,为改进疫苗的质量特性,引入柱层析等纯化技术去除杂质蛋白[76],疫苗仍然添加氢氧化铝佐剂,NIH法检测效价可达2.5 IU以上,达到了WHO设定的疫苗有效标准。
使用WHO推荐的通用的暴露前“3针法”和暴露后“5针法”,尽管添加氢氧化铝佐剂可以增加免疫效果,但会导致机体免疫应答缓慢,产生中和抗体延迟。由于狂犬病疫苗主要用于暴露后免疫,疫苗诱导免疫的时效性非常重要。2005年,国家食品药品监督管理局要求去除氢氧化铝佐剂。临床研究显示,去佐剂疫苗的早期免疫反应明显高于佐剂疫苗,初次免疫14 d中和抗体阳转率可达100%,且不良反应发生率低[77]。1990年以来,我国研制或引进Vero细胞为基质的纯化狂犬病疫苗大量上市,2014年国产HDCV也批准上市,疫苗种类不断增多,我国目前批准上市的人用狂犬病疫苗种类见表 1。
(三)人用狂犬病疫苗免疫程序的演变:人类最早由路易巴斯德应用感染病毒的干燥兔脊髓悬液的减毒活病毒尝试预防狂犬病,连续注射13针而获得成功。之后研发的灭活神经组织疫苗需连续接种14~21针。随着细胞培养疫苗的出现,疫苗的免疫原性有了较大提高,通过实验不同免疫针次和间隔时间进行抗体应答比较,对于效价高于2.5 IU/剂的细胞培养疫苗可采用简化的接种程序,欧洲率先采用0、3、7、14、28、90 d注射的6针接种程序。随着研究数据的积累发现第6针疫苗的接种并不能显著提高抗体水平,所以改为根据受种者机体的具体情况决定是否接种第6针[20],一般情况下仅需要接种5针。之后,“5针法”被WHO推荐且目前仍在全球广泛应用。1984年,前南斯拉夫的Zagreb公共卫生研究院针对不同种类狂犬病疫苗进行不同间隔接种的免疫程序及优化接种程序的探索研究,结果显示,于0 d(当天)上臂三角肌各接种1剂,7、21 d再分别接种1剂的免疫程序所产生的中和抗体时间较早,且水平也较高,此免疫程序被称为“2-1-1”程序[78]。1992年WHO在狂犬病专家委员会第八次会议中正式推荐应用[79]。美国免疫实施顾问委员会(Advisory Committee on Immunization Practices,ACIP)于2009年在综合已发表文献的基础上,建议健康成年人在规范处置的情况下,可采取原5针免疫程序减少最后1针的方法,即在0、3、7、14 d注射的“简易4针法”免疫程序[80]。
目前,WHO推荐的暴露后免疫肌内注射程序包括“5针法”(Essen法)、“2-1-1”程序(Zagreb法)以及ACIP推荐的“简易4针法”[22]。推荐的暴露前免疫肌内注射方案为3剂疫苗,分别在0、7和21或28 d接种。我国批准上市的狂犬病疫苗的暴露后免疫程序包括“5针法”和“2-1-1”程序两种,各疫苗的免疫程序以国家食品药品监督管理总局批准的疫苗使用说明书为准。
(四)人用狂犬病疫苗的免疫机制、毒株及质量标准:病毒RNA编码核蛋白(N)、M1、M2、病毒包膜糖蛋白(G)和L 五种蛋白,其中 G蛋白是病毒最主要的抗原,可有效刺激特异性辅助性T细胞(helper T,Th)和细胞毒性T细胞(cytotoxic lymphocyte,CTL)增生,并诱导机体产生特异性抗体[81]。G蛋白特异性抗体是狂犬病疫苗最重要的保护性抗体[82],免疫效果主要依赖其抗原表位、结构、蛋白折叠及糖基化等。N蛋白也是一种有效的保护性抗原,能够刺激B细胞和Th细胞诱导产生细胞和体液免疫。磷蛋白(P)可诱导CTL,但保护作用较弱。机体在接种狂犬病疫苗约7 d左右产生IgM(immunoglobulin M)抗体,在约14 d后产生IgG(immunoglobulin G)抗体并迅速升高[83]。IgM和IgG抗体均具有中和病毒的能力[3],有些中和抗体能进入感染狂犬病病毒的神经细胞内抑制病毒复制。CTL的高峰出现在免疫后12 d,可清除中枢神经系统内的病毒,Th细胞可增强抗核蛋白和糖蛋白抗体,也能增加保护效果。但Suss和Sinnecker[84]的研究认为细胞免疫在狂犬病中的作用不明。
由于病毒核蛋白序列高度保守,氨基酸同源性达78%~93%,故病毒之间在核壳体水平上存在着广泛的抗原交叉反应。病毒的主要抗原部位为G蛋白外功能区,当其氨基酸同源性>74%时,病毒之间能够交叉中和,为同一遗传谱系内的病毒;膜外区的氨基酸同源性<62%时,则无交叉中和反应。目前疫苗株均属于遗传谱系Ⅰ,对遗传谱系Ⅱ中的病毒感染不具保护作用[3]。
现已经有十余个种类或基因型的狂犬病病毒属病毒被描述为狂犬病的病原体。目前为止,遗传谱系Ⅰ的RABV是引起人狂犬病的最常见的病毒型别,也是至今应用于狂犬病疫苗生产的唯一病毒种类。故现有疫苗可能无法为遗传谱系Ⅰ外的其他血清型病毒感染提供保护。因此,用于疫苗的病毒种类必须慎重选择。生产用毒种应是在实验室细胞培养适应和减毒,并具有稳定生物学特性的固定毒株,其历史和来源应确证清楚,并经过全面的特征性检定,符合国家相关文件的要求。病毒灭活后制成的疫苗对人体安全且能产生有效的免疫保护作用[3]。WHO推荐用于疫苗生产的病毒固定毒株包括Pasteur Virus、Pitman-Moore、Vnukovo-32、Flury鸡胚细胞低传代株(low egg passage,LEP)和CTN株等[85]。
人用狂犬病疫苗应符合WHO生物制品标准专家委员会(Expert Committee on Biological Standardization,ECBS)制定的指导原则中对疫苗特性、生产及质量控制的要求[85]。用于制备疫苗的细胞基质应来源于健康动物,动物来源品系清楚。根据现行《中国药典》的要求,动物必须是清洁级或以上的动物。所用动物应符合实验动物微生物学和寄生虫学检测要求的相关规定。人二倍体及传代细胞应在限定代次内使用。病毒在细胞(或胚蛋)中增殖后,将收获的病毒进行浓缩、纯化、灭活,加入保护剂冻干而成。细胞培养疫苗的最低效价为在效期内肌肉注射每一剂量达2.5 IU以上,由NIH法检测确定。ELISA检测糖蛋白等其他体外测定方法目前仍处于实验室验证阶段,但该方法已用于生产过程中抗原含量的控制[6]。疫苗需经临床前研究及临床试验,企业需获得国家食品药品监督管理总局批准的生产许可证方可生产疫苗。WHO建议对新申请注册的疫苗,在临床试验中检测0、14、28/30、180、360 d血清中和抗体水平[3]。已经获准生产的人用狂犬病疫苗需按照国家食品药品监督管理总局的要求申请批签发,仅有获得批签发合格证的狂犬病疫苗批次方可上市使用。
(五)疫苗的血清学效果评价:WHO仅推荐小鼠脑内中和试验和荧光灶抑制试验(RFFIT)检测中和抗体,两种方法均可以正确评价疫苗免疫后的中和抗体水平,WHO认为免疫后血清中的病毒中和抗体≥0.5 IU/ml即达到有效保护水平[3]。国内外疫苗的临床研究数据显示,疫苗按暴露后的“5针法”或“2-1-1”等免疫程序接种,大多可在接种后7 d出现中和抗体,14 d时100%抗体阳转。而美国ACIP认为,疫苗暴露后免疫的14~28 d中和抗体滴度已处于峰值,28 d的第5针注射不能使抗体继续升高,因此,推荐美国健康成年人的暴露后免疫采用0、3、7和14 d的4针免疫程序[80]。
1. 暴露前免疫:Morris等[86]的研究显示,接受3针狂犬病疫苗,所有接种者的血清抗体均阳转,但抗体滴度与年龄增长呈负相关。我国使用国产纯化人Vero细胞疫苗按照0、7、21 d各1针的程序进行暴露前免疫,结果显示,受试者血清中和抗体阳转率为100%,几何平均滴度(GMT)为15.87 IU/ml[87]。Sehgal等[88]的研究显示,采用0、7、21 d程序的暴露前免疫血清中和抗体GMT为7.08 IU/ml。
使用HDCV和Vero细胞疫苗分别采用2针(0、28 d)和3针(0、7、28 d)程序进行暴露前初次免疫,结果显示,初次免疫2针组1年后抗体明显下降,但3针组抗体阳性率仍能维持在87.9%~100%,加强免疫1针后14 d抗体水平迅速提高。暴露前程序经加强免疫后抗体可维持较高水平,免疫后3年时仍为12.6 IU/ml,5年时为10.6 IU/ml,第10年至少可维持96%阳性。此外,在满10年时再次加强免疫1针,观察全部对象的抗体滴度几乎又恢复到满1年加强1针后14 d的水平[89]。
2. 暴露后程序:
(1)“5针法”程序的保护性研究:2009年,Rupprecht等[90]对1976-2008年发表的12篇狂犬病疫苗研究进行Meta分析。全部研究共包含1 000名受试者,所有受试者在第1针疫苗免疫后14 d均产生中和抗体,使用细胞培养疫苗进行免疫接种后产生的抗体滴度一般高于10 IU/ml。
王凌云等[91]发现,对2~67岁健康人群按“5针法”免疫程序分别接种国产和进口冻干Vero细胞疫苗,接种后、14 d两种疫苗血清抗体水平无显著性差异,且首剂接种后45 d的抗体阳转率均达100%,14、45 d血清中和抗体GMT均>0.5 IU/ml,两种疫苗间差异无统计学意义。叶茂华等[92]发现,经实验室确诊为狂犬病的犬只咬伤的7例暴露者使用5针法免疫后,全部获得保护。Zhang等[34]一项使用“5针法”免疫的持续5年的疫苗持久性研究显示,接种后产生的中和抗体具有良好持久性及免疫记忆效应。
(2)“2-1-1”程序的保护性研究:Zagreb研究中心的研究结果显示,分别采用HDCV、原代牛肾细胞疫苗、纯化鸡胚细胞疫苗、Vero细胞疫苗按“2-1-1”程序免疫,第7天抗体阳转率分别为65%、38%、83%和78%,14 d时全部阳转,抗体水平达到高峰,GMT为17.0~54.9 IU/ml,继续观察至28 d抗体水平基本保持不变。与0、7、21 d各接种1针相比,抗体水平较高[78]。多项血清学研究显示,与5针程序相比“2-1-1”程序第7天抗体阳转率和血清抗体水平均更高,14和42 d抗体水平无差异[93, 94, 95]。
对于被狂犬咬伤的实际保护效果,Wasi等[93]在泰国进行的一项原代鸡胚细胞纯化疫苗临床观察中,82名确认为被狂犬病动物致伤的暴露者分别采用“6针法”(0、3、7、14、28、90 d各接种一针)和“2-1-1”程序进行免疫接种,根据暴露的严重程度,部分暴露者同时注射狂犬病人免疫球蛋白。两种方法显示出相似的免疫应答,均能快速提供足够的抗体保护。所有暴露者接种后1年100%存活,中和抗体 GMT 仍高于0.5 IU/ml的保护性水平。使用Vero细胞疫苗对100名被狂犬严重咬伤的患者进行“2-1-1”程序免疫,同时注射被动免疫制剂,一年后所有人均存活[96]。国内对于经实验室确认为狂犬病犬只咬伤的暴露者进行Vero细胞疫苗“2-1-1”程序接种并联合应用被动免疫制剂,所有受种者抗体全部阳转,6个月后均存活[97]。
目前对“2-1-1”程序的持久性研究数据有限,Vodopija等[98]在1997年开展的研究中,分别采用人二倍体细胞、鸡胚细胞和Vero细胞纯化狂犬病疫苗进行免疫,第1 100天测血清抗体GMT为0.61~0.97 IU/ml,给予1剂加强后14 d检测血清抗体水平,GMT增高至14.28~28.81 IU/ml 。
3. 特殊人群:Vodopija 等的研究表明,使用原代鸡胚细胞纯化疫苗的“5针法”免疫程序接种无临床症状的HIV感染者,首剂接种后14 d抗体阳转率为64%,30 d为89%。有明显临床症状的艾滋病患者,且CD4T+淋巴细胞数<300 cells/μl者,对狂犬病疫苗免疫应答很差,首剂接种后14 d抗体阳转率仅为25%,30 d仅为42%[99]。对于使用免疫抑制药物的患者,狂犬病疫苗接种后应监测患者是否具有适当的病毒中和抗体应答[99]。妊娠妇女几乎均能对狂犬病疫苗产生正常的免疫应答,且对胎儿不会造成不良影响[100]。对接受器官移植的儿童进行肌内接种免疫反应良好[101]。
4. 疫苗效力及免疫失败: Nicholson[102]估计在发达国家中应用细胞培养疫苗免疫失败率为每80 000人中1例,而发展中国家为每12 000~30 000人中发生1例。
早期最著名的狂犬病疫苗的保护性研究案例之一,是伊朗对45例被狂犬病动物致伤的患者接种6针次疫苗并联合注射抗狂犬病血清,所有接受暴露预防处置者均存活。出于伦理的考虑,对狂犬病疫苗有效性的研究不可能设置安慰剂对照,而仅可通过以往经验和案例记载估算,如不经疫苗免疫,预计有35%的严重致伤者将患狂犬病死亡[103]。后续在德国、美国以及泰国的狂犬严重暴露后免疫研究均得到类似的结果[104, 105]。
绝大多数狂犬病的发病是由于没有接受规范的暴露后预防处置,包括接受暴露后处置较晚,多处咬伤等严重暴露,以及头、颈部咬伤时难以彻底进行伤口清洗等。Krebs等[106]对于28例使用疫苗后仍发病的案例进行回顾性分析发现,90%的病例未应用被动免疫制剂,或者应用方法不当。其他操作失误包括应用疫苗24 h前进行了被动免疫、局部伤口清洗不当、多部位咬伤未发现细小伤口而遗漏处理、疫苗注射部位不正确(如注射臀部而非三角肌)。只有两例为严重面部咬伤的患者,虽进行了被认为正确的暴露后处置仍然发病。
一项使用原代鸡胚细胞纯化疫苗的有效性随访研究共报道46例可疑失败病例,43例发生在印度,3例发生在泰国,分析显示所有案例均未完全执行WHO的暴露预防处置指南[107]。
2007年Wilde[108]研究综合报道了7例失败病例,均经过正确规范的伤口处理和暴露预防处置,并接受HDCV或Vero细胞疫苗及抗血清或人免疫球蛋白注射。免疫失败的原因可能包括①存在不易察觉的微小穿透性损伤,致使伤口未得到冲洗、消毒,局部未注射免疫球蛋白;②伴有未被发现的免疫功能减低性疾病或应用免疫抑制性药物而未报告。
王世清等[109]研究显示,暴露后处置失败率为1.24/万,主要原因为狂犬病被动免疫制剂应用率低,未完成全程接种等。
5. 疫苗安全性:WHO的立场文件中指出[22],不同种类狂犬病疫苗的安全性和耐受性整体较好。不良反应的出现与狂犬病疫苗的纯度、制备工艺、处方成分及剂型有关,并可能与产品各批次间的差异相关。此外,疫苗的使用方式(如肌肉注射或皮内注射)和受种者的个体差异也有影响。据统计,约有35%~45%的受种者接种部位会出现一过性轻微红疹、疼痛和/或红肿,在接种加强针次时尤为显著。5%~15%的受种者曾观察到一过性发热、头痛、头晕、胃肠道症状等轻微全身不良反应,过敏、神经系统症状等严重不良反应罕见。
1997-2005年,据美国疫苗不良事件报告系统(Vaccine Adverse Event Reporting System,VAERS)显示,在鸡胚细胞疫苗的所有不良反应中严重不良反应占7%,主要为神经系统反应和过敏反应,神经系统反应临床表现不一,过敏反应主要表现为荨麻疹、皮疹和血管性水肿[110]。对HDCV安全性和免疫原性的观察中,超过1 770名志愿者中观察到的不良反应如下:严重上臂疼痛(15%~25%);头痛(5%~8%);不适、恶心,或两者兼有(2%~5%);过敏性水肿(0.1%)[111],过敏反应主要发生于加强免疫之后[112]。加强免疫后,全身过敏反应发生率上升至6%[113]。
细胞培养疫苗的神经系统并发症少。在注射HDCV的数百万个体中,共报告发生5例中枢神经系统疾病,包括GBS及急性播散性脊髓炎,不超过疾病的基础发生率,可能与接种疫苗无关。目前大规模使用的Vero细胞疫苗及原代鸡胚细胞纯化疫苗神经系统并发症与HDCV相仿[72]。
国内对国产与进口Vero细胞疫苗安全性对比研究发现,国产疫苗的局部红肿、硬结、疼痛、瘙痒的发生率分别1.4%、0.8%、17.1%和2.4%;发热、皮疹、头痛、疲劳乏力和其他全身反应的发生率分别为1.2%、0.4%、2.4%、4.2%和0.3%,上述不良反应均在第7天完全消失,与进口疫苗的安全性基本一致[91]。对于肌肉接种和皮内接种的不良反应发生率比较,有部分研究显示二者差异无统计学意义,但也有研究显示皮内接种的不良反应发生率高于肌肉接种,主要表现为局部红斑、疼痛和肿胀,但总体来讲反应较轻微。目前的研究表明,“2-1-1”程序与“5针法”程序比较,不良反应发生率的差异无统计学意义[114, 115]。
研究表明,孕妇接种狂犬病疫苗是安全的,并且不会对胎儿造成影响。对202名孕妇接种Vero细胞狂犬病疫苗的观察发现[116, 117, 118],孕妇的不良反应发生率与非孕妇的差异无统计学意义,国内大量研究的结论与上述观点一致[119, 120, 121, 122, 123]。
(六)暴露前及暴露后预防成本效益评价:国外对于暴露后预防成本效益的相关评价,由于研究地区的自然、社会和经济条件不同,得到的结论也不尽相同。Chulasugandha等[124]关于泰国儿童暴露前预防与暴露后预防的成本比较发现,当犬咬伤率达到2%~30%时,对于儿童采取暴露前免疫和暴露后免疫的预防成本一致,具体取决于应用何种暴露后程序。
美国的研究表明,当感染狂犬病的可能性>0.7%时,暴露后免疫是经济的。对于低风险区,避免1例发病的成本在50万至100万美元,具体数额取决于风险程度[124, 125, 126]。
Shim等[127]在坦桑尼亚的研究显示,每伤残调整生命年(disability adjusted life year,DALY)医疗花费为27美元,政府花费为32美元。成本效益较低,但对于1%的真正暴露于狂犬病的人群来说,非常符合成本效益原则。
国内学者周世红和李晓松[128]通过建立暴露前及暴露后预防方案的狂犬病发病(死亡)及成本的决策树模型,进行成本效果分析和敏感性分析。在每10万人中,暴露前预防可避免12人发病,暴露后预防可避免8人发病,暴露前预防避免1例发病的成本为273.34 万元,暴露后预防避免1例发病的成本为19.60万元,前者为后者的14倍。王传林等[129]对暴露后5针程序和“2-1-1”程序进行经济成本分析,测算直接医疗成本、直接非医疗成本和间接成本,两种程序的就医成本分别为694 元、482.2 元,每名患者节省超过210元,按每年暴露后接种疫苗1 400万人计算,采用“2-1-1”程序,全国的就医总成本将节约29.63 亿元。
五、被动免疫制剂WHO狂犬病专家咨询委员会建议[6],对于狂犬病病毒Ⅲ级暴露者,应在接种疫苗的同时对伤口进行彻底清洗并在周围浸润注射被动免疫制剂,即人狂犬病免疫球蛋白或马源抗狂犬病血清,以阻止病毒进入神经组织从而获得快速保护作用。另外,对于免疫功能严重低下的暴露者,即使Ⅱ级暴露,也应联合应用被动免疫制剂。
(一)被动免疫制剂的种类:目前国际上狂犬病被动免疫制剂可分为马源免疫球蛋白(equine rabies immune globulin,ERIG)、马源纯化F(ab’)2片段制品和人源免疫球蛋白(human rabies immune globulin,HRIG) 3种,前两种在国内习惯上沿用“马抗狂犬病血清”的名称(equine rabies antiserum,ERA)。我国被批准上市的为马源纯化F(ab’)2片段制品和HRIG。依据现行《中国药典》标准,HRIG产品效价标准为不低于100 IU/ml,而ERIG产品效价标准为不低于200 IU/ml[130]。
HRIG是采集经人用狂犬病疫苗免疫的人的血浆,采用低温乙醇蛋白分离或其他经批准的分离制造工艺获得的抗狂犬病免疫球蛋白(IgG)。马源纯化F(ab’)2片段制品为采用不含人源成分的狂犬病病毒抗原免疫马匹后采集血浆,采用硫酸铵盐析方法获得ERIG,在ERIG基础上经胃蛋白酶水解切除Fc段保留完整的F(ab’)2并高度纯化所得。ERIG因其来源相对方便和经济,国内早期暴露后的被动免疫制剂以此产品为主。目前的马源制品均为胃蛋白酶水解制备的F(ab’)2片段,并改进了纯化方法,以尽量提高制剂的比活性。国内外马抗狂犬病血清的总蛋白含量标准均为≤17 g/100 ml,国内产品的纯度往往在10 g/100 ml 左右[131],其中F(ab’)2片段含量不低于60%,完整IgG的含量不高于5%。国内ERA制品的总蛋白含量绝对值仍须进一步降低,以减少或减轻人体使用后可能引起的异源蛋白所致的不良反应(如血清病、过敏性休克等);其另一个缺点是由于在人体内半衰期较短,因此所需注射剂量比HRIG高,增加了不良反应的风险。与此相对,HRIG由于无异源蛋白反应风险,故不良反应率较低,但其缺点是需要不断从加强免疫的健康人群中获得,来源相对困难,价格昂贵。两者的优缺点比较见表 2所示。
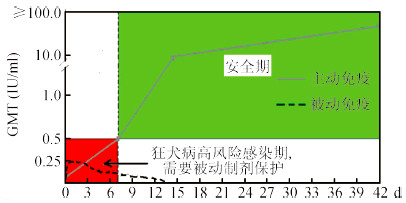
(二)被动免疫制剂的作用机制:抗狂犬病血清作为狂犬病病毒的特异性被动免疫制剂,无需机体免疫应答过程就能够对狂犬病病毒进行即时中和。其主要作用为在疫苗诱导机体产生有效抗体之前,在患者暴露部位立即提供所需的中和抗体,其作用迅速但短暂。而疫苗诱导产生抗体虽需1~2周的时间,但抗体可持续存在数年。从图 3可以看出狂犬病疫苗暴露后免疫程序启动后分别在0、3、7、14、28 d诱导产生的抗体滴度变化趋势(实折线),在第一针疫苗注射后至机体产生足量抗体(≥0.5 IU/ml)之前(主动免疫诱导的保护力空白区或称高风险感染期),被动免疫制剂可为该高风险时段提供免疫保护。在高风险感染期伤口周围浸润注射的被动免疫制剂可使伤口局部获得高浓度的中和抗体,阻断病毒在伤口中的扩散。值得注意的是,伤口周围浸润注射的中和抗体并不会令外周循环中的抗体水平明显增高(图 3中虚折线),外周循环中的中和抗体水平增高主要依赖于疫苗注射后产生的主动免疫保护。因此,该阶段被动免疫制剂的浸润注射对疫苗所提供的主动免疫保护所产生的干扰并不严重,但首剂疫苗注射7 d后,机体已产生较高水平的中和抗体,此时再注射被动免疫制剂已无意义。
(三)被动免疫制剂的保护效果:根据WHO狂犬病专家咨询委员会建议,原卫生部颁布的《狂犬病暴露预防处置工作规范(2009年版)》以及狂犬病疫苗使用说明书等相应规定,Ⅲ级暴露即一处或多处皮肤出血性咬伤或被抓伤出血,或被不能确定健康状况的动物唾液污染黏膜,应按暴露后程序在彻底清洗伤口的基础上立即接种疫苗并注射ERA或HRIG。ERA按40 IU/kg给予,HRIG按20 IU/kg给予,将被动制剂尽可能多的在咬伤局部浸润注射,剩余部分肌肉注射。对于艾滋病患者等免疫力低下人群,WHO专家建议即使是Ⅱ级暴露也应联合使用被动免疫制剂。
被动免疫制剂的正确使用十分重要。基本原则是首先在受伤部位局部进行浸润注射,可直接中和刚进入体内的病毒,构建阻遏病毒从伤口向周边神经组织蔓延的第一道屏障。国内很多暴露后免疫失败病例,是因未联合使用被动免疫制剂或使用方法不当造成的。Khawplod等[132]研究指出,已单独使用疫苗,而未能及时使用被动免疫制剂的Ⅲ级暴露者,在7 d内仍应考虑给予被动免疫制剂,其主要依据为在此期间内机体对疫苗的主动免疫保护尚未产生,而局部伤口的浸润注射对于使用疫苗后机体主动免疫产生的影响较小。
抗狂犬病被动免疫制剂的应用最早可追溯到1891年,当时即有报道采用疫苗免疫的人全血治疗被疯狼严重咬伤者。此后采用抗血清治疗暴露后病例的案例时有报道,但疗效无法肯定。WHO狂犬病专家咨询委员会通过现场观察肯定了疫苗与被动免疫制剂的联合应用效果。1954年在伊朗一起疯狼咬伤18人的事件中,5人仅单用疫苗治疗,最终3人患狂犬病死亡;而暴露程度相似的另外13人采用疫苗联合抗血清治疗,最终仅1人患病死亡。伊朗一项为期17年的调查显示,单纯用狂犬病疫苗的298名重伤患者病死率为25%,而在疫苗联合抗血清处置的364名重伤患者病死率仅为5.3%[3]。对感染狂犬病病毒的动物模型的研究也发现,尽管均接种狂犬病疫苗,但是否联用抗狂犬病被动免疫制剂的保护效果存在显著性差异。
我国已有多起关于疫苗与被动免疫制剂联合应用效果自然对照的报告。1981年和1982年先后报告两起狂犬病动物伤多人事件,暴露者共58人,重伤者中单纯应用疫苗的3人均发病死亡,而及时采用疫苗联合马抗狂犬病血清治疗的26人均存活。2004年,江西省景德镇一只狂犬咬伤29人,其中Ⅲ级暴露12人,1人未接种疫苗和抗血清发病死亡,而另外11人采用疫苗和被动免疫制剂联合处置后全部存活。2010年报告的一起狂犬咬伤多人面部事件中,单纯采用疫苗治疗的暴露者发病死亡,而其余暴露者采用联合被动免疫制剂治疗后均存活[3]。
由此可见,在疫苗初次免疫接种后的有效中和抗体产生前的窗口期,采用被动免疫制剂联合治疗至关重要,Ⅲ级暴露者尤甚。
(四)被动免疫制剂的安全性:最早上市的抗狂犬病被动免疫制剂为马抗狂犬病血清,因血清病发生率高达40%,美国于1965年停止了该抗血清的使用。目前应用的马抗狂犬病血清为利用胃蛋白酶切除ERIG免疫球蛋白Fc段,通过纯化提高制剂中F(ab’)2纯度并降低其他血清蛋白成分及过敏物质含量的纯化制剂。部分马抗狂犬病血清制剂有引起血清病的风险,取决于其总蛋白质含量。一项对使用者的研究发现,ERIG制剂血清病的发生率从0.82%至6.19%不等。与ERIG相比,纯化的F(ab’)2制剂血清病发生率大幅降低,且大部分为轻症病例。尽管F(ab’)2制剂安全性较好,但由于无法完全除去异性蛋白,仍然不能排除引起个别敏感者出现不良反应的风险。与马抗狂犬病血清相比,HRIG则不存在因异源蛋白等因素而导致过敏的风险,不良反应发生率相对更低。其存在的另一个问题就是因其来源于人,理论上具有传播血源性病原体的潜在风险。因此在HRIG制品的生产工艺中除采用低温乙醇法外还增加了严格的病毒灭活/去除工艺。国内大量的实验和资料证实,目前国内外上市的HRIG具有很高的安全性。
(五)经济成本与研究进展:对HRIG的经济学研究很少。由于诱导免疫的疫苗成本、人体免疫应答的时间成本以及免疫供血员的人力成本等因素,HRIG的生产成本非常高。加之HRIG要求血清抗体滴度不低于10 IU/ml,对其产量造成限制,故HRIG的价格较为昂贵。马抗狂犬病血清生产成本相对低廉,价格一般为HRIG的十分之一,对于发展中国家,ERIG不失为一种安全、有效的产品。但基于综合因素考虑,美国免疫实施咨询委员会(ACIP)仍优先推荐HRIG。
鉴于上述被动免疫制剂供应量有限,价格偏高,且存在血清病类过敏反应和血源传播疾病的潜在风险,目前,狂犬病治疗性单克隆抗体研究已取得较大进展。如2005年Bakker小组获得高亲和活性的人源化单抗-McABCR57[133]。Sun等[134]也已成功研发多株具有中和活性的人源化狂犬病治疗性单抗。依据WHO建议,抗狂犬病单克隆抗体制剂应将针对病毒不同抗原位点的多株单抗组合成“鸡尾酒式”组合制剂,以保证单抗制剂对不同病毒株或病毒的不同基因型的有效性[135]。但上述人源化治疗性单克隆抗体离正式商品化尚有一定距离。
六、人间狂犬病的预防建议(一)暴露前预防:
1. 基础免疫:所有持续、频繁暴露于RABV危险环境下的个体均推荐进行暴露前预防性狂犬病疫苗接种,如接触RABV的实验室工作人员、可能涉及狂犬病患者管理的医护人员、狂犬病患者的密切接触者、兽医、动物驯养师以及经常接触动物的农学院学生等。此外,建议到高危地区旅游的游客、居住在狂犬病流行地区的儿童或到狂犬病高发地区旅游的儿童进行暴露前免疫[6]。
●免疫程序:第0天、第7天和第21天(或第28天)分别接种1剂,共接种3剂。
●接种途径、部位和剂量:肌肉注射。2岁及以上儿童和成年人于上臂三角肌注射;2岁以下儿童于大腿前外侧肌注射。禁止在臀部肌肉注射。每剂0.5 ml或1.0 ml(具体参照产品规格或产品说明书)。
2. 加强免疫:如出于暴露前预防的目的,则已接受全程基础免疫者无需定期进行加强免疫。定期加强免疫仅推荐用于因职业原因存在持续、频繁或较高的狂犬病病毒暴露风险者(如接触RABV的实验室工作人员和兽医)。
●免疫程序:接触RABV的实验室人员每6个月监测一次血清中和抗体水平;兽医、动物疫控部门等每2年监测一次血清中和抗体水平。当血清中和抗体水平<0.5 IU/ml时需加强接种1剂。
●接种途径、部位和剂量:肌肉注射。2岁及以上儿童和成年人于上臂三角肌注射;2岁以下儿童可在大腿前外侧肌注射。每剂0.5 ml或1.0 ml(具体参照产品规格或产品说明书)。
3. 使用禁忌:对于暴露前预防,对疫苗中任何成分曾有严重过敏史者应视为接种同种疫苗的禁忌症。妊娠、患急性发热性疾病、急性疾病、慢性疾病的活动期、使用类固醇和免疫抑制剂者可酌情推迟暴露前免疫。免疫缺陷者不建议进行暴露前免疫,如处在狂犬病高暴露风险中,亦可进行暴露前免疫,但完成免疫接种程序后需进行中和抗体检测。对一种品牌疫苗过敏者,可更换另一种品牌疫苗继续原有免疫程序。
(二)暴露后预防:
1. 暴露的定义与分级:狂犬病暴露是指被狂犬、疑似狂犬或者不能确定是否患有狂犬病的宿主动物咬伤、抓伤、舔舐黏膜或者破损皮肤处,或者开放性伤口、黏膜直接接触可能含有狂犬病病毒的唾液或者组织。此外,罕见情况下,可以通过器官移植或吸入气溶胶而感染狂犬病病毒。
按照暴露性质和严重程度将狂犬病暴露分为三级[6, 18, 19, 22]。
Ⅰ级暴露(符合以下情况之一者):①接触或喂养动物;②完好的皮肤被舔;③完好的皮肤接触狂犬病动物或人狂犬病病例的分泌物或排泄物。
Ⅱ级暴露(符合以下情况之一者):①裸露的皮肤被轻咬;②无出血的轻微抓伤或擦伤。首先用肉眼仔细观察暴露处皮肤有无破损;当肉眼难以判断时,可用酒精擦拭暴露处,如有疼痛感,则表明皮肤存在破损(此法仅适于致伤当时测试使用)。
Ⅲ级暴露(符合以下情况之一者):①单处或多处贯穿皮肤的咬伤或抓伤(“贯穿”表示至少已伤及真皮层和血管,临床表现为肉眼可见出血或皮下组织);②破损皮肤被舔舐(应注意皮肤皲裂、抓挠等各种原因导致的微小皮肤破损);③黏膜被动物唾液污染(如被舔舐);④暴露于蝙蝠(当人与蝙蝠之间发生接触时应考虑进行暴露后预防,除非暴露者排除咬伤、抓伤或黏膜的暴露)。
2. 暴露后处置:见表 3。包括①尽早进行伤口局部处理;②尽早进行狂犬病疫苗接种;③需要时,尽早使用狂犬病被动免疫制剂(HRIG、抗狂犬病血清)。
判定暴露级别后,根据需要应尽快进行伤口处理;在告知暴露者狂犬病危害及应当采取的处置措施并获得知情同意后,采取相应处置措施:①判定为Ⅰ级暴露者,无需进行处置;②判定为Ⅱ级暴露者,应立即处理伤口,并按相关规定进行狂犬病疫苗接种(参见下文疫苗接种及再次暴露后处置中疫苗接种的内容);③判定为Ⅲ级暴露者,应立即处理伤口,并按照相关规定使用狂犬病被动免疫制剂,并接种狂犬病疫苗(参见下文疫苗接种、再次暴露后处置中疫苗接种及被动免疫制剂的内容)。
(1)伤口的外科处置:暴露后处置有两个主要目标,一是预防狂犬病的发生,二是预防伤口发生继发细菌感染,促进伤口愈合和功能恢复。对于Ⅱ级和Ⅲ级暴露,彻底的伤口处理是非常重要的。伤口处理包括对伤口内部进行彻底的冲洗、消毒以及后续的外科处置,这对于预防狂犬病发生,避免继发细菌感染具有重要意义[6, 18, 136]。伤口处理包括对每处伤口进行彻底的冲洗、消毒以及后续的外科处置。局部伤口处理越早越好。如清洗或消毒时疼痛剧烈,可先给予局部麻醉。
①伤口冲洗:用肥皂水(或其他弱碱性清洗剂)和一定压力的流动清水交替清洗咬伤和抓伤的每处伤口至少15 min。如条件允许,建议使用狂犬病专业清洗设备和专用清洗剂对伤口内部进行冲洗。最后用生理盐水冲洗伤口以避免肥皂液或其他清洗剂残留[6, 31, 37, 137, 138]。
②消毒处理:彻底冲洗后用稀碘伏(0.025%~0.05%)[130]、苯扎氯铵(0.005%~0.01%)[139]或其他具有病毒灭活效力的皮肤黏膜消毒剂消毒涂擦或消毒伤口内部。
③外科处置:在伤口清洗、消毒,并根据需要使用狂犬病被动免疫制剂至少2 h后,根据情况进行后续外科处置[6]。外科处置要考虑致伤动物种类、部位、伤口类型、伤者基础健康状况等诸多因素。
普通创伤伤口相比,动物致伤伤口具有病情复杂、软组织损伤严重、合并症多、细菌感染率高等特点,目前尚无统一的外科处置规范[139, 140]。且动物咬伤涉及骨科、耳鼻咽喉科、眼科、整形外科、普通外科、泌尿外科等多个临床专业,各专业在开放伤口处置上均有各自的原则或规范。因此,严重、复杂的动物咬伤伤口的后续外科处置,最好由专科医生或在专科医生协助下完成。
●外科清创术:所有严重的咬伤伤口(如撕裂伤、贯通伤、穿刺伤等)均需进行彻底的外科清创术。术前要根据伤口部位、手术大小及方式等选择合适的麻醉方式(如局部麻醉、区域麻醉、复合麻醉或全身麻醉),手术按照标准的外伤清创术原则进行[141]。
●组织修复:咬伤所导致的重要器官、组织(如:神经、肌腱、骨、关节、血管等)损伤,应根据受损器官组织的具体情况(如受损程度、感染可能性、修复难度等)、相应专科的处置原则,选择进行Ⅰ期修复、Ⅱ期修复或延期修复。
●关闭伤口及抗生素使用:伤口是否进行Ⅰ期闭合以及是否预防性使用抗生素要考虑众多因素,如就诊时间、伤口严重程度、伤口部位、致伤动物、伤口类型、伤者基础健康状况(年龄和基础疾病,如糖尿病、免疫功能受损及长期使用免疫抑制剂、激素等)以及医生对动物咬伤伤口处置的经验等[30, 32, 38, 142, 143, 144, 145, 146, 147, 148, 149]。上述因素均可影响伤口继发细菌感染的风险。
暴露于犬、啮齿类动物,以及位于头面部、口腔黏膜的浅表、清洁、新鲜伤口[37, 39, 40, 41, 42, 43, 150, 151]属于继发感染的低危因素。而暴露于猫、灵长类、猪等动物;位于手、足、胫前、关节部位的穿刺伤、贯通伤、大面积撕裂伤、大面积皮肤软组织缺损伤口;老年患者或合并糖尿病、外周血管病、应用激素及免疫抑制剂、免疫性疾病、营养不良、放化疗等基础疾病等均属继发细菌感染的高危因素。存在感染高危因素者尽量避免Ⅰ期缝合,可用透气性敷料覆盖创面,3~5 d后根据伤口情况决定是否进行延期缝合或Ⅱ期缝合,必要时可以预防性使用抗生素。
早期许多文献建议对伤者常规预防性使用抗生素[32, 142]。近些年的文献报道显示,预防伤口感染的关键在于尽早进行彻底的伤口清洗、清创及伤口闭合或覆盖。及时正确的伤口处理可显著降低咬伤伤口的细菌感染率[143, 144, 145, 146, 147]。文献研究提示,对于细菌感染低危者,在对伤口进行彻底清洗、消毒和清创后,与Ⅱ期、延期闭合伤口或伤口保持开放相比,Ⅰ期闭合伤口并不增加伤口的感染率,且缩短了伤口愈合时间,愈合后瘢痕更小[30, 32, 140, 141]。也有许多研究显示,常规预防性使用抗生素并未令咬伤患者受益[152, 153, 154, 155]。
不推荐对所有的Ⅲ级咬伤病例预防性使用抗生素,对存在感染高危因素或已出现伤口感染的病例可预防性或治疗性使用抗生素。抗生素最好根据伤口分泌物的细菌培养及药物敏感试验结果选择,推荐使用含有β-内酰胺酶抑制剂的β-内酰胺类抗生素、头孢洛林酯和第四代喹诺酮类抗生素[37, 39, 40, 41, 42, 43, 150, 151, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166]。
●存在感染高风险因素者的处置:伤口内应放置引流条或引流管,以利于伤口污染物及分泌物的排出。伤口较大时,为避免继发感染,可用透气性敷料覆盖创面。如必须缝合,应采取松散稀疏的缝合方式,以便于继续引流。如果就诊时伤口已缝合,原则上不主张拆除。若缝合前未浸润注射被动免疫制剂,仍应在伤口周围浸润注射被动免疫制剂。存在感染高风险因素者,应根据伤口状况、伤者基础免疫情况(破伤风类毒素)、距离最后接种时间等,酌情进行抗破伤风免疫预防处置。
(2)疫苗接种:应用人群为Ⅱ级和Ⅲ级暴露者;接种程序为“5针法程序”(第0、3、7、14和28天各接种1剂,共接种5剂)或“2-1-1”程序 [第0天接种2剂(左右上臂三角肌各接种1剂),第7天和第21天各接种1剂,共接种4剂(此程序只适用于我国已批准可以使用“2-1-1”程序的狂犬病疫苗产品)];采用肌肉注射(2岁及以上儿童和成年人上臂三角肌注射;2岁以下儿童可在大腿前外侧注射),每剂0.5 ml或1.0 ml(具体参照产品规格或产品说明书)。
●使用禁忌:狂犬病为致死性疾病,暴露后狂犬病疫苗使用无任何禁忌,但接种前应充分询问受种者个体基本情况(如有无严重过敏史、其他严重疾病等)。即使存在不适合接种疫苗的情况,也应在严密监护下接种疫苗。如受种者对某一品牌疫苗的成分有明确过敏史,应更换无该成分的疫苗品种。
●接种延迟:狂犬病疫苗接种应当按时完成全程免疫,按照程序正确接种对机体产生抗狂犬病的免疫力非常关键,如某一针次延迟一天或数天注射,其后续针次接种时间按原免疫程序的时间间隔相应顺延[167]。
●疫苗品牌更换:尽量使用同一品牌狂犬病疫苗完成全程接种。若无法实现,可使用不同品牌的合格狂犬病疫苗继续按原程序完成全程接种,原则上不建议就诊者携带狂犬病疫苗至异地注射[167]。
(3)被动免疫制剂注射:狂犬病被动免疫制剂的作用机制是在主动免疫诱导的保护力空白区,通过在暴露部位即刻提供所需的中和抗体,中和伤口处理时残留在伤口内部的病毒,发挥快速保护效果[6, 20, 22]。所有首次暴露的Ⅲ级暴露者,以及患有严重免疫缺陷、长期大量使用免疫抑制剂、头面部暴露的Ⅱ级暴露者均应使用狂犬病被动免疫制剂。被动免疫制剂应尽早使用,最好在伤口清洗完成后立刻开始。如未能及时注射,在第一剂狂犬病疫苗接种后的7 d内均可使用。7 d后疫苗引起的主动免疫应答反应已经出现,此时再使用被动免疫制剂意义不大。
狂犬病被动免疫制剂应严格按照体重计算剂量,一次性足量使用。HRIG按照每公斤体重20 IU,ERA按照每公斤体重40 IU计算。如所用总剂量不足以浸润注射全部伤口,可用生理盐水适当稀释。ERA注射前必须严格按照产品说明书进行过敏试验。
如果解剖结构允许(但应避免因注射引起骨筋膜室综合征),应当按照计算剂量,仔细地将狂犬病被动免疫制剂全部浸润注射到伤口周围,所有伤口无论大小均应进行浸润注射,当全部伤口进行浸润注射后尚有剩余时,应将其注射到远离疫苗注射部位的肌肉(建议腰部以上注射到伤口同侧的后背肌群,腰部以下注射到伤口同侧的大腿中段外侧肌群)[6, 20, 22]。不得把狂犬病被动免疫制剂和狂犬病疫苗注射在同一部位;禁止用同一注射器注射狂犬病疫苗和狂犬病被动免疫制剂。
对于黏膜暴露者,可将狂犬病被动免疫制剂滴/涂在黏膜上。如果解剖学结构允许,也可进行局部浸润注射。剩余狂犬病被动免疫制剂参照前述方法进行肌肉注射。
3. 再次暴露后的处置:
(1)伤口处理:任何一次暴露后均应及时进行规范的伤口处理(参见上文伤口的外科处置内容)。
(2)疫苗接种:对于再次暴露后狂犬病疫苗接种程序争议较大。2010年WHO立场性文件建议[22]:如能证实暴露者曾接受过暴露前或暴露后全程免疫,则在第0天和第3天各肌肉接种1剂狂犬病疫苗,共接种2剂。该方案也同样适用于接种过狂犬病疫苗,且狂犬病病毒中和抗体滴度≥0.5 IU/ml者。2013年WHO更新的《狂犬病专家磋商会(第2版报告)》中建议[6]:对于曾接受过全程暴露前或暴露后预防接种者,在接种完成3个月内发生暴露或再暴露,如致伤动物健康且已被免疫,并能进行10日观察,则在确保给予正确伤口处理的前提下,可推迟加强免疫。使用神经组织疫苗等效力不确定的疫苗(无论是否曾接受过全程免疫)、以及未接受过全程暴露前或暴露后预防接种的Ⅲ级暴露者,均应再次接受全程暴露后免疫和被动免疫制剂注射。
因此,结合WHO两个文件,本指南建议:①对于曾经接受过疫苗全程接种者,如3个月内再次暴露,在符合2013年WHO报告中提及的各项条件时,可推迟加强免疫;②超过3个月以上再次暴露者,需第0天和第3天各接种1剂疫苗;③若使用了效力不确定的疫苗、之前未全程接种或暴露严重的Ⅲ级暴露者,在再次暴露后则需全程进行疫苗接种。
此外,也可采用我国现行药典和《狂犬病暴露预防处置工作规范(2009年版)》中的建议[130, 167]。
(3)被动免疫制剂:按暴露前或暴露后程序完成了全程狂犬病疫苗接种者,以后均无需使用被动免疫制剂。
4. 不良反应的临床处置:
(1)人用狂犬病疫苗:
●常见的不良反应:①局部反应:接种疫苗后24 h内,注射部位可出现红肿、疼痛、发痒,一般不需处理即可自行缓解;②全身性反应:可有轻度发热、无力、头痛、眩晕、关节痛、肌肉痛、呕吐、腹痛等,一般不需处理即可自行消退。
●罕见不良反应:①中度以上发热反应:可先采用物理降温方法,必要时可以使用解热镇痛剂;②过敏性皮疹:接种疫苗后72 h内出现荨麻疹,出现反应时,应及时就诊,给予抗过敏治疗。
●极罕见不良反应:包括过敏性休克、过敏性紫癜和血管神经性水肿。
过敏性休克:一般在注射疫苗后数分钟至数十分钟内发生。患者突然出现典型休克表现,如:出汗、面色苍白、脉速而弱,四肢湿冷、发绀,烦躁不安、意识不清或完全丧失,血压迅速下降乃至测不出,脉搏消失,甚至导致心跳停止;在休克出现之前或同时,可伴有一些过敏相关的症状,如:皮肤潮红、瘙痒,继而出现广泛的荨麻疹和(或)血管神经性水肿;还可出现喷嚏、水样鼻涕、声音嘶哑等;发生喉头水肿和(或)支气管痉挛时,可出现咽喉堵塞感、胸闷、气急、喘鸣、憋气、发绀等;其他较常见的症状还可能有刺激性咳嗽、连续打嚏、恶心、呕吐、腹痛、腹泻,严重者可出现大小便失禁。
急救处理:由于死亡可发生于几分钟内,因此迅速处理十分重要。开始治疗的关键是维持呼吸道通畅和保持有效血液循环,尤其强调肾上腺素的紧急使用。①患者斜卧,双脚抬高,确保气道开放,给氧。如果出现威胁生命的气道阻塞,立即进行气管插管。②肾上腺素1:1 000(0.01 mg/kg),0.01~0.3 mg/kg肌肉注射,如果需要可每15 min重复一次。③如果出现低血压或对起始的肾上腺素剂量无反应静脉给入1:10 000肾上腺素0.01 mg/kg(0.1 mg/kg);静脉给入生理盐水20 ml/kg;如果低血压持续存在,予肾上腺素2~4 μg·kg-1·min-1或多巴胺2~10 μg·kg-1·min-1持续静脉滴注以维持血压。④甲基泼尼松龙 1~2 mg/kg 静脉注射,最大量125 mg,每小时4~6次,或泼尼松1~2 mg/kg 口服,最大量80 mg。⑤监测生命指征,因有些患儿呈双向性表现形式,因此应观察至少8~12 h,如为严重反应或有哮喘病史,则应观察至少24 h。临床表现严重者需住院治疗[168]。
过敏性紫癜:出现过敏性紫癜时应及时就诊。
一般治疗:急性期卧床休息。要注意出入液量、营养及保持电解质平衡。有消化道出血者,如腹痛不重,仅大便潜血阳性者,可用流食。如有明显感染,应给予有效抗生素。注意寻找和避免接触过敏原。
对症治疗:有荨麻疹或血管神经源性水肿时,应用抗组织胺药物和钙剂;近年来又提出用H2受体阻滞剂西米替丁20~40 mg·kg-1·d-1,分二次加入葡萄糖溶液中静脉滴注,1~2周后改为口服,15~20 mg·kg-1·d-1,分3次服用,继续应用1~2周。有腹痛时应用解痉挛药物,消化道出血时应禁食。
抗凝治疗:本病可有纤微蛋白原沉积、血小板沉积及血管内凝血的表现,故近年来有使用肝素的报道,剂量为肝素钠120~150 U/kg加入10%葡萄糖溶液100 ml中静脉滴注,每日1次,连续5 d,或每次肝素钙10 U/kg,皮下注射,每日2次,连续7 d。也有推荐使用尿激酶2 500 U/kg。
其他抗血小板凝集药物包括阿司匹林3~5 mg·kg-1·d-1或25~50 mg·kg-1·d-1,每日一次口服;潘生丁3~5 mg·kg-1·d-1,分次服用。
其他治疗:单独皮肤或关节病变时,无须使用肾上腺皮质激素。以下几种情况是用激素的指征:①有严重消化道病变,如消化道出血时,可服泼尼松1~2 mg·kg-1·d-1,分次口服,或用地塞米松、甲基泼尼松龙静脉滴注,症状缓解后即可停用;②表现为肾病综合征者,可用泼尼松1~2 mg·kg-1·d-1,不短于8周;③急进性肾炎可用甲基泼尼松龙冲击治疗,剂量同狼疮性肾炎,如激素治疗无效者,可加用环磷酰胺等免疫抑制剂;④有肾功能衰竭时,可采用血浆置换及透析治疗;⑤对严重病例可用大剂量丙种球蛋白冲击治疗,剂量为400 mg·kg-1·d-1,静脉滴注,连用2~3 d;对急进性肾炎可进行血浆置换疗法[168]。
血管神经性水肿:可应用抗组织胺药物治疗,必要时可联合使用糖皮质激素类药物(如甲泼尼龙琥珀酸钠)给予抗过敏治疗[113, 168, 169, 170, 171, 172, 173]。
(2)抗狂犬病血清:发生率约1%~3%,主要症状为荨麻疹、发热、淋巴结肿大、局部水肿,偶有蛋白尿、呕吐、关节痛,注射部位可出现红斑、瘙痒及水肿,一般在注射后7~14 d发病,称为延缓型;亦有在注射后2~4 d发病者,称为加速型[174, 175]。治疗主要是对症处理和抗组织胺药物治疗,必要时可联合使用糖皮质激素类药物(如甲泼尼龙琥珀酸钠)和钙剂给予抗过敏治疗。一般数天至十余天可痊愈。
(3)HRIG:一般无不良反应,少数患者在注射后出现局部红肿、疼痛,一般不需处理即可自行缓解。极罕见有血管神经性水肿、皮疹及过敏性休克者,治疗同上[176]。
5. 狂犬病暴露预防处置服务实施:
(1)门诊配置:对于需要进行狂犬病暴露预防处置的对象建议前往获得当地卫生行政部门资质认证的暴露预防处置门诊或当地卫生行政部门指定并向大众公布的、具备疫苗接种资质的接种点接受暴露预防处置。建议狂犬病暴露预防处置门诊悬挂专用标志,消毒设备需齐全,尽量设置“注射室”、“处置室”、“候诊区”、“观察区”等区域,并配备冰箱、伤口冲洗设备、抢救药品和体检设备等。门诊工作人员建议配备具有一定外伤处置工作经验的医务人员,并在上岗前经过相关知识培训并考核认证。
(2)管理制度:包括①卫生宣传制度:建议暴露处置门诊内悬挂狂犬病防治知识的宣传图画,张贴或悬挂狂犬病免疫接种程序等相关信息。②登记报告制度:建议暴露处置门诊应建立预防接种卡和登记簿,做好门诊登记,并及时上报各种报表。③知情同意制度:建议门诊医生应向暴露者介绍狂犬病暴露预防处置流程,说明常见的接种反应以及其他的注意事项。无论暴露者是否接受注射疫苗和/或被动免疫制剂,均须暴露者本人或其家属签字。
(3)生物制品管理:建议狂犬病暴露处置门诊应建立真实、完整的购进、分发、供应狂犬病疫苗及其被动免疫制剂的记录,包括通用名称、生产企业、剂型、规格、批号、有效期、批准文号、(购销、分发)单位、数量、价格、(购销、分发)日期、产品包装以及外观质量、储存温度、运输条件、批签发合格证明编号或者合格证明、验收结论、验收人签名等。
狂犬病疫苗和抗狂犬病血清/HRIG应储存于2~8 ℃专用冰箱内,建议上、下午各进行一次温度记录,发现设备问题及时维修,确保疫苗质量;疫苗带出时应置冷藏包装内。在领取和使用过程中,建议做好疫苗领用登记记录,每次门诊日接种工作结束,对疫苗的数量进行核点。
(4)疫苗不良反应监测:建议各级疾控部门和接种单位做好狂犬病疫苗的不良反应监测工作,一旦出现不良反应或事件应及时启动疑似预防接种异常反应(adverse event following immunization,AEFI)监测工作,并按照《全国疑似预防接种异常反应监测方案要求》,开展监测报告、调查诊断、处置等工作。建议接种单位在由于疫苗接种出现疑似不良反应后,需尽快报告属地疾控部门,流程如下:
●在获知受种者发生异常反应后24 h内上报AEFI报告卡。
●除明确诊断的一般反应外的AEFI均要求在上报后48 h内展开调查,并在调查开始后3 d内上报个案调查表。
●报告内容应明确包括主要临床经过,尤其是接种与症状发生的时间间隔,同时收集相关临床资料、预防接种资料等。
●发现怀疑与接种相关的死亡、严重残疾、群体性疑似预防接种异常反应、对社会有重大影响的AEFI时,应当在发现后2 h内上报。
●AEFI报告卡和个案调查表完成后应上报属地疾控部门,并电话通知疾控主管部门。属地疾控部门接到AEFI报告后,建议当地立即组织专业人员进行调查分析,尽快给出初步结论并撰写调查报告。对结论出现异议时,需上报接种单位所在地的市级医学会进行鉴定,做出最终结论。在判定是否为预防接种异常反应时,以下情形不属于预防接种异常反应:①因疫苗本身特性引起的接种后一般反应;②因疫苗质量不合格给受种者造成的损害;③因接种单位违反预防接种工作规范、免疫程序、疫苗使用指导原则、接种方案给受种者造成的损害;④接种者在接种时正处于某种疾病的潜伏期或者前驱期,接种后偶合发病;⑤受种者有疫苗说明书规定的接种禁忌,在接种前受种者或者其监护人未如实提供受种者的健康状况和接种禁忌等情况,接种后受种者原有疾病急性复发或者病情加重。
●因心理因素发生的个体或者群体的心因性反应。处理AEFI病例时,建议接种单位要搜集并整理好患者临床就诊的各种资料,同时备好狂犬病疫苗接种的相关资料,以备上级组织的AEFI调查诊断专家组使用。需要注意的是,临床医疗和接种单位任何个人均不具备做出AEFI诊断的资格。
(5)被动免疫制剂不良反应监测:建议接种单位应做好狂犬病被动免疫制剂的不良反应报告工作,当获知或者发现可能与之相关的不良反应,应当通过国家药品不良反应监测信息网络报告;不具备在线报告条件的,应当通过纸质报表报所在地药品不良反应监测机构,由所在地药品不良反应监测机构代为在线报告。接种单位若发现或者获知新的、严重的药品不良反应,应当在15 d内报告,其中死亡病例须立即报告;其他药品不良反应应在30 d内报告。有随访信息的,建议及时报告。建议报告内容应当确保真实、完整、准确,同时建立并保存不良反应报告和监测档案。其中,新的药品不良反应是指药品说明书中未载明的不良反应。说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。严重药品不良反应包括以下6种情形:导致死亡;危及生命;致癌、致畸、致出生缺陷;导致显著的或者永久的人体伤残或者器官功能的损伤;导致住院或者住院时间延长;导致其他重要医学事件,如不进行治疗可能出现上述所列情况者。
目前国内批准上市的人用狂犬病疫苗和被动免疫制剂的生产企业及其产品规格见附表 1、2。 审核专家及单位:中国食品药品检定研究院(俞永新、董关木);中国疾病预防控制中心病毒病预防控制所(唐青);解放军军事医学科学院(扈荣良);武汉生物制品研究所(严家新)
| [1] Jackson AC.Rabies[M].3rd ed.London:Elservier Science, 2013. |
| [2] Nel LH, Markotter W.Lyssaviruses[J].Crit Rev Microbiol, 2007, 33(4):301-324.DOI:10.1080/10408410701647602. |
| [3] 俞永新.狂犬病和狂犬病疫苗[M].2版.北京:中国医药科技出版社, 2009.Yu YX.Rabies and rabies vaccine[M].2nd ed.Beijing:China Medical Science and Technology Press, 2009. |
| [4] World Health Organization.Rapid laboratory techniques for the diagnosis of viral infections[R].Geneva:WHO, 1981. |
| [5] Meslin FX, Kaplan MM, Koprowski H, et al.Laboratory techniques in rabies[R].Geneva:WHO, 1996. |
| [6] WHO.WHO expert consultation on rabies[R].Geneva:WHO, 2013. |
| [7] Fooks AR, Banyard AC, Horton DL, et al.Current status of rabies and prospects for elimination[J].Lancet, 2014, 384(9951):1389-1399.DOI:10.1016/S0140-6736(13)62707-5. |
| [8] Dacheux L, Wacharapluesadee S, Hemachudha T, et al.More accurate insight into the incidence of human rabies in developing countries through validated laboratory techniques[J].PLoS Negl Trop Dis, 2010, 4(11):e765.DOI:10.1371/journal.pntd.0000765. |
| [9] 中华人民共和国卫生部.WS 281-2008狂犬病诊断标准[S].北京:人民卫生出版社, 2008.The Ministry of Health of the People's Republic of China.WS 281-2008 Diagnostic criteia for rabies[S].Beijing:People's Medical Publishing House, 2008. |
| [10] Ugolini G.Rabies virus as a transneuronal tracer of neuronal connections[J].Adv Virus Res, 2011, 79:165-202.DOI:10.1016/B978-0-12-387040-7.00010-X. |
| [11] Ugolini G.Advances in viral transneuronal tracing[J].J Neurosci Methods, 2010, 194(1):2-20.DOI:10.1016/j.jneumeth.2009.12.001. |
| [12] Ugolini G.Use of rabies virus as a transneuronal tracer of neuronal connections:implications for the understanding of rabies pathogenesis[J].Dev Biol, 2008, 131:493-506. |
| [13] Hemachudha T, Ugolini G, Wacharapluesadee S, et al.Human rabies:neuropathogenesis, diagnosis, and management[J].Lancet Neurol, 2013, 12(5):498-513.DOI:10.1016/S1474-4422(13)70038-3. |
| [14] Hemachudha T, Laothamatas J, Rupprecht CE.Human rabies:a disease of complex neuropathogenetic mechanisms and diagnostic challenges[J].Lancet Neurol, 2002, 1(2):101-109.DOI:10.1016/S1474-4422(02)00041-8. |
| [15] Hemachudha T, Wacharapluesadee S, Mitrabhakdi E, et al.Pathophysiology of human paralytic rabies[J].J Neurovirol, 2005, 11(1):93-100.DOI:10.1080/13550280590900409. |
| [16] Klingen Y, Conzelmann KK, Finke S.Double-labeled rabies virus:live tracking of enveloped virus transport[J].J Virolo, 2008, 82(1):237-245. |
| [17] Morimoto K, Patel M, Corisdeo S, et al.Characterization of a unique variant of bat rabies virus responsible for newly emerging human cases in North America[J].Proceed Natl Academy Sci, 1996, 93(11):5653-5658. |
| [18] Manning SE, Rupprecht CE, Fishbein D, et al.Human rabies prevention-United States, 2008:recommendations of the Advisory Committee on Immunization Practices[J].MMWR Recomm Rep, 2008, 57(RR-3):1-28. |
| [19] Mclean HQ.The immunological basis for immunization series:module 17:rabies[R].Geneva:WHO, 2011. |
| [20] Stanley AP, Walter AO, Paul AO.Vaccines[M].6th ed.London:Elsevier Science, 2013. |
| [21] Megyeri K, Berencsi K, Halazonetis TD, et al.Involvement of a p53-dependent pathway in rubella virus-induced apoptosis[J]..Virology, 1999, 259(1):74-84.DOI:10.1006/viro.19999757. |
| [22] Publication W.Rabies vaccines:WHO position paper-recommendations[J].Vaccine, 2010, 28(44):7140-7142. |
| [23] Mitrabhakdi E, Shuangshoti S, Wannakrairot P, et al.Difference in neuropathogenetic mechanisms in human furious and paralytic rabies[J].J Neurol Sci, 2005, 238(1/2):3-10.DOI:10.1016/j.jns.2005.05.004. |
| [24] Adamo P, Asís L, Silveyra P, et al.Rubella virus does not induce apoptosis in primary human embryo fibroblast cultures:a possible way of viral persistence in congenital infection[J].Viral Immunol, 2004, 17(1):87-100.DOI:10.1089/088282404322875485. |
| [25] Töndury G, Smith DW.Fetal rubella pathology[J].J Pediatr, 1966, 68(6):867-879.DOI:10.1016/S0022-3476(66)80204-4. |
| [26] Naeye RL, Blanc W.Pathogenesis of congenital rubella[J].JAMA, 1965, 194(12):1277-1283.DOI:10.1001/jama.1965.03090250011002. |
| [27] 杨先涛, 朱朝敏.儿童狂犬病53例临床分析[J].重庆医科大学学报, 2013, 38(8):949-952.Yang XT, Zhu CM.Clinical analysis of rabies cases in 53 children[J].J Chongqing Med Univ, 2013, 38(8):949-952. |
| [28] 史映红, 刘昌弟, 龙波.狂犬病29例临床分析[J].中国人兽共患病学报, 2011, 27(2):165-166.DOI:10.3969/j.issn.1002-2694.2011.02.023.Shi YH, Liu CD, Long B.Clinical analysis of 29 patients with rabies[J].Chin J Zoonoses, 2011, 27(2):165-166.DOI:10.3969/j.issn.1002-2694.2011.02.023. |
| [29] 魏书德.533例狂犬病流行病学分析[J].现代预防医学, 2004, 31(5):746-747.DOI:10.3969/j.issn.1003-8507.2004.05.048.Wei SD.The epidemiological analysis of 533 rabies cases[J].Mod Prev Med, 2004, 31(5):746-747.DOI:10.3969/j.issn.1003-8507.2004.05.048. |
| [30] Sagerman PJ.Wounds[J].Pediatr Rev, 2005, 26(2):43-49.DOI:10.1542/pir.26-2-43. |
| [31] 陈瑞丰, 王立秋, 黄立嵩, 等.犬与猫咬伤创口特点及感染的研究[J].转化医学杂志, 2013(4):219-221.DOI:10.3969/j.issn.2095-3097.2013.04.008.Chen RF, Wang LQ, Huang LS, et al.The infectious characteristies of dog and cat bites[J].Transl Med J, 2013(4):219-221.DOI:10.3969/j.issn.2095-3097.2013.04.008. |
| [32] Talan DA, Citron DM, Abrahamian FM, et al.Bacteriologic analysis of infected dog and cat bites.Emergency Medicine Animal Bite Infection Study Group[J].N Engl J Med, 1999, 340(2):85-92.DOI:10.1056/NEJM199901143400202. |
| [33] Muniz IM, Penna B, Lilenbaum W.Treating animal bites:susceptibility of Staphylococci from oral mucosa of cats[J].Zoonoses Public Health, 2013, 60(7):504-509.DOI:10.1111/zph.12027. |
| [34] Zhang XW, Wei L, Xiaowei H, et al.Comparison of primary and delayed wound closure of dog-bite wounds[J].Vet Comp Orthop Traumatol, 2013, 26(3):204-207.DOI:10.3415/VCOT-12-04-0053. |
| [35] Johnson KA.Animal-induced injuries of humans[J].Vet Comp Orthop Traumatol, 2013, 26(3):V.DOI:10.3415/VCOT-13-04-0050. |
| [36] Kennedy SA, Stoll LE, Lauder AS.Human and other mammalian bite injuries of the hand:evaluation and management[J].J Am Acad Orthop Surg, 2015, 23(1):47-57.DOI:10.5435/JAAOS-23-01-47. |
| [37] Abrahamian FM, Goldstein EJ.Microbiology of animal bite wound infections[J].Clin Microbiol Rev, 2011, 24(2):231-246.DOI:10.1128/CMR.00041-10. |
| [38] Paschos NK, Makris EA, Gantsos A, et al.Primary closure versus non-closure of dog bite wounds.A randomised controlled trial[J].Injury, 2014, 45(1):237-240.DOI:10.1016/j.injury.2013.07.010. |
| [39] Ambro BT, Wright RJ, Heffelfinger RN.Management of bite wounds in the head and neck[J].Facial Plast Surg, 2010, 26(6):456-463.DOI:10.1055/s-0030-1267720. |
| [40] Looke D, Dendle C.Bites(Mammalian)[J].BMJ Clin Evid, 2010, 2010:0914. |
| [41] Babovic N, Cayci C, Carlsen BT.Cat bite infections of the hand:assessment of morbidity and predictors of severe infection[J].J Hand Surg Am, 2014, 39(2):286-290.DOI:10.1016/j.jhsa.2013.11.003. |
| [42] Crecelius C.Soft tissue trauma[J].Atlas Oral Maxillofac Surg Clin North Am, 2013, 21(1):49-60.DOI:10.1016/j.cxom.2012.12.011. |
| [43] Akingba AG, Robinson EA, Jester AL, et al.Management of vascular trauma from dog bites[J].J Vasc Surg, 2013, 58(5):1346-1352.DOI:10.1016/j.jvs.2013.05.101. |
| [44] Rupprecht CE, Scheld M.Infections of the central nervous system[M].3ed.Philadelphia, 2004. |
| [45] Laothamatas J, Hemachudha T, Mitrabhakdi E, et al.MR imaging in human rabies[J].AJNR Am J Neuroradiol, 2003, 24(6):1102-1109. |
| [46] Thanomsridetchai N, Singhto N, Tepsumethanon V, et al.Comprehensive proteome analysis of hippocampus, brainstem, and spinal cord from paralytic and furious dogs naturally infected with rabies[J].J Proteome Res, 2011, 10(11):4911-4924.DOI:10.1021/pr200276u. |
| [47] Hampson K, Coudeville L, Lembo T, et al.Estimating the global burden of endemic canine rabies[J].PLoS Negl Trop Dis, 2015, 9(4):e0003709.DOI:10.1371/journal.pntd.0003709. |
| [48] Dodet B, Africa Rabies Expert Bureau(AfroREB), Adjogoua EV, et al.Fighting rabies in Africa:the Africa Rabies Expert Bureau(AfroREB)[J].Vaccine, 2008, 26(50):6295-6298.DOI:10.1016/j.vaccine.2008.04.087. |
| [49] Knobel DL, Cleaveland S, Coleman PG, et al.Re-evaluating the burden of rabies in Africa and Asia[J].Bull World Health Organ, 2005, 83(5):360-368.DOI:10.1590/S0042-96862005000500012. |
| [50] Yao HW, Yang Y, Liu K, et al.The spatiotemporal expansion of human rabies and its probable explanation in mainland China, 2004-2013[J].PLoS Negl Trop Dis, 2015, 9(2):e0003502.DOI:10.1371/journal.pntd.0003502. |
| [51] 余宏杰, 罗会明, 罗述斌, 等.湖南省耒阳市狂犬病发病调查[J].中华流行病学杂志, 2006, 27(3):252.Yu HJ, Luo HM, Luo SB, et al.Investigation of rabies cases in Mo Yang, Hunan[J].Chin J Epidemiol, 2006, 27(3):252. |
| [52] Yin W, Jie D, Tu C, et al.Challenges and needs for China to eliminate rabies[J].Infect Dis Poverty, 2013, 2(1):23.DOI:10.1186/2049-9957-2-23. |
| [53] Cleaveland S.Historical perspectives of rabies in Europe and the mediterranean basin[J].Trop Animal Health Prod, 2006, 38(2):169-170.DOI:10.1007/s11250-006-0001-y. |
| [54] Sabeta CT, Mansfield KL, McElhinney LM, et al.Molecular epidemiology of rabies in bat-eared foxes(Otocyon megalotis) in South Africa[J].Virus Res, 2007, 129(1):1-10.DOI:10.1016/j.virusres.2007.04.024. |
| [55] Zulu GC, Sabeta CT, Nel LH.Molecular epidemiology of rabies:focus on domestic dogs(Canis familiaris) and black-backed jackals(Canis mesomelas) from northern South Africa[J].Virus Res, 2009, 140(1/2):71-78.DOI:10.1016/j.virusres.2008.11.004. |
| [56] MacInnes CD, Smith SM, Tinline RR, et al.Elimination of rabies from red foxes in eastern Ontario[J].J Wildl Dis, 2001, 37(1):119-132.DOI:10.7589/0090-3558-37.1.119. |
| [57] Rupprecht CE, Barrett J, Briggs D, et al.Can rabies be eradicated?[J].Dev Biol, 2008, 131:95-121. |
| [58] De Serres G, Dallaire F, Côte M, et al.Bat rabies in the United States and Canada from 1950 through 2007:human cases with and without bat contact[J].Clin Infect Dis, 2008, 46(9):1329-1337.DOI:10.1086/586745. |
| [59] Animals and rabies.U.S CDC[EB/OL].http://www.cdc.gov/rabiesandkids/animals.html. |
| [60] Zhang YZ, Xiong CL, Xiao DL, et al.Human rabies in China[J].Emerg Infect Dis, 2005, 11(12):1983-1984.DOI:10.3201/eid1112.040775. |
| [61] 卫生部, 公安部, 农业部, 等.中国狂犬病防治现状[R].北京:卫生部, 2009.Ministry of Health, Ministry of Public Security, Ministry of Agriculture, et al.The current situation of prevention and control of rabies[R].Beijing:Ministry of Health, 2009. |
| [62] Song M, Tang Q, Wang DM, et al.Epidemiological investigations of human rabies in China[J].BMC Infect Dis, 2009, 9:210.DOI:10.1186/1471-2334-9-210. |
| [63] Guo DH, Zhou H, Zou Y, et al.Geographical analysis of the distribution and spread of human rabies in China from 2005 to 2011[J].PLoS One, 2013, 8(8):e72352.DOI:10.1371/journal.pone.0072352. |
| [64] 宋淼, 唐青, 冯子健, 等.1996-2006年中国狂犬病流行特征分析[J].中国人兽共患病学报, 2008, 24(6):584-586.DOI:10.3969/j.issn.1002-2694.2008.06.024.Song M, Tang Q, Feng ZJ, et al.Analysis of the epidemiological characteristics of rabies prevalent in China from 1996 to 2006[J].Chin J Zoonoses, 2008, 24(6):584-586.DOI:10.3969/j.issn.1002-2694.2008.06.024. |
| [65] 王梅, 周航, 殷文武, 等.中国2005-2011年人狂犬病不同地区季节分布特征研究[J].中华流行病学杂志, 2012, 33(11):1151-1154.DOI:10.3760/cma.j.issn.0254-6450.2012.11.012.Wang M, Zhou H, Yin WW, et al.Study on the seasonal distribution of human rabies in different regions of China[J].Chin J Epidemiol, 2012, 33(11):1151-1154.DOI:10.3760/cma.j.issn.0254-6450.2012.11.012. |
| [66] 许真, 刘波, 殷文武, 等.2006-2008年全国狂犬病流行病学监测分析[J].疾病监测, 2010, 25(5):360-364.DOI:10.3784/j.issn.1003-9961.2010.05.008.Xu Z, Liu B, Yin WW, et al.Epidemiological analysis on rabies surveillance in China from 2006 to 2008[J].Dis Surv, 2010, 25(5):360-364.DOI:10.3784/j.issn.1003-9961.2010.05.008. |
| [67] 周航, 满腾飞, 李群, 等.2009年中国狂犬病监测分析[J].疾病监测, 2010, 25(12):934-937.DOI:10.3784/j.issn.1003-9961.2010.12.003.Zhou H, Man TF, Li Q, et al.Surveillance of human rabies in China, 2009[J].Dis Surv, 2010, 25(12):934-937.DOI:10.3784/j.issn.1003-9961.2010.12.003. |
| [68] Yin CP, Zhou H, Wu H, et al.Analysis on factors related to rabies epidemic in China from 2007-2011[J].Virol Sin, 2012, 27(2):132-143.DOI:10.1007/s12250-012-3244-y. |
| [69] 周航, 牟笛, 李昱, 等.2013年中国狂犬病流行特征分析[J].国际病毒学杂志, 2015, 22(3):145-148.DOI:10.3760/cma.j.issn.1673-4092.2015.03.001.Zhou H, Mou D, Li Y, et al.Epidemiological features and analysis on human rabies in China, 2013[J].Int J Virol, 2015, 22(3):145-148.DOI:10.3760/cma.j.issn.1673-4092.2015.03.001. |
| [70] 周航, 李昱, 牟笛, 等.中国2012年狂犬病流行特征分析[J].中华流行病学杂志, 2015, 36(3):205-209.DOI:10.3760/cma.j.issn.0254-6450.2015.03.004.Zhou H, Li Y, Mou D, et al.Analysis of epidemiological features of human rabies in China, 2012[J].Chin J Epidemiol, 2015, 36(3):205-209.DOI:10.3760/cma.j.issn.0254-6450.2015.03.004. |
| [71] Rupprecht CE, Hanlon CA, Hemachudha T.Rabies re-examined[J].Lancet Infect Dis, 2002, 2(6):327-343.DOI:10.1016/S1473-3099(02)00287-6. |
| [72] Plotkin SA, OrensteinWA, OffitPA.疫苗学[M].5版.梁晓峰, 罗凤基, 封多佳, 译.北京:人民卫生出版社, 2011.Plotkin SA, OrensteinWA, OffitPA.Vaccines[M].5th ed.Liang XF, Luo FJ, Feng DJ, Trans.Beijing:People's Medical Publishing House, 2011. |
| [73] 舒俭德.纯化鸡胚细胞狂犬病疫苗瑞必补尔TM临床试验概述[J].中国计划免疫, 2005, 11(3):209.DOI:10.3969/j.issn.1006-916X.2005.03.031.Shu JD.The clinical trial of Rabipur's PCECV[J].Chin J Vaccin Immun, 2005, 11(3):209.DOI:10.3969/j.issn.1006-916X.2005.03.031. |
| [74] 李薇, 刘增顺, 王玉琳, 等.地鼠肾细胞狂犬病纯化疫苗临床研究观察[J].微生物学免疫学进展, 2004, 32(2):17-19.Li W, Liu ZS, Wang YL, et al.Observation on clinical trial of purified primary hamster kidney cell rabies vaccine(PHKRV)[J].Prog Microbiol Immunol, 2004, 32(2):17-19. |
| [75] Lin FT, Zeng FZ, Lu LM, et al.The primary hamster kidney cell rabies vaccine:adaptation of viral strain, production of vaccine, and pre-and postexposure treatment[J].J Infect Dis, 1983, 147(3):467-473.DOI:10.1093/infdis/147.3.467. |
| [76] 俞永新.国产狂犬病纯化疫苗的研制和应用前景[J].中国计划免疫, 2000, 6(3):176-177, 188.DOI:10.3969/j.issn.1006-916X.2000.03.027.Yu YX.The development and application prospect of domestic purifed rabies vaccine[J].Chin J Vaccin Immun, 2000, 6(3):176-177, 188.DOI:10.3969/j.issn.1006-916X.2000.03.027. |
| [77] 董关木, 郑海发, 刘增顺, 等.我国纯化狂犬病疫苗的临床反应及效果评价[J].中国生物制品学杂志, 2002, 15(5):312-314.DOI:10.3969/j.issn.1004-5503.2002.05.022.Dong GM, Zheng HF, Liu ZS, et al.The clinical reaction and effect evaluation of purifed rabies vaccine in China[J].Chin J Biologicals, 2002, 15(5):312-314.DOI:10.3969/j.issn.1004-5503.2002.05.022. |
| [78] Vodopija I, Sureau P, Lafon M, et al.An evaluation of second generation tissue culture rabies vaccines for use in man:a four-vaccine comparative immunogenicity study using a pre-exposure vaccination schedule and an abbreviated 2-1-1 postexposure schedule[J].Vaccine, 1986, 4(4):245-248.DOI:10.1016/0264-410X(86)90138-6. |
| [79] WHO.WHO expert committee on rabies[R].Geneva:World Health Organization Technical Report 824, 1992:1-84. |
| [80] Rupprecht CE, Briggs D, Brown CM, et al.Use of a reduced(4-dose) vaccine schedule for postexposure prophylaxis to prevent human rabies:recommendations of the advisory committee on immunization practices[J].MMWR Recomm Rep, 2010, 59(RR-2):1-9. |
| [81] Turner GS.Immunoglobulin(IgG) and(IgM) antibody responses to rabies vaccine[J].J Gen Virol, 1978, 40(3):595-604.DOI:10.1099/0022-1317-40-3-595. |
| [82] Hasbahceci M, Kiyan M, Eyol E, et al.Human diploid-cell rabies vaccine:efficacy of four doses[J].Lancet, 1996, 347(9006):976-977.DOI:10.1016/S0140-6736(96)91467-1. |
| [83] Johnson N, Cunningham AF, Fooks AR.The immune response to rabies virus infection and vaccination[J].Vaccine, 2010, 28(23):3896-3901.DOI:10.1016/j.vaccine.2010.03.039. |
| [84] Suss J, Sinnecker H.Immune reactions against rabies viruses-infection and vaccination[J].Exp Pathol, 1991, 42(1):1-9.DOI:10.1016/S0232-1513(11)80028-9. |
| [85] WECOBS, WHO.WHO Expert Committee on Biological Standardization:fifty-sixth report[R].Geneva:WHO, 2007. |
| [86] Morris J, Crowcroft NS, Fooks AR, et al.Rabies antibody levels in bat handlers in the United Kingdom:immune response before and after purified chick embryo cell rabies booster vaccination[J].Hum Vaccin, 2007, 3(5):165-170.DOI:10.4161/hv.3.5.4216. |
| [87] 陈恩富, 王臻, 胡建锦, 等.国产纯化Vero细胞狂犬病疫苗暴露前免疫效果观察[J].中华流行病学杂志, 2009, 30(1):33.DOI:10.3760/cma.j.issn.0254-6450.2009.01.009.Chen EF, Wang Z, Hu JJ, et al.The observation on domasticate purified Vero cell rabies vaccine's immune effect of pre-exposure prophylaxis[J].Chin J Epidemiol, 2009, 30(1):33.DOI:10.3760/cma.j.issn.0254-6450.2009.01.009. |
| [88] Sehgal S, Bhattacharya D, Bhardwaj M.Ten year longitudinal study of efficacy and safety of purified chick embryo cell vaccine for pre-and post-exposure prophylaxis of rabies in Indian population[J].J Commun Dis, 1995, 27(1):36-43. |
| [89] Strady A, Lang J, Lienard M, et al.Antibody persistence following preexposure regimens of cell-culture rabies vaccines:10-year foliow-up and proposal for a new booster policy[J].J Infect Dis, 1998, 177(5):1290-1295.DOI:10.1086/515267. |
| [90] Rupprecht CE, Briggs D, Brown CM, et al.Evidence for a 4-dose vaccine schedule for human rabies post-exposure prophylaxis in previously non-vaccinated individuals[J].Vaccine, 2009, 27(51):7141-7148.DOI:10.1016/j.vaccine.2009.09.029. |
| [91] 王凌云, 孙美平, 张雪春, 等.国产冻干人用狂犬病疫苗(Vero细胞)的接种反应及其免疫原性[J].中国生物制品学杂志, 2008, 21(12):1115-1117.DOI:10.3969/j.issn.1004-5503.2008.12.024.Wang LY, Sun MP, Zhang XC, et al.Adverse reaction and immunogenicity of domestic freeze-dried rabies vaccine(Vero cells)for human use[J].Chin J Biol, 2008, 21(12):1115-1117.DOI:10.3969/j.issn.1004-5503.2008.12.024. |
| [92] 叶茂华, 雷永良, 王晓光.7例被狂犬咬伤者接种狂犬病疫苗的效果观察[J].中国生物制品学杂志, 2008, 21(12):1046.DOI:10.3969/j.issn.1004-5503.2008.12.025.Ye MH, Lei YL, Wang XG.Effect observation on 7 cases' rabies vaccination after being bit by rabies[J].Chin J Biologicals, 2008, 21(12):1046.DOI:10.3969/j.issn.1004-5503.2008.12.025. |
| [93] Wasi C, Chaiprasithikul P, Auewarakul P, et al.The abbreviated 2-1-1 schedule of purified chick embryo cell rabies vaccination for rabies postexposure treatment[J].Southeast Asian J Trop Med Public Health, 1993, 24(3):461-466. |
| [94] Huang GH, Liu HZ, Tang Q, et al.Making rabies prophylaxis more economical:immunogenicity and safety results from a preliminary study using a 2-1 intramuscular regimen in healthy volunteers[J].Hum Vaccin Immunother, 2014, 10(1):114-119.DOI:10.4161/hv.26264. |
| [95] Hu Q, Liu MQ, Zhu ZG, et al.Comparison of safety and immunogenicity of purified chick embryo cell vaccine using Zagreb and Essen regimens in patients with category Ⅱ exposure in China[J].Hum Vaccin Immunother, 2014, 10(6):1645-1649.DOI:10.4161/hv.28420. |
| [96] Chutivongse S, Wilde H, Fishbein DB, et al.One-year study of the 2-1-1 intrmauscular postexposure rabies vaccineregimen in 100 severely exposed Thai patients using rabies immune globulin and Vero cell rabies vaccine[J].Vaccine, 1991, 9(8):573-576.DOI:10.1016/0264-410X(91)90244-Z. |
| [97] 陈荣富, 李羽敏, 王晓光, 等.狂犬病病毒高危暴露者使用2-1-1程序预防效果分析[J].中国医药导报, 2014, 11(31):141-144.Chen RF, Li YM, Wang XG, et al.Analysis of preventive effects of rabies vaccination with Zagrab regimen on persons with high-risk exposure to rabies virus[J].Chin Med Herald, 2014, 11(31):141-144. |
| [98] Vodopija R, Lafont M, Baklaić Z, et al.Persistence of humoral immunity to rabies 1100 days after immunization and effect of a single booster dose of rabies vaccine[J].Vaccine, 1997, 15(5):571-574.DOI:10.1016/S0264-410X(97)00207-7. |
| [99] Rotivel Y, Weber P, Goudal M.Post-exposure treatment of patients with impaired or suboptimal immunity//Rotivel Y, Weber P, Goudal M.Merieux foundation[C].Paris:WHO, 2011:5-9, 61-65. |
| [100] Abazeed ME, Cinti S.Rabies prophylaxis for pregnant women[J].Emerg Infect Dis, 2007, 13(12):1966-1967.DOI:10.3201/eid1312.070157. |
| [101] Cramer CH Ⅱ,Shieck V,Thomas SE,et al.Immune response to rabies vaccination in pediatric transplant patients[J].Pediatr Transplant,2008,12(8):874-877.DOI:10.1111/j.1399-3046.2008.00936.x. |
| [102] Nicholson KG.Modern vaccines:rabies[J].Lancet,1990,335(8699):1201-1205.DOI:10.1016/0140-6736(90)92710-Y. |
| [103] Bahmanyar M,Fayaz A,Nour-Salehi S,et al.Successful protection of humans exposed to rabies infection.Postexposure treatment with the new human diploid cell rabies vaccine and antirabies serum[J].JAMA,1976,236(24):2751-2754.DOI:10.1001/jama.1976.03270250019017. |
| [104] Anderson LJ,Sikes RK,Langkop CW,et al.Postexposure trial of a human diploid cell strain rabies vaccine[J].J Infect Dis,1980,142(2):133-138.DOI:10.1093/infdis/142.2.133. |
| [105] Wilde H,Glueck R,Khawplod P,et al.Efficacy study of a new albumin-free human diploid cell rabies vaccine(Lyssavac-HDC,Berna) in 100 severely rabies-exposed Thai patients[J].Vaccine,1995,13(6):593-596.DOI:10.1016/0264-410X(94)00049-S. |
| [106] Krebs JW,Smith JS,Rupprecht CE,et al.Rabies surveillance in the United States during 1997[J].J Am Vet Med Assoc,1998,213(12):1713-1728. |
| [107] Fescharek R.What can be learned from a decade of worldwide postmarketing surveillance?[C].International Rabies Meeting.Paris:Institute Pasteur,1997:13-14. |
| [108] Wilde H.Failures of post-exposure rabies prophylaxis[J].Vaccine,2007,25(44):7605-7609.DOI:10.1016/j.vaccine.2007.08.054. |
| [109] 王世清,高立冬,胡世雄,等.狂犬病暴露后预防处置失败病例流行病学分析[J].当代医学,2010,16(28):154-156.DOI:10.3969/j.issn.1009-4393.2010.28.124.Wang SQ,Gao LD,Hu SX,et al.Epidemiological analysis of the failure prevention and treatment cases after rabies exposure[J].Contempor Med,2010,16(28):154-156.DOI:10.3969/j.issn.1009-4393.2010.28.124. |
| [110] Dobardzic A,Izurieta H,Woo EJ,et al.Safety review of the purified chick embryo cell rabies vaccine:Data from the Vaccine Adverse Event Reporting System(VAERS),1997-2005[J].Vaccine,2007,25(21):4244-4251.DOI:10.1016/j.vaccine.2007.02.075. |
| [111] Plotkin SA.Rabies vaccine prepared in human cell cultures:progress and perspectives[J].Rev Infect Dis,1980,2(3):433-448.DOI:10.1093/clinids/2.3.433. |
| [112] Centers for Disease Control(CDC).Systemic allergic reactions following immunization with human diploid cell rabies vaccine[J].MMWR Morb Mortal Wkly Rep,1984,33(14):185-187. |
| [113] Fishbein DB,Yenne KM,Esen DW,et al.Risk factors for systemic hypersensitivity reactions after booster vaccinations with human diploid cell rabies vaccine:a nationwide prospective study[J].Vaccine,1993,11(14):1390-1394.DOI:10.1016/0264-410X(93)90167-V. |
| [114] 王桂红,张金华,齐桂华."2-1-1"与传统"5针次"狂犬病疫苗免疫程序不良反应的比较[J].中国生物制品学杂志,2013,26(3):400-401.Wang GH,Zhang JH,Qi GH.The adverse reaction camparion between "2-1-1" methold and trditional "5 doses" for rabies vaccination[J].Chin J Biol,2013,26(3):400-401. |
| [115] 张进保,王志谦,杨海峰.成大速达2-1-1免疫程序观察[J].中国公共卫生管理,2013,29(1):75-77.Zhang JB,Wang ZQ,Yang HF.The inspection of chengda sucheng's " 2-1-1" vaccination program[J].Chin J Public Health Manage,2013,29(1):75-77. |
| [116] Chabala S,Williams M,Amenta R,et al.Confirmed rabies exposure during pregnancy:treatment with human rabies immune globulin and human diploid cell vaccine[J].Am J Med,1991,91(4):423-424.DOI:10.1016/0002-9343(91)90161-P. |
| [117] Chutivongse S,Wilde H,Benjavongkulchai M,et al.Postexposure rabies vaccination during pregnancy:effect on 202 women and their infants[J].Clin Infect Dis,1995,20(4):818-820.DOI:10.1093/clinids/20.4.818. |
| [118] Chutivongse S,Wilde H.Postexposure rabies vaccination during pregnancy:experience with 21 patients[J].Vaccine,1989,7(6):546-548.DOI:10.1016/0264-410X(89)90280-6. |
| [119] 李大伟,郝丽佳,王德贤,等.孕妇接种国产Vero细胞人用狂犬病纯化疫苗的安全性[J].中国生物制品学杂志,2003,16(6):382.DOI:10.3969/j.issn.1004-5503.2003.06.025.Li DW,Hao LJ,Wang DX,et al.The safety ofinoculating domestic purifed Vero cellhuman rabies vaccine among pregnant women[J].Chin J Biol,2003,16(6):382.DOI:10.3969/j.issn.1004-5503.2003.06.025. |
| [120] 刘琼芳.87例孕妇狂犬病暴露后接种狂犬疫苗对孕妇影响的研究[J].中华流行病学杂志,2006,27(12):1064.DOI:10.3760/j.issn:0254-6450.2006.12.025.Liu QF.The study oninfluence of post-exposure prophylasxis among 87 pregnant women after rabies exposure[J].Chin J Epidemiol,2006,27(12):1064.DOI:10.3760/j.issn:0254-6450.2006.12.025. |
| [121] 吴珍红,黄李杉.68例孕妇注射狂犬病疫苗的反应及对婴儿的影响[J].海峡预防医学杂志,2002,8(3):27.DOI:10.3969/j.issn.1007-2705.2002.03.049.Wu ZH,Huang LS.The reaction ofrabies vaccination and its influence on infant among 68 pregant women[J].Strait J Prev Med,2002,8(3):27.DOI:10.3969/j.issn.1007-2705.2002.03.049. |
| [122] 殷萍萍.人用狂犬病疫苗(非洲绿猴肾细胞)维尔博在特殊人群使用的临床效果[J].中国疫苗和免疫,2009,15(6):562-564.Yin PP.The clinical effect of human rabies vaccine(The African green monkey kidney cells) Verorab among special crowd[J].Chin J Vaccin Immuniz,2009,15(6):562-564. |
| [123] 黄桂花.孕妇狂犬病暴露后免疫安全性分析//2010全国狂犬病防控高层论坛论文集[C].北京:中华预防医学会,2010.Huang GH.The analysis of immunization safety among pregnant women after exposure to rabies//The national top forum of rabies' prevention and control in 2010[C].Beijing:Chinese Preventive Medicine Association,2010. |
| [124] Chulasugandha P,Khawplod P,Havanond P,et al.Cost comparison of rabies pre-exposure vaccination with post-exposure treatment in Thai children[J].Vaccine,2006,24(9):1478-1482.DOI:10.1016/j.vaccine.2005.03.059. |
| [125] Dhankhar P,Vaidya SA,Fishbien DB,et al.Cost effectiveness of rabies post exposure prophylaxis in the United States[J].Vaccine,2008,26(33):4251-4255.DOI:10.1016/j.vaccine.2008.05.048. |
| [126] Dumas FR,N'Diaye DS,Paireau J,et al.Cost-effectiveness of rabies post-exposure prophylaxis in the context of very low rabies risk:A decision-tree model based on the experience of France[J].Vaccine,2015,33(20):2367-2378.DOI:10.1016/j.vaccine.2015.02.075. |
| [127] Shim E,Hampson K,Cleaveland S,et al.Evaluating the cost-effectiveness of rabies post-exposure prophylaxis:a case study in Tanzania[J].Vaccine,2009,27(51):7167-7172.DOI:10.1016/j.vaccine.2009.09.027. |
| [128] 周世红,李晓松.狂犬病暴露前预防与暴露后预防的成本效果比较[J].现代预防医学,2010,37(19):3663-3666.Zhou SH,Li XS.Cost-effectiveness comparison of rabiespre-exposure prophylaxis and post-exposure prophylaxis[J].Mod Prev Med,2010,37(19):3663-3666. |
| [129] 王传林,张晓威,俞永新.狂犬病疫苗接种程序的依从性调查及经济成本分析[J].中国疫苗和免疫,2010,16(3):254-257.Wang CL,Zhang XW,Yu YX.Study on the compliance and economic cost of rabies vaccination[J].Chin J Vaccin Immuniz,2010,16(3):254-257. |
| [130] 国家药典委员会.中华人民共和国药典临床用药须知[M].4版.北京:中国医药科技出版社,2015.Committee of Pharmacopeia.Pharmacopoeia of the people's republic of China[M].4th ed.Beijing:Pharmacopoeia of the People's Republic of China,2015. |
| [131] 董关木.狂犬病的防治、疫苗和抗血清的安全性探讨[J].中国预防医学杂志,2006,7(4):362-365.DOI:10.3969/j.issn.1009-6639.2006.04.059.Dong GM.The prevention and treatment of rabies,the discussion about the safety of rabies vaccine and antiserum[J].Chin Prev Med,2006,7(4):362-365.DOI:10.3969/j.issn.1009-6639.2006.04.059. |
| [132] Khawplod P,Wilde H,Chomchey P,et al.What is an acceptable delay in rabies immune globulin administration when vaccine alone had been given previously?[J].Vaccine,1996,14(5):389-391.DOI:10.1016/0264-410X(95)00213-K. |
| [133] Bakker AB,Marissen WE,Kramer RA,et al.Novel human monoclonal antibody combination effectively neutralizing natural rabies virus variants and individual in vitro escape mutants[J].J Virol,2005,79(14):9062-9068.DOI:10.1128/JVI.79.14.9062-9068.2005. |
| [134] Sun LN,Chen Z,Yu L,et al.Generation and characterization of neutralizing human recombinant antibodies against antigenic siteⅡof rabies virus glycoprotein[J].Appl Microbiol Biotechnol,2012,96(2):357-366.DOI:10.1007/s00253-012-4171-4. |
| [135] WHO.WHO consultation on a rabies monoclonal antibody cocktail for rabies post exposure treatment[R].Geneva:WHO,2002. |
| [136] Criteria for application withholding of post-exposure treatment.http://www.who.int/rabies/human/generalconsid/en/. |
| [137] Dean DJ,Baer GM,Thompson WR.Studies on the local treatment of rabies-infected wounds[J].Bull World Health Organ,1963,28(4):477-486. |
| [138] 陈瑞丰,王立秋,黄立嵩,等.犬咬伤创口清创研究[J].中国急救复苏与灾害医学杂志,2010,5(1):23-24.DOI:10.3969/j.issn.1673-6966.2010.01.009.Chen RF,Wang LQ,Huang LS,et al.Debridement of dog bite wounds[J].Chin J Emerg Resuscit Dis Med,2010,5(1):23-24.DOI:10.3969/j.issn.1673-6966.2010.01.009. |
| [139] Armstrong JA,Froelich EJ.Inactivation of viruses by benzalkonium chloride[J].Appl Microbiol,1964,12(2):132-137. |
| [140] Evgeniou E,Markeson D,Iyer S,et al.The management of animal bites in the United kingdom[J].Eplasty,2013,13:e27. |
| [141] 吴孟超,吴在德.黄家驷外科学[M].7版.北京:人民卫生出版社,2008.Wu MC,Wu ZD.Huang Gusi surger[M].7th ed.Beijing:People's Medical Publishing House,2008. |
| [142] Westling K,Farra A,Cars B,et al.Cat bite wound infections:a prospective clinical and microbiological study at three emergency wards in Stockholm,Sweden[J].J Infect,2006,53(6):403-407.DOI:10.1016/j.jinf.2006.01.001. |
| [143] Ellis R,Ellis C.Dog and cat bites[J].Am Fam Physician,2014,90(4):239-243. |
| [144] Morgan M,Palmer J.Dog bites[J].BMJ,2007,334(7590):413-417.DOI:10.1136/bmj.39105.659919.BE. |
| [145] Fleisher GR.The management of bite wounds[J].N Engl J Med,1999,340(2):138-140.DOI:10.1056/NEJM199901143400210. |
| [146] Stevens DL,Bisno AL,Chambers HF,et al.Practice guidelines for the diagnosis and management of skin and soft-tissue infections[J].Clin Infect Dis,2005,41(10):1373-1406.DOI:10.1086/497143. |
| [147] Bassetti M,Baguneid M,Bouza E,et al.European perspective and update on the management of complicated skin and soft tissue infections due to methicillin-resistant Staphylococcus aureus after more than 10 years of experience with linezolid[J].Clin Microbiol Infect,2014,20Suppl4:3-18.DOI:10.1111/1469-0691.12463. |
| [148] Cheng HT,Hsu YC,Wu CI.Does primary closure for dog bite wounds increase the incidence of wound infection? A meta-analysis of randomized controlled trials[J].J Plast Reconstr Aesthet Surg,2014,67(10):1448-1450.DOI:10.1016/j.bjps.2014.05.051. |
| [149] Esposito S,Picciolli I,Semino M,et al.Dog and cat bite-associated infections in children[J].Eur J Clin Microbiol Infect Dis,2013,32(8):971-976.DOI:10.1007/s10096-013-1840-x. |
| [150] Quinn JV,McDermott D,Rossi J,et al.Randomized controlled trial of prophylactic antibiotics for dog bites with refined cost model[J].West J Emerg Med,2010,11(5):435-441. |
| [151] Shoji K,Cavanaugh Z,Rodner CM.Acute fight bite[J].J Hand Surg Am,2013,38(8):1612-1614.DOI:10.1016/j.jhsa.2013.03.002. |
| [152] Taplitz RA.Managing bite wounds.Currently recommended antibiotics for treatment and prophylaxis[J].Postgrad Med,2004,116(2):49-52,55-56,59. |
| [153] Stefanopoulos P,Karabouta Z,Bisbinas I,et al.Animal and human bites:evaluation and management[J].Acta Orthop Belg,2004,70(1):1-10. |
| [154] Kramer A,Assadian O,Frank M,et al.Prevention of post-operative infections after surgical treatment of bite wounds[J].GMS Krankenhhyg Interdiszip,2010,5(2).DOI:10.3205/dgkh000155. |
| [155] Philipsen TE,Molderez C,Gys T.Cat and dog bites.What to do?Guidelines for the treatment of cat and dog bites in humans[J].Acta Chir Belg,2006,106(6):692-695. |
| [156] Goldstein EJ,Citron DM,Merriam CV,et al.Ceftaroline versus isolates from animal bite wounds:comparative in vitro activities against 243 isolates,including 156 Pasteurella species isolates[J].Antimicrob Agents Chemother,2012,56(12):6319-6323.DOI:10.1128/AAC.01794-12. |
| [157] Sabhaney V,Goldman RD.Child health update.Management of dog bites in children[J].Can Fam Physician,2012,58(10):1094-1096,e1548-1050. |
| [158] Madsen IR,Justesen US.Bacteremia with Bacteroides pyogenes after a cat bite[J].J Clin Microbiol,2011,49(8):3092-3093.DOI:10.1128/JCM.00250-11. |
| [159] Goldstein EJ,Citron DM,Hudspeth M,et al.Trovafloxacin compared with levofloxacin,ofloxacin,ciprofloxacin,azithromycin and clarithromycin against unusual aerobic and anaerobic human and animal bite-wound pathogens[J].J Antimicrob Chemother,1998,41(3):391-396.DOI:10.1093/jac/41.3.391. |
| [160] Houshian S,Seyedipour S,Wedderkopp N.Epidemiology of bacterial hand infections[J].Int J Infect Dis,2006,10(4):315-319.DOI:10.1016/j.ijid.2005.06.009. |
| [161] Yaqub S,Bjørnholt JV,Hellum KB,et al.Bite wound infections[J].Tidsskr Nor Laegeforen,2004,124(24):3194-3196. |
| [162] Tabaka ME,Quinn JV,Kohn MA,et al.Predictors of infection from dog bite wounds:which patients may benefit from prophylactic antibiotics?[J].Emerg Med J,2015,32(11):860-863.DOI:10.1136/emermed-2014-204378. |
| [163] Korczak BM,Bisgaard M,Christensen H,et al.Frederiksenia canicola gen.nov.,sp.nov.isolated from dogs and human dog-bite wounds[J].Antonie van Leeuwenhoek,2014,105(4):731-741.DOI:10.1007/s10482-014-0129-0. |
| [164] Henton J,Jain A.Cochrane corner:antibiotic prophylaxis for mammalian bites(intervention review)[J].J Hand Surg Eur Vol,2012,37(8):804-806.DOI:10.1177/1753193412452204. |
| [165] 陈瑞丰,王立秋,黄立嵩,等.犬咬伤创口感染分布及特点的研究[J].中国急救复苏与灾害医学杂志,2011,6(1):21-23.DOI:10.3969/j.issn.1673-6966.2011.01.008.Chen RF,Wang LQ,Huang LS,et al.Distribution and characteristics of infection in dog bite wounds[J].Chin J Emerg Resuscit Dis Med,2011,6(1):21-23.DOI:10.3969/j.issn.1673-6966.2011.01.008. |
| [166] Kaplan MM,Wiktor T,Koprowski H.An intracerebral assay procedure in mice for chemical inactivation of rabies virus[J].Bull World Health Organ,1966,34(2):293-297. |
| [167] 中华人民共和国国家卫生和计划生育委员会.狂犬病暴露预防处置工作规范(2009年版)[EB/OL].[2013-08-07].http://www.xyws.gov.cn/news/61/5610.html.National Health and Family Planning Commission:Worke norm forprevention and treatment of rabies exposure(2009)[EB/OL].[2013-08-07].http://www.xyws.gov.cn/news/61/5610.html. |
| [168] 卫生部.过敏性紫癜等6种疾病诊疗指南[S].2010.Ministry of Health.Diagnosis guidline of 6 kind disease such as allergic purpura[S].2010. |
| [169] 黄肖梅.人用狂犬病疫苗不良反应的调查报告[J].海峡药学,2010,22(4):178-179.DOI:10.3969/j.issn.1006-3765.2010.04.099.Huang XM.The investigation report on the adverse reaction of huaman rabies vaccine[J].Strait J Prev Med,2010,22(4):178-179.DOI:10.3969/j.issn.1006-3765.2010.04.099. |
| [170] 史建伟,彭芝英,汤卫平,等.狂犬病疫苗接种后不良反应观察研究[J].实用预防医学,2006,13(6):1515-1516.DOI:10.3969/j.issn.1006-3110.2006.06.046.Shi JW,Peng ZY,Tang WP,et al.The observation on the adverse reaction of rabies vaccination[J].Pract Prev Med,2006,13(6):1515-1516.DOI:10.3969/j.issn.1006-3110.2006.06.046. |
| [171] 苏雪媚,李文东.狂犬疫苗致不良反应156例文献分析[J].中国药房,2009,20(17):1348-1350.Su XM,Li WD.Adverse drug reactions induced by rabies vaccine:literature analysis of 156 cases[J].Chin Pharm,2009,20(17):1348-1350. |
| [172] Simons FE,Ardusso LR,Bilò MB,et al.2012 Update:World Allergy Organization Guidelines for the assessment and management of anaphylaxis[J].Curr Opin Allergy Clin Immunol,2012,12(4):389-399.DOI:10.1097/ACI.0b013e 328355b7e4. |
| [173] Simons FER,Ardusso LRF,Vesselin D,et al.World Allergy Organization Anaphylaxis Guidelines:2013 update of the evidence base[J].Int Arch Allergy Immunol,2013,162(3):193-204.DOI:10.1159/000354543. |
| [174] 花高荣,葛传远.接种抗狂犬病血清不良反应观察[J].安徽预防医学杂志,2013,19(3):158-159.Hua GR,Ge CY.Adverse reaction after exposed to rabies antiserum[J].Anhui J Prev Med,2013,19(3):158-159. |
| [175] 左永波,杜松涛,钱燕玲,等.精制抗狂犬病血清的接种反应[J].中国生物制品学杂志,2007,20(12):930-931.DOI:10.3969/j.issn.1004-5503.2007.12.017.Zuo YB,Du ST,Qian YL,et al.Adverse reactions after vaccination with purified rabies antiserum[J].Chin J Biol,2007,20(12) 930-931.DOI:10.3969/j.issn.1004-5503.2007.12.017. |
| [176] 季冬英.狂犬病人免疫球蛋白不良反应的文献分析[J].中国药房,2014,25(18):1694-1696.Ji DY.Analysis of literatures on ADR induced by human rabies immunoglobulin[J].Chin Pharm,2014,25(18):1694-1696. |
 2016, Vol. 37
2016, Vol. 37