文章信息
- 赵嘉咏, 谢志强, 穆玉姣, 苏佳, 夏胜利, 黄学勇, 许汴利.
- Zhao Jiayong, Xie Zhiqiang, Mu Yujiao, Su Jia, Xia Shengli, Huang Xueyong, Xu Bianli.
- 河南省2009-2011年伤寒副伤寒沙门菌分子分型与耐药研究
- Characteristics of drug resistance and molecular type of Salmonella typhi and Salmonella paratyphi isolated in Henan province, 2009-2011
- 中华流行病学杂志, 2016, 37(1): 111-114
- Chinese Journal of Epidemiology, 2016, 37(1): 111-114
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.01.024
-
文章历史
- 投稿日期: 2015-04-26
伤寒副伤寒在我国一般呈散在发生,可出现局部暴发或流行,是我国法定报告的乙类传染病之一。本研究对2009-2011年河南省分离的78株伤寒副伤寒沙门菌进行PFGE分子特征分析与药敏测试,为指导临床合理用药和肠道传染病防控提供科学依据。
材料与方法1. 菌株来源:自河南省腹泻病多病原监测系统中选取2009-2011年分离自患者的伤寒副伤寒沙门菌78株,其中伤寒沙门菌5株,甲型副伤寒沙门菌71株,乙型、丙型副伤寒沙门菌各1株。
2. 主要试剂与仪器:主要试剂包括沙门菌科玛嘉鉴定培养基(法国CHROMAgar公司)、脑心浸液/M-H琼脂及药敏纸片(英国Oxoid公司)、API20E肠杆菌科细菌鉴定板条(法国bioMérieux公司)、沙门菌诊断血清(丹麦SSI公司)、药敏纸片分配器(英国Oxoid公司)、Seakem Glod琼脂糖(美国Lonza公司)、蛋白酶K(英国Roche公司)、限制性内切酶XbaⅠ[宝生物工程(大连)有限公司]、Tris-HCl/EDTA/5XTBE(北京Solarbio公司); 主要仪器包括VITEK浊度仪(法国bioMérieux公司)、去离子水系统(美国Milipore公司)、SHZ-C型水浴摇床(上海博迅仪器公司)、三温水浴锅(北京东方精瑞公司)、Minispin台式离心机(德国Eppendorf公司)、PFGE系统(美国Bio-Rad公司)、凝胶成像系统(美国Bio-Rad公司)。
3. 测试方法:①菌株的生化鉴定与血清分型:从沙门菌科玛嘉平板上直接挑取淡紫色菌落转种脑心浸液平板,37 ℃培养16~18 h,0.85%生理盐水制备0.5麦氏浊度菌液,API20E肠杆菌科系统生化鉴定,沙门菌诊断血清进行O相玻片凝集分型,再利用0.4%营养软琼脂(参见WHO沙门菌鉴定手册)进行H相(1/2相)鞭毛诱导与血清凝集,生理盐水做自凝对照。根据K-W血清分型表确定对应血清型别[1]。②药敏试验参照WHO推荐的Kirby-Bauer法,将伤寒副伤寒沙门菌转种脑心浸液琼脂平板,37 ℃培养16 h后0.85%生理盐水制成0.5麦氏单位悬液;用无菌棉拭子蘸取菌液均匀涂布于M-H平板表面,用分配器将药敏纸片压盖其上,15 min内送37 ℃温箱培养18 h后测量各药敏纸片抑菌圈直径,参照美国临床实验室标准化协会(CLSI)2009年标准进行耐药表型判定,大肠埃希菌ATCC25922作为质控菌株[2]。③PFGE分型:按照国际PulseNet网络实验室与美国CDC公布的沙门菌PFGE标准分型方法,对78株伤寒副伤寒沙门菌菌株进行分子分型,沙门菌标准株H9812作为分子质量标记。限制性内切酶XbaⅠ(50 U),37 ℃酶切2 h。电泳参数:电压6 V/cm,脉冲时间2.2~63.8 s,线性转换,电场角度120°,电泳时间19 h,电泳液温度14 ℃。电泳结束后胶块用GelRed染料染色20 min后纯水清洗30 min后凝胶成像仪拍照(曝光时间3.0 s,去过饱和成像)[3, 4]。
4. 数据分析:用BioNumerics 6.0软件对电泳图谱进行数据分析,绘制聚类分析树状图。聚类算法为非加权配对平均法(UPGMA),电泳条带位置优化度(position tolerance)1.5%,相似度100%认定为同一PFGE带型[5, 6]。
结 果1. 菌株背景资料:分离菌株的78例伤寒副伤寒患者中男女性别比为1.1 ∶ 1(41 ∶ 37); 以青壮年为主。其中16~18岁年龄组7例(9.0%),19~40岁组52例(66.7%),41~60岁组16例(20.5%),>60岁组3例(3.9%);分离时间多集中于每年5-10月,具有较典型的夏秋季节特征。
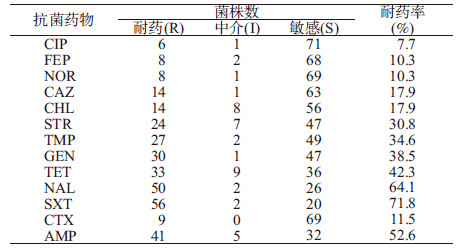
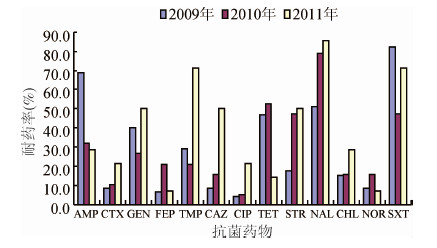
2. 药敏测试:78株伤寒副伤寒沙门菌中41株对广谱合成类青霉素氨苄西林(AMP)耐药,耐药率为52.6%;14株对三代头孢类头孢他啶(CAZ)耐药,耐药率为17.9%,9株对头孢噻肟(CTX)耐药,耐药率为11.5%;8株对四代头孢类头孢吡肟(FEP)耐药,耐药率为10.3%;50株对一代喹诺酮类萘啶酸(NAL)耐药,耐药率为64.1%;6株对三代氟喹诺酮类环丙沙星(CIP)耐药,耐药率为7.7%,8株对诺氟沙星(NOR)耐药,耐药率为10.3%;30株对氨基糖苷类庆大霉素(GEN)耐药,耐药率为38.5%,24株对链霉素(STR)耐药,耐药率为30.8%;14株对氯霉素类(CHL)耐药,耐药率为17.9%;27株对增效磺胺类甲氧苄氨嘧啶(TMP)耐药,耐药率为34.6%,56株对复方新诺明(SXT)耐药,耐药率为71.8%;33株对四环素(TET)耐药,耐药率为42.3%。78株伤寒副伤寒沙门菌中耐>2种抗生素的多重耐药菌株为62株(79.5%),其中耐2~3种为4株(5.2%),耐5~8种为41株(52.6%),耐9~10种为14株(17.9%),耐11~12种为3株(3.8%)。三代头孢类CAZ、CTX,一代与三代喹诺酮类NAL、CIP,氨基糖苷类STR耐药率总体呈年份上升趋势(表1,2和图1)。
|
| 图 1 2009-2011年河南省伤寒副伤寒沙门菌耐药率变化趋势 |
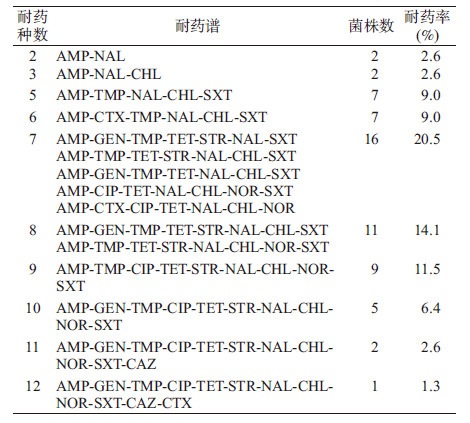
3. PFGE分子分型:78株伤寒副伤寒沙门菌经XbaⅠ酶切后共分为14种带型 (图2)。各带型包含菌株数1~47株,带型相似度为66.03%~100.00%,其中4株伤寒沙门菌分为2种带型(TY1/TY2),以TY1为主;72株甲型副伤寒沙门菌分为10种带型(PTYA1~PTYA10),PTYA1为主要优势带型,PTY4/6/7三种带型均包含7株菌,带型相似度与PTYA1很高(>95%),乙型与丙型副伤寒沙门菌各1株菌1种带型。78株伤寒副伤寒沙门菌PFGE带型与耐药谱之间呈现一定的对应关系,PTYA1、PTYA4、PTYA6与PTYA1/PTYA4间均存在耐药表型一致的菌株聚集现象,在单菌株带型对应的耐药谱中,带型与耐药谱未发现一致性或高相似性(表3)。

|
| 图 2 78株伤寒副伤寒沙门菌PFGE聚类分析 |
目前河南省伤寒副伤寒流行趋势以高度散发为主,暴发疫情偶然发生在卫生条件差的特殊人群中,发病率基本控制在1.75/10万至0.32/10万。由于慢性带菌者持续存在,传播途径不易彻底切断和人工免疫效果欠佳,输入性与聚集性病例仍时有出现。本研究中伤寒副伤寒病例多集中在18~40岁青壮年人群中,男女性别比趋于一致,发病时间集中于夏秋季,体现了河南省近年来伤寒副伤寒流行病学的基本特点和变化趋势。
临床过度治疗与抗生素滥用是造成病原菌耐药问题日益突出的主要原因。本研究中分离自病例的伤寒副伤寒沙门菌耐药问题十分严重,对8类13种抗菌药物均存在不同程度耐药,比较严重的有青霉素类、磺胺类、四环素类、氯霉素类、氨基糖苷类以及一代喹诺酮类,对临床常用药物三代喹诺酮类也存在一定程度耐药;其多重耐药情况也非常严重,临床分离菌株普遍对2~12种抗生素耐药,且对头孢类、喹诺酮类一线常用药及其他3类抗生素的耐药率呈逐年上升趋势,值得临床和公共卫生高度关注。这些多重耐药表型的出现一方面归因于病原菌的自发偶发性耐药突变,更重要的原因在于抗生素滥用产生的高选择压力和耐药基因的水平传递。
本研究利用PFGE分析伤寒副伤寒沙门菌全染色体“指纹图谱”特征。值得关注的是甲型副伤寒沙门菌XbaⅠ带型的高聚集性与相似度;部分伤寒副伤寒沙门菌的耐药表型与PFGE带型呈现聚类一致性,提示基于共同暴露源的菌株往往也具有相同的基因和耐药表型特征,这种特征尽管存在变异性和不确定性,但在一定范围内可以成为及早发现聚集性病例的重要指征参数。
利益冲突 无
| [1] 王鸣柳,阚飙,杨进,等. 广西壮族自治区1994-2013年伤寒流行病学特征及菌株耐药分析[J]. 中华流行病学杂志,2014,35(8):930-934. DOI:10.3760/cma.j.issn.0254-6450.2014.08.012. Wang ML,Kan B,Yang J,et al. Epidemiological characteristics of typhoid fever and antibiotic susceptibility testing of Salmonella typhi isolates in Guangxi,1994-2013[J]. Chin J Epidemiol,2014,35(8):930-934. DOI:10.3760/cma.j.issn.0254- 6450.2014.08. 012. |
| [2] Khan AA,Melvin CD,Dagdag EB. Identification and molecular characterization of Salmonella spp. from unpasteurized orange juices and identification of new serotype Salmonella strain S. enterica serovar tempe[J]. Food Microbiol,2007,24(5):539- 543. DOI:10.1016/j.fm.2006.09.002. |
| [3] Rivoal K,Protais J,Quéguiner S,et al. Use of pulsed-field gel electrophoresis to characterize the heterogeneity and clonality of Salmonella serotype enteritidis,typhimurium and infantis isolates obtained from whole liquid eggs[J]. Int J Food Microbio,2009,129(2):180-186. DOI:10.1016/j.ijfoodmicro.2008.11.021. |
| [4] Petrov P,Hendriksen RS,Kantardjiev T,et al. Occurrence and characterization of Salmonella enterica subspecies enterica serovar 9,12:l,v:-strains from Bulgaria,Denmark,and the United States[J]. Eur J Clin Microbiol Infect Dis,2009,28(5):473-479. DOI:10.1007/s10096-008-0653-9. |
| [5] Harbottle H,White DG,McDermott PF,et al. Comparison of multilocus sequence typing,pulsed-field gel electrophoresis,and antimicrobial susceptibility typing for characterization of Salmonella enterica serotype newport isolates[J]. J Clin Microbiol,2006,44(7):2449-2457. DOI:10.1128/JCM.00019- 06. |
| [6] Chiou CS,Lin JM,Chiu CH,et al. Clonal dissemination of the multi-drug resistant Salmonella enterica serovar Braenderup,but not the serovar Bareilly,of prevalent serogroup c1 Salmonella from Taiwan[J]. BMC Microbiol,2009,9:264. DOI:10.1186/1471-2180-9-264. |
 2016, Vol. 37
2016, Vol. 37