文章信息
- 陈陶阳, 曲春枫, 姚红玉, 陆玲玲, 樊健, 王宇婷, 黄飞, 陆建华, 倪正平, 樊春笋, 张亚玮.
- Chen Taoyang, Qu Chunfeng, Yao Hongyu, Lu Lingling, Fan Jian, Wang Yuting, Huang Fei, Lu Jianhua, Ni Zhengping, Fan Chunsun, Zhang Yawei.
- 启东乙型肝炎干预研究:2013年随访人群HBV感染及慢性肝病现患调查
- Long-term efficacy of neonatal hepatitis B vaccination against chronic hepatitis B virus infection and chronic liver disease: a cross-sectional study based on Qidong Hepatitis B Intervention Study
- 中华流行病学杂志, 2016, 37(1): 64-67
- Chinese Journal of Epidemiology, 2016, 37(1): 64-67
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.01.013
-
文章历史
- 投稿日期: 2015-06-15
2. 100021 北京, 中国医学科学院肿瘤医院分子肿瘤学国家重点实验室;
3. 100021 北京, 中国医学科学院肿瘤医院 免疫学研究室;
4. 美国耶鲁大学公共卫生学院环境健康科学系
2. State Key Lab of Molecular Oncology, Chinese Academy of Medical Sciences, Beijing 100021, China;
3. Immunology Department Cancer Institute/Hospital, Chinese Academy of Medical Sciences, Beijing 100021, China;
4. Department of Environmental Health Sciences, Yale School of Public Health, USA
启东乙肝干预研究(Qidong Hepatitis B Intervention Study,QHBIS)是一项具备大规模同龄对照人群的新生儿乙型肝炎(乙肝)疫苗接种试验(注册号:NCT00222664),1985-1990年为主体试验阶段,共纳入8万余名启东农村地区新生儿作为研究对象[1, 2]。该研究中疫苗接种组新生儿于出生后24 h、第1个月和第6个月分别接受3针(每针5 μg)血源性乙肝疫苗[3],大部分对照组研究对象在2000年10~14岁时接受3针(每针10 μg)基因重组乙肝疫苗[4]。近期通过对QHBIS形成的新生儿乙肝疫苗接种队列及同龄对照队列的随访,已证实新生儿乙肝疫苗接种可减少启东地区84%的原发性肝癌(PLC)[4]。为此本研究分析QHBIS随访队列2013年横断面调查资料,阐述新生儿接种乙肝疫苗对乙肝慢性感染及肝硬化等慢性肝病的远期保护作用。
对象与方法1. 研究对象:为QHBIS中1983-1990年启东地区出生的农村(排除父母一方为城镇人口者)新生儿,均为汉族,根据其母亲户口所在地,随机分配为乙肝疫苗接种组(疫苗组)和同龄对照组。有关QHBIS的研究设计及每出生年所纳入研究对象人数见已发表文献[1, 2, 3]。截止2013年底,新生儿疫苗接种队列总人数为33 947人,对照队列总人数为29 668人[4]。2013年1-10月采用分层随机抽样方法,从新生儿疫苗接种队列和同龄对照队列中各抽取约5 000人,该人群在收到启东现场乡村医生发放的书面通知后,至启东市人民医院体检中心接受横断面调查,内容包括自填式问卷、HBV感染相关的血清学检测、常规体检及肝胆B超检查。研究对象均签署知情同意书,本研究方案经启东市人民医院伦理委员会审核。
2. 研究方法:通过问卷获得一般信息(性别、年龄、婚姻状况、居住地等),经核对后以身份证号码作为唯一编码并用作研究对象性别、年龄核对及对缺失值的补充。血清ALT采用紫外-乳酸脱氢酶法检测(临床正常值上限为54 IU/L);HBV感染血清学标志物(“乙肝两对半”)检测采用ELISA,直接免疫酶标法检测HBsAg、HBeAg及抗-HBs(样品A值高于阴性对照至少2.1倍判定为阳性,HBsAg检测敏感性为0.5 ng/ml);抗-HBe和抗-HBc检测则采用竞争法,每次检测设置6个阴性对照,根据说明书的计算方法获得检测的临界值(COV)(样品A值低于COV判定为阳性)。抗-HBc检测时,血清预先行30倍稀释,其余4项均采用原血清检测。“乙肝两对半”及ALT检测试剂均购自上海科华生物公司(HBsAg批号:201212051,抗-HBs批号:201212011,HBeAg批号:201205031,抗-HBe批号:201212021,抗-HBc批号:201212012,ALT批号:20121232),所有检测均在启东市人民医院检验科完成。肝胆B超在启东市人民医院体检中心完成,B超结果与调查问卷同时录入EpiData 3.1软件。
3. 诊断标准:根据2010版《慢性乙型肝炎防治指南》结合本研究的特点,乙肝慢性感染活动期的诊断标准为HBsAg阳性合并ALT大于临床正常值(54 IU/L);慢性肝病的诊断标准为HBsAg阳性者合并腹部B超影像发现肝脏表面粗糙,实质内出现回声分布不均。
4. 统计学分析:采用SAS 9.3软件合并人口学信息、ALT数值、HBV血清学感染指标及肝胆B超数据。符合正态分布的连续变量采用x±s表示,分类变量采用频数及构成比表示。二项分布计算率或构成比的95%CI,率或构成比的组间比较采用 χ2检验(必要时采用Fisher精确概率法)。所有假设检验均为双侧,P<0.05为差异有统计学意义。
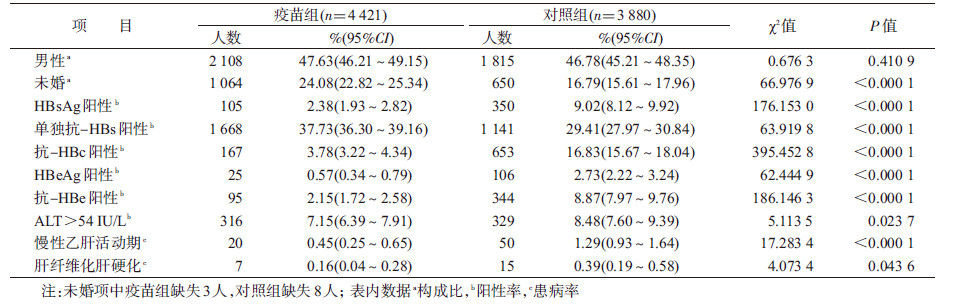
结 果1. HBV感染标志物阳性率及慢性肝病患病率: 总有效调查人数为8 301人。其中疫苗组4 421(男性2 108、女性2 313)人,平均年龄(25.59±1.84)岁;对照组3 891(男性1 815、女性2 065)人,平均年龄(26.61±2.24)岁。疫苗组HBsAg、单独抗-HBs、抗-HBc、HBeAg和抗-HBe阳性率分别为2.38%、37.73%、3.78%、0.57%和2.15%,对照组分别为9.02%、29.41%、16.83%、2.73%和8.87%,两组间上述指标的差异均有统计学意义(P<0.05);疫苗组慢性乙肝活动期及慢性肝病的患病率分别为0.45%和0.16%,对照组分别为1.29%和0.39%,两组间患病率的差异均有统计学意义(P<0.05),见表1。
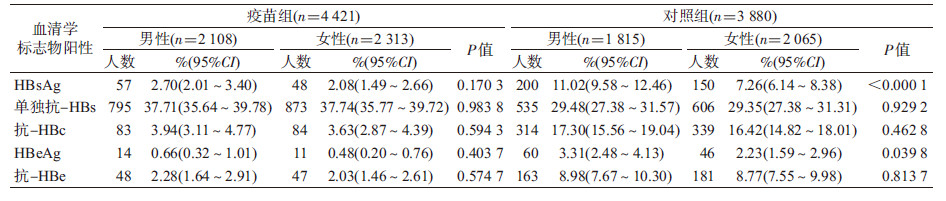
2. HBV感染标志物阳性率:按性别分层后疫苗组HBsAg、单独抗-HBs、抗-HBc、HBeAg及抗-HBe阳性率的差异在性别间均无统计学意义(P>0.05);对照组男性HBsAg及HBeAg阳性率均高于女性,差异有统计学意义(P<0.05),见表2。
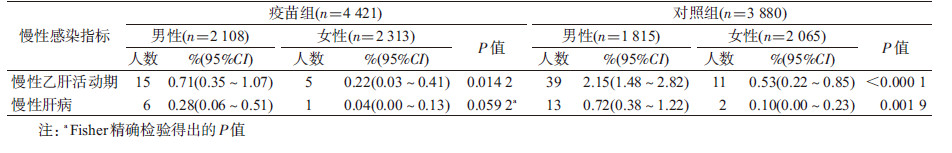
3. 慢性乙肝活动期及其他慢性肝病患病率:按性别分层后疫苗组男性慢性乙肝活动期患病率高于女性(差异有统计学意义,P=0.014 2),慢性肝病患病率男性虽高于女性,但统计学差异处于临界值(P=0.059 2);对照组无论慢性乙肝活动期患病率还是慢性肝病患病率,均为男性高于女性,差异有统计学意义(P<0.05),见表3。
我国HBV慢性感染主要发生于学龄前,1992年全国HBV感染流行病学调查结果表明,1~4岁组儿童HBsAg阳性率与成年组相当[5]。在QHBIS接种人群的既往研究结果表明,新生儿乙肝疫苗接种对成年后HBsAg携带的保护效力也远高于10~14岁时的乙肝疫苗补种[4],所产生的免疫记忆至少可持续到20岁[6]。本研究分析QHBIS随访队列2013年横断面抽样调查资料发现,在研究人群整体进入婚配年龄(>22周岁)后,反映HBV感染的3项血清学指标(HBsAg、抗-HBc、HBeAg)阳性率,疫苗组均远低于对照组。其中HBsAg是反映HBV感染总体流行情况的最重要指标,本文疫苗组HBsAg阳性率为2.38%,高于张焕珠等[7]报道的上海地区1986年出生者在接受新生儿期血源性乙肝疫苗接种23年后的HBsAg阳性率(0.68%),并稍高于2006年HBV感染全国血清学调查报道的接种后人群HBsAg阳性率(2.1%)[8]以及对新生儿接种后人群13~23年随访得出的HBsAg阳性率(2.01%)[9],但与我国台湾地区学者报道的新生儿疫苗接种22~24年后[10],接种人群的HBsAg阳性率(2.0%~3.0%)相似。对照组人群尽管在10~14岁时补种了乙肝疫苗,但HBsAg阳性率仍高达9.02%,处于HBV高流行区水平,与广西地区的研究结论相近[11]。
QHBIS的中期目标是观察新生儿乙肝疫苗接种预防HBV慢性感染和慢性乙肝,研究终点则是失代偿性肝硬化和PLC。慢性乙肝和肝硬化为HBV感染后病程演变过程中的不同疾病状态,与PLC相比,难以获取确切的发病数据,通过横断面研究比较现患率可作为替代,也较容易实施。本研究结果显示,疫苗组慢性乙肝活动期患病率约为对照组的1/3。Peto等[12]最近在非洲冈比亚乙肝疫苗接种研究远期随访队列的横断面分析显示,慢性乙肝活动期患病率在未接种人群为4.1%,高于本研究的1.29%;疫苗组为0.2%,低于本研究的0.45%。本研究按性别分层后发现,女性慢性乙肝活动期患病率低于男性,因此疫苗保护作用的性别差异值得进一步研究。
本研究疫苗组慢性肝病(肝纤维化、肝硬化)患病率也低于对照组,但男性与女性间患病率差异的P值接近0.05。2000年我国台湾地区报道认为,从降低PLC发病的角度,相对于女性接种者,男性更能从新生儿乙肝疫苗接种获得保护作用[13]。但本研究未能排除HCV感染及过量酒精摄入等导致的肝纤维化、肝硬化,为研究中的不足。对照组(新生儿期未接种人群)男性的HBsAg和HBeAg阳性率均高于女性,而疫苗组则未发现HBsAg和HBeAg阳性率的性别差异。随着随访队列继续观察,通过比较男女性接种人群的肝癌发病率,结合其他先天或后天暴露因素的检测,或有助于阐明HBV感染在肝癌发病性别差异中所起的作用[14, 15]。
综上所述,QHBIS随访队列的2013年横断面抽样调查研究显示,新生儿乙肝疫苗接种对接种人群的保护作用可延长至婚配年龄以后,然而疫苗接种对不同性别人群慢性乙肝与肝硬化现患保护作用的差异有待进一步研究。
利益冲突 无| [1] Sun ZT,Ming LH,Zhu X,et al. Prevention and control of hepatitis B in China[J]. J Med Virol,2002,67(3):447-450. DOI:10.1002/jmv.10094. |
| [2] Sun TT,Chu YR,Ni ZQ,et al. A pilot study on universal immunization of newborn infants in an area of hepatitis B virus and primary hepatocellular carcinoma prevalence with a low dose of hepatitis B vaccine[J]. J Cell Physiol Suppl,1986,129 Suppl 4:83-90. DOI:10.1002/jcp.1041290415. |
| [3] Sun Z,Zhu Y,Stjernsward J,et al. Design and compliance of HBV vaccination trial on newborns to prevent hepatocellular carcinoma and 5-year results of its pilot study[J]. Cancer Detect Prev,1991,15(4):313-318. |
| [4] Qu CF,Chen TY,Fan CS,et al. Efficacy of neonatal HBV vaccination on liver cancer and other liver diseases over 30-year follow-up of the Qidong hepatitis B intervention study:a cluster randomized controlled trial[J]. PLoS Med,2014,11(12):e1001774. DOI:10.1371/journal.pmed.1001774. |
| [5] Xia GL,Liu CB,Cao HL,et al. Prevalence of hepatitis B and C virus infections in the general Chinese population. Results from a nationwide cross-sectional seroepidemiologic study of hepatitis A,B,C,D and E virus infections in China,1992[J]. Int Hepatol Commun,1996,5(1):62-73. DOI:10.1016/S0928-4346(96)82012-3. |
| [6] Zhu CL,Liu P,Chen TY,et al. Presence of immune memory and immunity to hepatitis B virus in adults after neonatal hepatitis B vaccination[J]. Vaccine,2011,29 (44):7835-7841. DOI:10. 1016/j.vaccine.2011.07.098. |
| [7] 张焕珠,吴维寿,宿飞,等. 上海市黄浦区新生儿血源乙型肝炎疫苗免疫后23年免疫效果追踪[J]. 中华流行病学杂志,2012,33(2):207-209. DOI:10.3760/cma.j.issn.0254- 6450.2012.02. 018. Zhang HZ,Wu WS,Su F,et al. Evaluation on the immunization efficacy on the 23 years who had received plasma-dirived HBV vaccine as newborns[J]. Chin J Epidemiol,2012,33(2):207-209. DOI:10.3760/cma.j.issn.0254-6450.2012.02.018. |
| [8] Liang XF,Bi SL,Yang WZ,et al. Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine,2009,27 (47):6550-6557. DOI:10.1016/j.vaccine.2009.08.048. |
| [9] Wang F,Shen LP,Cui FQ,et al. The long-term efficacy,13-23 years,of a plasma-derived hepatitis B vaccine in highly endemic areas in China[J]. Vaccine,2015,33 (23):2704-2709. DOI:10.1016/j.vaccine.2015.03.064. |
| [10] Ni YH,Chang MH,Wu JF,et al. Minimization of hepatitis B infection by a 25-year universal vaccination program[J]. J Hepatol,2012,57(4):730-735. DOI: 10.1016/j.jhep.2012.05. 021. |
| [11] Fang ZL,Harrison TJ,Yang JY,et al. Prevalence of hepatitis B virus infection in a highly endemic area of southern China after catch-up immunization[J]. J Med Virol,2012,84(6):878-884. DOI:10.1002/jmv.23278. |
| [12] Peto TJ,Mendy ME,Lowe Y,et al. Efficacy and effectiveness of infant vaccination against chronic hepatitis B in the Gambia Hepatitis Intervention Study (1986-90) and in the nationwide immunisation program[J]. BMC Infect Dis,2014,14:7. DOI:10.1186/1471-2334-14-7. |
| [13] Chang MH,Shau WY,Chen CJ,et al. Hepatitis B vaccination and hepatocellular carcinoma rates in boys and girls[J]. JAMA,2000,284(23):3040-3042. DOI: 10.1001/jama.284.23.3040. |
| [14] Seton-Rogers S. Hepatocellular carcinoma:gender differences[J]. Nat Rev Cancer,2014,14(9):578-579. DOI:10.1038/nrc3808. |
| [15] Humphries C. Sex differences:Luck of the chromosomes[J]. Nature,2014,516(7529):S10-11. DOI:10.1038/516S10a. |
 2016, Vol. 37
2016, Vol. 37