文章信息
- 黄三唤, 徐叶清, 陈茂林, 黄锟, 潘维君, 葛星, 严双琴, 毛雷婧, 牛影童, 童世庐, 陶芳标.
- Huang Sanhuan, Xu Yeqing, Chen Maolin, Huang Kun, Pan Weijun, Ge Xing, Yan Shuangqin, Mao Leijing, Niu Ying, Tong Shilu, Tao Fangbiao.
- 孕中期血糖水平与新生儿出生体重的队列研究
- Mid-gestational glucose levels and newborn birth weight: birth cohort study
- 中华流行病学杂志, 2016, 37(1): 45-49
- Chinese Journal of Epidemiology, 2016, 37(1): 45-49
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.01.009
-
文章历史
- 投稿日期: 2015-05-25
2. 243000 安徽省马鞍山市妇幼保健院院部;
3. 243000 安徽省马鞍山市妇幼保健院 妇产科;
4. 243000 安徽省马鞍山市妇幼保健院保健部
2. Department of Administration, Maternal and Child Health Care Center of Ma'anshan, Ma'anshan 243000, China;
3. Department of Obstetrics and Gynecology, Maternal and Child Health Care Center of Ma'anshan, Ma'anshan 243000, China;
4. Department of Health Care, Maternal and Child Health Care Center of Ma'anshan, Ma'anshan 243000, China
大于胎龄儿(LGA)指新生儿出生体重大于相同胎龄正常体重第90百分位(P90)者,是肥胖、糖尿病等代谢异常疾病的重要危险因素之一[1]。多种因素影响新生儿出生体重,包括孕期血糖、孕期血压、孕前BMI、孕期增重、产次等。而胎儿宫内暴露于高水平血糖可能导致巨大儿、剖宫产、肩难产或产伤等不良出生结局[2]。高血糖与不良妊娠结局研究合作组(HAPO)证实,LGA发生率会随血糖水平的增高而不断增大[3],表明血糖水平的升高可增加胎儿过度生长的风险。本研究基于马鞍山优生优育队列(Ma’anshan-Anhui Birth Cohort,MABC),探讨孕中期FPG值和服糖后1 h、2 h血糖水平与新生儿出生体重的关系及其与发生LGA的关联。
对象与方法1. 研究对象:将2013年5月至2014年9月在马鞍山市妇幼保健院建卡且符合以下标准的孕妇纳入队列:①年龄≥18周岁,首次产检并建立围产手册;②孕周≤14周;③有意向在马鞍山市妇幼保健院定期产检和分娩;④语言表达能力正常,能独立完成调查;⑤无精神病史。所有研究对象均征得书面知情同意。排除标准:①妊娠期显性糖尿病(孕早期FPG≥7.0 mmol/L)或糖尿病合并妊娠;②双(多)胎妊娠;③未完成75 g口服糖耐量试验(OGTT);④无分娩及新生儿情况记录。
2. 研究方法:初次建册时孕妇填写孕早期(孕周≤14周)问卷,内容包括孕妇出生日期、文化程度、职业、孕早期吸烟饮酒情况、生育史、家庭人均月收入、疾病史等。并由专门人员测量身高体重(杠杆式磅秤)、血压(水银血压计)。孕周大小依据末次月经推算,若末次月经不确定则依据首次B超结果判断。孕中期(孕24~28周)直接行OGTT,由马鞍山市市立医疗集团临床检验中心完成检测并由专门人员抄录结果。三项血糖值符合任意一项者诊断为妊娠期糖尿病:①FPG≥5.1 mmol/L;②OGTT-1 h≥10.0 mmol/L;③OGTT-2 h≥8.5 mmol/L。孕妇分娩时由专门调查员填写分娩及新生儿情况记录表,包括分娩孕周、分娩并发症、分娩方式、妊娠并发症,新生儿出生体重、身长、头围、胸围、Apgar评分和出生缺陷等。采用文献[4]2011年最新标准,以本研究新生儿出生体重的均值和变异系数(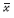 =3 489.6 g,CV=11.171%)为参考诊断LGA、小于胎龄儿(SGA)及适于胎龄儿(AGA)。
=3 489.6 g,CV=11.171%)为参考诊断LGA、小于胎龄儿(SGA)及适于胎龄儿(AGA)。
3. 统计学分析:采用EpiData 3.0 和SPSS 16.0软件录入分析数据,以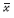 ± s描述正态分布的计量资料,百分数描述计数资料。利用t和 χ2检验分析未完成和完成OGTT组孕妇的一般人口统计学特征差异,采用多项logistic回归法分析新生儿出生体重影响因素、多元线性回归法分析血糖值与新生儿出生体重的关系。P<0.05判断为差异有统计学意义。
± s描述正态分布的计量资料,百分数描述计数资料。利用t和 χ2检验分析未完成和完成OGTT组孕妇的一般人口统计学特征差异,采用多项logistic回归法分析新生儿出生体重影响因素、多元线性回归法分析血糖值与新生儿出生体重的关系。P<0.05判断为差异有统计学意义。
1. 一般资料:队列共纳入3 474人,其中宫外孕2人,胚胎停止发育(孕10周内胚胎发育异常)75人,治疗性引产30人,自然流产45人,死胎引产7人,早产死胎或死产3人。排除妊娠期显性糖尿病和糖尿病合并妊娠者13人,双胎妊娠39人,无分娩及新生儿情况记录7人,未完成OGtt者172人。最终3 081例活产单胎及孕妇资料完整者纳入本研究,纳入队列时孕妇平均年龄(26.13±3.62)岁;78.4%(2 407/3 070)长期居住市区;汉族孕妇占98.4%(3 032/3 080);孕前BMI均值为(20.86±2.83) kg/m2;平均胎龄(39.2±1.36)周;90.3%(2 778/3 076)为初产妇;孕早期吸烟者占2.8%(87/3 078);8.0%(246/3 072)孕妇孕早期有饮酒史。未完成OGtt的172例与进入本研究的3 081例孕妇平均年龄(t=1.252,P=0.211)、孕前BMI(
将出生体重分为LGA、SGA和AGA组(对照组)作为因变量,以孕前BMI(<18.5、18.5~、24.0~、≥28.0 kg/m2)、高血压情况(慢性高血压合并妊娠组、妊娠期高血压组、子痫前期组和血压正常组)和妊娠糖尿病情况、产次(初产与经产)、孕妇年龄(≤24、25~、30~、>35岁)、孕早期吸烟饮酒状况、文化程度(小学或以下、初中、高中或中专、大专、本科及以上)、家庭人均月收入(<2 500、2 500~、 >4 000元)和新生儿性别为自变量,进行多项logistic回归分析。结果显示孕前消瘦(BMI<18.5 kg/m2)、初产会降低新生儿LGA的发生风险,男性新生儿LGA的发生风险较女性高,妊娠期糖尿病和孕前超重(24.0 kg/m2≤BMI<28.0 kg/m2)是LGA发生的高危因素。对于SGA而言,孕前消瘦和子痫前期是危险因素,妊娠期糖尿病对SGA影响的差异无统计学意义(表1)。孕妇年龄、文化程度、家庭人均月收入、吸烟饮酒情况对LGA和SGA发生的影响均无统计学意义(统计分析结果未在表1中显示)。
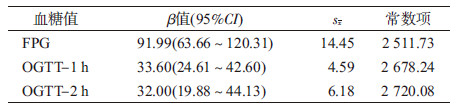
2. 血糖值与新生儿出生体重的多元线性回归分析:分别以孕中期FPG值及OGTT-1 h、2 h值作为自变量,新生儿出生体重为因变量,控制因素为孕前BMI、孕妇年龄、产次、高血压情况、文化程度、家庭人均月收入、孕早期孕妇吸烟饮酒状况、新生儿性别,结果显示三项血糖值与新生儿出生体重均呈正相关,即随着血糖水平升高,新生儿出生体重增大,三项血糖每增加1 mmol/L,新生儿出生体重分别增加91.99 g、33.60 g、32.00 g(表2)。
3. 血糖四分位分组与新生儿出生体重的关系:将FPG、OGTT-1 h和OGTT-2 h血糖值分别按四分位分组,并以此为横坐标,各组新生儿出生体重均值为纵坐标作线图,可见随孕妇血糖四分位数升高各组新生儿出生体重均值呈上升趋势(图1)。
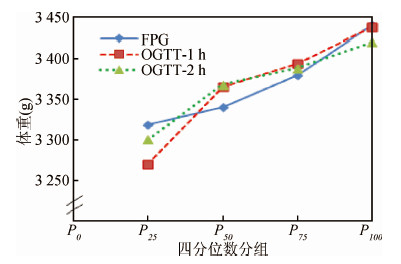
|
| 图 1 三项血糖值四分位分组与新生儿出生体重的关系 |
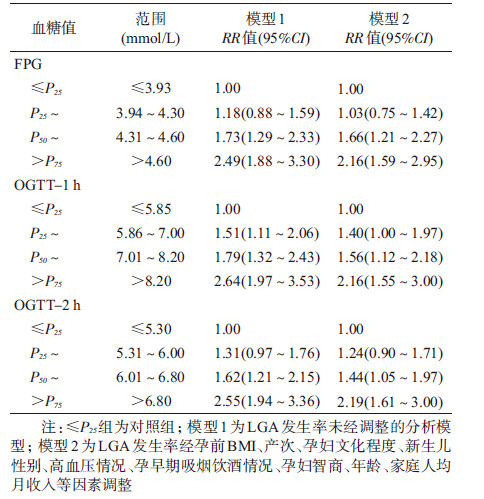
4. 血糖值四分位分组与LGA发生风险的分析:本研究中LGA、SGA发生率分别为16.6%和9.7%。采用多项logistic回归分析法,以新生儿出生体重分组为因变量(AGA组为对照组),血糖四分位分组为自变量(血糖值≤P25为对照组),分别分析三项血糖值P25~P50、P50~P75、>P75三组的LGA发生风险(表3)。结果可见随着三项血糖值四分位升高,LGA的发生风险呈增大趋势,调整前后血糖四分位与发生LGA的关联都逐渐增强。
妊娠期糖尿病孕妇发生LGA的风险是非妊娠期糖尿病患者的2.39倍。Sung等[2]研究认为,在非糖尿病孕妇中,孕期动态监测的血糖水平与新生儿出生体重百分数有关联(r=0.29,P<0.05)。也有研究显示妊娠期糖尿病和孕期肥胖都是LGA的危险因素(OR=2.19,95%CI:1.93~2.47;OR=1.73,95%CI:1.50~2.00),两者交互作用对LGA影响更大(OR=3.62,95%CI:3.04~4.32)[5]。孕妇高血糖持续通过胎盘可引起胎儿高血糖,刺激胎儿胰岛素分泌增加,导致胎儿高胰岛素血症。胰岛素是胎儿期最关键的生长因素,直接或间接刺激胰岛素样生长因子轴,促使胎儿生长加速[6]。因此高血糖孕妇的子代为巨大儿的风险较大。但母体血糖水平异常升高只能对胎儿过大做出部分解释,胎儿生长过速存在着其他的影响因素,如孕期增重[7, 8]、孕前BMI[8, 9]、产次、胎儿性别等。多项logistic回归分析结果显示,孕妇初产是LGA发生的保护因素,孕前超重是LGA发生的危险因素;另外,LGA的发生有性别差异,男性胎儿发生的可能性更大。孕前消瘦会降低LGA发生的风险,但又有增大SGA出生的可能。子痫前期患者SGA出生的风险是血压正常组孕妇的5.39倍,但妊娠期糖尿病对其影响无统计学意义。此外,年龄、家庭收入和吸烟饮酒情况对LGA、SGA的影响均无统计学意义(P<0.05)。Lee等[10]研究结论为不吸烟但孕期暴露于吸烟环境的孕妇胎儿发生SGA的可能性比对照组更大(OR=1.59,95%CI:1.05~2.42)。刘涛等[11]通过Meta分析发现孕妇孕期被动吸烟是SGA的危险因素。本研究只考虑了孕早期孕妇吸烟情况,未考虑孕中、晚期吸烟情况和孕期二手烟暴露,可能对结果有偏倚。
本研究将孕前BMI、产次、新生儿性别、孕妇高血压情况、孕早期吸烟饮酒情况、孕妇年龄、家庭人均月收入、文化程度等因素作为控制变量,分别分析三项血糖值与新生儿出生体重的关系。结果显示三项血糖值与新生儿出生体重均呈正相关。分别以血糖四分位分组和各组新生儿出生体重均值为横纵坐标作图,新生儿出生体重随FPG、OGTT-1 h和OGTT-2 h升高趋势接近一致。
国内研究大多以1988年我国15个城市不同胎龄新生儿正常体重标准诊断LGA和SGA。以此标准,安徽C-ABCS队列报道的合肥、芜湖、马鞍山三地SGA发生率为3.4%[12]。太原市LGA和SGA发生率分别为9.04%和9.94%[13]。以自身队列出生体重x和s作标准,2002年广州地区LGA 和SGA发生率分别为9.2%和10.0%,2012年为8.5%和8.6%[14]。为更准确判断,本研究以队列孕妇中孕40周分娩的新生儿出生体重的x和CV代入公式诊断,LGA、SGA发生率较高。除受判断标准不同的影响,各地区LGA、SGA发生率的差异可能还与各地经济发展水平和人口学特征等有关。
多项logistic回归法分析血糖四分位分组与LGA发生风险,发现随着血糖四分位升高,调整前后LGA的发生风险都逐渐上升。经混杂因素调整后三项血糖值>P75组发生LGA的风险相近,分别是对照组的2.16、2.16、2.19倍;P50~P75组发生LGA的风险分别是对照组的1.66、1.56和1.44倍。结果表明FPG、OGTT-1 h和OGTT-2 h均能很好预测LGA的发生且效果相近,对于无法完成OGTT的孕妇来说,孕中期FPG值同样可以作为新生儿出生体重预测因素之一。
HAPO研究证实,LGA的发生率会随血糖水平的增高而不断增大[3]。Stuebe等[15]研究结果提示血糖水平与LGA的发生呈线性相关(P<0.05),但尚无法确定某阈值以控制不良出生结局在最小范围。国内有研究认为,孕期FPG水平控制在3.5~4.9 mmol/L较为适宜[16]。孕期血糖水平控制在何种程度以最大限度降低不良出生结局需进一步研究。
本研究存在局限。首先,所有研究对象都是在马鞍山市妇幼保健院纳入,可能影响结果的代表性;其次,本次研究未考虑孕中期后孕妇血糖水平的控制情况,结果可能存在部分偏倚;此外,目前队列尚未列入检测胎盘项目,而胎盘功能对评估胎儿生长和孕妇血糖水平有一定意义。
本研究结论为孕中期行OGTT的血糖值四分位分组与新生儿出生体重呈正线性相关,且随着其四分位升高,LGA发生风险增大,但对发生SGA的影响无统计学意义。结果提示与OGTT-1 h、OGTT- 2 h相比,FPG对发生LGA有同样的预测价值。
利益冲突 无| [1] Yachi Y,Tanaka Y,Nishibata I,et al. Second trimester postload glucose level as an important predictor of low birth weight infants:Tanaka women's clinic study[J ]. Diabetes Res Clin Pract,2014,105(3):e16-19. DOI:10.1016/j.diabres.2014.02.006. |
| [2] Sung JF,Kogut EA,Lee HC,et al. Correlation of continuous glucose monitoring profiles with pregnancy outcomes in nondiabetic women[J]. Am J Perinatol,2015,32(5 ):461-468. DOI:10.1055/s-0034-1390344. |
| [3] HAPO Study Cooperative Research Group,Metzger BE,Lowe LP,et al. Hyperglycemia and adverse pregnancy outcomes[J]. N Engl J Med,2008,358(19):1991-2002. DOI: 10.1056/NEJMoa 0707943. |
| [4] Mikolajczyk RT,Zhang J,Betran AP,et al. A global reference for fetal-weight and birthweight percentiles[J]. Lancet,2011,377(9780):1855-1861. DOI: 10.1016/S0140-6736(11)60364-4. |
| [5] Rogne T,Jacobsen GW. Association between low blood glucose increase during glucose tolerance tests in pregnancy and impaired fetal growth[J]. Acta Obstet Gynecol Scand,2014,93(11):1160-1169. DOI:10.1111/aogs.12365. |
| [6] Sommer C,Sletner L,Mørkrid K,et al. Effects of early pregnancy BMI,mid-gestational weight gain,glucose and lipid levels in pregnancy on offspring's birth weight and subcutaneous fat:a population-based cohort study[J]. BMC Pregnancy Childbirth,2015,15:84. DOI:10.1186/s12884-015-0512-5. |
| [7] Dzakpasu S,Fahey J,Kirby RS,et al. Contribution of prepregnancy body mass index and gestational weight gain to adverse neonatal outcomes:population attributable fractions for Canada[J]. BMC Pregnancy Childbirth,2015,15:21. DOI:10.1186/s12884-015-0452-0. |
| [8] Yu ZB,Han SP,Zhu JA,et al. Pre-pregnancy body mass index in relation to infant birth weight and offspring overweight/obesity:a systematic review and meta-analysis [J]. PLoS One,2013,8(4):e61627. DOI:10.1371/journal. pone.0061627. |
| [9] Catalano PM,McIntyre HD,Cruickshank JK,et al. The hyperglycemia and adverse pregnancy outcome study:associations of GDM and obesity with pregnancy outcomes[J]. Diabetes Care,2012,35(4):780-786. DOI:10.2337/dc11-1790. |
| [10] Lee J,Lee DR,Lee DH,et al. Influence of maternal environmental tobacco smoke exposure assessed by hair nicotine levels on birth weight[J]. Asian Pac J Cancer Prev,2015,16(7):3029-3034. DOI:10.7314/APJC P.2015.16.7.3029. |
| [11] 刘涛,陈维清,何艳辉,等. 孕妇被动吸烟与小于胎龄儿关系的Meta分析[J]. 中华流行病学杂志,2009,30(1):68-72. DOI:10.3760/cma.j.issn.0254-6450.2009.01.019. Liu T, Chen WQ,He YH,et al. A Meta-analysis on the association between maternal passive smoking during pregnancy and small-for-gestational-age infants[J]. Chin J Epidemiol,2009,30(1):68-72. DOI:10.3760/cma.j.issn.0254-6450.2009.01.019. |
| [12] 徐蓉,郝加虎,陶芳标,等. 10 407名单胎活产儿SGA发生率及其影响因素的队列研究[J]. 中国妇幼保健,2012,27(4):560-565. DOI:10.3969/j.issn.1001-4411(2012)04-0560- 06. Xu R,Hao JH,Tao FB,et al. Cohort study on the incidence and effect factors of small for gestational age among 10 407 infants with single fetus and live birth[J]. Mater Child Health Care Chin,2012,27(4):560-565. DOI:10.3969/j.issn.1001-4411(2012)04-0560-06. |
| [13] 张燕萍,齐惠萍,封宝琴,等. 新生儿胎龄体重参考标准研究[J]. 中国妇幼保健,2008,23(32):4575-4579. DOI:10.3969/j.issn.1001-4411.2008.32.027. Zhang YP,Qi HP,Feng BQ,et al. Research on reference standard of gestational age weight[J]. Mater Child Health Care Chin,2008,23(32):4575-4579. DOI:10.3969/j.issn.1001-4411. 2008.32.027. |
| [14] Guo Y,Liu Y,He JR,et al. Changes in birth weight between 2002 and 2012 in Guangzhou,China[J]. PLoS One,2014,9(12):e115703. DOI: 10.1371/journal.pone.0115703. |
| [15] Stuebe AM,Landon MB,Lai Y,et al. Is there a threshold oral glucose tolerance test value for predicting adverse pregnancy outcome?[J]. Am J Perinatol,2015,32( 9):833-838. DOI:10.1055/s-0034-1543949. |
| [16] Zhu M,Cai J,Liu SJ,et al. Relationship between gestational fasting plasma glucose and neonatal birth weight,prenatal blood pressure and dystocia in pregnant Chinese women[J]. Diabetes Metab Res Rev,2014,30(6):489-496. DOI:10.1002/dmrr.2544. |
 2016, Vol. 37
2016, Vol. 37