文章信息
- 李柏生, 谭海玲, 柯碧霞, 何冬梅, 柯昌文, 张永慧.
- Li Baisheng, Tan Hailing, Ke Bixia, He Dongmei, Ke Changwen, Zhang Yonghui.
- 广东省2014年食源性副溶血弧菌病原学特征分析
- Etiologic characteristics of food-borne Vibrio parahaemolyticus strains isolated in Guangdong, 2014
- 中华流行病学杂志, 2015, 36(11): 1283-1287
- Chinese Journal of Epidemiology, 2015, 36(11): 1283-1287
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.11.020
-
文章历史
- 投稿日期: 2015-03-17
副溶血弧菌近年来导致的食源性疾病已超过非伤寒沙门菌成为我国食源性疾病暴发的首要病原菌[1, 2, 3]。2014年广东省食源性疾病监测及食物中毒事件中共分离到副溶血弧菌60株,为了解这些菌株之间的菌型分布特征和遗传相关性,本研究对分离的60株菌进行血清分型、抗生素敏感性试验及耐热直接溶血素基因(tdh)和耐热相关溶血素基因(trh)PCR检测,并结合脉冲场凝胶电泳(PFGE)分型和多位点序列分型(MLST)进行分子特征分析。
材料与方法1. 菌株及试剂:2014年广东省共分离收集到副溶血弧菌60株。其中在食源性疾病监测中分离到41株,一起疑似食物中毒事件处理中分离到19株(病例源8株、食品源11株)。选用TCBS培养基(广东环凯公司)作为选择性分离培养基,副溶血弧菌血清分型用的各种O和K血清购自日本Denka Seiken公司。所有试剂均在有效期内使用。
2. 血清学分型:用3%NaCl TSA培养物上的菌苔做玻片凝集检测K抗原。取新鲜培养物至3% NaCl灭菌盐水试管中研磨制成均匀浓厚的菌悬液,经121 ℃灭菌1 h,4 000 r/min离心10 min,吸弃上清液,再用3% NaCl灭菌盐水重悬,此菌悬浮液用于检测O抗原,用生理盐水作对照。
3. 抗生素敏感性试验:参照《全国临床检验操作规程》和美国临床实验室标准化委员会(CLSI),采用Kirby-Bauer纸片法进行抗生素敏感试验,12种抗菌药物分别为氨苄西林(AMP,10 μg)、四环素(TCY,30 μg)、复方新诺明(SXT,1.25 μg/23.5 μg)、氯霉素(CHL,30 μg)、庆大霉素(GEN,10 μg)、磺胺复合物(S3,300 μg)、环丙沙星(CIP,5 μg)、阿米卡星(AMK,30 μg)、头孢噻吩(CTX,30 μg)、头孢曲松(CRO,30 μg)、萘啶酸(NAL,30 μg)和亚胺培南(IPM,5 μg)。抑菌圈判定标准参照CLSI 2014药敏试验指南中规定的肠杆菌科抑菌圈直径判定标准。药敏试验采用ATCC25922大肠埃希菌做质控菌株。所有抗生素纸片及M-H琼脂平板购自OXOID公司,实验结果采用WHONET 5.4软件进行录入和分析。
4. 细菌DNA提取:用水煮法粗提DNA,具体步骤:经复苏的分离株接种于3%NaCl TSA斜面培养基,37 ℃培养18~24 h后,挑取1环菌苔于200 μl灭菌水中充分研磨,菌悬液于100 ℃水浴10 min后冰浴5 min,10 000 r/min离心5 min,上清即为菌株DNA稀释液。
5. 毒力因子PCR检测:对60株副溶血弧菌进行毒力因子(tdh、trh)PCR检测。PCR反应体系为25 μl,内含12.5 μl Taq Premix(2×),上、下游引物各1 μl,模板DNA 2 μl。引物序列及反应条件见表 1。PCR检测在温度梯度PCR仪T-100(美国BioRad公司)上进行。PCR产物电泳后观察结果。
6. PFGE分型:参照美国PulseNet副溶血弧菌PFGE标准操作方法[5],用NotⅠ内切酶消化基因组DNA后进行PFGE,并通过BioNumerics V6.6软件(Applied Maths BVBA,Belium)分析图谱,方法采用 UPGMA(unweighted pair group method using arithmetic averages),聚类相似性系数(距离)采用的是基于条带比较的 Dice,得到菌株带型相似性的聚类分析树图。
7. MLST分型:参照MLST副溶血弧菌数据库(http://pubmlst.org/vparahaemolyticus/)公布的引物,分别对dnaE、gyrB、recA、dtdS、pntA、pyrC和tnaA 7对管家基因进行扩增并测序。引物由上海生工生物工程有限公司合成。将所获得的序列信息上传到副溶血弧菌数据库进行查询,确定等位基因型和序列型(sequence types,ST),并通过BioNumerics V6.6软件(Applied Maths BVBA)分析进化关系。
结 果1. 血清学分型:2014年广东省食源性疾病监测分离得到41株副溶血弧菌,主要分离自广州(24株)、佛山(10株)、阳江(3株)、中山(3株)和江门(1株)5个地区,通过血清学分型可分为8种血清型,主要为O3:K6(28株),其次为O4:K8(4株)和O4:KUT(4株),而O1:KUT、O1:K36、O2:KUT、O4:K55和O5:KUT各1株。从珠海一起聚集性腹泻病例调查中分离得到副溶血弧菌19株,其中病例8株,分成4个血清型:O1:K36型4株,O1:KUT型2株,O4:K34和O4:KUT各1株;食品来源11株,分成6个血清型,其中O1:KUT型5株,O5:KUT型2株,O1:K32、O3:K54、O7:K19和O4:K55型各1株。
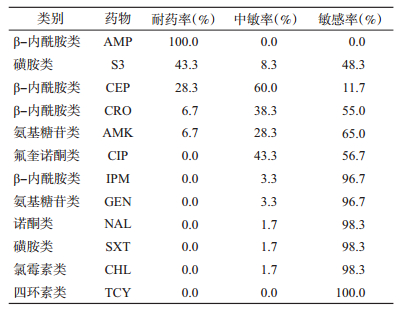
2. 抗生素敏感试验:60株副溶血弧菌对AMP 100.0%耐药,S3和CEP的耐药率也分别达到43.3%和28.3%,而对其他抗生素的耐药率均低于10.0%(表 2)。值得注意的是,虽然菌株未显示对CIP耐药,但其中度敏感率已经达到43.3%。此外,有60.0%的菌株也显示对CEP中度敏感。
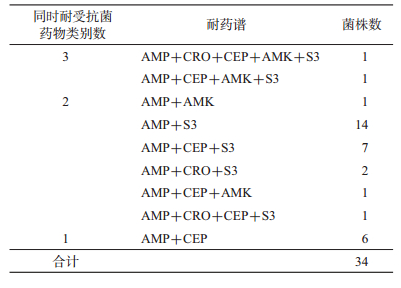
多重耐药分析显示,56.7%(34/60)的菌株对≥2个抗菌药物同时耐药。从药物类别分析,发现2株菌(VP14-37,O4:KUT;VP14-63,O3:K6)对三类抗菌药物同时耐受,耐药谱分别为AMP+CRO+CEP+AMK+S3和AMP+CEP+AMK+S3。此外,有26株对两类抗菌药物同时耐受,6株对同一类中2种抗菌药物耐药(表 3)。
3. 毒力基因及分子分型:采用PCR检测毒力基因,有63.3%(38/60)的分离株为tdh+trh-菌株,仅1株为tdh+trh+菌株,血清型为O1:KUT,其余21株为tdh-trh-菌株。
60株副溶血弧菌菌株经NotⅠ酶消化后,产生48个PFGE谱型,大致可分成Cluster A、B和C 3个聚类(图 1)。PFGE谱型分析显示,同样分离自珠海市一起聚集性腹泻病例及其可疑食品的菌株,主要集中于Cluster A,血清型别主要是O1:KUT和O4:KUT,菌株间的遗传关系较远,PFGE谱型的相似度为34.1%~100.0%;而分布在Cluster B中病例来源的4株O1:K36型菌株之间显示出高度的遗传相关性(94.7%~100.0%),其他菌株主要来自省内各地食源性疾病监测点的病例,血清型别以O3:K6为主,菌株间的遗传关系也较近,PFGE谱型的相似度在62.6%~100.0%。Cluster C主要是由4株O4:K8型菌株组成,全部来自食源性疾病监测点的病例,PFGE谱型的相似度为56.7%~62.5%。
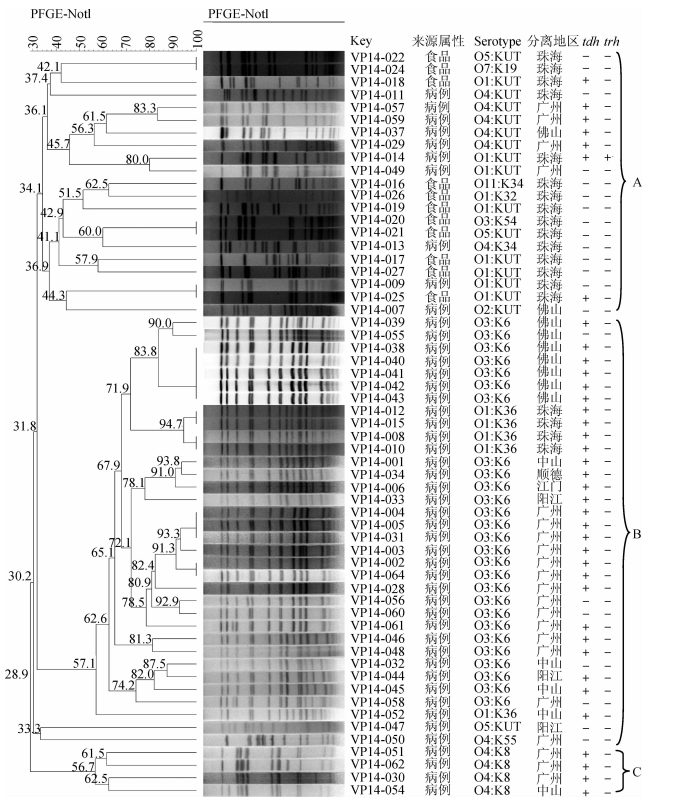 |
| 图 1 2014年广东省60株副溶血弧菌PFGE分子分型 |
|
|
60株副溶血弧菌MLST分型显示,可分成26个ST型,其中33株菌为ST-3型,主要由O3:K6和O1:K36型菌株组成,这些相同ST-3型的菌株形成克隆复合群CC3(图 2)。4株O4:K8型菌株聚集成另外一个相对优势的菌群,与ST-3组成的CC3克隆复合群遗传关系明显不同。食品分离株其ST型则分布相对散在,并不形成明显的优势菌群,与病例分离株呈现出明显不同的遗传关系。
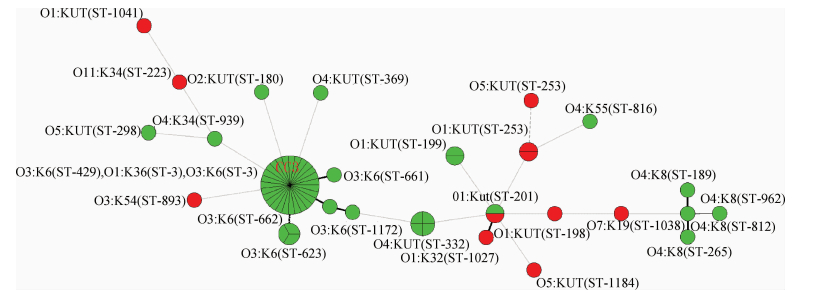 |
| 注:绿色为病例源菌株,红色为食品源菌株 图 2 2014年广东省60株副溶血弧菌MLST分型最小生成树分析 |
|
|
2014年广东省分离收集到的60株副溶血弧菌血清型有13种,其中以O3:K6、O4:K8、O1:K36和O4:KUT为主,主要流行血清型与其他省份目前流行的优势血清型一致[6, 7],与本省往年监测相比,主要流行的血清型别基本一致,并未发现新优势血清型别,毒力基因携带情况仍然是以tdh+trh-为主[8, 9]。病例源和食品源分离株的血清型别不一致,病例源菌株的血清型相对集中,以O3:K6、O4:K8和O4:KUT为主,tdh毒力基因携带率高;而食品源菌株的血清型以O1:KUT为主,型别较为分散,tdh毒力基因携带率低。本研究PFGE谱型分析中,源自珠海市一起聚集性腹泻调查中分离的病例和食品菌株,表型和分子型别均不完全相同,有部分菌株的PFGE型别之间显示出一定的相关性,如来自食品源的O1:KUT菌株和病例源的O1:K36菌株,给溯源追踪带来一定的困难。有研究认为,导致病例与食品分离菌株血清型别和毒力基因相悖的原因可能与目前副溶血弧菌检测方式有关[10]。有研究证实,结合血清与分子生物学方法,同一标本中可检测出2~5种菌型[11]。提示在暴发调查时,对可疑食品和病例标本,应采用从每份样品中挑取多个菌落并结合分子生物学方法,或者通过分析其中相对优势菌型之间的关系,并结合流行病学调查进行溯源分析。
抗生素敏感性试验结果显示,副溶血弧菌对大多数受试药物敏感,与以往监测结果一致,2014年仍然有部分菌株对β-内酰胺类(AMP、CTX)以及磺胺类药物耐药率较高,有43.3%的菌株对CIP中度敏感性,提示临床仍应谨慎合理使用[9, 12]。此外部分菌株出现多重耐药现象,因此有必要继续开展菌株耐药监测。
PFGE和MLST分子分型结果显示,携带tdh基因的菌株,其PFGE型别遗传关系比较相近,MLST型别也显示出一定的群落分布特征,表明这些血清型菌株已在本省持续流行并成为优势菌型。未携带tdh基因的菌株,主要源自食品,血清型别分布多样,其PFGE型别之间的遗传关系较远,MLST型别也未形成一定的群落,由此可见,广东省副溶血弧菌菌型存在多样性的特点,并可能是造成副溶血弧菌腹泻病高发的原因之一。此外,研究中还发现O4:K8型携带tdh基因,PFGE型别高度一致,MLST型别成群落分布,并与CC3克隆复合群明显不同,这在既往的监测中也经常出现该菌型,虽然比例不大,但应警惕该型菌株可能引起的暴发。
| [1] Mao XD,Hu JF,Liu XM. Epidemiological characteristics of bacterial foodborne disease during the year 2003-2007 in China[J]. Chin J Food Hyg,2010,22(3):224-228. (in Chinese) 毛雪丹,胡俊峰,刘秀梅. 2003-2007年中国1 060起细菌性食源性疾病流行病学特征分析[J]. 中国食品卫生杂志,2010,22(3):224-228. |
| [2] Shen ZY,Gao WJ,Wang HH,et al. Analysis of the detection result of pathogen in bacterial food poisoning from 2001 to 2009[J]. Mod Prev Med,2011,38(1):30-33. (in Chinese) 沈志英,高文洁,王恒辉,等. 2001-2009年细菌性食物中毒病原菌检测结果分析[J]. 现代预防医学,2011,38(1):30-33. |
| [3] Li JS,Liang JH,Ke BX,et al. Surveillance of forborne disease in Guangdong,2012[J]. South Chin J Prev Med,2013,39(6):10-16. (in Chinese) 李剑森,梁骏华,柯碧霞,等. 2012年广东省食源性疾病监测结果分析[J]. 华南预防医学,2013,39(6):10-16. |
| [4] Bej AK,Patterson DP,Brasher CW,et al. Detection of total and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tl,tdh and trh[J]. J Microbiol Methods,1999,36(3):215-225. |
| [5] Parsons MB,Cooper KL,Kubota KA,et al. Pulse Net USA standardized pulsed-field gel electrophoresis protocol for subtyping of Vibrio parahaemolyticus[J]. Foodbore Pathog Dis,2007,4(3):285-292. |
| [6] Zhang HZ,Sun SF,Shi WM,et al. Serotype,virulence,and genetic traits of foodborne and clinical Vibrio parahaemolyticus isolates in Shanghai,China[J]. Foodborne Pathog Dis,2013,10(9):796-804. |
| [7] Shi XL,Wang Y,Hu QH,et al. Molecular characterization of Vibrio parahaemolyticus collected from human infections in Shenzhen,between 2002 and 2008[J]. Chin J Epidemiol,2013,34(6):609-613. (in Chinese) 石晓路,王艺,扈庆华,等. 深圳地区2002-2008年副溶血弧菌分子特征研究[J]. 中华流行病学杂志,2013,34(6):609-613. |
| [8] Xiao N,Li BS,Liu X,et al. Etiologic characteristics of Vibrio parahaemolyticus strains causing outbreaks and sporadic cases in Guangdong,2013[J]. Chin J Epidemiol,2014,35(12):1379- 1383. (in Chinese) 效拟,李柏生,刘谢,等. 广东省2013年副溶血弧菌暴发与散发菌株的病原学特征[J]. 中华流行病学杂志,2014,35(12):1379-1383. |
| [9] Ke BX,Tan HL,Li BS,et al. Etiologic characteristics of Vibrio parahaemolyticus strains causing outbreaks and sporadic cases in Guangdong,2009[J]. Chin J Epidemiol,2011,32(12):1237- 1241. (in Chinese) 柯碧霞,谭海玲,李柏生,等. 广东省2009年副溶血弧菌暴发与散发菌株的病原学特征分析[J]. 中华流行病学杂志,2011,32(12):1237-1241. |
| [10] Chen HY,Sheng YY,Tu LH,et al. Distribution of serotype and virulence factors among Vibrato parahaemolyticus in shanghai,2012[J]. J Microbes Infect,2014,9(1):37-42. (in Chinese) 陈洪友,盛跃颖,屠丽红,等. 2012年上海地区副溶血性弧菌血清分型和毒力基因携带状况研究[J]. 微生物与感染,2014,9(1):37-42. |
| [11] Bhoopong P,Palittapongarnpim P,Pomwised R,et al. Variability of properties of Vibrio parahaemolyticus strains isolated from individual patient[J]. J Clin Microbiol,2007,45(5):1544- 1550. |
| [12] Ye LQ,Chen WY,Liu WB,et al. Antibiotic profile of Vibrio parahaemolyticus and its resistance to cephalosporins[J]. J Chin Inst Food Sci Technol,2011,11(7):157-162. (in Chinese) 叶灵琼,陈万义,刘卫兵,等. 副溶血弧菌耐药谱及其对头孢类药物抗性分析[J]. 中国食品学报,2011,11(7):157-162. |
 2015, Vol. 36
2015, Vol. 36