文章信息
- 苏银霞, 王志强, 姚华, 王婷婷, 马琦, 朱筠, 王淑霞, 马艳.
- Su Yinxia, Wang Zhiqiang, Yao Hua, Wang Tingting, Ma Qi, Zhu Jun, Wang Shuxia, Ma Yan.
- 锌转运蛋白-8基因单核苷酸多态性和基因-吸烟的交互作用及与维吾尔族人群2型糖尿病的关联研究
- Association between type 2 diabetes in Uygur and polymorphisms of SLC30A8 and its interaction with smoking
- 中华流行病学杂志, 2015, 36(10): 1167-1171
- Chinese Journal of Epidemiology, 2015, 36(10): 1167-1171
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.10.028
-
文章历史
- 投稿日期: 2015-02-10
2. 公共卫生学院;
3. 乌鲁木齐市沙依巴克区疾病预防控制中心
2 Department of Public Health, Xinjiang Medical University, Urumqi 830011, China;
3 Shayibake District Centers for Disease Control and Prevention, Urumqi
T2DM是以 β 细胞功能受损和/或外周胰岛素抵抗导致体内血糖水平升高为特点,遗传因素和环境因素共同作用引起的慢性复杂性疾病[1]。近年来全基因组关联研究已发现多个T2DM的遗传危险因素,其中锌转运蛋白-8基因(solute carrier family 30,member 8 gene,SLC30A8)与T2DM的发生具有显著相关性,并在欧洲人群[2]、亚洲人群以及我国汉族人群中得到验证[3],但研究对象均存在种族和居住环境的差异。由于新疆维族人群与我国汉族人群有着不同的人种起源、地理环境以及生活方式和饮食习惯,所以SLC30A8及环境因素对于维族T2DM的影响也不同于其他人群。为此本课题采用病例对照研究,分析维族人群SLC30A8单核苷酸多态性(SNP)与T2DM 的关联性。由于吸烟是T2DM 的危险因素之一,因此将进一步分析基因-主动吸烟及基因-被动吸烟交互作用与T2DM 易感性的关系。
对象与方法1. 研究对象:病例组源自2012年3月至2013年6月新疆医科大学第一附属医院(一附院)新入院的1 000例维族T2DM患者,其中男性627例,女性373例。纳入标准为年龄20~80岁,FPG≥7.0 mmol/L,和/或口服葡萄糖耐量试验(OGTT 2 h)≥11.0 mmol/L,或FPG和OGTT 2 h低于此标准但已确诊为T2DM 正在使用各类降糖药物者。排除标准为1型糖尿病和病毒感染、结核、恶性肿瘤等消耗性疾病及患精神疾病或癫痫不能签署知情同意及完成问卷的患者。对照组源自同期一附院体检中心维族体检人群中的1 010名健康人,其中男性635人,女性375人。纳入标准为20~80岁,未服用降糖药且FPG<7.0 mmol/L,和/或OGTT 2 h< 11.1 mmol/L者。排除标准为任何患有其他内分泌疾病、恶性肿瘤、冠心病、慢性肝肾疾病等慢性疾病者,并剔除不能签署知情同意及完成问卷的精神疾患者及癫痫、结缔组织病、炎症急性期者。两组人群均来自新疆各地,个体间无血缘关系,按年龄相差±3岁,性别构成无差别的原则匹配。
2. 研究方法:
(1)SNP位点的选择:本研究参考hot SNP(国内外T2DM研究中常用的SNP)、功能性SNP[基因编码区和前导区的SNP,最小等位基因频率(MAF)>0.05]和TagSNP。初步选入3个位点即rs13266634、rs2466294、rs2466293,其中rs2466294由于引物设计失败而被剔除,故最终选择rs13266634、rs2466293位点。
(2)基因组DNA的提取:空腹抽取5 ml静脉血,充分抗凝处理后置于-80 ℃冰箱保存备用,采用全血基因组DNA提取试剂盒(北京百泰克生物技术有限公司),提取外周静脉血白细胞DNA,利用紫外分光光度仪检测DNA含量,测定吸光度A260和A280,比值为1.8~2.0。
(3)基因型分析:采用多重PCR、单碱基延伸技术和基质辅助激光解吸附电离飞行时间质谱分析(MALDI-TOF) 进行SNP分型[4]。使用Sequenom公司Genotyping Tools 及MassARRAY Assay Design软件设计待测SNP位点的PCR扩增引物及单碱基延伸引物。rs13266634引物序列F:ACG TTG GAT GGC AAT TTC TCT CCG AAC CAC,R:ACG TTG GAT GGC AAT CAG TGC TAA TCT CCC,扩增产物片段长度为99 bp。rs2466293引物序列F:ACG TTG GAT GCT GAA GAT GTG CAG GCC AAC,R:ACG TTG GAT GCA GAA GTC CAG GTT CCA AAC,扩增产物片段长度为89 bp。随机抽取5%的样本进行SNP位点重复分型检测,计算基因分型的成功率和一致率,分型成功率>95%,基因分型一致率>98%。
3. 统计学分析:采用SPSS 16.0统计软件,以Hardy-Weinberg(H-W)遗传平衡定律检验样本群体代表性;定量资料采用t检验,定性资料采用Pearsonχ2检验;用多因素logistic回归分析综合评价各因素与T2DM的关系,以及基因型、等位基因频率、性别、吸烟、被动吸烟在两组间的分布差异,并计算OR值及其95%CI。采用非条件logistic 回归模型分析吸烟与基因的相乘交互作用。通过Bootstrap法[5],先采用Multinomial logistic回归模型的参数估计值和协方差矩阵控制混杂因素,再引入Andersson等编制的Excel计算表计算相对超额危险度比(RERI)、归因比(AP)和交互作用指数(S)及其95%CI,以评价二者之间的相加交互作用。以P<0.05为差异有统计学意义。 结果 1. 一般特征:病例组中被动吸烟人数多于对照组;病例组SBP、TC、LDL-C、BMI均值高于对照组,差异均有统计学意义;病例组HDL-C均值低于对照组,差异有统计学意义(P<0.05)。两组人群年龄、性别、主动吸烟、DBP、TG的差异均无统计学意义(P>0.05),见表 1。
2. SLC30A8等位基因频率分布:经检验rs13266634及rs2466293均符合H-W遗传平衡定律(P>0.05),见表 2。病例组中rs13266634及rs2466293的MAF值分别为0.293及0.433,均接近HapMap中欧洲人群的分布特点(表 3)。对照组MAF值则介于亚洲人群与欧洲人群之间。rs13266634野生型等位基因C和rs2466293突变型等位基因C为危险等位基因,OR值(95%CI)分别为1.194(1.044~1.366)和1.166(1.028~1.324);两组间rs13266634的基因频率分布的差异有统计学意义(P<0.05),见表 2。
3. 两组不同遗传模型的SLC30A8基因型分布的差异:经调整被动吸烟、SBP、TC、HDL-C、LDL-C、BMI后,logistic回归分析显示位点rs13266634基因型分布在隐性模型中与T2DM存在相关性(P=0.016),OR=0.607(95% CI:0.404~0.912),见表 4。两位点在加性模型与显性模型均未显示统计意义的相关性(P>0.05)。
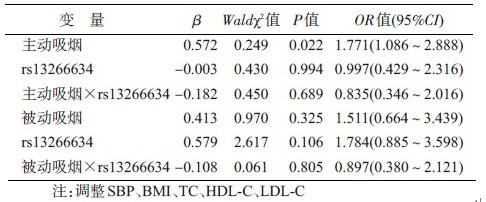
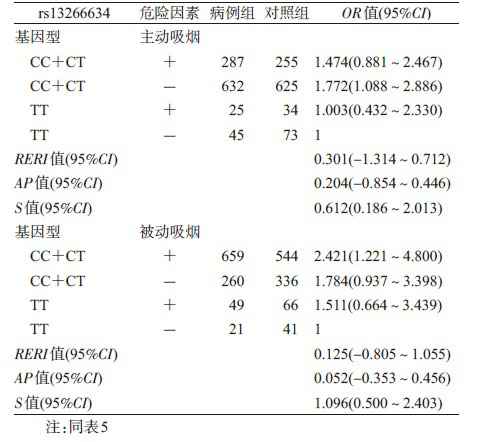
4. rs13266634位点SNP和吸烟及被动吸烟的交互作用与维族T2DM关系:logistic回归分析显示,对维族T2DM调整SBP、TC、HDL-C、LDL-C、BMI后,rs13266634和吸烟及rs13266634和被动吸烟的乘积项显示无相乘交互作用(P>0.05),见表 5;相加交互作用各项指标RERI、AP和S值及其95%CI显示rs13266634与被动吸烟、rs13266634与主动吸烟的RERI和AP值及其95%CI均包括0,S值及其95%CI均包括1,表明rs13266634与主动吸烟或被动吸烟之间均不存在相加交互作用(表 6)。
T2DM是遗传因素与环境因素共同作用的复杂性疾病,其病因至今尚不十分明确。2013年一项实验性研究证实,在小鼠体内锌和胰岛素的联合被分泌是依赖于锌转运蛋白-8(ZnT-8)的方式[6]。SLC30A8位于8号染色体的短臂24.11,基因全长为41.62 kb,该基因的mRNA编码一个长度为369个氨基酸构成的蛋白质,即ZnT-8。ZnT-8仅在胰腺 β细胞分泌性囊中表达[7],其在胰岛 β细胞中被特异性的高表达,也从另一方面证实了SLC30A8在T2DM发病机制中的作用。
SLC30A8基因T2DM的相关性已在欧洲、亚洲以及我国汉族人群中得到验证[3]。Scott等[8]在芬兰较大样本人群 (包括1 161例T2DM患者和1 174名对照)研究中筛查>315 000个SNP,证实SLC30A8基因与芬兰人群T2DM易感性增加有关。Sladek等[7]在法国人群中发现SLC30A8基因和T2DM相关。Lyssenko等[9]在两个独立的人群(芬兰和瑞典)的前瞻性研究中发现,rs13266634位点和可能发展为T2DM显著相关。Palmer等[10]证实SLC30A8基因rs13266634位点的C等位基因为T2DM的风险等位基因。Omori[11]等以1 630例T2DM患者和1 064名健康对照为研究对象,采用Taqman探针方法,发现SLC30A8基因rs13266634与T2DM有关。Wu等[12]以中国上海和北京市人群为研究对象,包括424例T2DM患者、878例IFG者和1 908例血糖正常者,发现SLC30A8基因与中国汉族人T2DM和IFG相关。
本研究选择SLC30A8的2个位点rs13266634和rs2466293,其中rs13266634的MAF值在病例组为0.293与“千人基因组计划”公布的欧洲人群数据(0.239)接近。对照组为0.331介于亚洲人群数据(0.465)与欧洲人群数据之间。这很可能与新疆地处于种族交界处的中亚,维族可能是种族混合而产生的过渡性或中间性种族类型有关。分析结果显示,rs13266634等位基因频率在病例组和对照组的差异有统计学意义且危险等位基因为野生型C,混杂因素矫正前后基因型频率分布在两组间的差异均有统计学意义。logistic回归模型结果显示,隐性模型中rs13266634多态性与T2DM有相关性,OR=0.607(95%CI:0.404~0.912)。Geraldine等[13]在病例对照研究基因统计方法一文中指出,隐性模型有意义则突变纯合子增加发病风险的倍数即等于OR值,在本研究中此结果则说明突变基因型TT增加维族T2DM患病风险的倍数为0.607倍,即TT为保护基因型,其降低维族T2DM患病风险的倍数为1/0.607,即1.647倍,而野生型CC则为危险基因型。2014年一项包括5个不同种族150 000人的研究结果显示,SLC30A8基因突变极有可能预防T2DM[14],这与本文结果一致。
吸烟是T2DM的危险因素之一。本研究分析显示主动吸烟在病例组和对照组中的差异无统计意义,且与rs13266634也不存在交互作用。分析原因可能有二。其一病例组为糖尿病现患人群,在住院期间可能暂停吸烟,故在完成问卷时可能存在回忆偏倚;其二,本研究两组人群均为维族,生活习惯相似,且维族吸烟率较低。国内外有研究认为被动吸烟可能成为T2DM突出的危险因素[15, 16]。为此本研究采用交互作用模型,探讨SLC30A8基因rs13266634位点与吸烟的交互作用对T2DM的影响。通过logistic回归模型引入rs13266634与主动吸烟及被动吸烟的乘积项,评价二者的相乘交互作用。结果发现,调整相关因素后,rs13266634与主动吸烟和被动吸烟对维族T2DM均无相乘交互作用。为控制不同水平BMI、SBP、TC、HDL-C、LDL-C等混杂因素的干扰,在分析相加交互作用时采用Bootstrap法,先采用Multinomial logistic回归模型进行参数估计和协方差矩阵控制混杂因素,再将所得结果引入Andersson等编制的Excel计算表计算RERI、AP和S及其95%CI。结果显示rs13266634与主动吸烟和被动吸烟的RERI和AP值的95%CI均包括0,S值的95%CI均包括1,表明不存在相加交互作用。
综上所述,本研究发现SLC30A8基因的rs13266634位点与维族T2DM有相关性,且突变等位基因TT可能为保护型基因型,所以该位点突变可能会降低维族患T2DM的风险。被动吸烟可能是维族T2DM的危险因素之一,但尚未发现其与rs13266634的交互作用。由于T2DM受到多基因与环境因素等共同作用,各基因之间及基因-环境的交互作用还有待于进一步研究。
| [1] Defronzo RA,Ferrannini E,Keen H.International textbook of diabetes mellitus[M].Chichester:John Wiley and Sons,2004. |
| [2] Abara Y,Osawa H,Kawamoto R,et al.Replication study of candidate genes associated with type2diabetes based on genome-wide screening[J].Diabetes,2009,58(2):493-498. |
| [3] Wang ZH,Zhang SH,Wang ZC,et al.Relationship of rs13266634polymorphism in SLC30A8(solute carrier family30,member8)gene with type2diabetes in Chinese Han population[J].Shanghai Med J,2008,31(5):323-327.(in Chinese)汪志红,张素华,王增产,等.中国汉族人群SLC30A8基因rs13266634多态性与2型糖尿病的关联[J].上海医学,2008,31(5):323-327. |
| [4] Schaeffeler E,Zanger UM,Eichelbaum M,et al.Highly multiplexed genotyping of thiopurine S-methyltransferase variants using MALDI-TOF mass spectrometry:reliable genotyping in different ethnic groups[J].Clin Chem,2008,54(10):1637-1647. |
| [5] Andersson T,Alfredsson L,Källberg H,et al.Calculating measures of biological interaction[J].Ear J Epidemiol,2005,20(7):575-579. |
| [6] Tamaki M,Fujitani Y,Hara A,et al.The diabetes susceptible gene SLC30A8/ZnT8regulates hepatic insulin clearance[J].J Clin Invest,2013,123(10):4513-4524. |
| [7] Sladek R,Rocheleau G,Rung J,et al.A genome-wide association study identifies novel risk loci for type2diabetes[J].Nature,2007,445(7130):881-885. |
| [8] Scott LJ,Mohlke KI,Bonnyeastle LL,et al.A genome-wide association study of type2diabetes in Finns detects multiple susceptibility variants[J].Science,2007,316(5829):1341-1345. |
| [9] Lyssenko V,Jonsson A,Almgren P,et al.Clinical risk factors,DNA variants,and the development of type2diabetes[J].N Engl J Med,2008,359(21):2220-2232. |
| [10] Palmer ND,Goodarzi MO,Langefeld CD,et al.Quantitative trait analysis of type2diabetes susceptibility loci identified from whole genome association studies in the insulin resistance atherosclerosis family study[J].Diabetes,2008,57(4):1093-1100. |
| [11] Omori S,Tanaka Y,Takahashi A,et al.Association of CDKAL1,IGF2BP2,CDKN2A/B,HHEX,SLC30A8,and KCNJ11with susceptibility to type2diabetes in a Japanese population[J].Diabetes,2008,57(3):791-795. |
| [12] Wu Y,Li HX,Loos RJF,et al.Common variants in CDKAL1,CDKN2A/B,IGF2BP2,SLC30A8,and HHEX/IDE genes are associated with type2diabetes and impaired fasting glucose in a Chinese Han population[J].Diabetes,2008,57(10):2834-2842. |
| [13] Geraldine M,Carl A,Fredrik H,et al.Basic statistical analysis in genetic case-control studies[J].Nat Protoc,2011,6(2):121-133. |
| [14] Flannick J,Thorleifsson G,Beer NL,et al.Loss-of-function mutations in SLC30A8protect against type2diabetes[J].Nat Genet,2014,46(4):357-363. |
| [15] Wang Y,Ji J,Liu YJ,et al.Passive smoking and risk of type2diabetes:a Meta-analysis of prospective cohort studies[J].PLoS One,2013,8(7):e69915. |
| [16] Lajous M,Tondeur L,Fagherazzi G,et al.Childhood and adult secondhand smoke and type2diabetes in women[J].Diabetes Care,2013,36(9):2720-2725. |
 2015, Vol. 36
2015, Vol. 36