文章信息
- 刘晓明, 张桂林, 刘然, 孙响, 郑重, 邱尔臣, 马晓玲.
- Liu Xiaoming, Zhang Guilin, Liu Ran, Sun Xiang, Zheng Zhong, Qiu Erchen, Ma Xiaoling.
- 新疆维吾尔自治区夏尔西里自然保护区全沟硬蜱复合感染蜱媒病原研究
- Study on co-infection of tick-borne pathogens in Ixodes persulcatus in Charles Hilary,Xinjiang Uygur autonomous region
- 中华流行病学杂志, 2015, 36(10): 1153-1157
- Chinese Journal of Epidemiology, 2015, 36(10): 1153-1157
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.10.025
-
文章历史
- 投稿日期: 2015-02-10
2. 武警新疆总队医院
2 General Hospital of Xinjiang Armed Police
蜱传疾病(Tick-borne diseases,TBDs)是通过蜱叮咬吸血传播的人畜共患病。全沟硬蜱[Ixodes(I.) persulcatus]是我国最重要的媒介蜱种,主要分布在大/小兴安岭和新疆维吾尔自治区(新疆)北天山一带,是蜱传脑炎、莱姆病、粒细胞无形体病和巴贝西原虫病的主要媒介[1, 2, 3, 4, 5, 6]。全沟硬蜱能感染多种病原体,叮咬人体后引起多种蜱传疾病的合并感染[7]。新疆博乐市夏尔西里自然保护区分布有大量的全沟硬蜱,本研究通过PCR方法对该地区全沟硬蜱可能感染的病原进行检测。
材料与方法1. 标本采集:2012年6月及2013年6月在新疆博乐市夏尔西里自然保护区采用布旗法采集游离蜱,经分类鉴定为全沟硬蜱。活蜱液氮保存用于病原分离,死蜱70%乙醇保存用于病原检测。
2. 蜱媒病原检测:(1)DNA提取:将蜱从乙醇取出后,灭菌蒸馏水冲洗,用灭菌滤纸吸干水分,研碎,使用天根生化科技(北京)有限公司DNA提取试剂盒提取DNA,-20 ℃保存备用。
(2)引物设计:分别对蜱体内莱姆病伯氏疏螺旋体[Borrelia(B.) burgdorferi] 5S~23S rRNA 基因间隔区、无形体(Anaplasma)16S rRNA基因、斑点热立克次体(Rickettsia)ompA基因、Q热贝氏柯克斯体Coxiella(C.) burneti的com1基因、巴贝西原虫(Babesia)的Nss-rRNA基因进行PCR扩增。引物序列见表 1。引物由生工生物工程(上海)股份有限公司合成。
(3)PCR扩增:根据文献[8, 9, 10, 11, 12]进行扩增,反应条件见表 1。阳性产物由生工生物工程(上海)股份有限公司测序。
(4)序列分析:登录美国国家生物技术信息中心(NCBI)站点,利用“Blast Sepuence Similarity Searching”工具,将测序结果与GenBank中注册的核苷酸序列进行同源性比较。使用Mega 6.0软件构建系统发育树。
3. 统计学分析:利用SPSS 19.0软件进行统计学分析,通过χ2检验分析不同病原感染率差异,P<0.05为差异有统计学意义。
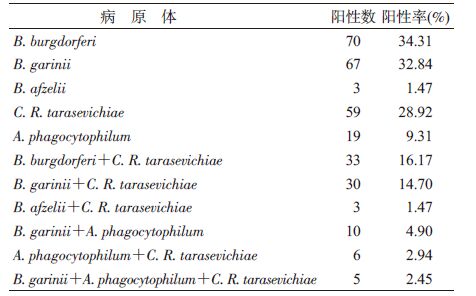
结果1. 病原体检测:共检测204只全沟硬蜱成蜱,104只蜱病原检测阳性,阳性率为50.98%(104/204)。其中伯氏疏螺旋体阳性率为34.31%(n=70),斑点热立克次体[Candidatus(C.) Rickettsia(R.) tarasevichiae]阳性率为28.92%(n=59),嗜吞噬细胞无形体[Anaplasma (A.)phagocytophilum]阳性率为9.31%(n=19),未检出Q热贝氏柯克斯体和巴贝西原虫,见表 2。χ2检验显示,不同病原感染率差异有统计学意义(χ2=38.517,P=0.000)。经χ2分割后两两比较,伯氏疏螺旋体与斑点热立克次体阳性率差异无统计学意义(χ2=1.372,P=0.242),伯氏疏螺旋体与无形体阳性率差异有统计学意义(χ2=37.378,P=0.000),斑点热立克次体与无形体阳性率差异有统计学意义(χ2=25.361,P=0.000)。
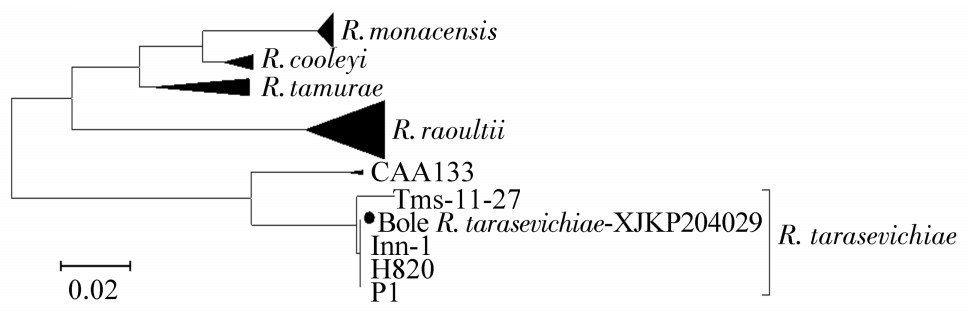
通过对伯氏疏螺旋体5S~23S rDNA 序列比对,发现阳性序列为2条不同序列,分别命名为XJ/Bole 2012-9和XJ/Bole 2012-24,其中XJ/Bole 2012-9为 B. afzelii基因型,XJ/Bole 2012-24为B. garinii基因型。在阳性序列中B. garinii基因型占95.71%(n=67),B. afzelii占4.29%(n=3)。中国新疆XJ/Bole 2012-24与从俄罗斯全沟硬蜱中分离的B. garinii BgVir(CP003151.1)同源性为100%。XJ/Bole 2012-9与从黑龙江人全血中分离的B. afzelii(JX888444.1)同源性为100%,见图 1。通过对无形体16S rDNA序列分析,阳性序列为嗜吞噬细胞无形体(A. phagocytophilum),将序列命名为XJ-Bole-07/21,与吉林地区西伯利亚金花鼠(Siberian chipmunk)脾脏中检测到的A. phagocytophilum(DQ449946)同源性为99.3%,见图 2。通过斑点热立克次体ompA序列分析,发现感染的立克次体为C. R. tarasevichiae。将序列命名为R. tarasevichiae-XJKP204029,经BLAST比对分析,与我国黑龙江全沟硬蜱检测到的C. R. tarasevichiae(序列号KF008253)同源性为100%,见图 3。

|
| 图 1 基于5S~23S rRNA序列的伯氏疏螺旋体系统进化树 |

|
| 图 2 基于16S rRNA序列的嗜吞噬细胞无形体系统进化树 |
|
| 图 3 基于ompA序列的斑点热立克次体系统进化树 |
2. 复合感染:204只蜱中有39只存在复合感染,复合感染率为19.12%,在病原检测阳性蜱中复合感染率为37.50%(39/104)。B. burgdorferi与C. R. tarasevichiae 复合感染率为16.18%(n=33);B. garinii与A. phagocytophilum复合感染率为4.90%(n=10),A. phagocytophilum与C. R. tarasevichiae复合感染率为2.94%(n=6),B. garinii、A. phagocytophilum 及 C. R. tarasevichiae复合感染率为2.45%(n=5),见表 2。经χ2检验,3种混合感染率差异有统计学意义(χ2=41.328,P=0.000);χ2分割检验显示,B. burgdorferi与C. R. tarasevichiae混合感染率及B. garinii与A. phagocytophilum混合感染率差异有统计学意义(χ2=13.752,P=0.000),与C. R. tarasevichiae和A. phagocytophilum混合感染率差异有统计学意义(χ2=20.668,P=0.000);B. burgdorferi和A. phagocytophilum混合感染率与C. R. tarasevichiae和嗜A. phagocytophilum混合感染率差异无统计学意义(χ2=1.041,P=0.308)。
讨论本研究从新疆博乐地区全沟硬蜱中检测出伯氏疏螺旋体、嗜吞噬细胞无形体和斑点热立克次体C. R. tarasevichiae。伯氏疏螺旋体是引起莱姆病的病原体,1985年在我国黑龙江省海林县首次发现莱姆病病例,至今,29个省出现病例,19个省存在疫源地,主要分布在东北和西北地区[13]。伯氏疏螺旋体在全沟硬蜱中的感染率较高。在俄罗斯,全沟硬蜱感染率为29.9%[14]。在我国黑龙江和吉林省全沟硬蜱感染率分别为20.87%和37.00%,但内蒙古自治区感染率较低,为7.80%[15, 16]。本研究中全沟硬蜱感染率较高(34.31%),与吉林地区相似。伯氏疏螺旋体有11种基因型,但只有4个基因型(B. burgdorferi sensu stricto、B. afzelii、B. garinii和B. bissettii)能引起人类疾病。我国有4个基因型B. bttrgdoferi. sensu.stricto、B. garinii、B. afzelii和 B. valaisiana,南方地区以B. bttrgdoferi. sensu. stricto为流行优势株,北方地区以B. garinii和B. afzelii为流行株[13]。在全沟硬蜱感染中B. garinii占75.68%~89.58%,B. afzelii占10.42%~24.32%[15]。本研究全沟硬蜱感染的伯氏疏螺旋体有2个基因型,B. garinii为流行优势株(95.71%),B. afzelii占4.29%。与东北地区相比,B. garinii所占的比列更大。B. garinii和B. afazenii均具有致病性,但引起不同的莱姆病临床症状,B. garinii主要引起神经功能紊乱,而B. afazenii主要引起皮肤病变。因此对莱姆病的临床早期诊断和鉴别诊断中应注意患者神经系统损伤和皮肤症状。嗜吞噬细胞无形体是引起人粒细胞无形体病的病原。人粒细胞无形体病是一种新发蜱传疾病,在我国东北、华中等多个地区出现病例和疫源地,全沟硬蜱是其主要媒介。嗜吞噬细胞无形体在全沟硬蜱中的感染率较低,俄罗斯报道的是1%[14],我国东北地区及内蒙古自治区是4.0%~6.8%[16]。本研究中全沟硬蜱嗜吞噬细胞无形体自然感染率为9.31%,高于其他地区。C. R. tarasevichiae是一种新发现斑点热群立克次体,具有致病性,在东北地区全沟硬蜱中发现,感染率为1.53%[17]。本研究中C. R. tarasevichiae在全沟硬蜱中的感染率为28.92%,高于东北地区。
本研究发现全沟硬蜱存在2~3种病原体的复合感染。俄罗斯全沟硬蜱复合感染率为1.2%[14]。在国内东北地区和内蒙古自治区全沟硬蜱复合感染率为0.50%~1.47%[16, 18]。本研究中全沟硬蜱复合感染率(19.12%)显著高于其他地区。其原因可能与该地区全沟硬蜱种群密度、栖息习性、吸血习性以及宿主动物病原感染率等因素有关。此外蜱体内复合感染的病原种类可能对感染率也有一定影响。蜱内感染的病原体之间也存在相互关系,如共栖、拮抗或互不干扰,不同的关系可能使感染率升高或降低[19]。全沟硬蜱复合感染的病原包括伯氏疏螺旋体、嗜吞噬细胞无形体、巴贝西原虫、斑点热立克次体以及蜱传脑炎病毒,其中伯氏疏螺旋体与嗜吞噬细胞无形体以及伯氏疏螺旋体与巴贝西原虫的复合感染较为多见[20]。有研究表明,在全沟硬蜱中伯氏疏螺旋体B. afzelii和 B. garinii两个基因型与嗜吞噬细胞无形体之间存在共栖的关系[20]。本研究中,伯氏疏螺旋体与斑点热立克次体C. R. tarasevichiae混合感染率要高于伯氏疏螺旋体与嗜吞噬细胞无形体混合感染率以及C. R. tarasevichiae与嗜吞噬细胞无形体的混合感染率。伯氏疏螺旋体与C. R. tarasevichiae是否存在共栖关系还有待于进一步研究。
复合感染的蜱叮咬吸血就可能使人同时感染多种病原体,使得对患者的诊断和治疗更加困难。据报道,与单一感染引起的莱姆病患者相比,伯氏疏螺旋体与嗜吞噬细胞无形体复合感染的患者症状更复杂、更严重,持续时间更长,预后也更差[21, 22]。新疆博乐地区同时存在多种蜱传疾病,并且全沟硬蜱复 图 2基于16S rRNA序列的嗜吞噬细胞无形体系统进化树 图 3基于ompA序列的斑点热立克次体系统进化树 合感染率较高,因此在蜱传疾病的防治中应注意蜱媒疾病合并感染的诊断和治疗。
| [1] Zhao JW,Wang HY,Wang Y.Regional distribution profiles of tick-borne pathogens in China[J].Chin J Vector Biol Control,2012,23(5):445-448.(in Chinese)赵俊伟,王环宇,王英.中国蜱传病原体分布研究概况[J].中国媒介生物学及控制杂志,2012,23(5):445-448. |
| [2] Zhang SH.The latest research progress of tick and the tick-borne diseases[J].Anhui J Prev Med,2012,18(1):45-48.(in Chinese)张思华.蜱与蜱传疾病最新研究进展[J].安徽预防医学杂志,2012,18(1):45-48. |
| [3] Geng Z,Wan KL.The latest research progress of Lyme disease[J].Chin J Nat Med,2007,9(2):158-160.(in Chinese)耿震,万康林.莱姆病流行病学研究新进展[J].中国自然医学杂志,2007,9(2):158-160. |
| [4] Fu WM,He H,Hu MX,et al.Babesia Microti-like rodent parasites isolated from Ixodes persulcatus(Acari:Ixodidae)at China-Russia ports of Heilongjiang province[J].Chin J Front Health Quar,2010,33(2):99-104.(in Chinese)付维明,何浩,呼满霞,等.黑龙江中俄边境口岸全沟硬蜱中分离到人巴贝西原虫[J].中国国境卫生检疫杂志,2010,33(2):99-104. |
| [5] Cao WC,Zhan L,He J,et al.Natural Anaplasma phagocytophilum infection of ticks and rodents from a forest area of Jilin province,China[J].Am J Trop Med Hyg,2006,75(4):664-668. |
| [6] Zhang GL,Liu R,Sun X,et al.Investigation on the endemic foci of new emerged tick-borne encephalitis in Charles Hilary,Xinjiang[J].Chin J Epidemiol,2013,34(5):438-442.(in Chinese)张桂林,刘然,孙响,等.新疆夏尔希里自然保护区蜱传脑炎疫源地调查[J].中华流行病学杂志,2013,34(5):438-442. |
| [7] Masuzawa T,Kharitonenkov IG,Okamoto Y,et al.Prevalence of Anaplasma phagocytophilum and its coinfection with Borrelia afzelii in Ixodes ricinus and Ixodes persulcatus ticks inhabiting Tver Province(Russia):a sympatric region for both tick species[J].J Med Microbiol,2008,57(8):986-991. |
| [8] Lee SH,Kim BJ,Kim JH.Characterization of Borrelia burgdorferi strains isolated from Korea by16S rDNA sequence analysis and PCR-RFLP analysis of rrf(5S)-rrl(23S)intergenic spacer amplicons[J].Int J Syst Evol Microbiol,2000,50(2):857-863. |
| [9] Goodman JL,Nelson C,Vitale B,et al.Direct cultivation of the causative agent of human granulocytic ehrlichiosis[J].N Engl J Med,1996,334(4):209-215. |
| [10] Roux V,Fournier PE,Raoult D.Differentiation of spotted fever group rickettsiae by sequencing and analysis of restriction fragment length polymorphism of PCR-amplified DNA of the gene encoding the protein rOmpA[J].J Clin Microbiol,1996,34(9):2058-2065. |
| [11] Hendrix LR,Mallavia LP,Samuel JE.Cloning and sequencing of Coxiella burnetii outer membrane protein gene com1[J].Infect Immun,1993,61(2):470-477. |
| [12] Armstrong PM,Katavolos PP,Caporale DA,et al.Diversity of Babesia infecting deer ticks(Ixodes dammini)[J].Am J Trop Med Hyg,1998,58(6):739-742. |
| [13] Wu XB,Na RH,Wei SS,et al.Distribution of tick-borne diseases in China[J].Parasit Vectors,2013,6:119. |
| [14] Swanson SJ,Neitzel D,Reed KD,et al.Coinfections acquired from Ixodes ticks[J].Clin Microbiol Rev,2006,19(4):708-727. |
| [15] Wang HW,He J,Chu CY,et al.Detection and genotyping of Borrelia burgdorferi sensu lato in ticks from some areas of China[J].Chin J Path Biol,2006,1(2):81-85.(in Chinese)王宏伟,何静,褚宸一,等.我国部分地区蜱中莱姆病螺旋体的检测与基因分型研究[J].中国病原生物学杂志,2006,1(2):81-85. |
| [16] Zhao QM,Wu XM,Zhang PH,et al.Study on the coinfection of three tick-borne infectious diseases in China using polymerase chain reaction method[J].Chin J Epidemiol,2005,26(1):9-13.(in Chinese)赵秋敏,吴晓明,张泮河,等.三种蜱媒传染病在媒介蜱和鼠类中复合感染的研究[J].中华流行病学杂志,2005,26(1):9-13. |
| [17] Jia N,Zheng YC,Jiang JF,et al.Human infection with Candidatus Rickettsia tarasevichiae[J].N Engl J Med,2013,369(12):1179-1180. |
| [18] Cao WC,Zhao QM,Zhang PH,et al.Prevalence of Anaplasma phagocytophila and Borrelia burgdorferi in Ixodes persulcatus ticks from northeastern China[J].Am J Trop Med Hyg,2003,68(5):547-550. |
| [19] Ginsberg HS.Potential effects of mixed infections in ticks on transmission dynamics of pathogens:comparative analysis of published records[J].Exp Appl Acarol,2008,46(1/4):29-41. |
| [20] Ni XB,Ma L,Jia N,et al.Coinfection of tick-borne diseases[J].Acta Parasitol Med Entomol Sin,2013,20(1):66-74.(in Chinese)倪雪冰,马兰,贾娜,等.蜱媒传染病复合感染研究进展[J].寄生虫与医学昆虫学报,2013,20(1):66-74. |
| [21] Thomas V,Anguita J,Barthold SW,et al.Coinfection with Borrelia burgdorferi and the agent of human granulocytic ehrlichiosis alters murine immune responses,pathogen burden,and severity of Lyme arthritis[J].Infect lmmun,2001,69(5):359-371. |
| [22] Krause PJ,McKay K,Thompson CA,et al.Disease-specific diagnosis of coinfecting tickborne zoonoses:babesiosis,human granulocytic ehrlichiosis,and Lyme diseases[J].Clin Infect Dis,2002,34(9):1184-1191. |
 2015, Vol. 36
2015, Vol. 36