文章信息
- 刘金花, 孙焕芹, 赵艳, 孙焕焕, 乔桂芳, 徐杰, 刘宁, 覃岭, 李昂, 江娜, 张永宏. 2014.
- Liu Jinhua, Sun Huanqin, Zhao Yan, Sun Huanhuan, Qiao Guifang, Xu Jie, Liu Ning, Qin Ling, Li Ang, Jiang Na, Zhang Yonghong. 2014.
- HIV对HIV/HCV共感染患者丙型肝炎病程进展的影响
- Influence of HIV infection on hepatitis C progress in patients co-infected with HIV/HCV
- 中华流行病学杂志, 2015, 36(7): 738-742
- Chinese Journal of Epidemiology, 2015, 36(7): 738-742
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.07.016
-
文章历史
- 投稿日期:2014-12-02
HIV和HCV具有相似的传播途径,均可经静脉注射、使用血液制品传播,亦可通过性途径、母婴等方式传播。世界流行病学调查数据表明,HIV 感染者合并HCV 感染的现象普遍,HIV/HCV 共感染已经成为全球性问题。全世界的HIV/AIDS 感染者中约23%~75%为HIV/HCV共感染[1],然而,在全国流调统查报道HIV 感染者中HIV/HCV 共感染率为56.9%[1],经有偿献血途径感染HIV 的人群中,HIV/HCV 共感染率高达86.3%[2],明显高于其他国家。国内外研究报道HIV/HCV 共感染影响丙型肝炎的病情进展[3, 4],但是其免疫机制尚不清楚。研究表明,肝内调节性T 细胞(regulatory T cell,Treg)在慢性丙型肝炎中起着重要作用[5]。因此,本研究通过对HIV/HCV共感染患者及HCV单独感染患者外周血Treg的分析,从而探讨Treg的变化及临床意义。
对象与方法1. 研究对象:以2013 年12 月到北京佑安医院进行随访的河南籍28 例HIV/HCV共感染患者以及12例HCV单独感染患者为研究对象,采集患者病史及外周血,进行HIV对HIV/HCV共感染患者病情进展影响分析及免疫机制研究。28 例HIV/HCV 共感染患者均进行了抗-HIV治疗,所有研究对象均未进行抗-HCV治疗。入组病例一般情况,见表 1。两组患者年龄、性别、HCV 感染时间及感染方式均具有可比性。
2. 诊断标准:AIDS及HIV感染诊断参照美国疾病预防控制中心(CDC)修订,于1993 年1 月1 日起实行的青年和成年人HIV/AIDS 分类和扩大的AIDS定义[3]。所有病例均经免疫印迹试验(WB)确定为HIV 感染。丙型肝炎诊断参照文献[4]。所有丙型肝炎病例均为HCV RNA(+)和/或抗HCV(+),并选取HAV、HBV、HDV、HEV 抗体阴性者,以排除HAV、HBV、HDV、HEV 及其他原因引起的急慢性肝损害。
3. 抗-HIV 抗体检测:抗-HIV 抗体检测采用HIV 1+2 型抗体检测试剂盒(WB,新加坡MP 公司),严格按照说明书进行实验操作。
4. HCV载量及抗-HCV抗体检测:外周血HCV载量检测采用丙型肝炎病毒核酸定量检测试剂盒(PCR-荧光探针法,湖南圣湘生物),使用ABI7500荧光PCR 仪,严格参照试剂操作规程进行。抗-HCV抗体检测采用罗氏Cobas e601 全自动电化学发光免疫分析仪。
5. 血生化检测:采用富士700 全自动干生化分析仪,操作按说明书进行。
6. 肝脏纤维化评估:采用瞬时弹性扫描仪FibroScan 测定肝脏硬度值,以评估患者肝纤维化程度。评估标准参照瞬时弹性成像技术诊断肝纤维化专家意见[6]。
7. Treg 百分率检测:CD4+CD25+CD127dim/- Treg 检测[7, 8],试剂采用BD 公司CD3-PE-Cy7 抗体、CD4-Alexa Fluor 488 抗体、CD25-AmCyan 抗体及CD127-DAPI 抗体,仪器采用BD公司LSRFortessa 流式细胞仪。实验方法严格参照仪器及试剂规程操作。采集患者肘静脉血,肝素抗凝,取100 μl 置于待检管,同时加入5 μ l CD3-PE-Cy7 抗体、5 μ lCD4-Alexa Fluor 488 抗体、5 μl CD25-AmCyan 抗体及5 μl CD127-DAPI 抗体荧光抗体,充分混匀,室温,避光30 min。加入1 ml 溶血素,室温,避光15 min。加入1 ml PBS,1 500 r/min,离心5 min,弃上清,加入300 μl PBS,上机。
8. 统计学分析:数据录入SPSS 13.0 统计软件包,图像处理采用GraphPad Prism 5.0 专业软件。两组计量资料经Kolmogorov-Smirnov 检验,正态分布资料以x±s 表示,比较采用独立样本t 检验,非正态分布计量资料以中位数和四分位数间距表示,采用MannWhitney U 检验,两组计数资料比较采用χ2检验,相关性分析采用Spearman 检验,P<0.05 为差异有统计学意义。
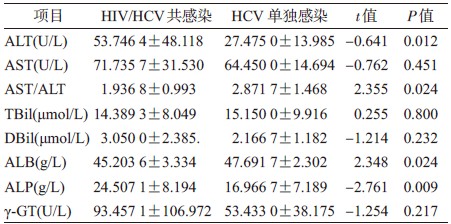
结果1. HIV/HCV 共感染患者与HCV单独感染者肝功能指标比较:ALT、总胆红素(TBil)、直接胆红素(DBil)、白蛋白(ALB)、ALP及谷氨酰转移酶(γ-GT)水平在HIV/HCV共感染组患者中与在HCV单独感染组患者中的两组比较,HIV/HCV共感染患者ALT及ALP 水平明显高于HCV 单独感染组,AST/ALT比值低于HCV 单独感染组,P 值分别为0.012、0.009、0.024,见表 2。
2. HIV/HCV 共感染患者与HCV单独感染者肝脏纤维化指标比较:采用FibroScan 无创评估HIV/HCV共感染患者及HCV单独感染者肝脏纤维化程度。HIV/HCV 共感染组患者肝脏纤维化指标E 值为5.950 0~5.825 0 Kpa,高于HCV单独感染患者E值为5.150 0~1.050 0 Kpa,两者比较,差异无统计学意义(P=0.117)。
3. HIV/HCV 共感染对HCV 复制及清除的影响:HIV/HCV 共感染组及HCV单独感染组HCV载量分别为6.476 8~5.343 4 lg copy/ml 及1.699 0~2.681 46 lg copy/ml,两组病毒载量比较,HIV/HCV共感染组高于HCV单独感染组,差异有统计学意义(P=0.012)。HIV/HCV 共感染组HCV 清除率为32.14%(9/28),低于HCV单独感染组[75%(9/12)],差异有统计学意义(P=0.032)。
4. HIV/HCV 共感染患者与HCV 单独感染者Treg 百分率比较:HIV/HCV 共感染组与HCV 单独感染组CD3+CD4+CD25+CD127dim/-Treg 百分率分别为7.460 0%~2.287 5%、5.965 0%~2.105 0%,HIV/HCV共感染组Treg 百分率高于HCV单独感染组,差异有统计学意义(P=0.019),见图 1。
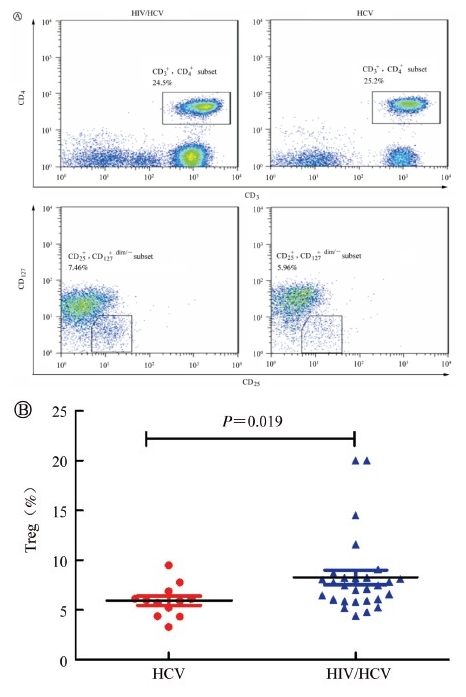 |
| 图 1 HIV/HCV共感染患者与HCV单独感染者Treg百分率比较 |
5. Treg 百分率与HCV载量相关性、HCV载量与肝脏纤维化指标E 值相关性分析:在HIV/HCV共感染者及HCV 单独感染者中,Treg 百分率与HCV 载量呈显著正相关(ρ=0.350,P=0.027),HCV载量与肝脏纤维化程度E 值存在相关性(ρ=0.487,P=0.001),如图 2 所示,而Treg 百分率与肝脏纤维化指标E值不具有明显相关性(ρ=0.228,P=0.158)。
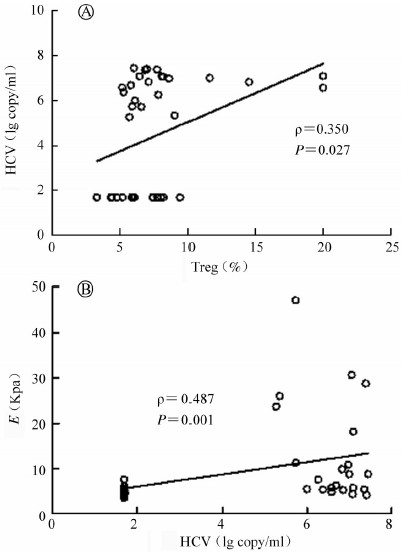 |
| 图 2 ⒶTreg百分率与HCV载量相关性分析; ⒷHCV载量与肝纤维化指标E值相关性分析 |
目前,普遍认为在HIV/HCV 共感染者中,HIV感染加速丙型肝炎的病情进展,促进肝硬化及并发症的进程[9]。既往研究表明,与HCV单独感染者相比,HIV/HCV共感染者由急性丙型肝炎发展为慢性肝炎的概率更高[10],HCV载量更高,进展为失代偿性肝病及肝硬化的危险性更高[11]。上述研究发现与本研究结果一致,与HCV 单独感染组相比,HIV/HCV 共感染组肝功能指标ALT、ALP 水平明显增高,而ALB 水平降低,肝脏纤维化指标E 值有增高趋势,提示HIV/HCV 共感染者肝脏受损更加严重。HIV/HCV 共感染组HCV 载量高于HCV 单独感染组,而HCV 清除率明显低于HCV 单独感染组,即HIV/HCV 共感染者进展为慢性丙型肝炎的概率更高。可见,HIV/HCV 共感染促进HCV病毒繁殖,抑制HCV清除,加重肝脏纤维化,从而加速丙型肝炎病程进展。因本研究病例数偏少,为进一步确证结论,将扩大样本量继续后续研究。
研究结果发现,HIV/HCV共感染组Treg 百分率高于HCV单独感染组,并且Treg 百分率与HCV载量具有显著正相关性,HCV载量与肝脏纤维化指标E 值呈正相关,而Treg 百分率与肝脏纤维化没有明显相关性。可见,HCV载量影响肝脏纤维化程度,而Treg 促进HCV复制,但是目前数据不支持Treg 直接影响肝脏纤维化程度。Treg 是不同于Th1 和Th2细胞的一种CD4+T 淋巴细胞亚群,可抑制CD4、CD8效应T 细胞及自然杀伤细胞(natural killer cell,NK)功能。既往研究表明,在慢性丙型肝炎中,Treg 抑制HCV特异性CD8+T淋巴细胞增殖[12],细胞免疫反应受损,HCV特异性CD8+T 淋巴细胞增殖能力、细胞因子分泌及细胞毒性效应功能受损[13],从而抑制HCV 清除,进展为慢性丙型肝炎。研究发现,在HIV感染者中,Treg/CD4+T淋巴细胞百分率增高[14],HIV 感染导致CD4+T 淋巴细胞减少,Treg 增殖能力增强,从而Treg 百分率增高[15]。因此,HIV/HCV 共感染者Treg百分率增高与HIV感染有关。
1995 年在小鼠模型中第一次发现,表达IL-2 受体α链分子(CD25)的CD4+T淋巴细胞,下调T细胞免疫反应,保持自身免疫耐受[16]。随后,在人体中发现,CD4+CD25+T淋巴细胞具有抑制性T细胞亚群即Treg 特性[17, 18]。但是,T 细胞激活过程中也表达CD25,因此,CD25 分子不能作为Treg 特异性标记分子。Hori 等[19]发现,在小鼠中,Foxp3(forkhead boxP3)转录因子是鉴定Treg必要及特异性分子。但是,在人体中,CD4+CD25-T淋巴细胞也表达Foxp3[20]。研究发现,CD4+CD25+Foxp3+细胞低表达CD127 分子(IL-7 受体α链分子),CD25及CD127共表达可用于鉴定CD4+ Treg。
综上所述,HIV/HCV 共感染加速丙肝病程进展,Treg 促进HCV 繁殖,而HCV 载量影响肝脏纤维化程度。Treg 影响HCV复制的免疫机制有待深入研究。但抑制Treg 可能为丙型肝炎治疗提供新思路。
| [1] Luo RD. Lecture of infectious diseases[M]. Beijing:People’s Medical Publishing House,2002:114-122.(in Chinese) 罗端德. 传染病讲座[M]. 北京:人民卫生出版社,2002: 114-122. |
| [2] Liu Z,Xing WG,Zhang YH,et al. Study on the epidemiology and HCV genotype distribution of HIV/HCV co-infection among HIV infected blood donors in China[J]. Chin J Hepatol,2006,14 (6):464-465.(in Chinese) 刘震,邢文革,张永宏,等. 既往有偿献血(浆)人群中艾滋病毒 与丙型肝炎病毒共感染研究[J]. 中华肝脏病杂志,2006,14 (6):464-465. |
| [3] Lin WY,Weinberg EM,Chung RT. Pathogenesis of accelerated fibrosis in HIV/HCV co-infection[J]. J Infect Dis,2013,207 Suppl 1:S13-18. |
| [4] Neukam K,García-Rey S,Cifuentes C,et al. HIV-coinfection leads to a modest increase in plasma HCV-RAN load in patients with chronic HCV infection[J]. Antiviral Res,2012,95(3):212-215. |
| [5] Ward SM,Fox BC,Brown PJ,et al. Quantification and localisation of FOXP3 + T lymphocytes and relation to hepatic inflammation during chronic HCV infection[J]. J Hepatol,2007, 47(3):316-324. |
| [6] Review Panel for Liver Stiffness Measurement. Recommendations for the clinical application of transient elastography in liver fibrosis assessment[J]. Chin J Hepatol,2013,21(6):420-424. (in Chinese) 肝脏硬度评估小组. 评估标准参照瞬时弹性成像技术诊断肝 纤维化专家意见[J]. 中华肝脏病杂志,2013,21(6):420-424. |
| [7] Liu WH,Putnam AL,Zhou XY,et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4 + Treg cells[J]. J Exp Med,2006,203(7):1701-1711. |
| [8] Seddiki N,Santner-Nanan B,Martinson J,et al. Expression of interleukin(IL)-2 and IL-7 receptors discriminates between human regulatory and activated T cells[J]. J Exp Med,2006,203 (7):1693-1700. |
| [9] Hernandez MD,Sherman KE. HIV/HCV coinfection natural history and disease progression,a review of the most recent literature [J]. Curr Opin HIV AIDS,2011,6(6):478-482. |
| [10] Singal AK,Anand BS. Management of hepatitis C virus infection in HIV/HCV co-infected patients:clinical review[J]. World J Gastroenterol,2009,15(30):3713-3724. |
| [11] López-Diéguez M,Montes ML,Pascual-Pareja JF,et al. The natural history of liver cirrhosis in HIV/HCV coinfection patients [J]. AIDS,2011,25(7):899-904. |
| [12] Boettler T,Spangenberg HC,Neumann-Haefelin C,et al. T cells with a CD4 + CD25 + regulatory phenotype suppress in vitro proliferation of virus-specific CD8 + T cells during chronic hepatitis C virus infection[J]. J Viral,2005,79(12):7860-7867. |
| [13] Wedemeyer H,He XS,Nascimbeni M,et al. Impaired effector function of hepatitis C virus-specific CD8 + T cells in chronic hepatitis C virus infection[J]. J Immunol,2002,169(6):3447- 3458. |
| [14] Tsunemi S,Iwasaki T,Imado T,et al. Relationship of CD4 + CD25 + regulatory T cells to immune status in HIV-infected patients[J]. AIDS,2005,19(9):879-886. |
| [15] Bi XQ,Suzuki Y,Gatanaga H,et al. High frequency and proliferation of CD4 +FOXP3+ Treg in HIV-1-infected patients with low CD4 counts[J]. Eur J Immunol,2009,39(1):301-309. |
| [16] Sakaguchi S,Sakaguchi N,Asano M,et al. Immunologic selftolerance maintained by activated T cells expressing IL-2 receptor α-chains(CD25)[J]. J Immunol,1995,155(3):1151- 1164. |
| [17] Baecher-Allan C,Brown JA,Freeman GJ,et al. CD4 +CD25 high regulatory cells in human peripheral blood[J]. J Immunol,2001, 167(3):1245-1253. |
| [18] Ng WF,Duggan PJ,Ponchel F,et al. Human CD4 +CD25 + cells:a naturally occurring population of regulatory T cells[J]. Blood, 2001,98(9):2736-2744. |
| [19] Hori S,Nomura T,Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science, 2003,299(5609):1057-1061. |
| [20] Allan SE,Crome SQ,Crellin NK,et al. Activation-induced FOXP3 in human T effector cells does not suppress proliferation or cytokine production[J]. Int Immunol,2007,19(4):345-354. |
 2015, Vol. 36
2015, Vol. 36