文章信息
- 闫笑梅, 陶晓霞, 遇晓杰, 闫军, 张建中. 2014.
- Yan Xiaomei, Tao Xiaoxia, Yu Xiaojie, Yan Jun, Zhang Jianzhong. 2014.
- 健康人携带金黄色葡萄球菌耐药表型及基因型研究
- Phenotype and genotype of antimicrobial resistance on nasal Staphylococcus aureus isolates from healthy people
- 中华流行病学杂志,2015, 36(6): 639-643
- Chinese Journal of Epidemiology,2015, 36(6): 639-643
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.06.022
-
文章历史
- 投稿日期:2015-02-11
2. 黑龙江省疾病预防控制中心
2. Heilongjiang Provincial Center for Disease Control and Prevention
据估算,约20%的健康白种人携带金黄色葡萄球菌[1]。金黄色葡萄球菌可以通过破损的皮肤或黏膜进入组织引起广泛感染。1960年甲氧西林耐药[Methicillin-resistant Staphylococcus(S.) aureus,MRSA]菌株在英国出现,成为近40年世界范围内医院获得性感染的主要病原菌。虽然我国医院内MRSA流行率从2006年开始呈下降趋势,至2011年仍有50%左右的金黄色葡萄球菌为MRSA[2]。在医院内,MRSA对多种抗生素的耐药率明显高于甲氧西林敏感菌株[3]。20世纪90年代后期,社区获得性MRSA(CA-MRSA)作为社区发生严重感染的重要致病因子引起广泛关注[4]。CA-MRSA具有医院内MRSA完全不同的遗传特征,包括对大部分抗生素(除β-内酰胺类)敏感,携带更小的葡萄球菌染色体mec基因盒(staphyloccoccal cassette chromosome mec,SCCmec)和毒力更强[5]。金黄色葡萄球菌的分子流行特征变化引导研究者更加关注健康人群携带菌株的遗传特征。目前,国内相关数据贫乏。2009-2011年本课题组对北京和哈尔滨地区2 448名健康从业人员进行调查,发现金黄色葡萄球菌和MRSA人群携带率分别为16.5%和0.33%[6]。本研究旨在进一步分析这些菌株的耐药情况及耐药相关基因分布。
对象与方法1.研究对象:药物敏感性分析选取2009-2011年收集的北京和哈尔滨地区健康人鼻部携带的金黄色葡萄球菌共100株,其中50株北京分离株全部为甲氧西林敏感金黄色葡萄球菌(MSSA),而50株哈尔滨分离株中1株为MRSA,其余为MSSA菌株。耐药基因检测所用菌株包括红霉素抗性的健康人携带菌株52株、黑龙江省哈尔滨市猪来源菌株38株(31株MRSA、7株MSSA)、安徽省合肥市患者MRSA菌株20株,共110株。
2.研究方法:
(1)菌株分离及鉴定:金黄色葡萄球菌用5%羊血的哥伦比亚培养基,37 ℃培养18 h。菌株鉴定包括乳胶凝集实验和nuc基因检测[7]。mecA基因检测用于确认MRSA菌株[7]。
(2)试剂与仪器:乳胶凝集实验用法国生物梅里埃公司试剂盒(REF73116),金黄色葡萄球菌染色体提取试剂盒(DNeasy blood and tissue kit)为德国Qiagen公司产品;溶葡萄球菌酶购自生工生物工程(上海)股份有限公司。PCR仪(MycyclerTM thermal cycler)和凝胶成像系统(CHEF DR ⅢSystem)为美国伯乐公司产品;分光光度计为德国Eppendorf公司产品。E-test药敏条为瑞典AB bioMérieux公司产品,Mueller-Hinton琼脂和D实验药敏纸片为英国Oxiod公司产品。PCR引物合成由生工生物工程(上海)股份有限公司完成,测序由北京天一辉远生物科技有限公司完成。
(3)E-test法测最小抑菌浓度(MIC):将细菌配成0.50号麦氏比浊管浊度的纯菌悬液,用无菌棉拭子蘸取菌液挤干后均匀涂布于150 mm 直径(60 ml琼脂/皿)的药敏平板上,贴E-test条6条。35 ℃培养16~20 h ,椭圆形的抑菌环与试验条的交界处上的刻度读出MIC结果,单位为μg/ml。结果按美国临床实验室标准化研究所(CLSI,2013)规定将MIC值判定为敏感或耐药。质控菌株为金黄色葡萄球菌ATCC29213。选择药物:头孢西丁、氯霉素、四环素、庆大霉素、万古霉素、环丙沙星、红霉素、克林霉素、利福平、磺胺甲恶唑/甲氧苄啶、替考拉宁、奎奴普丁/达呋普丁、莫匹罗兴、利奈唑烷、替加环素和达托霉素。
(4)克林霉素诱导D实验:将细菌配成0.50 McFarland的菌悬液,用无菌棉拭子蘸取菌液挤干后均匀涂布于MH平皿上,15 μg红霉素纸片和2μg克林霉素纸片边缘相距15~26 mm,37 ℃孵育16~18 h,与红霉素相邻侧抑菌圈出现“截平”(D抑菌圈)或克林霉素抑菌圈内有薄雾状生长时为阳性,克林霉素抑菌圈为圆形时为阴性。
(5)spa分型:所有菌株进行spa分型[8],依据网站(http://www.seqnet.org/),引物序列分别为spaF:5′-ACG ATC CTT CGG TGA GC-3′和spaR:5′-CAG CAG TAG TGC CGT TTG- 3′,分析软件为Ridom StaphType 1.5.12。
(6)大环内酯类耐药相关基因检测:检测的耐药基因包括甲基化酶[erm(A),mec(B),mec(C),mec(F),mec(T),mec(Y),mec(33) 和mec(G)]、ATP结合转运蛋白[msr(A)和msr(D)]、主要易化子[mef(A)]、酯酶[ere(A)]及磷酸化酶[mph(C)]。PCR所用引物见表 1。
3. 统计学分析:χ2检验使用PASW Statistics 18.0.3 软件。P≤0.05为差异有统计学意义。
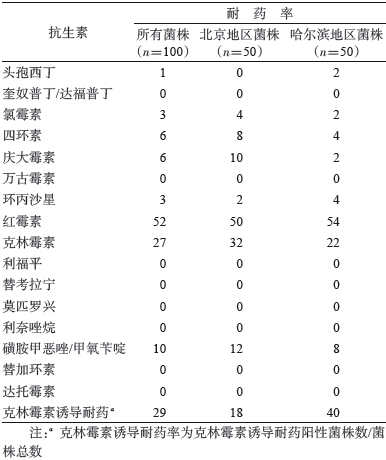
结果1.健康携带者菌株药物敏感性分析:所有菌株对红霉素和克林霉素耐药率较高,分别为52%和27%。98%红霉素和100%克林霉素耐药菌株为高度耐药(MIC>256 μg/ml)。磺胺甲恶唑/甲氧苄啶的耐药率为10%,其余抗生素敏感率较高(表 2)。所有菌株对奎奴普丁/达福普丁、万古霉素、利福平、替考拉宁、莫匹罗兴、利奈唑烷、替加环素和达托霉素均敏感。药物敏感性分析未见地区差异有统计学意义。
2.不同来源菌株克林霉素诱导耐药实验:健康人携带菌株克林霉素诱导耐药率为29%,北京地区菌株耐药率为18%,而哈尔滨地区菌株耐药率为40%,高于北京地区,差异有统计学意义(P=0.015) ,见表 2。临床患者与动物菌株均表现为克林霉素固有耐药。
3.健康携带者菌株spa分型:100株健康携带者菌株,共鉴定出35个spa型(表 3),其中51.0%的spa型别为t189、t571、t002、t796、t437、t034和t701。50.0%北京地区菌株的spa型别为t002、t189、t571、t796、t701和t437,哈尔滨地区菌株以t189、t571、t034、t216、t437和t377为主,占该地区菌株总数的52.0%。红霉素耐药菌株分布在24个spa型中。59.5%的红霉素耐药菌株的spa型别为t002、t796、t437、t216、t571、t034和t701。
4.不同来源菌株大环内酯类耐药相关基因分析:52株健康人菌株主要携带mec(C)(57.7%)和mec(B)(34.6%),未检测出同时携带2种以上耐药基因的菌株,4株菌未检测出任何已知耐药基因(表 4)。82.7%(24/27)的克林霉素诱导耐药菌株携带mec(C)。哈尔滨地区菌株以携带mec(C)为主,其检出率略高于北京地区分离菌株(P=0.054)。在安徽临床分离菌株中,95%的菌株携带mec(A),其中有3株菌同时还携带mec(C)基因。100%哈尔滨猪鼻拭子分离菌株均携带mec(C)菌株,其中2株菌分别携带mec(B)和ere(A)。
讨论国内关于健康携带者菌株药物敏感性分析研究非常有限。本研究发现健康携带者菌株对大部分测试抗生素敏感,对红霉素及克林霉素的耐药率较高,分别为52%和27%,与之前报道的健康士兵携带菌株的结果相似[9]。而本研究发现磺胺甲恶唑/甲氧苄啶的耐药率(10%)略高于士兵携带菌株(1.1%)[14],但低于另一项针对特定人群(医学院校学生)的调查结果,该研究显示,医学院校学生携带菌株对磺胺甲恶唑/甲氧苄啶(93.0%)、红霉素(52.1%)和克林霉素(31.2%)具有较高耐药率[15]。美国在2003-2004年对健康人携带菌株的调查表明,MSSA菌株对红霉素和克林霉素的耐药率分别为24.0%和2.1%[16]。红霉素和克林霉素在我国临床仍广泛使用。健康携带者菌株展示的高耐药性值得关注。
到目前为止,金黄色葡萄球菌对大环内酯类抗生素的耐药性主要由3个机制产生。最重要的一个机制是由erm基因编码产生的核糖体甲基化酶对核糖体23S rRNA抗生素结合位点进行修饰,导致核糖体对大环内酯类抗生素的亲和力下降[17]。另一个机制是外排泵将抗生素主动排出菌体外,如Msr(A) 泵和Mef泵[18]。第三个机制是合成大环内酯类抗生素失活酶,如mph编码的磷酸化酶[19]。
本研究发现不同来源(患者、健康人和动物)金黄色葡萄球菌对大环内酯类抗生素产生耐药性主要通过第一种机制。mec基因在不同来源菌株的分布不同,健康人携带菌株以mec(C)和mec(B)为主,动物来源菌株以mec(C)为主,而临床患者菌株以携带mec(A)为主。既往研究显示,mec(B)在金黄色葡萄球菌中少见,主要在肠球菌中多见[13]。我国临床菌株mec(B)鲜有报道,王立新等[20]发现菌血症患者MSSA菌株中具有较高mec(B)携带率,并与结构性耐药有关。本研究首次从健康携带者菌株中发现较高mec(B)携带率,并以固有型高水平耐药(MIC>256 μg/ml)为主,这些菌株是否是临床mec(B)阳性菌株的源头还需要进一步证实。mec(A)基因位于转座子Tn554上,具有特定的插入识别位点,该转座子通常存在于金黄色葡萄球菌SCCmec原件上。研究表明,Tn554与Ⅱ型和Ⅲ型SCCmec关系密切[21, 22],我国也有临床mec(A)携带菌株主要为SCCmec Ⅲ型的报道[20]。本研究所用的临床菌株全部为MRSA菌株,我国MRSA菌株SCCmec分型以Ⅱ型和Ⅲ型为主[23],由此可以解释mec(A)在临床菌株的高检出率。mec(C)主要在MSSA菌株中存在,并与克林霉素诱导抗性相关[24]。本研究结果与之前的研究一致,在健康人携带的MSSA菌株中诱导抗性主要与mec(C)有关。mec(C)在动物菌株中也广泛检出,我国牛乳腺炎及各种食品中均有报道[25, 26],但本研究所有动物菌株中携带的mec(C)均与结构型耐药有关。
本研究发现在健康携带者菌株中,这些耐药基因散在于多个克隆系菌株中,并未发现某个耐药基因与特定分子型别相对应,提示这些耐药基因通过水平转移广泛存在于定植人类的菌株中。
| [1] Wertheim HF, Melles DC, Vos MC, et al. The role of nasal carriage in Staphylococcus aureus infections[J]. Lancet Infect Dis,2005,5(12):751-762. |
| [2] Xiao YH, Shen P,Wei ZQ, et al. Mohnarin report of 2011:monitoring of bacterial resistance in China[J]. Chin J Nosocomiol,2012,22(22):4946-4952. (in Chinese)肖永红,沈萍,魏泽庆,等. Mohnarin 2011年度全国细菌耐药监测[J]. 中华医院感染学杂志,2012,22(22):4946-4952. |
| [3] Xiao YH,Giske CG,Wei ZQ,et al. Epidemiology and characteristics of antimicrobial resistance in China[J]. Drug Resist Updat,2011,14(4/5):236-250. |
| [4] David MZ, Daum RS. Community-associated methicillin-resistant Staphylococcus aureus:epidemiology and clinical consequences of an emerging epidemic[J]. Clin Microbiol Rev,2010,23(3):616-687. |
| [5] Otto M. Community-associated MRSA:what makes them special ?[J]. Int J Med Microbiol,2013,303(6/7):324-330. |
| [6] Yan XM, Song YY, Yu XJ, et al. Factors associated with Staphylococcus aureus nasal carriage among healthy people in Northern China[J]. Clin Microbiol Infect,2014,21(2):157-162. |
| [7] Brakstad OG,Aasbakk K,Maeland JA. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene[J]. J Clin Microbiol,1992,30(7):1654-1660. |
| [8] Harmsen D, Claus H, Witte W, et al. Typing of methicillin- resistant Staphylococcus aureus in a university hospital setting by using novel software for spa repeat determination and database management[J]. J Clin Microbiol,2003,41(12):5442-5448. |
| [9] Sutcliffe J, Grebe T, Tait-Kamradt A, et al. Detection of erythromycin-resistant determinants by PCR[J]. Antimicrob Agents Chemother,1996,40(11):2562-2566. |
| [10] Chung WO,Werckenthin C,Schwarz S,et al. Host range of the ermF rRNA methylase gene in bacteria of human and animal origin[J]. J Antimicrob Chemother,1999,43(1):5-14. |
| [11] Feβler A,Scott C,Kadlec K,et al. Characterization of methicillin- resistant Staphylococcus aureus ST398 from cases of bovine mastitis[J]. J Antimicrob Chemother,2010,65(4):619-625. |
| [12] Nakaminami H, Noguchi N, Ikeda M, et al. Molecular epidemiology and antimicrobial susceptibilities of 273 exfoliative toxin-encoding-gene-positive Staphylococcus aureus isolates from patients with impetigo in Japan[J]. J Med Microbiol,2008,57(10):1251-1258. |
| [13] Jaglic Z,Vlkova H,Bardon J,et al. Distribution,characterization and genetic bases of erythromycin resistance in staphylococci and enterococci originating from livestock[J]. Zoon Public Health,2012,59(3):202-211. |
| [14] Qu F,Cui EB,Guo TS, et al. Nasal colonization of and clonal transmission of methicillin-susceptible Staphylococcus aureus among Chinese military volunteers[J]. J Clin Microbiol,2010,48(1):64-69. |
| [15] Du JM,Chen C,Ding BX,et al. Molecular characterization and antimicrobial susceptibility of nasal Staphylococcus aureus isolates from a Chinese medical college campus[J]. PLoS One,2011,6(11):e27328. |
| [16] Tenover FC,McAllister S,Fosheim G,et al. Characterization of Staphylococcus aureus isolates from nasal cultures collected from individuals in the United States in 2001 to 2004[J]. J Clin Microbiol,2008,46(9):2837-2841. |
| [17] Weisblum B. Inducible resistance to macrolides, lincosamides and streptogramin type B antibiotics:the resistance phenotype,its biological diversity,and structural elements that regulate expression-a review[J]. J Antimicrob Chemother,1985,16 Suppl A:S63-90. |
| [18] Otto M, Götz F. ABC transporters of staphylococci[J]. Res Microbiol,2001,152(3/4):351-356. |
| [19] Matsuoka M,Inoue M,Endo Y,et al. Characteristic expression of three genes,msr(A),mph(C) and erm(Y),that confer resistance to macrolide antibiotics on Staphylococcus aureus[J]. Fems Microbiol Lett,2003,220(2):287-293. |
| [20] Wang LX,Hu WM,Hu ZD,et al. Detection of erm genes and epidemiology research of Staphylococcus aureus in patients with bloodstream infection[J]. Lab Med,2013,28(3):189-193. (in Chinese)王立新,胡祎明,胡志东,等. 血流感染患者金黄色葡萄球菌erm基因检测及流行病学研究[J]. 检验医学,2013,28(3):189-193. |
| [21] Murphy E,Huwyler L,de Freire Bastos MC. Transposon Tn554:complete nucleotide sequence and isolation of transposition- defective and antibiotic-sensitive mutants[J]. EMBO J,1985,4(12):3357-3365. |
| [22] Teodoro CRS,Mattos CS,Cavalcante FS,et al. Characterization of MLSb resistance among Staphylococcus aureus and Staphylococcus epidermidis isolates carrying different SCCmec types[J]. Microbiol Immunol,2012,56(9):647-650. |
| [23] Liu YD,Wang H,Du N,et al. Molecular evidence for spread of two major methicillin-resistant Staphylococcus aureus clones with a unique geographic distribution in Chinese hospitals[J]. Antimicrob Agents Chemother,2009,53(2):512-518. |
| [24] Schmitz FJ, Sadurski R,Kray A,et al. Prevalence of macrolide- resistance genes in Staphylococcus aureus and Enterococcus faecium isolates from 24 European university hospitals[J]. J Antimicrob Chemother,2000,45(6):891-894. |
| [25] Wang DF,Wang ZC,Yan ZT,et al. Bovine mastitis Staphylococcus aureus:Antibiotic susceptibility profile,resistance genes and molecular typing of methicillin-resistant and methicillin-sensitive strains in China[J]. Infect Genet Evol,2015,31:9-16. |
| [26] Xu J, Shi CL, Song MH, et al. Phenotypic and genotypic antimicrobial resistance traits of foodborne Staphylococcus aureus isolates from Shanghai[J]. J Food Sci,2014,79(4):M635-642. |
 2015, Vol. 36
2015, Vol. 36