文章信息
- 孙定勇, 刘佳, 王奇, 杨文杰, 岳彦超, 过智勇, 杨世梅, 朱谦, 王哲. 2014.
- Sun Dingyong, Liu Jia, Wang Qi, Yang Wenjie, Yue Yanchao, Guo Zhiyong, Yang Shimei, Zhu Qian, Wang Zhe. 2014.
- 河南省81例HCV/HIV共感染者接受艾滋病二线抗病毒治疗效果及HIV耐药性分析
- Effect of treatment and HIV drug resistance of 81 cases of HCV/HIV co-infected individuals who had received AIDS second-line antiretroviral treatment in Henan province
- 中华流行病学杂志, 2015, 36(6): 576-579
- Chinese Journal of Epidemiology, 2015, 36(6): 576-579
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.06.008
-
文章历史
- 投稿日期:2015-01-14
2. 新蔡县疾病预防控制中心;
3. 尉氏县疾病预防控制中心;
4. 确山县疾病预防控制中心
2. Xincai Center for Disease Control and Prevention;
3. Weishi Center for Disease Control and Prevention;
4. Queshan Center for Disease Control and Prevention
IV和HCV的流行严重破坏公共卫生的安全,相同的传播途径又使其在人群中存在着一定比例的共感染,在我国由于早期不规范采供血途径导致的HIV 感染者中HCV的感染率更是显著高于一般人群[1, 2]。抗病毒治疗是近30年来艾滋病防治领域中的重大进展,降低了艾滋病的发病率和病死率,提高了艾滋病患者的寿命和生活质量,但是由于HCV较易引起高效抗反转录病毒治疗(HAART)药物的肝毒性[3],以及还存在争议的两种病毒相互作用加速了疾病进程等等问题都对共感染者的艾滋病抗病毒治疗有较大影响。河南省是我国不规范采供血途径导致HIV感染的重点省份之一[4],大规模的一线艾滋病抗病毒治疗已经开展了10余年,涵盖4万多艾滋病患者[5, 6],治疗人群中存在着相当比例的共感染者和一线治疗病毒学失败的病例,并且有些患者是因为感染丙肝的原因而更换了副作用更低的二线抗病毒治疗药物。本研究招募3个重点县中经历艾滋病一线治疗方案病毒学失败后更换二线治疗方案的HCV/HIV共感染患者进行了1年的随访,评估他们更换艾滋病二线抗病毒治疗方案后的治疗效果。 对象与方法
1. 调查对象:河南省新蔡、确山及尉氏3个县中使用国家免费艾滋病抗病毒一线方案12个月及以上并感染丙型肝炎的艾滋病患者,年龄>18岁,在2012年5-10月间进行HIV病毒载量检测且结果大于1 000 copies/ml,符合更换国家免费艾滋病抗病毒药物治疗手册(2012年版)中二线药物治疗方案的标准且更换为二线药物方案,愿意并能够按知情同意参加研究。
2. 调查随访时间:基线调查时间为2012年5-10月且在二线药物更换前1个月内;在更换二线药物后的6、12个月进行随访,并开展相关检测。起始时间为二线药物更换日期,随访窗口期要求为目标日期的前后1个月内。
3. 实验室检测:包括HCV抗体、免疫学指标(CD4)、病毒载量(VL)和耐药性指标(基因型突变)。使用BD FACSCalibur/ FACSCount流式细胞仪进行CD4+T淋巴细胞计数;使用bioMérieux NucliSens® easy MAGTM病毒核酸提取仪进行HIV RNA的提取,使用bioMérieux NucliSens® EasyQ仪器进行病毒载量检测。基因型耐药检测使用先前报道过的In-house方法[7, 8],检测得到的序列输入Stanford HIV Drug Resistance Database(http://hivdb.stanford.edu/)进行耐药突变和药物敏感性分析。使用英科新创HCV抗体检测试剂盒(酶联免疫法)进行第一次HCV抗体检测,使用科华生物HCV抗体检测试剂盒(酶联免疫法)对第一次HCV抗体检测阳性的样本进行检测,两次都为阳性者判定为HCV抗体阳性,操作和结果判定按照试剂说明书进行。
4. 统计学分析:病例的部分信息来源于中国法定传染病监测信息网络直报系统子平台《艾滋病综合防治数据信息管理系统》和现场调查。对所有数据进行审核、双盲录入和一致性检验,并进行数据库的对接和清理。按照标准操作程序完成上述指标的实验操作。CD4+T淋巴细胞M的比较应用配对资料t检验,构成比的比较应用χ2检验。检验水准α=0.05。使用SPSS 19.0软件进行统计学分析。 结 果
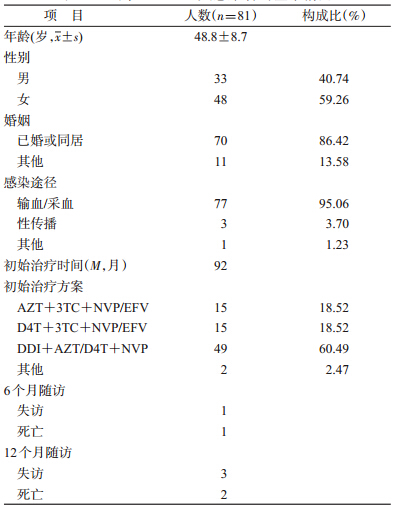
1. 一般情况:本研究在艾滋病疫情较重且抗病毒治疗人数多的3个地区根据原有调查和检测记录选取了在2012年5-10月更换了二线抗病毒治疗方案的93例艾滋病感染者,基线调查时对其重新进行了丙肝抗体的两次初筛,其中81例患者两次丙肝抗体均是阳性,也即是本研究最终选定了81例更换了二线抗病毒治疗方案的HCV/HIV共感染者,其中女性占59.26%,86.42%已婚或同居,感染途径为非法有偿采供血者占95.06%;艾滋病二线抗病毒治疗药物使用方案均为3TC+TDF+LPV/r,均未采集到肝功能测定数据,患者均未接受丙肝的抗病毒治疗,6个月随访时,1人死亡,1人失访,随访率为97.53%;12个月随访时,2人死亡,3人失访,随访率为93.83%。见表 1。
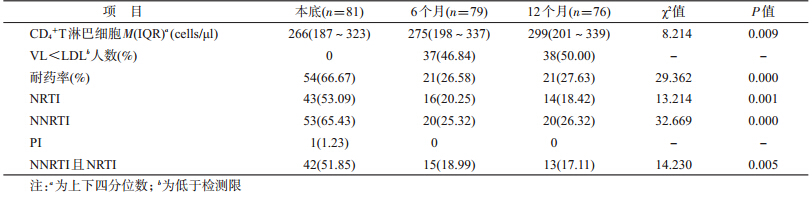
2. HCV/HIV共感染者更换二线方案后治疗效果分析:通过对pol区的序列分析,81例患者感染的HIV-1毒株均为Thai B亚型。基线、6个月和12个月随访的结果显示:CD4在更换二线药物后缓慢回升;HIV病毒载量得到抑制患者的比例上升到50.00%;耐药的发生率整体显著下降,总的发生率从66.67%下降到27.63%;NRTI的耐药发生率从53.09%下降到18.42%;NNRTI的耐药发生率从65.43%下降到26.32%,NRTI和NNRTI二者均耐药的发生率也从51.85%下降到17.11%。见表 2。
基线调查发现81例患者对NRTI中3TC、ABC和FTC的耐药发生率都在50%以上,对AZT、D4T和DDI的耐药发生率在41%~44%之间,对TDF的耐药发生率为33.33%,而在更换二线药物6个月后都下降到12%~18%,12个月的耐药发生率也都维持在12%~18%。患者对NNRTI中NVP和EFV的耐药率都达到65.43%,而在更换二线药物后的6个月后都下降到了24.05%,12个月后的耐药发生率都为26.32%。见图 1。
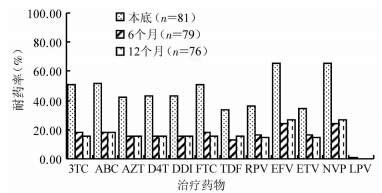 |
| 图 1 HCV/HIV共感染者不同时期对各抗病毒治疗药物耐药情况 |
本研究对河南省81例发生病毒学失败的HIV/HCV共感染患者更换艾滋病二线抗病毒治疗药物后12个月内的治疗效果进行了观察。研究发现:患者在更换二线药物6个月后治疗效果明显,CD4+T淋巴细胞数明显回升,超过一半的患者体内病毒载量得到抑制,核苷类耐药发生率明显下降,这与其他类似研究的结果相似[9]。但是在换药后的6~12个月治疗效果却很有限,其他研究者也发现在未达到免疫学治疗失败指证的患者中也存在同样的情况,而在免疫学治疗失败出现治疗失败指证的情况下则是有较大而持续12个月以上的改进[10]。本研究的CD4+T淋巴细胞数均值表明这些患者的免疫学水平相比其他研究(多在100 cells/μl左右)的人群来说较好,说明本研究中相当比例的患者正处在病毒学失败而未明显发生免疫学失败的状况中,二线药物的影响对治疗失败程度的不同所达到的效果也不尽相同。更长时间的随访观察是必要的。
本研究表明在治疗半年后存在耐药突变的患者显著降低,但是12个月后还存在一定的耐药比例,先前的研究已经发现产生耐药的患者在更换二线药物后体内的耐药毒株在很长的周期内仍然存在10%~20%的突变不能清除,但这种情况在1年期的治疗中并未能影响2项抗病毒治疗的疗效[11],而且使用PI单药进行治疗就能够在很长时间内维持良好的有效性[12]。本研究中存在这种情况虽然是符合预期的,但是对于河南省如此大范围的治疗人群基数来说仍是一个不小的隐患,这就说明了伴随着大规模的抗病毒治疗,耐药的监测应该及时并尽量覆盖所有治疗人群,这也是WHO所推荐的[13]。
病毒载量是能够最早反映病患状况的监测指标,本研究的患者群在二线抗病毒治疗12个月后仍然存在50.00%的患者病毒未得到抑制。通常来说,一线病毒载量失败人群在更换二线方案后病毒未抑制最主要的原因是依从性差和NRTI的耐药,上述关于耐药对二线治疗的讨论中已经说明HIV-1耐药的影响并不是形成这种情况的充分因素。而依从性是治疗效果的重要影响因素,本研究的随访率虽然高但未有详细的依从性调查是本文的一个限制,HIV/HCV共感染患者可能存在的肝功能损害是导致服药依从性降低的重要原因,这是否对抗病毒治疗的依从性产生了重要影响是下一步需要调查的重点。在很多类似的研究中发现依从性差的患者人群中也仅有22%~32%的人群存在病毒的未抑制,本研究虽然缺少依从性的数据但是如此高的未抑制率单纯用依从性差来解释是否足够,对于HCV的共感染除了公所周知的肝毒性副作用之外是否还存在其他影响HIV抗病毒治疗的因素,目前还未有充足的研究证据去证明或证否,本文提供了一个重要的切入点,更加深入的工作还需要在下一步调查研究中进行。同时需要强调的是本文中HIV/HCV共感染者是指HIV/HCV的抗体阳性者,进一步研究需要依据是否核酸阳性做更进一步准确的分类。
研究中有1例患者在基线中被监测到PI的耐药突变,而在此后的随访中却未再检测到,这种情况在其他的研究中也有发现[14],这可能是由于基因型耐药监测的方法学上的问题。
总的来说,本研究发现艾滋病一线抗病毒治疗病毒学失败的HIV/HCV共感染患者在更换二线治疗方案12个月后患者的状况得到一定改善,但是在1年内并未取得持续改善的效果,共感染HCV是否有影响,影响有多大是一个亟需进一步调查的问题。
| [1] Gao XF,Cui Q,Shi X,et al. Prevalence and trend of hepatitis C virus infection among blood donors in Chinese mainland:a systematic review and meta-analysis[J]. BMC Infect Dis,2011,11:88. |
| [2] Shang H, Zhong P, Liu J, et al. High prevalence and genetic diversity of HCV among HIV-1 infected people from various high-risk groups in China[J]. PLoS One,2010,5(5):e10631. |
| [3] Sulkowski MS,Thomas DL,Chaisson RE, et al. Hepatotoxicity associated with antiretroviral therapy in adults infected with human immunodeficiency virus and the role of hepatitis C or B virus infection[J]. Jama,2000,283(1):74-80. |
| [4] Li N, Wang Z,Sun DY,et al. HIV among plasma donors and other high-risk groups in Henan,China[J]. J Acquir Defic Syndr,2010,53 Suppl 1:S41-47. |
| [5] He N,Detels R. The HIV epidemic in China:history,response,and challenge[J]. Cell Res,2005,15(11/12):825-832. |
| [6] Zhang FJ,Haberer JE,Wang Y,et al. The Chinese free antiretroviral treatment program:challenges and responses[J]. AIDS,2007,21 Suppl 8:S143-148. |
| [7] Liao LJ,Xing H,Shang H,et al. The prevalence of transmitted antiretroviral drug resistance in treatment naïve HIV-infected individuals in China[J]. J Acquir Immune Defic Syndr,2010,53 Suppl 1:S10-14. |
| [8] Zhong P, Pan QC,Ning Z,et al. Genetic diversity and drug resistance of human immunodeficiency virus type 1 (HIV-1) strains circulating in Shanghai[J]. AIDS Res Hum Retrov,2007,23(7):847-856. |
| [9] Liu J,Zhang M,Zhu Q,et al. Effect of HCV RNA on response to highly active antiretroviral therapy in HIV/HCV co-infected patients[J]. Chin J Lab Med,2009,32(4):372-376. (in Chinese)刘静,张旻,朱谦,等. HCV RNA对HIV合并HCV感染者高效抗逆转录病毒治疗的影响[J]. 中华检验医学杂志,2009,32(4):372-376. |
| [10] Zhang M,Shang MQ,Yang WW,et al. Treatment effect and drug-resistant mutations in Chinese AIDS patients switching to second-line antiretroviral therapy[J]. PLoS One,2014,9(10):e110259. |
| [11] Zhao Y,Mu WW,Harwell J,et al. Drug resistance profiles among HIV-1-infected children experiencing delayed switch and 12- month efficacy after using second-line antiretroviral therapy:an observational cohort study in rural China[J]. J Acquir Immune Defic Syndr,2011,58(1):47-53. |
| [12] Arribas JR, Delgado R, Arranz A,et al. Lopinavir-ritonavir monotherapy versus lopinavir-ritonavir and 2 nucleosides for maintenance therapy of HIV:96-week analysis[J]. J Acquir Immune Defic Syndr,2009,51(2):147-152. |
| [13] WHO. WHO HIV drug resistance report 2012[R]. Journal Watch. AIDS Clinical Care,2012. |
| [14] Marconi VC,Sunpath H,Lu ZG,et al. Prevalence of HIV-1 drug resistance after failure of a first highly active antiretroviral therapy regimen in KwaZulu Natal,South Africa[J]. Clin Infect Dis,2008,46(10):1589-1597. |
 2015, Vol. 36
2015, Vol. 36