文章信息
- 石国祥, 张政, 梅玲玲, 陈劲华, 梅盛华, 金大智, 张志凯, 王宇萌, 张孝和, 罗芸, 孙继民, 俞东征, 夏连续. 2014.
- Shi Guoxiang, Zhang Zheng, Mei Lingling, Chen Jinhua, Mei Shenghua, Jin Dazhi, Zhang Zhikai, Wang Yumeng, Zhang Xiaohe, Luo Yun, Sun Jimin, Yu Dongzheng, Xia Lianxu. 2014.
- 鼠疫耶尔森菌和假结核耶尔森菌基因鉴别方法的建立及评价
- Establishment and evaluation of identification method for Yersinia pestis and Yersinia pseudotuberculosis
- 中华流行病学杂志, 2015, 36(5): 496-500
- Chinese Journal of Epidemiology, 2015, 36(5): 496-500
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.05.018
-
文章历史
- 投稿日期:2014-10-30
2. 浙江省义乌市疾病预防控制中心;
3. 浙江省龙泉市疾病预防控制中心;
4. 中国疾病预防控制中心传染病预防控制所;
5. 浙江省温州市疾病预防控制中心
2. Yiwu Prefecture Center for Disease Control and Prevention;
3. Longquan County Center for Disease Control and Prevention;
4. Institute for Communicable Disease Prevention and Control, Chinese Center for Disease Control and Prevention;
5. Wenzhou Prefecture Center for Disease Control and Prevention
鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)和假结核耶尔森菌(Yersinia pseudotuberculosis,假结核菌)为革兰阴性肠杆菌科耶尔森菌属细菌。耶尔森菌属有11个种,具有致病性的仅3个种,即鼠疫菌、假结核菌和小肠结肠炎耶尔森菌(Yersinia enterocolitia,小肠结肠炎菌),3种菌在致病性方面存在着很大差异。历史上鼠疫曾出现多次世界性大流行[1],导致至少1.6亿人死亡[2]。研究表明,鼠疫菌由假结核菌的O ∶ 1b血清型菌株在1 500~20 000年前进化而来,两者DNA同源性很高,且在很短时间内转变成了具有极高致病力且高度保守的鼠疫菌[3, 4]。最近基于adk、argA、 aroA、glnA、thrA、tmk、trpE 7个管家基因的MLST分析:在假结核菌O ∶ 1b血清型菌株中,有81.25%的菌株克隆群为ST43,而鼠疫菌的最主要克隆群ST90与ST43仅存在1个管家基因的差异,提示鼠疫菌与O ∶ 1b血清型假结核菌的遗传关系最近[5]。微生物分类学上曾一度把鼠疫菌命名为假结核菌鼠疫变种,但是由于鼠疫菌在致病性和传播途径上与假结核菌感染差异很大,最后仍旧分为两个种。
鼠疫菌在自然界中可以以非典型形式长期保存,特别是在流行静息期[6],用常规的细菌培养很难分离出鼠疫菌。因此本研究旨在建立针对鼠疫菌和假结核菌基因的鉴别方法,以便在遇到非典型菌株能够及时进行鉴别。 材料与方法
1. 菌株来源:实验所用的鼠疫菌均由中国疾病预防控制中心传染病预防控制所鼠疫室保存,来自我国11类鼠疫自然疫源地的52株鼠疫菌,其中患者1株、媒介蚤4株、宿主动物47株。57株假结核菌和1株全基因组序列已在NCBI公布的LC20小肠结肠炎菌均分离自浙江省2005-2013年鼠粪便标本。21株标准或参考菌株来自浙江省疾病预防控制中心的菌种保藏室,其他肠道菌株来自浙江省疾病预防控制中心微生物检验所肠道病原菌检测实验室。
2. 细菌分离和鉴定:鼠疫菌经鼠疫噬菌体裂解试验确认。假结核菌、小肠结肠炎菌分离:采集鼠的结肠部位粪便置于改良PBS中,置4 ℃冰箱中冷增菌15~21 d,将增菌液接种到耶尔森菌选择性培养基上(CM0653,OXOID LTD,England),三段法划线、28 ℃培养,挑出24~36 h培养才形成的肉眼可见、镜下菌落表面布满丛刺的可疑菌落,用API20E肠道菌试剂鉴定条(法国Biomerieux公司)进行系统生化鉴定。
3. PCR扩增: (1)细菌DNA模板制备:分别将鼠疫菌和假结核菌接种到营养琼脂平板上,28 ℃培养48 h后刮取菌苔,使用德国Qiagen公司的QIAamp DNA Mini Kit(51306)DNA提取试剂盒进行提取,-20 ℃保存备用。
(2)引物设计及片段测序:依据鼠疫菌“疫岛”及假结核菌“假岛”的基因片段[7],在NCBI上重新对这些片段进行比对,选择“疫岛”和“假岛”上的特异性片段作为引物设计靶标,用Primer3在线引物设计工具设计引物,经鼠疫EV疫苗株及假结核菌进行初筛后再用于检测,引物名称、目标基因、引物序列及PCR扩增的退火温度等信息见表 1。引物合成和片段的序列测定委托生工生物工程(上海)股份有限公司完成。
(3)扩增与产物检测:PCR反应体系采用宝生物工程(大连)有限公司的premix Taq PCR扩增混合体系(RR901A)。反应条件:94 ℃ 5 min;94 ℃ 30 s,退火30 s,72 ℃ 40 s,30个循环;72 ℃ 5 min。取扩增产物8 μl进行琼脂糖凝胶电泳,120 V电泳30 min后在紫外检测仪上观测并记录结果。10对引物扩增鼠疫菌和假结核菌的典型图谱见图 1。
 |
| 注:10对引物检测,每对引物8孔,1~4孔为鼠疫菌DNA,5~7孔为假结核菌DNA,N为ddH2O对照孔;M:Marker,从下到中间高亮度条带的分别为100、200、300、400和500 bp图 1 10对引物检测鼠疫菌和假结核菌的电泳图谱 |
1. 鼠疫菌检测:对来自我国11类鼠疫自然疫源地的52株鼠疫菌用10对引物进行PCR扩增,5对鼠疫菌鉴定引物(PeI1、PeI2、PeI3、PeI11、PeI12)全部扩出目的条带;假结核菌PsI1引物在所有鼠疫菌中扩出目的条带,其他4对假结核菌鉴定引物PsI7、PsI16、PsI18、PsI19未扩出目的条带(图 1,表 2)。
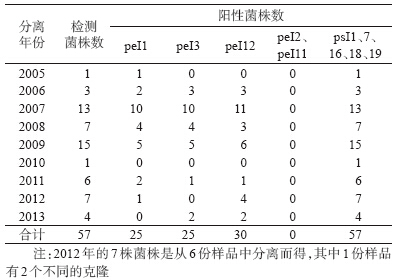
2. 假结核菌检测:2005-2013年浙江省分离的57株假结核菌经10对引物检测,5对假结核菌鉴定引物全部扩出目的条带,2对鼠疫菌鉴定引物(PeI2和PeI11)在57株假结核菌未扩出目的条带,另外3对鼠疫菌鉴定引物(PeI1、PeI3和PeI12)在部分菌株中扩出目的条带(图 1,表 3),条带经测序及比对,与鼠疫菌的序列基本相同。
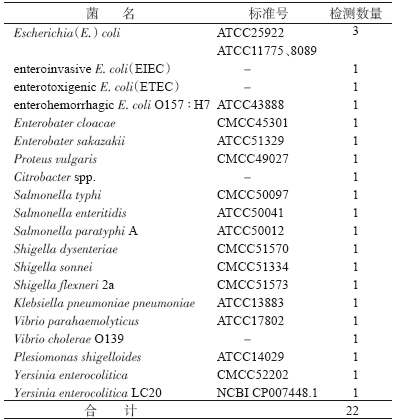
3. 标准和参考菌株检测:17株标准菌株和5株参考菌株(无标准号的4株及1株全基因组序列已公布的小肠结肠炎LC20菌株)经10对引物进行扩增,除LC20的小肠结肠炎菌PsI7扩出目的条带外,其他引物均未扩出条带。经序列比对,LC20的片段序列与假结核菌的PsI7片段为同源性较低的非特异性片段。检测菌株的名称、标准号、数量见表 4。
4. 现场分离菌株和样品的检测:从浙江省鼠粪便样品中分离的28株小肠结肠炎耶尔森菌、1株弗氏或中间型耶尔森菌、1株弗氏柠檬酸杆菌、1株克吕沃尔菌、16株从鼠粪便和鼠脏器中分离到的未定种菌株、从鼠洞泥土样品中分离的3株小肠结肠炎耶尔森菌、从人粪便中分离的3株小肠结肠炎耶尔森菌、1株弗氏或中间型耶尔森菌、19株沙门菌、1株志贺菌、2株气单胞菌、2株布氏柠檬酸杆菌以及5份鼠洞泥土DNA样品经10对引物进行扩增,PsI1在4株菌中扩出目的条带(3株小肠结肠炎菌,1株为福氏或中间型耶尔森菌);PsI7在1株小肠结肠炎菌现场分离株中扩出目的条带外,其他引物均未扩出目的条带。PsI7检出阳性的1株菌经序列测定和片段比对,与假结核菌序列差异较大,与鼠疫菌不同源。PsI1检出阳性的3株菌(另1株测序不成功)经序列测定,并在NCBI上进行BLAST比对显示,片段同源性较高。系统进化树分析显示,PsI1片段可以将耶尔森菌属分成二个大的分支,一个大的分支为小肠结肠炎菌等,另一个大的分支为鼠疫菌和假结核菌,鼠疫菌除CO92株外,所有12株鼠疫菌与6株假结核菌序列完全相同并聚类在一起(图 2)。
 |
| 注:Y. pseudotuberculosis IP 32953为参考菌株图 2 用PsI1片段序列比对构建的耶尔森菌属系统进化树(邻-接法) |
鼠疫菌有20处特有的“疫岛”序列,假结核菌39处特有的“假岛”序列[7],疫岛和假岛的确定,为鉴别鼠疫与假结核菌提供了较好的靶标。本研究通过对已公布全基因组序列的12株鼠疫菌和4株假结核菌进行比对,各选择5个片段设计引物,并对22株标准(或参考)菌株、全国11类鼠疫疫源地的52株鼠疫菌,浙江省现场分离的57株假结核菌、34株小肠结肠炎耶尔森菌、2株其他耶尔森菌、19株沙门菌、7株其他肠道菌株及样品等进行扩增,筛选出了2套鼠疫菌染色体上的特异性扩增引物PeI2和PeI11(靶基因分别为YPO0392、YPO1668)、4套假结核菌染色体上的特异性扩增引物PsI7、PsI16、PsI18和PsI19(靶基因分别为YPTB1059、YPTB2182、YPTB2200和YPTB2205)。本文通过对52株鼠疫菌和57株假结核菌及其他一些肠道菌株进行PCR扩增,结果显示,假结核菌上的PsI1引物(靶基因YPTB0085)可作为鼠疫菌和假结核菌的通用鉴定引物。这也从PsI1片段全序列BLAST比对结果中获得理论依据(图 2)。PsI1片段全长944 bp,包括2个CDS,glpX基因(YPTB0085)编码果糖1,6-二磷酸酶Ⅱ;glpK基因(YPTB0086)编码甘油激酶;而鼠疫菌CO92株完全缺失了该片段。鼠疫菌CO92株是1992年从美国1例被猫感染的肺鼠疫患者中分离到,2001年由英国Sanger研究中心用鸟枪法完成全基因组的测序工作[8],是鼠疫菌中最早完成全基因组测序的菌株,也是鼠疫菌基因组学分析的经典代表株。PsI1被认为是“假岛”,可能是在进行鼠疫菌和假结核菌基因组比较分析时,选用了鼠疫菌CO92株与假结核菌的IP32953株进行分析得出的结果。当然这也从另外一个角度证实了鼠疫菌CO92株与其他在NCBI公布全基因组序列的12株鼠疫菌和本文完成检测的52株鼠疫菌之间的一个不同之处。虽然本文也发现在个别小肠结肠炎菌株中也能检测到PsI1 的条带,但从PsI1片段的系统发生树和序列测定结果来看,小肠结肠炎菌株上片段的同源性与鼠疫菌和假结核菌相对较低,而且也只在少数菌株中检出该片段,完全可以通过本研究中的其他多对引物的检测加以排除。
鼠疫菌基因检测方法有环介导等温扩增检测[9]和TaqMan探针实时荧光定量PCR[10]等,上述方法选用的扩增靶目标均为鼠疫菌编码F1抗原的cafl基因。鼠疫菌caf1基因是在65×106的pMT1质粒上,这对自然缺失pMT1质粒的鼠疫菌而言,由于检测靶标的缺失造成错误的假阴性结果。环介导等温扩增技术虽不需要特殊仪器设备、在等温状态下扩增效率较高、较适用于基层或现场的检测,但也存在环介导的稳定性不够、引物设计复杂、结果判定时个人主观因素影响较大等缺点。而荧光定量PCR虽然敏感、快速,但因需要昂贵的特殊仪器,不适合在基层和现场的推广和应用。而本文选用的检测靶标是在细菌的染色体上、稳定性高,并经过了大量的鼠疫菌、假结核菌及小肠结肠炎等肠道菌株验证过的特异性靶标,采用的又是经过较长时间发展的成熟的普通PCR扩增技术,无论是在仪器设备还是在技术条件上,非常适合在基层和现场的使用。
在我国目前的鼠疫监测中,常会在野生动物大量死亡的情况下发现一些不明病原,以往均作为“杂菌”处理掉,而这些菌有可能是发生变异的鼠疫菌。前苏联也有过报道,从鼠疫噬菌体作用过的无毒力鼠疫菌株中,分离出1株抗鼠疫噬菌体菌株,全部特性与假结核菌相似[6]。何建等[11]报道了1株具备鼠疫菌的典型形态特征、且能被鼠疫噬菌体裂解的菌株,最后经动物试验、鼠疫菌全基因芯片杂交、标识基因检测、DFR分型和MLST分析等,才确定是1株假结核耶尔森菌。而根据本文研究得出的一些特异性检测靶标,就可以快速地鉴定这些细菌到底是鼠疫菌还是假结核菌,从而达到快速鉴别和判定的目的。
在鼠疫流行静息期内或有微弱间断流行检出弱毒鼠疫菌和鼠疫血凝试验存在阳性的地区,对于非典型菌的分离至关重要[6]。在这样的地区,仅靠细菌学分离的方法是无法完全解决问题的,必须依靠分子生物学技术快速发展带来的极大便利,应用简便、可靠的分子检测方法来提高检测的灵敏度,同时也降低由于误判而带来的巨大社会风险,本研究为应对这种可能性建立了一套检测方法。这将进一步丰富我国的鼠疫检测手段,并对鼠疫静息疫源地的监测、非典型鼠疫菌的搜索等方面提供有益的帮助。
| [1] Morelli G, Song YJ, Mazzoni CJ, et al. Phylogenetic diversity and historical patterns of pandemic spread of Yersinia pestis[J]. Nat Genet, 2010, 42(12):1140-1143. |
| [2] Perry RD, Fetherston JD. Yersinia pestis-etiologic agent of plague[J]. Clin Microbiol Rev, 1997, 10(1):35-66. |
| [3] Achtman M, Zurth K, Morelli G, et al. Yersinia pestis, the cause of plague, is a recently emerged clone of Yersinia pseudotuberculosis[J]. Proc Natl Acad Sci USA, 1999, 96(24):14043-14048. |
| [4] Skurnik M, Peippo A, ErveläE. Characterization of the O-antigen gene clusters of Yersinia pseudotuberculosis and the cryptic O-antigen gene cluster of Yersinia pestis shows that the plague bacillus is most closely related to and has evolved from Y. pseudotuberculosis serotype O : 1b[J]. Mol Microbiol, 2000, 37(2):316-330. |
| [5] Duan R, Liang JR, Shi GX, et al. Homology analysis of pathogenic Yersinia species Yersinia enterocolitica, Yersinia pseudotuberculosis, and Yersinia pestis based on multilocus sequence typing[J]. J Clin Microbiol, 2014, 52(1):20-29. |
| [6] Song YF. The research progress of plague in atypical form in the long-term preservation of nature[J]. Chin J Endemic Dis Prev Control, 1995, 10(2):101-103. (in Chinese) 宋延富. 鼠疫以非典型形式在自然界长期保存的研究进展[J]. 中国地方病防治杂志, 1995, 10(2):101-103. |
| [7] Yu DZ. Comparative analysis of Yersinia pestis and Yersinia pseudotuberculosis chromosomes[J]. Dis Surveill, 2011, 26(10):760-765. (in Chinese) 俞东征. 鼠疫与假结核耶尔森菌基因组比较分析[J]. 疾病监测, 2011, 26(10):760-765. |
| [8] Parkhill J, Wren BW, Thomson NR, et al. Genome sequence of Yersinia pestis, the causative agent of plague[J]. Nature, 2001, 413(6855):523-527. |
| [9] Wei D, Wang JY, Wang GZ. Development of loop-mediated isothermal amplification method for detection of Yersinia pestis[J]. Chin J Health Laborat Technol, 2012, 22(9):2074-2077. (in Chinese) 魏东, 汪洁英, 王国治. 鼠疫耶尔森氏菌环介导等温扩增检测方法的建立[J]. 中国卫生检验杂志, 2012, 22(9):2074-2077. |
| [10] Wei Y, Zhou Y, Wang CH, et al. Rapid detection of Yersinia pestis with TaqMan probe by real time fluorescent quantitative PCR[J]. Chin J Dis Contr Prev, 2012, 16(11):954-957. (in Chinese) 韦耀, 周莹, 王春辉, 等. 鼠疫耶尔森菌TaqMan探针实时荧光定量PCR快速检测[J]. 中华疾病控制杂志, 2012, 16(11):954-957. |
| [11] He J, Li YJ, Qi ZZ, et al. Systematic identification of a suspicious Yerinia pestis isolate[J]. Chin J Zoon, 2011, 27(4):355-358. (in Chinese) 何建, 李艳君, 祁芝珍, 等. 对1株疑似鼠疫耶尔森氏菌的系统鉴定[J]. 中国人兽共患病学报, 2011, 27(4):355-358. |
 2015, Vol. 36
2015, Vol. 36