文章信息
- 陈霄, 王金桃, 白丽霞, 丁玲, 吴婷婷, 白兰, 许娟, 孙雪松. 2014.
- Chen Xiao, Wang Jintao, Bai Lixia, Ding Ling, Wu Tingting, Bai Lan, Xu Juan, Sun Xuesong. 2014.
- 宫颈癌变中叶酸缺乏与脆性组氨酸三联体基因表达异常的相互作用
- Interaction between folate deficiency and aberrant expression related to fragile histidine triad gene in the progression of cervical cancerization
- 中华流行病学杂志, 2015, 36(4): 387-392
- Chinese Journal of Epidemiology, 2015, 36(4): 387-392
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.04.020
-
文章历史
- 投稿日期:2014-11-19
叶酸具有参与和调节DNA甲基化的生物学功 能。研究显示,叶酸缺乏和异常的DNA甲基化与宫 颈癌发生密切相关[1, 2]。本课题组前期研究和国外 多数研究结果均提示,叶酸缺乏与宫颈癌的发生存 在剂量-反应关系[3, 4],但其机制尚不清楚。脆性组 氨酸三联体(FHIT)基因是一种特殊的抑癌基因,其 异常表达与宫颈癌的发生发展密切相关,而FHIT基 因CpG 岛甲基化是导致自身功能失活的重要机制 之一[5, 6]。鉴于叶酸在体内作为甲基供体直接参与 DNA甲基化,叶酸缺乏可导致抑癌基因CpG岛高甲 基化,进而推测叶酸可能通过影响FHIT基因甲基化 及蛋白的表达,在宫颈病变中发挥作用,但目前国内 外均未见相关报道。本研究综合分析不同宫颈病变 患者及宫颈癌细胞,探讨叶酸和FHIT蛋白在宫颈癌 及癌前病变中的作用及其相互关系,为宫颈癌病因 和发病机制研究提供科学依据。
对象与方法1. 研究对象:选取2009 年9 月至2010 年12 月在 山西省肿瘤医院、山西医科大学第二医院、介休市妇 幼保健院经病理学确诊的新发宫颈炎症(CI)患者 80 例、低度宫颈上皮内瘤样变(CINⅠ)患者55 例、 高度宫颈上皮内瘤样变(CINⅡ/Ⅲ)患者55 例以及 宫颈鳞状细胞癌(SCC)患者64 例作为研究对象。 所有研究对象均排除营养性巨幼细胞性贫血、溶血 性疾病、消化道疾病、其他肿瘤患者以及3 个月内B 族维生素使用者,在知情同意下,采用结构式问卷收 集研究对象的人口学特征、宫颈癌相关因素等资料, 同时采集全部研究对象入院后、系统治疗前清晨空 腹静脉血5 ml 和手术或活检宫颈组织标本,常规处 理,置于-80 ℃保存待检。本研究通过山西医科大 学伦理委员会审查。
2. 试验方法:
(1)细胞系选择及培养:选择人乳头瘤病毒16型 (HPV16)阳性宫颈癌细胞CaSki,用含10%小牛血清 的RP MI1640 培养液培养、传代,取对数生长期的CaSki 细胞培养24 h 后,转入含不同浓度叶酸培养液 中培养。以叶酸浓度1 μg/ml 为对照组,以叶酸浓度 10、100、250、500、1 000 μg/ml为5个干预组。各不同 浓度均设3个平行孔,检测不同叶酸浓度下细胞的生 长情况、FHIT基因甲基化状况和蛋白的表达水平。
(2)宫颈组织HPV16 DNA 检测:采用酚-氯仿 法提取宫颈组织总DNA,参照本课题组前期建立 的PCR 扩增方法进行HPV16 DNA 的扩增,确定 HPV16 感染状态[7]。
(3)血清叶酸含量测定:用1%抗坏血酸溶液处 理血清样本,离心取上清,参照本课题组前期建立的 微生物法检测血清叶酸浓度[8]。
(4)FHIT基因CpG岛甲基化测定:采用酚-氯仿 抽提法提取宫颈组织和宫颈癌细胞的总DNA,参照 本课题组前期建立的甲基化特异性PCR(MSP)法检 测FHIT 基因CpG岛甲基化状况[9]。FHIT 基因的甲 基化引物:上游5′-TTG GGG CGC GGG TTT GGG TTT TTA CGC-3′,下游5′-CGT AAA CGA CGC CGA CCC CAC TA-3′;非甲基化引物:上游 5′-TTG GGG TGT GGG TTT GGG TTT TTATG-3′, 下游5′-CATAAACAACAC CAACCC CAC TA-3′, 产物长度均为74 bp。对PCR扩增产物行2%琼脂糖 凝胶电泳,在VILBER CV-A50C 凝胶成像仪下观 察,分别获得FHIT基因甲基化和未甲基化条带。
(5)FHIT蛋白表达的检测:取宫颈组织(50 mg) 或宫颈癌细胞(细胞密度1×106 cell/ml),分别加适 量WIP裂解液和PMSF的混合液,冰浴中匀浆,充分 裂解。10 464 g 离心,取上清后参照本课题组前期 建立的方法(Western blot)检测FHIT 蛋白表达水 平[3]。一抗为1 ∶ 800 兔抗人FHIT单克隆抗体,在相 对分子质量43×103和16.8 ×103处分别获得内参照 蛋白β-actin 和FHIT蛋白条带。利用Quantity One软 件分析条带的A 值,以目的条带与内参β-actin 条带 的A值之比作为FHIT蛋白的相对表达量。
(6)细胞增殖检测:取对数生长期的CaSki 细胞 (细胞密度1×105 cell /ml),接种于含不同浓度叶酸的培养液中培养48 h,0.25%的胰蛋白酶液消化,制 成细胞悬液,显微镜下进行活细胞计数。抑制率= (对照组细胞总数-干预组细胞总数)/对照组细胞 总数。
(7)细胞凋亡检测:按上述方法制成细胞悬 液。采用流式细胞术(FCM)收集细胞,离心,弃上 清,PBS 洗涤,过滤,离心,弃上清。PE 染色 (Annexin Ⅴ -PE 凋亡试剂)15 min,加入150 μ l binding buffer,于流式细胞仪检测,获得宫颈癌细胞 的凋亡率。
3. 统计学分析:采用SPSS 17.0 软件进行相关资 料的χ2检验、Kruskal-Wallis(K-W)检验、Spearman 秩 相关分析,计算相关因素与宫颈癌变之间关联强度 的OR 值及其95%CI。应用相加模型及交互作用指 标超额相对危险度(RERI)、交互作用归因比(API) 和交互作用指数(S)进行交互作用定性和定量评 估。检验水准为α=0.05。
结果1. 人口学特征及相关因素:CI 组、CINⅠ组、 CINⅡ/Ⅲ组、SCC组的年龄M 值分别为45.0 岁(27~ 57 岁)、46.0 岁(29~67 岁)、44.0 岁(28~64 岁)和 51.0 岁(28~70 岁)。各组间在民族、出生地、居住 地、婚姻状况、肿瘤家族史等方面的差异均无统计学 意义(P>0.05),但在年龄、文化程度、职业、人工流 产史、妇科病史、HPV16 感染等方面的差异均有统 计学意义(P<0.05),见表 1。
2. 血清叶酸水平与宫颈癌变的关系:血清叶酸 含量为非正态分布,经K-W 检验,各组间血清叶酸 水平的总体分布差异有统计学意义(H=59.08,P< 0.001),其含量随着宫颈病变的加重而降低。以调整 检验水准α=0.008 3(α=0.05/比较次数=0.05/6),采 用Bonferroni 法两两比较发现,SCC 组和CINⅡ/Ⅲ 组的血清叶酸含量低于CINⅠ组和CI 组,差异均有 统计学意义,但SCC 组与CINⅡ/Ⅲ组、CIN Ⅰ组与 CI 组间的差异均无统计学意义。进一步以CI 组血 清叶酸含量的50%点值为界,≤5.96 ng/ml 为低叶酸 水平进行分析,结果显示,低血清叶酸率在SCC组、 CINⅡ/Ⅲ组和CINⅠ组均高于CI 组,随宫颈病变程 度的加重低血清叶酸率逐渐升高(趋势χ2=32.71, P<0.001),见表 2。
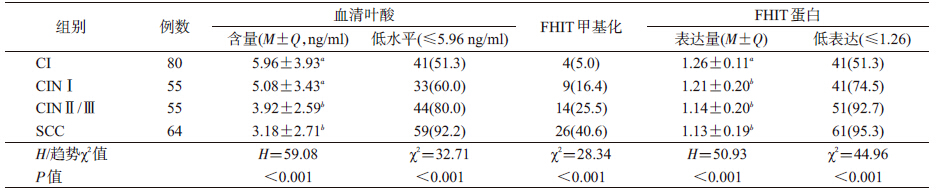 |
| 注:同表 1;M±Q 为中位数±四分位数间距;a,b组间比较时相同字母表示差异无统计学意义(P>0.05),不同字母表示差异有统计学意义 (P<0.05) |
3. FHIT 基因甲基化和蛋白表达与宫颈癌变的 关系:FHIT基因的甲基化率随着宫颈病变的加重逐 渐升高(趋势χ2=28.34,P<0.001)。FHIT 蛋白表达量为非正态分布,经K-W检验,各组间FHIT 蛋白表 达量总体分布差异有统计学意义(H=50.93,P< 0.001),其含量随着宫颈病变的加重而降低。调整检 验水准,采用Bonferroni 法两两比较发现,SCC 组、 CINⅡ/Ⅲ组和CINⅠ组的FHIT 蛋白表达量均低于 CI 组,差异均有统计学意义,但三组间相互的差异 均无统计学意义。进一步以CI 组FHIT 蛋白表达量 的50%点值为界,≤1.26 为低蛋白表达进行分析,结果显示,FHIT 蛋白低表达率在SCC 组、CINⅡ/Ⅲ组 和CINⅠ组均高于CI 组,随宫颈病变程度的加重 FHIT 蛋白低表达率逐渐升高(趋势χ2=44.96,P< 0.001),见表 2。
4. 血清叶酸与FHIT 蛋白表达在宫颈癌变中的 相互关系:采用Spearman 秩相关分析显示,宫颈病 变患者总体血清叶酸含量与FHIT 蛋白表达量呈正 相关(r=0.213,P=0.001),见图 1。进一步以CI 组 血清叶酸含量的50%点值(5.96 ng/ml)和FHIT 蛋白 表达量的50%点值(1.26)分别作为低血清叶酸水平 和FHIT蛋白低表达的界值,应用相加作用模型进行 交互效应分析。结果显示,叶酸缺乏和FHIT蛋白低 表达在CINⅠ组、CINⅡ/Ⅲ组和SCC 组均呈现正相 加交互作用,交互作用指标RERI、API和S均显示正 相加效应,调整宫颈癌相关因素后这种交互作用模 式仍然存在,各组间调整OR(aOR)值均有统计学意 义(表 3)。
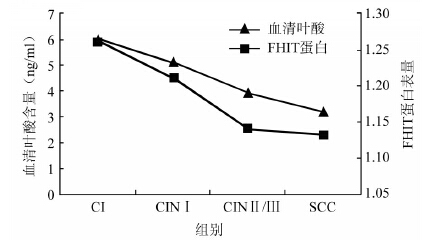 |
| 图 1不同宫颈病变组血清叶酸含量与FHIT蛋白 表达量的关系 |
5. 叶酸干预对宫颈癌细胞增殖凋亡及FHIT 基 因表达的影响:随着叶酸浓度的增加,宫颈癌细胞的 增殖抑制率(r=0.98,P<0.001)和凋亡率(r=0.99, P<0.001)均逐渐上升,与叶酸水平呈正相关;FHIT 基因甲基化程度逐渐减弱;FHIT蛋白表达水平均逐渐增高,与叶酸水平呈正相关(r=0.97,P<0.001), 见表 4。
宫颈癌是女性第二大恶性肿瘤,全球新发病例 80%以上来自发展中国家[10]。目前已证实HPV 感 染,特别是高危型HPV(HR-HPV)感染是宫颈癌发 生的主要病因[11]。HPV与宿主细胞DNA整合是致 癌过程的必要环节,该整合最易发生在染色体脆性 位点FRA3B处,而叶酸缺乏可导致这种整合的概率 增加[12],提示叶酸缺乏可能导致HPV的持续性感染 进而增加宫颈癌的发生风险。研究表明,高血清叶酸水平的妇女感染HR-HPV 的风险较低,补充叶酸 对宫颈癌前病变有逆转作用[13]。本课题组前期对叶 酸与宫颈癌关系的Meta 分析显示随着叶酸水平降 低,患宫颈癌的危险性增加[14]。本次研究显示随着 宫颈病变的加重,血清叶酸含量呈现逐渐降低的趋 势,且SCC 组和CINⅡ/Ⅲ组的叶酸水平明显低于 CINⅠ组和CI 组,再次验证了叶酸缺乏可增加宫颈 癌发生风险的结论。在此基础上,本次进一步采用 叶酸干预的体外实验研究,结果显示随着叶酸浓度 的增加,宫颈癌细胞的增殖抑制率和凋亡率均逐渐 上升,且均与叶酸浓度呈正相关。说明叶酸可以有 效抑制宫颈癌细胞生长,提示在人群中适当补充 叶酸对宫颈癌及癌前病变的预防和控制具有重要 意义。
近年研究显示,HPV感染的妇女发展为宫颈癌 者仅占较小比例,提示单纯HPV感染不足以引起宫 颈癌的发生,很可能存在其他致癌因子或HPV协同 因子。研究表明,宫颈癌的发生发展与多个抑癌基 因的失活有关,FHIT 基因定位于染色体3p14.2,覆 盖了染色体脆性位点FRA3B 及HPV16 DNA 整合 点,FHIT 基因异常与HPV 可协同触发宫颈癌发生 与进展[15]。研究发现,随着宫颈病变程度的加重, FHIT蛋白表达水平逐渐下降[5, 16]。本次研究分别采 用甲基化特异性PCR 和Western blot 法测定组织和 细胞中FHIT 基因甲基化状态和蛋白表达水平。结 果显示,随着宫颈病变的进展,FHIT 基因的甲基化 率逐渐升高,FHIT 蛋白的表达水平逐渐降低,且 SCC组和CIN 组明显低于CI 组。提示FHIT 基因高 甲基化和FHIT 蛋白低表达均与宫颈癌及癌前病变 的发生密切相关,特别发现FHIT蛋白这一代表基因 功能状态的指标,在宫颈癌前病变的早期阶段即发 生了下调,提示FHIT蛋白的检测对宫颈癌变的早期 发现具有重要的预警意义。
研究显示,宫颈组织中FHIT基因的异常甲基化是FHIT 蛋白失活的重要机制之一[6, 17, 18]。而叶酸作 为甲基供体参与DNA 的甲基化过程,叶酸缺乏可 导致抑癌基因异常甲基化,提示叶酸可能通过影响 FHIT 基因的甲基化状态,进而对FHIT 蛋白的表达 产生影响,但目前尚未见相关报道。本次研究显 示,随着宫颈病变的加重,血清叶酸含量和FHIT 蛋 白表达量均呈降低趋势,两者间存在正相关关系; 在CINⅠ 组、CINⅡ/Ⅲ 组和SCC 组,叶酸缺乏和 FHIT蛋白低水平表达均存在正相加交互作用,且该 交互作用随着宫颈病变的加重逐渐增大。体外研究 发现,随着叶酸干预浓度的增加,FHIT 基因的甲基 化程度逐渐减弱,FHIT 蛋白的表达水平逐渐升高, 验证了宫颈病变妇女中的研究结果,同时提示,补充 叶酸可能逆转FHIT 基因的高甲基化和蛋白低表 达。本次研究从患病群体和体外干预实验研究两个 层面,均揭示叶酸缺乏和FHIT基因的功能降低或缺 失在宫颈病变的恶性演进中均具有重要作用,当两 者同时存在时,其作用具有正相加交互效应,同时提 出叶酸缺乏可能通过引起FHIT 基因高甲基化和蛋 白低表达进而在宫颈病变中起重要作用的分子机 制,为后续进行宫颈癌及其癌前病变病因和机制的 研究提供了新线索,为该病干预和治疗的策略和方 案的制定开拓了新思路。
| [1] Pathak S, Bhatla N, Singh N. Cervical cancer pathogenesis is associated with one-carbon metabolism[J]. Mol Cell Biochem, 2012, 369(1/2):1-7. |
| [2] Flatley JE, McNeir K, Balasubramani L, et al. Folate status and aberrant DNA methylation are associated with HPV infection and cervical pathogenesis[J]. Cancer Epidemiol Biomarkers Prev, 2009, 18(10):2782-2789. |
| [3] Wang JT, Ding L, Jiang SW, et al. Folate deficiency and aberrant expression of DNA methyltransferase 1 were associated with cervical cancerization[J]. Curr Pharm Des, 2014, 20(11):1639-1646. |
| [4] Wang JT, Ma XC, Cheng YY, et al. A case-control study on the association between folate and cervical cancer[J]. Chin J Epidemiol, 2006, 27(5):424-427. (in Chinese)王金桃, 马晓晨, 程玉英, 等. 叶酸与宫颈癌关系的病例对照研究[J]. 中华流行病学杂志, 2006, 27(5):424-427. |
| [5] Huang LW, Chao SL, Chen TJ. Reduced fhit expression in cervical carcinoma:correlation with tumor progression and poor prognosis[J]. Gynecol Oncol, 2003, 90(2):331-337. |
| [6] Wu Y, Meng L, Wang H, et al. Regulation of DNA methylation on the expression of the FHIT gene contributes to cervical carcinoma cell tumorigenesis[J]. Oncol Rep, 2006, 16(3):625-629. |
| [7] Wang JT, Gao ES, Cheng YY, et al. Analysis on synergistic action between estrogen, progesterone and human papillomaviruses in cervical cancer[J]. Chin J Epidemiol, 2005, 26(5):370-373. (in Chinese)王金桃, 高尔生, 程玉英, 等. 内源性雌、孕激素与人乳头瘤病毒在宫颈癌发生中的协同作用研究[J]. 中华流行病学杂志, 2005, 26(5):370-373. |
| [8] Sun XS, Ding L, Chen F, et al. Effects of folate deficiency with HPV16 infection on cervix cancerization[J]. Chin J Epidemiol, 2014, 35(4):437-441. (in Chinese)孙雪松, 丁玲, 陈芳, 等. 叶酸缺乏及其与HPV16感染的交互效应对宫颈癌变的影响[J]. 中华流行病学杂志, 2014, 35(4):437-441. |
| [9] Wu TT, Wang JT, Ding L, et al. Folate deficiency and aberrant methylation of p16 CpG islands on cervical cancer and its precancerous lesions[J]. Chin J Dis Control Prev, 2013, 17(1):9-12. (in Chinese)吴婷婷, 王金桃, 丁玲, 等. 叶酸缺乏和 p16基因 CpG岛甲基化对宫颈癌变的作用[J]. 中华疾病控制杂志, 2013, 17(1):9-12. |
| [10] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA:Cancer J Clin, 2005, 55(2):74-108. |
| [11] Clifford GM, Smith JS, Plummer M, et al. Human papillomavirus types in invasive cervical cancer worldwide a meta-analysis[J]. Br J Cancer, 2003, 88(1):63-73. |
| [12] Blount BC, Mack MM, Wehr CM, et al. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage:implications for cancer and neuronal damage[J]. Proc Natl Acad Sci USA, 1997, 94(7):3290-3295. |
| [13] Piyathilake CJ, Badiga S, Paul P, et al. Indian women with higher serum concentrations of folate and vitamin B12 are significantly less likely to be infected with carcinogenic or high-risk(HR) types of human papillomaviruses (HPVs)[J]. Int J Womens Health, 2010, 2:7-12. |
| [14] Ma JL, Wang JT, Ding L. Meta-analysis of the relationship between serum folic acid status and the risk of cervical cancer [J]. Mod Prev Med, 2008, 35(21):4121-4124. (in Chinese)马景丽, 王金桃, 丁玲. 血清叶酸与宫颈癌发病关系的Meta分析[J]. 现代预防医学, 2008, 35(21):4121-4124. |
| [15] Butler D, Collins C, Mabruk M, et al. Loss of Fhit expression as a potential marker of malignant progression in preinvasive squamous cervical cancer[J]. Gynecol Oncol, 2002, 86(2):144-149. |
| [16] Connolly DC, Greenspan DL, Wu R, et al. Loss of fhit expression in invasive cervical carcinomas and intraepithelial lesions associated with invasive disease[J]. Clin Cancer Res, 2000, 6(9):3505-3510. |
| [17] Ki KD, Lee SK, Tong SY, et al. Role of 5-CpG island hypermethylation of the FHIT gene in cervical carcinoma[J]. J Gynecol Oncol, 2008, 19(2):117-122. |
| [18] Shi HR, Wu QH, Suo ZH, et al. Correlation between methylation of 5′-CpG islands and inactivation of FHIT gene in cervical cancer[J]. Chin J Cancer, 2005, 24(1):7-11. (in Chinese)史惠蓉, 吴庆华, 索振河, 等. 宫颈癌组织中FHIT基因5′端CpG岛甲基化及其与基因失活的关系[J]. 癌症, 2005, 24(1):7-11. |
 2015, Vol. 36
2015, Vol. 36