文章信息
- 严菊英, 缪梓萍, 吕华坤, 周佳悦, 龚黎明, 茅海燕, 孙逸, 张严峻. 2014.
- an Juying, Miao Ziping, Lyu Huakun, Zhou Jiayue, Gong Liming, Mao Haiyan, Sun Yi, Zhang Yanjun. 2014.
- 浙江省2013年病毒性脑膜脑炎病原学及分子流行病学特征
- Etiology and molecular-epidemiological characteristics of viral meningoencephalitis of Zhejiang province in 2013
- 中华流行病学杂志, 2015, 36(3): 280-284
- Chinese Journal of Epidemiology, 2015, 36(3): 280-284
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.03.019
-
文章历史
- 投稿日期:2014-09-25
2. 传染病预防控制所
2. Department of Infectious Disease, Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou 310051, China
引起病毒性脑膜脑炎的病原有人类肠道病毒(HEV)、腮腺炎病毒(MuV)、单纯疱疹病毒(HSV)、巨细胞病毒(CMV)和虫媒病毒等,研究表明,>80%病毒性脑膜脑炎由HEV引起。HEV属于微小核糖核酸病毒科的EV属,该属分为4类(HEV-A~D)[1],包括脊髓灰质炎病毒(Poliovirus,Polio)、柯萨奇病毒(Coxsackievirus,CV)、埃可病毒(Echovirus,E)和EV68-71型。不同病原引起的病毒性脑膜脑炎临床症状、治疗、预后和防制措施不同。本研究通过设立监测点,对疑似病毒性脑膜脑炎患者样本进行病原学与分子流行病学特征研究。 材料与方法
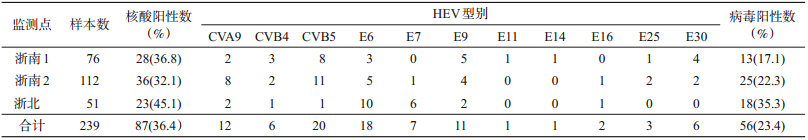
1. 标本来源:根据地理位置,在浙南的温州市鹿城区(浙南1),温州医科大学附属第二医院、瑞安县(浙南2),瑞安县人民医院和浙北的海盐县(浙北),海盐县人民医院设立专门监测点,全年开展监测。疑似病毒性脑膜脑炎病例定义:≤15岁,急性起病,具有发热、头痛、呕吐等症状,伴有不同程度意识障碍或脑膜刺激征,外周血和脑脊液实验室检测排除细菌性感染,高度怀疑为病毒性脑膜脑炎的所有患者。由医院采集患者脑脊液和/或粪便样本,送至疾病预防控制中心(CDC);2013年共采集229例患者239份样本(脑脊液226份,粪便13份),其中10例患者同时采集脑脊液和粪便样本。样本带冰运送到实验室,-80 ℃冰箱保存。
2. 病毒核酸检测:采用德国Qiagen公司的病毒总核酸提取试剂盒(MagAttract Virus Mini M48 Kit)提取核酸。采用荧光定量PCR方法检测脑脊液样本中的HEV、MuV、HSV、CMV和流行性乙型脑炎病毒(JEV)核酸和粪便样本中HEV核酸,试剂盒购自上海辉睿生物科技有限公司。反应体系:反应液Ⅰ 12.5 μl、热启动酶1.0 μl、反转录酶0.35 μl、反应液Ⅱ 4.0 μl、无RNA酶水2.15 μl和待检样本5.0 μl。反应条件:50 ℃ 30 min,92 ℃ 3 min;92 ℃ 10 s,55 ℃ 45 s,45个循环。结果判断:Ct值<35,扩增曲线呈“S”形,判为阳性,35.0<Ct值<38.0为临界值,Ct值≥38.0或无数值为阴性。
3. 病毒分离、基因扩增和测序:
(1)HEV分离与鉴定:采用人横纹肌瘤细胞(RD)和人喉表皮样癌细胞(Hep-2)培养法分离HEV[2],细胞来源于中国CDC病毒病预防控制所脊髓灰质炎病毒研究室,阳性分离物采用HEV荧光RT-PCR方法进行验证。
(2)VP1基因扩增:HEV分离株或脑脊液样本(HEV核酸阳性而病毒分离阴性)采用RT-PCR方法扩增VP1基因并测序。试剂采用宝生物工程(大连)有限公司的一步法RT-PCR试剂盒。引物序列参照文献[2]:008(5′-GCR TGC AAT GAY TTC TCW GT-3′)、011(5′-GCI CCI GAY TGI TGI CCR AA-3′),扩增片段为998 bp。 反应条件: 45 ℃ 30 min,99 ℃ 5 min,5 ℃ 5 min;95 ℃ 2 min;95 ℃ 1 min,45 ℃ 2 min,72 ℃ 1 min,40个循环;72 ℃ 8 min。PCR产物取5 μl进行琼脂糖凝胶电泳。
(3)测序与进化分析:PCR产物纯化后直接测序,委托生工生物工程(上海)股份有限公司完成。数据处理采用DNAMAN和Clustal X软件。采用Mega 6.2软件构建进化树,建树方法采用邻接法(NJ),Boostrap=1 000,鼻病毒(rhinovirus JAL-1)为外对照。 结果
1. 临床特征:229 例患者中男性151 例,女性78 例,性别比为1.94 ∶ 1;年龄5月龄至15 岁,其中≤5 岁110 例(48.0%)、6~10岁101 例(44.1%)、11~15 岁17 例(7.4%);发热205 例(89.5%)、头痛158 例(69.0%)、恶心104 例(45.4%)、呕吐155 例(67.7%)、意识障碍11 例(4.8%)、抽搐5 例(2.3%)、脑膜刺激征阳性4 例(1.7%);发病时间5-10 月有191 例(83.4%)。
2. 病毒分离及鉴定:239份样本中病毒核酸阳性92份(38.5%),其中HEV阳性87份,占94.6%(表 1),MuV、HSV和CMV阳性分别为1、2和2份,占5.4%;226份脑脊液中病毒核酸阳性81份(35.8%),13份粪便中阳性11份(84.6%)。239份样本中分离到HEV 56株,分离率为23.4%;31份HEV核酸阳性而病毒分离阴性的脑脊液样本中,经VP1基因扩增测序,结果31份均为HEV-B,其中E9检出最多(9份),其次是CVA9(8份)。87份HEV涉及11个血清型,分别为CVA9、CVB4、CVB5、E6、E7、E9、E11、E14、E16、E25和E30。在同时采集脑脊液和粪便样本的10个病例中,9例HEV阳性,其中4例从两类样本中均检测到同一血清型病毒(E6、E7),仅从脑脊液检测阳性1例(E6),仅从粪便中检测阳性4例(E6、E7和CVB5)。
3. HEV检测及进化树分析:
(1)不同监测点HEV优势株:浙南1优势流行株为CVB5(图 1),占HEV病原的28.6%(8/28),其次为E9(5/28);浙南2优势株也为CVB5,占30.6%(11/36),其次为CVA9(8/36),浙北则为E6,占43.5%(10/23),其次为E7(6/23),E7为浙江省首次分离到;2012年浙江省上述监测点优势株均为E30,占HEV病原的60.7%(17/28)[2]。
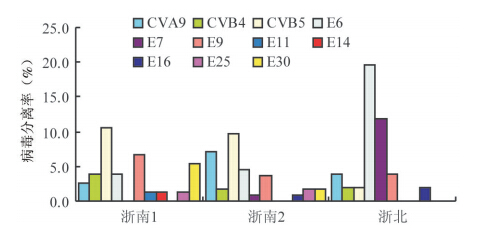 |
| 图 1 2013年浙江省不同监测点HEV型别分布与病毒分离率 |
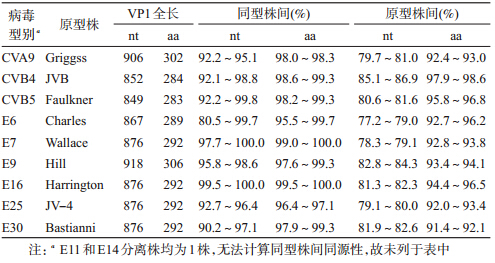
(2)VP1区同源性分析:87份HEV全部进行VP1区测序,获得全长849~918个核苷酸(nt),推导编码283~306个氨基酸(aa),测序株各血清型型内nt和aa同源性分别为80.5%~100.0%和95.5%~100.0%,与各原型株之间nt和aa的同源性分别为77.2%~86.9%和91.4%~98.6%(表 2);浙江省HEV血清型内nt和aa差异最大的为E6,分别为19.5%和4.5%,差异最小的为E16,nt和aa差异均为0.5%。浙江株E6与山东株JNEW10081 nt同源性为80.3%~97.9%,与韩国株kor08- ECV6-13cn nt同源性为81.8%~86.6%;浙江株E7与云南株298- YN-HC-103 nt同源性为98.1%~99.0%,浙江株CVB5与河南株17YB5 nt同源性为92.2%~97.5%。
(3)进化树分析:本研究HEV测序株与GenBank下载的国内外各血清型毒株VP1区全长nt序列构建进化树,可分成4个进化分支,分别为HEV-A~D(图 2),浙江分离株均位于HEV-B进化支上,并分成3个簇,Cluster 1包括E30、E25和E6,Cluster 2包括E14、E11、E16、E9、CVA9、E7和CVB4,Cluster 3为CVB5,每种血清型病毒单独成簇。E6、E9和CVA9等浙江分离株内部亲缘性很近,不同监测点的分离株在相同进化分支上紧密地排列在一起,显示一定的地域聚集性;E6血清型内部又明显分成2小簇,分别位于不同的小分支上,提示E6存在不同的基因亚型。浙江E6与山东株JNEW100811.29和JNEW100811.24亲缘关系很近,与韩国株kor08-ECV6-13cn和日本株0445-osaka-JPN-2011亲缘关系相对较远。浙江株CVB5与河南株17YB5之间亲缘关系很近,与印度株(M901)则亲缘关系较远。
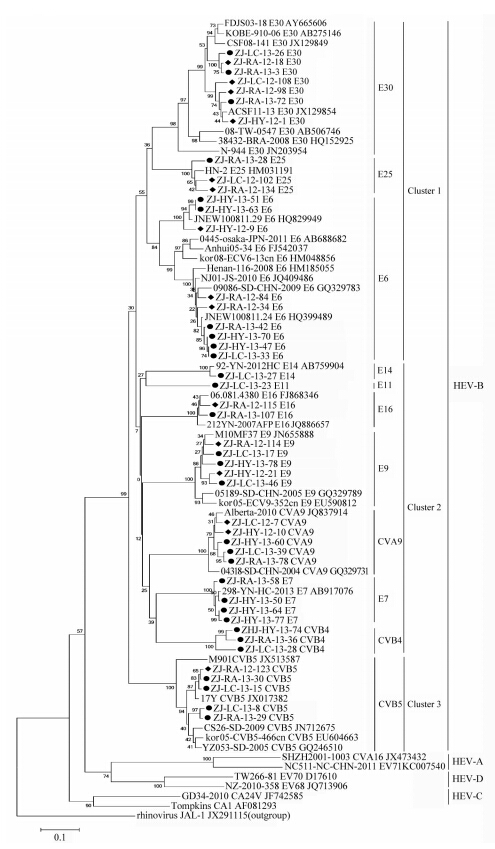 |
| 注:●和◆分别为2013年和2012年浙江省分离株,毒株命名:省份(ZJ)/监测点(鹿城:LC; 瑞安:RA; 海盐:HY)/分离年份/标本编号/血清型; 下载序列:毒株名称/血清型/GenBank accession number 图 2 浙江省HEV分离株VP1区进化树 |
近年来世界各地发生的多起病毒性脑膜脑炎暴发疫情与HEV有关[3,4]。美国建有全国性HEV监测网络[5],我国目前尚未建立该类监测网络,缺乏相关流行病学资料。浙江省2013年通过设立监测点,开展病毒性脑膜脑炎监测,结果显示:①引起浙江省病毒性脑膜脑炎的主要病原为HEV-B,占病原构成的94.6%(87/92),MuV、 HSV和CMV仅占5.4%(5/92),与Cabrerizo等[6]和王环宇等[7]报道结果相似,与谭毅等[8]报道的广西壮族自治区病毒性脑炎高发区的主要病原为流行性JEV、其次为EV和MuV结果不同。②浙江省HEV涉及11个血清型,分别为CVA9、CVB4、CVB5、E6、E7、E9、E11、E14、E16、E25和E30,优势流行株浙南地区为CVB5,浙北地区为E6,而2012年浙江省上述监测点优势株均为E30[2],提示浙江省不同的地理区域HEV优势株不同,不同年份优势株也在发生变化。③浙江省首次分离到E7,这是自2002年开展病毒性脑膜脑炎监测以来首次从患者的脑脊液和粪便中同时分离到E7[7],该血清型作为病毒性脑膜脑炎病原国内外报道较少[3,9],因此对其在外环境中的循环、变异及与疾病之间的关系值得进一步关注。④脑脊液中检测到病原的意义比粪便中更大,因为正常人群的粪便中10%左右携带HEV,本研究中脑脊液样本占了94.6%(226/239),从226份脑脊液中检出81份病毒阳性,尤其在同时采集脑脊液和粪便样本的10例中,4例均检测到同一血清型病毒,因此,这些病原的检出对疾病病因确证具有更强的说服力。本研究存在不足。监测点和监测医院偏少,监测结果只能代表监测点的情况;粪便样本采集较少;该研究只对引起病毒性脑膜脑炎的主要病原进行检测,检测病原的覆盖面欠广,使得样本总阳性检测率(38.5%)偏低。
VP1基因进化分析表明,引起浙江省病毒性脑膜脑炎的HEV均在B组EV分支上;浙江CVA9、E6和E9等血清型内部亲缘关系很近,浙南、浙北不同监测点分离株在相同的进化分支上紧密地排列在一起,显示一定的地域聚集性。浙江株CVB5与河南株(17YB5)亲缘关系很近,与韩国株kor05-CVB5- 466cn和印度株M901亲缘关系相对较远,浙江株E7与云南株298-YN-HC-2013也有很近的亲缘关系,提示浙江株与河南株和云南株可能存在着共同的循环和进化关系。浙江株E6内部分成2小簇,分别位于不同的小分支上,提示浙江株E6存在不同基因亚型,均可引起病毒性脑膜脑炎。
HEV检测方法有核酸检测、病毒分离和基因测序,国内常规采用RD和Hep-2细胞分离HEV,为分析不同检测方法对HEV的检出率及常规细胞培养法分离HEV是否存在漏检问题,本研究对所有样本同时进行HEV核酸检测、病毒分离和VP1基因测序,结果显示,核酸检测阳性率(38.5%)明显高于病毒分离率(23.4%),原因可能与荧光PCR方法敏感性高于病毒分离法及一些样本中病毒已失活但核酸能检出等因素有关; 对HEV核酸阳性而病毒分离阴性的31份脑脊液,直接从样本中扩增HEV VP1基因并测序,结果31份均为HEV-B,其中E9检出最多(9份),其次是CVA9(8份),该结果可能与HEV不同血清型致病特点和细胞敏感性不同有关,Tsao等[10]报道RD细胞分离E9和CVA9分离率较低,只有9.7%和25.2%,本研究结果与其相吻合,提示采用常规HEV分离法存在漏检E9和CVA9的风险,尤其是E9,因此,对结果的解释应慎重,在实际工作中,应根据疑似病例可能的病原,样本种类及细胞对不同病毒的敏感性等多种因素综合考虑选择不同的检测方法,防止漏检,为病例确诊或疫情研判提供准确的实验室依据。
(感谢各监测点医院及当地疾病预防控制中心完成样本采集和运输工作)
| [1] Knowles NJ, Hovi T, Hyypi? T, et al. Virus taxonomy:classification and nomenclature of viruses:ninth report of the international committee on taxonomy of viruses. San Diego[M]. Holland:Elsevier Inc. Picornaviridae,2012:855-880. |
| [2] Yan JY, Miao ZP, Lyu HK,et al. Etiological and molecular-epidemiological analysis on enterovirus associated encephalitis in Zhejiang,2008-2012[J]. Chin J Epidemiol,2013,34(12):1189-1193. (in Chinese). 严菊英,缪梓萍,吕华坤,等. 浙江省2008-2012年肠道病毒相关病毒性脑炎病原谱及分子流行病学特征分析[J]. 中华流行病学杂志,2013,34(12):1189-1193. |
| [3] Wolfaardt M, Büchner A, Myburgh M, et al. Molecular characterisation of enteroviruses and clinical findings from a cluster of paediatric viral meningitis cases in Tshwane,South Africa 2010-2011[J]. J Clin Virol,2014,61(3):400-405. |
| [4] Liu N,Jia LL,Yin JY,et al. An outbreak of aseptic meningitis caused by a distinct lineage of coxsackievirus B5 in China[J]. Int J Infect Dis,2014,23:101-104. |
| [5] Khetsuriani N,LaMonte-Fowlkes A,Oberste MS,et al. Enterovirus surveillance-United States,1970-2005[J]. MMWR Surveill Summ,2006,55(8):1-20. |
| [6] Cabrerizo M, Trallero G, Echevarría JE, et al. Molecular characterization of enteroviruses associated with neurological infections in Spain,2008[J]. J Med Virol,2013,85(11):1975- 1977. |
| [7] Wang HY,He XX,Luo J,et al. Laboratory diagnoses of patients with unknown fever and viral encephalitides in Fujian province China[J]. Chin J Zoonoses,2013,29(4):317-322. (in Chinese) 王环宇,赫晓霞,罗建,等. 福建省不明原因发热和病毒性脑炎患者病毒感染的实验室检测[J]. 中国人兽共患病学报,2013,29(4):317-322. |
| [8] Tan Y, Xie YH,Yang JY,et al. Epidemiological surveillance of viral encephalitis in high endemic areas in Guangxi[J]. Chin Trop Med,2011,11(8):949-951. (in Chinese) 谭毅,谢艺红,杨进业,等. 广西病毒性脑炎高发区流行病学监测[J]. 中国热带医学,2011,11(8):949-951. |
| [9] Zhang L,Yan J, Ojcius DM, et al. Novel and predominant pathogen responsible for the enterovirus-associated encephalitis in Eastern China[J]. PLoS One,2013,8(12):e85023. |
| [10] Tsao KC,Huang CG, Huang YL,et al. Epidemiologic features and virus isolation of enteroviruses in Northern Taiwan during 2000-2008[J]. J Virol Methods,2010,165(2):330-332. |
 2015, Vol. 36
2015, Vol. 36