文章信息
- 万李, 苏秋东, 伊瑶, 毕胜利, 管茶香. 2014.
- Wan Li, Su Qiudong, Yi Yao, Bi Shengli, Guan Chaxiang. 2014.
- 戊型肝炎病毒诊断抗原的克隆表达及抗原性初步鉴定
- Cloning and expression and preliminary antigenicity identification for the diagnostic antigen of hepatitis E virus
- 中华流行病学杂志, 2015, 36(3): 275-279
- Chinese Journal of Epidemiology, 2015, 36(3): 275-279
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.03.018
-
文章历史
- 投稿日期:2014-10-23
2. 中国疾病预防控制中心病毒病预防控制所
2. National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention
HEV主要通过肠道传播,亦可通过输血或垂直途径传播,常导致大的暴发和流行[1]。HEV为正链RNA病毒,基因组大小约为7.5 kb,包括3个开放阅读框(ORF),其中主要结构蛋白由ORF2编码。ORF1位于基因组的5′端,约长5 kb;ORF2从ORF1下游的37 kb开始,一直延伸到离3′端腺苷酸残基65 bp处,约2 kb;ORF3与ORF1和ORF2都有部分重叠,包含369 bp。ORF1编码非结构区蛋白包括一个依赖RNA的RNA聚合酶(RDRP)。ORF2编码的蛋白在氨基端有一个信号肽,还有一个富含碱性氨基酸的衣壳样蛋白区域。ORF3的表达可能与亚基因组的转录有关[2,3]。研究发现HEV衣壳蛋白pORF2上至少存在2个构象性中和表位,同时也是HEV的主要免疫优势表位,其中一个表位与单抗的结合会导致另一个表位的空间构象发生明显改变[4]。对该2个中和表位的结构基础进一步研究发现pORF2空间结构域由S结构域和P结构域组成,其中aa 597~602位于结构蛋白同源二聚体的结构界面,2个aa 597 空间距离在0.66 nm以内,aa 368~394调控着颗粒复合体的形成[5],随后的研究包含pORF2的中和表位区域的二聚体蛋白,并解析出X-射线衍射晶体结构[6]。这些均成为重组戊型肝炎(戊肝)疫苗以及高质量免疫诊断试剂研制的核心理论基础。
由于戊肝流行病学调查及临床诊断很大程度上掣肘于缺乏高灵敏度和特异性的诊断试剂,因此研制新一代诊断试剂已成为控制戊肝暴发迫切的需求。国内外研究均采用不同抗原相继建立了多种抗-HEV检测方法[7,8,9,10,11,12],但其灵敏度和特异性仍不够理想,且各种方法的检测结果不一致,符合率一般为17%~100%。硫氧还蛋白(thioredoxin,TRX)是广泛存在于原核和真核细胞中的低分子量蛋白质,含有保守的Cys-Gly-Pro-Cys活性位点,作为多效性细胞因子而具有重要的生物学功能。TRX易于外源基因以可溶性形式在大肠埃希菌中高效表达,并具有其他系统不具备的优点,如表达产物具备耐热特性,经CDE热处理可达到表达产物纯化的目的。本研究利用TRX作为融合蛋白的前导肽,旨在利用其特性,使HEV优势表位以可溶性形式大量表达于大肠埃希菌的表达工程菌中,对HEV特异结构蛋白进行克隆表达、鉴定和纯化,并采用Western blot印迹法鉴定,为实验室的临床诊断及用于流行病学调查建立简便、快速、有效方法提供理论基础。 材料与方法
1. 材料:
(1)质粒和菌株:M48表达载体、大肠埃希菌基因工程菌DH5α、表达工程菌BL21(DE3)、NcoⅠ和XhoⅠ限制性内切酶、氨苄青霉素(Amp+)、IPTG等。M48表达载体包含TRX基因表达序列,由中国疾病预防控制中心病毒病预防控制所肝炎室制备并保存。
(2)血清标本:抗-HEV抗体阳性血清源自临床和实验室确诊的戊肝患者;阴性血清来自健康人群,均为中国疾病预防控制中心病毒病预防控制所肝炎室收集并提供。上述所有血清标本均在-20 ℃保存,避免反复冻融。
2. 方法:
(1)目标基因序列的确定、密码子优化和全基因合成:根据参考文献[13],结合我国HEV新疆分离株结构基因序列(图 1),最终选取截断ORF2(去掉信号肽序列)和ORF3 羧基端的优势抗原表位,并按照大肠埃希菌密码子偏好表对目的基因进行密码子优化(图 2),全基因合成后插入pMD-19T中,基因片段两端带有2个限制性酶切位点(NcoⅠ和XhoⅠ),命名为N5-19T。
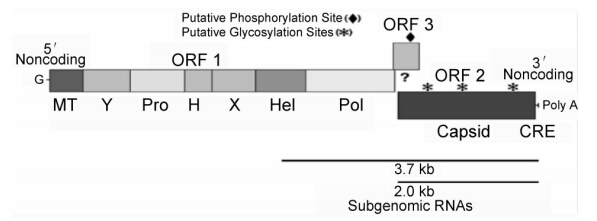 |
| 图 1 HEV基因组结构图 |
 |
| 图 2 经密码子优化的目的基因DNA序列 |
(2)表达载体的构建和鉴定:利用NcoⅠ和XhoⅠ两种限制性内切酶将目的片段和表达质粒加工成具有方向性的相同粘性末端,确保基因表达的方向性。目的基因片段经双酶切(NcoⅠ-XhoⅠ)处理N5-19T后获取,插入到经相同处理的M48表达载体中。在T4 DNA ligase作用下将其构建成表达工程质粒。连接体系:双酶切处理的目的基因片段 2 μl,M48质粒2 μl,T4 DNA ligase 0.5 μl,10×T4 buffer 2 μl,蒸馏水 13.4 μl,4 ℃过夜。连接产物转化入感受态DH5α细胞中,挑选白色克隆菌落培养并小量提取质粒。对重组质粒的采用酶切和测序验证,并将正确质粒命名为N5。
(3)戊肝诊断抗原表达与Western blot鉴定:转化经酶切和测序验证的重组质粒到BL21(DE3)感受态细胞中,挑取8个单菌落接种到1.5 ml含有氨苄青霉素的LB液体培养基中,37 ℃ 225 r/min振荡培养3 h。利用IPTG诱导细胞,继续培养2 h后采用SDS-PAGE和Western blot进行目的蛋白鉴定。取诱导前菌液300 μl/300 ml接种到3 L LB培养基中(50 μg/ml Amp+),30 ℃,240 r/min培养过夜。次日等倍扩菌后,将温度调整为37 ℃后继续培养2 h。加入终浓度为1 mmol/L的IPTG诱导后,将温度调整为34 ℃继续培养4 h后离心(4 000× g,10 min,4 ℃)收集菌体沉淀。菌体沉淀用适量buffer A(10 mmol/L Tris-HCl,0.5% Triton X-100,pH 8.0)重悬后超声处理。离心(12 000× g,10 min,4 ℃)分离上清和沉淀,分别取4 μl上样SDS-PAGE,观察目的蛋白在表达工程菌中的分布。
(4)目的蛋白的纯化:超声液经过离心后收集上清,加入终浓度为500 mmol/L NaCl后,上样亲和层析介质,利用不同浓度咪唑进行梯度洗脱,并对各峰值取样SDS-PAGE,观察目的蛋白的分布。
(5)ELISA诊断试剂盒的制备:每孔100 μl 15 ng/μl纯化的N5蛋白包被板条,4 ℃过夜后,封闭液37 ℃封闭1 h,为待测样品。80份血清样本1 ∶ 20稀释后加入微孔中,二抗为抗人IgG-HRP,A、B液显色后,分光光度仪器读取A450和A630,以阴性样品读数的2.1倍值作为cutoff值,大于此值为阳性,小于此值为阴性。
3. 统计学分析:以金标准和检测结果计数资料制备卡方表,利用χ2检验评价试剂盒的效用价值。 结果
1. 目的基因序列确定、密码子优化以及全基因合成:根据HEV的ORF2和ORF3 C端序列,进行密码子优化,基因合成后插入到pMD-19T中,并命名为N5-19T。
2. 重组质粒的构建:目的片段经双酶切处理N5-19T后获取,插入到相同处理的表达载体M48(图 3 )中。经双酶切鉴定,小量表达鉴定(图 4)以及测序(图 5)证实表达载体的构建成功,并将正确质粒命名为N5(图 3
)中。经双酶切鉴定,小量表达鉴定(图 4)以及测序(图 5)证实表达载体的构建成功,并将正确质粒命名为N5(图 3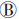 )。
)。
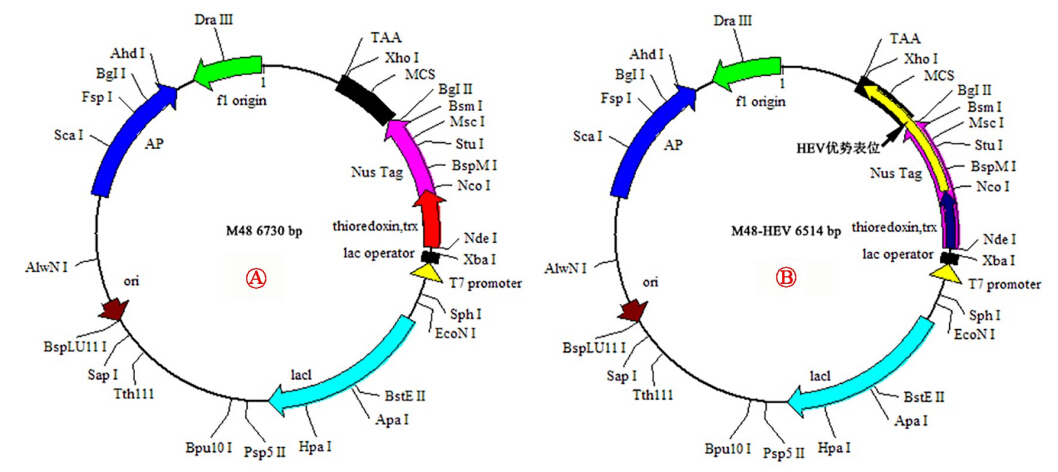 |
注: 表达载体质粒(M48); 表达载体质粒(M48);  含有目的基因的基因重组质粒(M48-N5)
图 3 表达载体质粒和基因重组质粒示意图 含有目的基因的基因重组质粒(M48-N5)
图 3 表达载体质粒和基因重组质粒示意图 |
 |
| 注:M:蛋白Markers,Dalton; 1~8:转化N5的BL21(DE3) 图 4 N5小量表达的SDS-PAGE结果 |
3. HEV诊断抗原的表达和鉴定:挑取8个新鲜转化N5的BL21(DE3)单菌落,进行小量表达培养。SDS-PAGE结果显示(图 5),存在一条明显的与预期大小一致的蛋白条带,约为29 kDa,证明目的蛋白可以在大肠埃希菌表达工程菌中有效表达。选取1~4号样品,电泳后转膜,第一抗体为HEV阳性血清,第二抗体为抗人IgG二抗-HRP,进行Western blot,同样证实HEV特异性目的蛋白的成功表达(图 6)。N5经大量表达后发现,目的蛋白主要以可溶性形式存在于超声处理后的上清液中,且目的蛋白占菌体总蛋白的41.23%(图 7)。
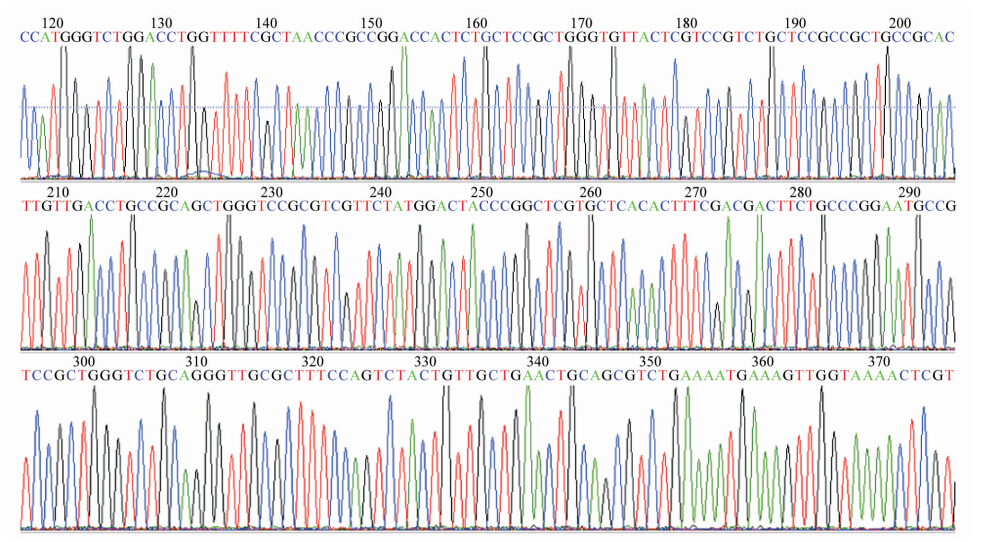 |
| 图 5 目的蛋白编码基因片段测序验证结果 |
 |
| 注:M:蛋白Markers,Dalton; 1~4:阳性患者血清Western blot结果 图 6 Western blot鉴定HEV特异蛋白N5的结果 |
4. 目的蛋白的纯化:通过Ni亲和柱层析技术对目的蛋白抗原进行初步纯化,SDS-PAGE结果表明,300 mmol/L咪唑洗脱峰中,目的蛋白的浓度和纯度均较好(图 7)。
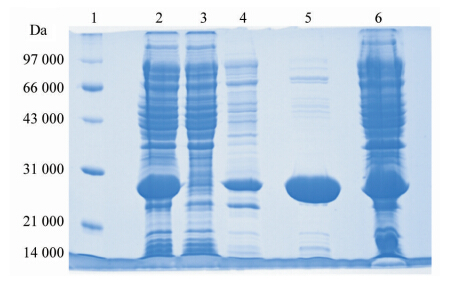 |
| 注:1:蛋白Markers,Dalton; 2:超声处理后上清液; 3:亲和层析穿柱液; 4: 60 mmol/L咪唑洗脱峰; 5:300 mmol/L咪唑洗脱峰; 6:总菌体蛋白 图 7 目的蛋白大量表达与纯化SDS-PAGE的结果 |
5. 目的蛋白抗原的诊断性能初步评价:以融合蛋白N5作为捕获抗原建立ELISA,病原检测和临床诊断为金标准,检测40份确诊戊肝患者血清和40份健康人血清,其灵敏度和特异度分别为95%(38/40)和90%(36/40),经χ2检验显示检测结果与金标准的差异无统计学意义(P>0.05)。 讨论
HEV的结构蛋白是其诊断试剂的主要组成部分[14]。HEV ORF2衣壳蛋白高度保守,免疫原性强,产生的抗体水平高,且体内维持时间长,具有中和性保护作用,是细胞免疫应答的主要靶物质。ORF3蛋白可以刺激机体产生抗体,但在体内存在时间短,并无中和病毒的作用。ORF1蛋白不是病毒体的结构成分,免疫原性弱,产生的抗体可能不具有保护作用[15]。
ORF2 编码蛋白抗原表位数量多,结构复杂,是感染血清抗体识别的主要表位区域。Khudyakov等[16]用3套不同长度(18 aa、25 aa、30 aa)的重叠合成肽研究发现,ORF2 编码的抗原表位大致可以分为6个抗原区域,至少含有26个表位,其中aa 12~147、aa 381~504和aa 573~660区域表位最为集中,而且表位的抗原性较强。有研究发现用GST 融合载体在大肠埃希菌表达HEV ORF2 aa 394~606,获得的融合蛋白能够自发形成同源二聚体E2[17]。Western blot发现戊肝患者血清对二聚体的反应性比单体强320倍。熊君辉等[18]通过合成多肽库的方法对多株HEV单克隆抗体识别ORF2 表位的作用进行系统研究,发现线性单抗的识别表位在ORF2 的aa 408~458 之间,构象型单抗识别表位在 aa 459~606。何水珍等[19]利用HEV原核表达蛋白P239吸附HepG2细胞的模型,模拟HEV对宿主细胞的吸附,初步确定P239与细胞相互作用的区域为ORF2的aa 423~443,该段多肽可能与病毒的受体结合部位非常接近或直接参与构成病毒与细胞特异性识别的表位。
HEV结构蛋白在大肠埃希菌中表达为包涵体形式[20],表达产物的纯化较难,生物活性受影响。本研究选用M48为表达载体,插入了TRX基因,成为TRX融合表达系统。而原核细胞表达载体——TRX融合表达系统的特点[21]包括①将外源蛋白与TRX一起表达可以帮助正确形成二硫键,使许多在大肠埃希菌中以包涵体形式表达的蛋白可以转变为可溶性表达;②产量高;③表达产物具有生物活性;④部分表达产物保留了TRX特有的耐高温处理的特性,使表达产物与不耐热变性蛋白区分,有利于表达产物的纯化。此外,表达载体M48带有氨苄青霉素抗性基因。本研究应用大肠埃希菌TRX基因序列融合表达系统高效表达了HEV重组特异抗原蛋白N5,并以此为抗原建立间接ELISA,以病原检测和临床诊断为金标准,检测40份确诊戊肝患者血清和40份健康人血清,其灵敏度和特异度均较高,为进一步建立用于临床戊肝实验室诊断和流行病学调查的方法提供了理论基础。
| [1] Dalton HR, Bendall R, Ijaz S,et al. Hepatitis E:an emerging infection in developed countries[J]. Lancet Infect Dis,2008,8(11):698-709. |
| [2] Jin Q. Medical Molecular Virology[M]. Beijing:Science Press,2001:367-372. (in Chinese) 金奇. 医学分子病毒学[M]. 北京:科学出版社,2001:367-372. |
| [3] Tam AW,Smith MM,Guerra ME,et al. Hepatitis E virus (HEV):molecular cloning and sequencing of the full-length viral genome[J]. Virology,1991,185:120-131. |
| [4] Zhang J, Gu Y,Ge SX, et al. Analysis of hepatitis E virus neutralization sites using monoclonal antibodies directed against a virus capsid protein[J]. Vaccine,2005,23(22):2881-2892. |
| [5] Li S,Tang X, Seetharaman J, et al. Dimerization of hepatitis E virus capsid protein E2s domainis essential for virus host interaction[J]. PLoS Pathog,2009,5(8):e1000537. |
| [6] Delano WS. The pymolecular graphics system[M]. San Carlos,CA:Delano Scientific,2002. |
| [7] Purdy MA, McCaustland KA,Krawczynski K,et al. Expression of a hepatitis E virus (HEV)-trpE fusion protein containing epitopes recognized by antibodies in sera from human cases and experimentally infected primates[J]. Arch Virol,1992,123(3/4):335-349. |
| [8] Ghabrah TM,Tsarev S,Yarbough PO,et al. Comparison of tests for antibody to hepatitis E virus[J]. J Med Virol,1998,55(2):134-137. |
| [9] Rong GY,Qiao XJ,Zhang JZ,et al. Serodiagnosis of hepatitis E virus infection by an ELISA based on synthetic antigens[J]. Chin J Med Lab Sci,1994,17(2):75-77. (in Chinese) 戎广亚,乔小江,张建宗,等. 以合成肽作抗原的酶联免疫吸附法诊断戊型肝炎病毒感染[J]. 中华医学检验杂志,1994,17(2):75-77. |
| [10] Bi SL,Jiang YZ,Zhao HL,et al. Expression of the hepatitis E virus structural proteins in E. coli and application of the recombinant products for diagnosis[J]. Chin J Virol,1996,12(2):118-122. (in Chinese) 毕胜利,江永珍,赵洪兰,等. 戊型肝炎结构区基因在大肠杆菌中的表达及其在诊断中的应用[J]. 病毒学报,1996,12(2):118-122. |
| [11] Jiang YZ,Bi SL,Zhao HL,et al. Establishment and application of enzyme immunoassay to detect hepatitis E virus[J]. Chin J Exp Clin Virol,1996,10(2):169-173. (in Chinese) 江永珍,毕胜利,赵洪兰,等. 戊型肝炎酶联免疫诊断方法的建立及其应用[J]. 中华实验和临床病毒学杂志,1996,10(2):169-173. |
| [12] Jiang YZ, Bi SL,Li JY, et al. Diagnosis of hepatitis E virus infection in sporadic acute hepatitis[J]. Chin J Exp Clin Virol,1997,11(2):177-180. (in Chinese) 江永珍,毕胜利,李景源,等. 散发性戊型肝炎病毒感染的诊断[J]. 中华实验和临床病毒学杂志,1997,11(2):177-180. |
| [13] Bi SL,Liu CB,Cao XY,et al. Molecular cloning and sequencing of the whole Chinese hepatitis E virus genome[J]. Chin J Virol,1992,8(3):271-279. (in Chinese) 毕胜利,刘崇柏,曹学义,等. 我国戊型肝炎病毒基因组cDNA全序列测定和分析[J]. 病毒学报,1992,8(3):271-279. |
| [14] Aggarwal R,Krawczynski K. Hepatitis E:an overview and recent advances in clinical and laboratory research[J]. J Gastroenterol Hepatol,2000,15(1):9-20. |
| [15] Sehgal D, Thomas S, Chakraborty M,et al. Expression and processing of the hepatitis E virus ORF1 nonstructural polyprotein[J]. Virol J,2006(3):38. |
| [16] Meng J,Dai X,Chang JC,et al. Identification and characterization of the neutralization epitope(s) of the hepatitis E virus[J]. Virology,2001,288(2):203-211. |
| [17] Li S,Tang X,Seetharaman J,et al. Dimerization of hepatitis E virus capsid protein E2s domain is essential for virus-host interaction[J]. PLoS Pathogens,2009,5(8):e000537. |
| [18] Xiong JH,Guo QS,Ge SX,et al. The preliminary analysis of the recognition epitopes of anti-HEV monoclonal antibodies on HEV ORF2[J]. Chin J Virol,2008,24(2):83-87. (in Chinese) 熊君辉,郭清顺,葛胜祥,等. 抗戊型肝炎病毒单克隆抗体识别表位的初步研究[J]. 病毒学报,2008,24(2):83-87. |
| [19] He SZ,Zheng ZZ,Wu T,et al. The establishment of cellular attachment model for hepatitis E virus(HEV) and its application in the identification of HEV cellular attachment region[J]. Chin J Virol,2006,22(6):426-430. (in Chinese) 何水珍,郑子峥,吴婷,等. 戊型肝炎病毒细胞吸附模型的建立及病毒吸附区域初步研究[J]. 病毒学报,2006,22(6):426-430. |
| [20] La Vallie ER,Diblasio EA,Kovacic S,et al. A thiotedoxin gene fusion expression system that circumvents inclusion body formation in the E. coli cytoplasm[J]. Biotechnology,1993,11:187-193. |
| [21] Zhang MC,Zhao HL,Jiang YZ,et al. Expression of hepatitis E virus structural gene in E. coli[J]. Chin J Exp Clin Virol,1999,13(2):130-132. (in Chinese) 张明程,赵洪兰,江永珍,等. 戊型肝炎病毒结构区基因在大肠杆菌中的表达[J]. 中华实验和临床病毒学杂志,1999,13(2):130-132. |
 2015, Vol. 36
2015, Vol. 36


