文章信息
- 张佳峰, 杨介者, 潘晓红, 郭志宏, 丁晓贝, 徐云, 黄晶晶, 夏燕. 2014.
- hang Jiafeng, Yang Jiezhe, Pan Xiaohong, Guo Zhihong, Ding Xiaobei, Xu Yun, Huang Jingjing, Xia Yan. 2014.
- 浙江省男男性行为人群HIV-1新近感染者的毒株亚型和传播簇研究
- HIV-1 subtype diversity and transmission clusters among men having sex with men who recently got HIV-l infection, in Zhejiang province
- 中华流行病学杂志, 2015, 36(1): 61-66
- Chinese Journal of Epidemiology, 2015, 36(1): 61-66
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.01.015
-
文章历史
- 投稿日期:2014-07-25
国内外文献显示,MSM的HIV毒株呈多样性和 复杂性[1, 2, 3, 4, 5, 6, 7]。浙江省MSM的HIV感染维持在较高水 平[8]。本研究对浙江省MSM新近感染者的HIV-1 毒株的遗传多样性进行系统研究,以了解毒株基因 变异情况,并进一步研究传播簇(包括传播性耐药)。 对象与方法
1. 研究对象:2011年浙江省新报告的MSM艾 滋病患者共计837例[8],采用BED捕获酶免试验 (BED-CEIA)检测血清中阳转后HIV-IgG抗体占总 IgG的比例以判断是否为HIV新近感染[9],所用试 剂为美国Sedia生物科学公司的SEDIATM BED HIV-1Incidence EIA试剂盒。排除条件:①已接受 抗病毒治疗;②确证检测后首次CD4+淋巴细胞计 数<200cell/μl;③符合WS293-288《艾滋病和艾滋 病病毒感染诊断标准》中艾滋病病例诊断标准;④既 往诊断为HIV感染的样本。837例新报告的MSM 中的艾滋病患者排除检测251例,6例无确证血清样 本,最终共有580例纳入BED-CEIA检测,233例检 测为新近感染,收集其中的107例(纳为研究对象) 血浆样本进行亚型检测。本研究通过中国疾病预防 控制中心性病艾滋病预防控制中心伦理委员会的伦 理学审查。
2.研究方法:
(1)核酸提取及PCR扩增:研究对象于2011年 CD4+淋巴细胞随访检测时抽取4~8ml EDTA抗 凝全血,采血前均未接受抗病毒治疗,血样立即混 匀,颠倒8~10次,全血标本离心后,分离出血浆和 淋巴细胞富积液分装后于-80℃冻存备用。采用德 国Qiagen公司的QIAamp Viral RNA Mini试剂盒从 140μl血浆样本中提取RNA。采用RT-PCR和巢 式PCR方法扩增HIV-1的pol基因蛋白酶(全长)和 反转录酶区(前300个氨基酸位点),扩增产物大小 为1316bp。扩增体系和扩增条件参照文献[10], PCR扩增产物经1.0%琼脂糖凝胶电泳,经DNA Marker比对确认是否含目的片段,目标产物直接送 至北京梓熙生物科技有限公司进行纯化和测序,其 所用测序仪为美国ABI公司PRISM3730XL,测序 试剂为BigDye Terminator3.1Cycle Sequencing试 剂盒。
(2)序列整理及分析:使用Sequencher5.0软件 对测序返回的序列进行清理和拼接,使用BioEdit 7.2.0软件将样本序列和国际参考株序列(来自美国 Los Alamos国家实验室的HIV序列数据库)进行 比对和校正,用Mega6.0软件构建系统进化树(邻 接法),选择Kimura2-parameter模型(BootstraP= 1000),根据系统进化树确定HIV毒株亚型。经整 理合格的基因序列采用美国斯坦福大学HIV耐药数 据库中的Calibrated Population Resistance(CPR)工 具(6.0)分析基因型耐药情况[11](http://cpr.stanford. edu/cpr/servlet/CPR),根据WHO2009版监测性耐药 突变(surveillance drug resistance mutation,SDRM) 位点确定是否存在SDRM突变[12]。
(3)重组分析:根据系统进化树分析,未能与已 知的亚型和流行重组型(CRFs)聚类的序列考虑为 独特重组型(URF),采用美国Los Alamos国家实验 室HIV序列数据库的RIP重组分析工具分析重组类 型,然后使用SimPlot3.5.1软件进一步确定重组模 式,分析时设定参数为滑动窗口200bp或350bp, BootstraP=20 bp,GapStrip开 启,重 复100次, Kimura(2-parameter)模 型,T/t:2.0,NeighborJoining。在分析URF时使用HIV序列数据库中的 HIV BLAST工具进行同源性分析,并下载2例高度 同源的新型01B序列(KC183779和KC183780)进行 系统进化树分析[4]。传播簇定义:构建的系统进化 树中分簇的Bootstrap≥90%,簇内样本数≥3个,且 簇内平均基因距离≤0.030。
3. 统计学分析:采用SPSS17.0软件进行χ2检 验。当P<0.05时,组间差异具有统计学意义。 结 果
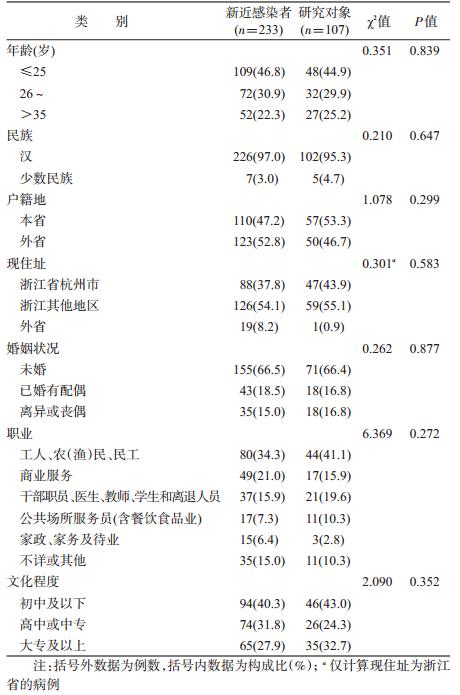
1. 基本特征:107例研究对象年龄以<35岁为 主(占74.8%),汉族占绝大多数(95.3%),多数未婚 (66.4%),工人、农(渔)民、民工比例最高(41.1%), 初中及以下文化程度比例最高(43.0%)。研究对象 在社会人口学特征方面(年龄、民族、户籍地、现住 址、婚姻、职业和文化程度)与当年检测发现的MSM 新近感染者(233例)差异无统计学意义(表 1)。
2. HIV亚型分析:107例研究对象中101例成功 获得序列,成功率为94.4%(101/107)。基于pol基因 的 系 统 进 化 树 分 析 显 示,63例 为CRF01_AE (62.4%),32例为CRF07_BC(31.7%),3例为B亚型 (3.0%),1例 为CRF55_01B(1.0%),2例 为URF (CRF01_AE/B和CRF01_AE/CRF07_BC各1例, 2.0%)。按社会人口学特征(年龄、民族、户籍地、现 住址、婚姻状况、职业和文化程度)对毒株亚型进行 分组比较,组间差异无统计学意义(均P>0.05)。
经HIV BLAST分析,CD4-4516(CRF01_AE/B) 与安徽省报道的毒株KC183780同源性高达98.7% (1184/1200),据SimPlot软件分析重组模式,其在 pol基因区为CRF01_AE(相对HXB2位置2253→ 3005)和B亚型(相对HXB2位置3006→3452)的重 组(图 1),与KC183780具有极为相似的重组断点模 式。CD4-5002(CRF01_AE/CRF07_BC)经重组分 析 显 示 为CRF01_AE(相 对 于HXB2位 置 2253→3067)和CRF07_BC(相对于HXB2位 置3068→3421)的重组(图 1)。
 |
注: 安徽省报道的MSM中CRF01_AE/B毒株KC183780; 安徽省报道的MSM中CRF01_AE/B毒株KC183780;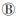 本研究发现的CRF01_AE/B毒株CD4-4516; 本研究发现的CRF01_AE/B毒株CD4-4516; 本研究发现的CRF01_AE/
CRF07_BC毒株CD4-5002; 本研究发现的CRF01_AE/
CRF07_BC毒株CD4-5002;  分析使用的滑动窗口为350bp, 分析使用的滑动窗口为350bp, 分析使用的滑动窗口为200bp,其余分析参数均一致(为默认)
图 1图 1 HIV URF重组断点分析 分析使用的滑动窗口为200bp,其余分析参数均一致(为默认)
图 1图 1 HIV URF重组断点分析 |
3.系统进化分析:研究对象所感染的 HIV毒株根据亚型不同,主要分为 CRF01_AE(63例)和CRF07_BC(32例)两大 簇,涵盖94.1%(95/101)的病例。其中 CRF01_AE大簇内部又可分为两簇,簇1(51 例)进一步分化为若干小簇,簇2(12例)进一 步细分为2个亚簇。与CRF01_AE大簇呈明 显差异,CRF07_BC大簇(簇3)内部未见明显 分化(分簇),在进化树上表现为散在集聚。
通过对簇1~簇3的社会人口学特征分 析,整体上未见明显差异,簇2通过检测咨询 发现的比例最高,达75.0%(9/12),在所有研 究对象中检测咨询发现的比例为38.3%(41/ 107),差异有统计学意义(χ2=5.959,P= 0.015)。
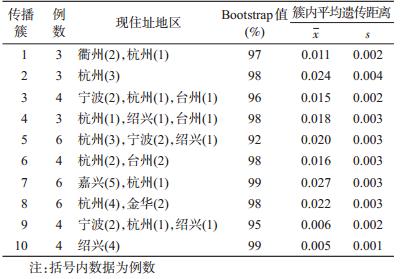
从毒株的地域信息(感染者现住址)分析 显示,浙江省的MSM毒株整体上未见明显 的地区聚集性,表现为相互混杂交织,尤其是 现住址为杭州的MSM感染者携带的毒株在 进化树中不只局限于杭州地区,而是散播于 各个进化分支,与全省各地流行的MSM毒 株均有同源性(图 2)。
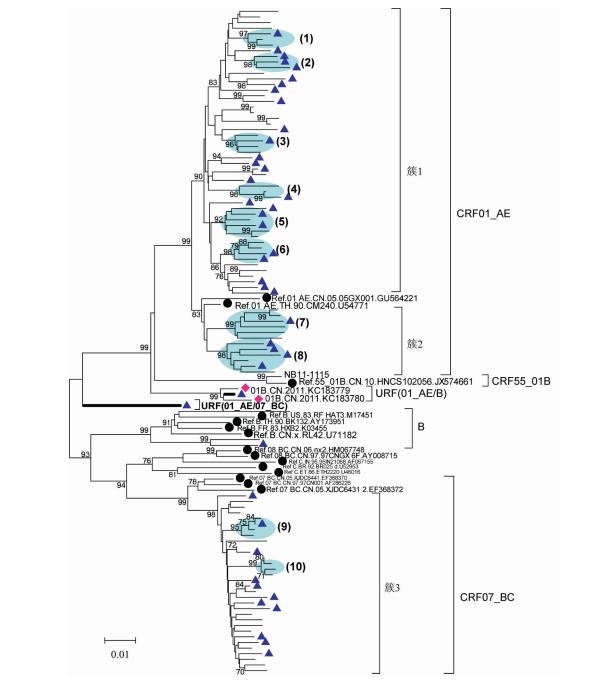 |
| 注:●国际参考株,▲现住址为杭州的病例,◆安徽省报道MSM的01B流行株;加粗的分支(2例)为本研究发现的URF,蓝色椭圆形标示 的为传播簇1~簇10;节点处仅显示≥70%的Bootstrap值 图 2 HIV系统进化树分析 |
4. 传播簇分析:本研究发现存在10个传 播簇(图 2),共涉及全省7个地(市),报告的 MSM新近感染者占现住址为浙江省的88.3% (189/214);10个传播簇共涉及43例,占所有序列的 42.6%;8个传播簇(80%)涉及≥2个的地市;10个传 播簇中仅传播簇10集中在绍兴地区,其余9个传播 簇(90%)均与现住址为杭州的病例相关(表 2)。
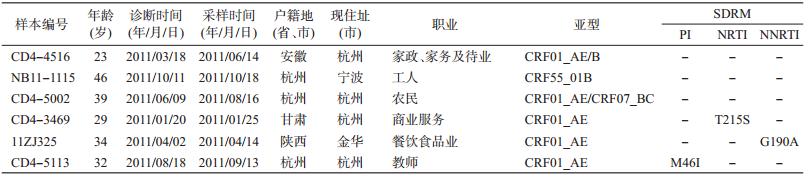
5. 传播性耐药突变与流行水平:根据WHO公 布的监测性耐药突变名录(2009年版),3个样本各 存在1个SDRM突变,分别为M46I(PI SDRM)、 T215S(NRTI SDRM)和G190A(NNRTI SDRM),见 表 3,传播性耐药率为2.97%(<5%),处于HIV耐药 株的低度流行水平。检出存在SDRM的样本感染均 是CRF01_AE毒株,其中2例现住址为杭州市。
MSM由于具有性活动活跃、多性伴和肛交性行 为等特征使该人群成为艾滋病流行的高危人群[2, 5], 且在未治疗的MSM感染者中已发生HIV耐药株的传播[1, 5, 13],对艾滋病的预防控制提出严峻的挑战。 本研究显示,浙江省MSM中HIV呈现跨地区网络 传播的特征,毒株亚型呈现复杂性趋势,对未来的艾 滋病防控将产生深远影响;传播性耐药处于低度流 行水平,暂不会对现有抗病毒治疗措施构成威胁。
HIV毒株亚型对于病毒致病性、传播流行、诊 断、治疗和疫苗研发等具有深远影响。中国MSM 的HIV毒株亚型组成随时间经历着显著变化,从 2005年以欧美B亚型为主,到2012年以CRF01_AE 为主[5]。本研究显示,CRF01_AE和CRF07_BC(共 占94.1%)是浙江省MSM中HIV感染者的优势毒 株,与近几年国内其他省份的报道类似[3, 4, 13, 14],也发 现存在一些罕见亚型(如CRF55_01B)和URF。 CRF55_01B于2012年在中国的MSM中首次报 道,并在深圳地区的MSM中出现小的暴发(占 9.2%,99/1072)[15]。本研究发现的CRF55_01B是浙 江省的首例报道,鉴于其近几年在全国的散发流行 趋势,应进一步予以跟踪和监控。MSM具有多性 伴、无保护性行为频繁等特征[2, 5],相比异性传播人 群更易发生HIV双重感染或多重感染[2],因此更易产 生HIV的新型重组型。目前国内MSM的HIV流行 株主要包括CRF01_AE、CRF07_BC和B亚型[7, 14],近 年来又陆续报道MSM存在新型重组型,尤其以 CRF01_AE与B(或CRF07_BC)的新型重组较为常 见[3, 4, 5, 6, 7]。本研究也在MSM各发现1例CRF01_AE/B 和CRF01_AE/CRF07_BC的新型重组,其中感染 CRF01_AE/B新型重组的病例是安徽户籍来浙江 省的打工者,毒株序列与安徽省报道的01B存在高 度同源性[4],该病例很有可能在安徽省发生感染,这 一方面印证MSM存在一定比例的URF,另一方面 也说明形成的URF已形成跨区域的流动,其对艾滋 病疫情的影响值得进一步研究。全国9个城市的 MSM感染者的分子流行病学研究显示,76.7%(447/ 583)的毒株在进化树上分属于3个进化簇(CRF01_AE的簇1和簇2,CRF07_BC的簇3)[5, 14], 其分簇现象与本研究结果一致。
本研究不仅掌握了MSM新近感染者中的HIV 毒株亚型的构成情况,而且能更有效地掌握最新传 播动态。通过系统进化分析和传播簇研究,发现浙 江省MSM新近感染者的特征:存在较多散在流行 圈,各自流行圈正发生着HIV的快速传播;MSM的 HIV传播流行未局限在某一特定区域,跨地区传播 较为普遍,呈现全省甚至更大地域间的传播特征,形 成混杂交织的复杂网络;杭州市作为省会城市,在浙 江省MSM的HIV传播过程中可能发挥着核心作 用,推测是浙江省MSM最重要的活动聚集地,也是 HIV向全省MSM散播的热点地区。中国的MSM 一般怕被认出而不在本地活动,大部分人会集中到 大都市活动,因为那里更易获得社会和性伴网络资 源[3]。本研究显示,带有杭州地域“印记”的毒株散播于全省各地,推测是省内其他地市的MSM汇聚杭 州进行集会活动,感染HIV后又重返原住址造成的 结果。
由于HIV耐药株有可能回复突变成野生株,在 新近感染者中开展传播性耐药监测能更准确地掌 握HIV-1耐药株的流行情况[16, 17, 18]。本研究显示,浙 江省MSM新近感染者的传播性耐药率处于低水平 (<5%),与国内其他地方的报道基本一致[1, 3, 13],与 2009-2011年浙江省整体的低度耐药传播水平一 致[10]。近年来报道国内未治疗的MSM中耐药株呈 增加趋势,耐药突变主要是对我国并未普及使用的抗 蛋白酶药物[1, 13],而本研究显示浙江省MSM PI耐药 突变相对较低(仅1.0%),与云南省报道接近[3]。
| [1] | Yang J, Xing H, Niu J, et al. The emergence of HIV-1 primary drug resistance genotypes among treatment-naive men who have sex with men in high-prevalence areas in China [J]. Arch Virol, 2013, 158(4):839-844. |
| [2] | Beyrer C, Baral SD, van Griensven F, et al. Global epidemiology of HIV infection in men who have sex with men [J]. Lancet, 2012, 380(9839):367-377. |
| [3] | Chen M, Ma Y, Su Y, et al. HIV-1 genetic characteristics and transmitted drug resistance among men who have sex with men in Kunming, China [J]. PLoS One, 2014, 9(1):e87033. |
| [4] | Wu J, Meng Z, Xu J, et al. New emerging recombinant HIV-1 strains and close transmission linkage of HIV-1 strains in the Chinese MSM population indicate a new epidemic risk[J]. PLoS One, 2013, 8(1):e54322. |
| [5] | Xu J, Han X, Reilly KH, et al. New features of the HIV epidemic among men who have sex with men in China [J]. Emerg Microbes Infect, 2013, 2(7):e45. |
| [6] | Wang W, Jiang S, Li S, et al. Identification of subtype B, multiple circulating recombinant forms and unique recombinants of HIV type 1 in an MSM cohort in China[J]. AIDS Res Hum Retroviruses, 2008, 24(10):1245-1254. |
| [7] | Wang W, Meng Z, Zhou M, et al. Near full-length sequence analysis of two new HIV type 1 unique (CRF01_AE/B) recombinant forms among men who have sex with men in China [J]. AIDS Res Hum Retroviruses, 2012, 28(4):411-417. |
| [8] | Guo ZH, Xu Y, Xia Y, et al. Estimation of new HIV-1 infection in high risk groups with BED-CEIA in Zhejiang, 2010-2012[J]. Dis Surv, 2013, 28(8):617-620. (in Chinese)郭志宏, 徐云, 夏燕, 等. 应用捕获酶联免疫测定法估算2010-2012年浙江省重点人群人类免疫缺陷病毒1型新发感染率[J]. 疾病监测, 2013, 28(8):617-620. |
| [9] | Parekh BS, Kennedy MS, Dobbs T, et al. Quantitative detection of increasing HIV type 1 antibodies after seroconversion: a simple assay for detecting recent HIV infection and estimating incidence[J]. AIDS Res Hum Retroviruses, 2002, 18(4):295-307. |
| [10] | Zhang JF, Pan XH, Guo ZH, et al. Survey of HIV drug resistance threshold in Zhejiang province from 2009 to 2011[J]. Chin J Prev Med, 2012, 46(6):519-523. (in Chinese)张佳峰, 潘晓红, 郭志宏, 等. 2009-2011年浙江省HIV耐药警戒线调查[J]. 中华预防医学杂志, 2012, 46(6):519-523. |
| [11] | Gifford RJ, Liu TF, Rhee SY, et al. The calibrated population resistance tool: standardized genotypic estimation of transmitted HIV-1 drug resistance[J]. Bioinformatics, 2009, 25(9):1197- 1198. |
| [12] | Bennett DE, Camacho RJ, Otelea D, et al. Drug resistance mutations for surveillance of transmitted HIV-1 drug-resistance: 2009 update[J]. PLoS One, 2009, 4(3):e4724. |
| [13] | Zhao B, Han X, Dai D, et al. New trends of primary drug resistance among HIV type 1-infected men who have sex with men in Liaoning Province, China[J]. AIDS Res Hum Retroviruses, 2011, 27(10):1047-1053. |
| [14] | Han X, An M, Zhang M, et al. Identification of 3 distinct HIV-1 founding strains responsible for expanding epidemic among men who have sex with men in 9 Chinese cities[J]. J Acquir Immune Defic Syndr, 2013, 64(1):16-24. |
| [15] | Zhao J, Cai W, Zheng C, et al. Origin and outbreak of HIV-1 CRF55_01B among MSM in Shenzhen, China[J]. J Acquir Immune Defic Syndr, 2014, 66(3):e65-67. |
| [16] | Murillo W, Paz-Bailey G, Morales S, et al. Transmitted drug resistance and type of infection in newly diagnosed HIV-1 individuals in Honduras[J]. J Clin Virol, 2010, 49(4):239-244. |
| [17] | Feng LG, Wang MJ, Han M, et al. Drug resistance among recent HIV-l infected men who have sex with men in Chongqing municipality of China[J]. Chin J Epidemiol, 2008, 29(5):455- 458. (in Chinese)冯连贵, 王慜杰, 韩梅, 等. 重庆市男男性接触人群中HIV-1新近感染者耐药监测[J]. 中华流行病学杂志, 2008, 29(5):455-458. |
| [18] | Jayaraman GC, Archibald CP, Kim J, et al. A population-based approach to determine the prevalence of transmitted drug- resistant HIV among recent versus established HIV infections: results from the Canadian HIV strain and drug resistance surveillance program[J]. J Acquir Immune Defic Syndr, 2006, 42(1):86-90. |
 2015, Vol. 36
2015, Vol. 36