文章信息
- 戴丐国, 伍登海, 连建安, 马红梅, 姜斌华. 2014.
- Dai Gaiguo, Wu Denghai, Lian Jianan, Ma Hongmei, Jiang Binhua. 2014.
- 微生态制剂联合肠内营养治疗肝性脑病的研究
- Clinical research on microecologic treatment combined enteral nutrition for hepatic encephalopathy
- 中华流行病学杂志, 2014, 35(12): 1392-1395
- Chinese Journal of Epidemiology, 2014, 35(12): 1392-1395
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2014.12.018
-
文章历史
- 投稿日期:2014-09-15
2 浙江省肿瘤医院
2 Zhejiang Provincial Cancer Hospital
肝性脑病(HE)是肝硬化失代偿期常见的并发症,“氨中毒学说”在其发病机制中处于中心地位。在我国肝性脑病患者中大部分存在不同程度的营养不良,因此系统而科学的营养支持治疗对提高临床疗效、促进病情恢复具有重要意义。近些年来肠内营养已成为营养支持治疗的首选方式,广泛应用于临床多种疾病。然而肝硬化并发门脉高压症可导致肠黏膜淤血水肿、通透性增加,一方面引起肠道消化吸收功能下降,行肠内营养时常常并发恶心呕吐、腹胀腹泻等消化道反应,降低了治疗的依从性及疗效;另一方面,未经消化吸收的蛋白成分在肠道潴留,使肠源性“血氨”水平增高;此外,肠道黏膜屏障受损引起菌群易位和比例失调,导致肠源性内毒素血症及炎性介质大量释放直接加重肝损,干扰血氨在肝脏的转化和代谢,加重疾病进展。为此本研究旨在观察微生态制剂联合肠内营养支持治疗肝硬化失代偿期肝性脑病患者血清内毒素、肿瘤坏死因子α(TNF-α)、白细胞介素18(IL-18)、血氨水平及对全身营养状态的影响,为临床治疗HE提供可靠的理论依据。 对象与方法
1. 研究对象:60例肝硬化失代偿期HE患者均源自2010年5月至2012年1月浙江中医药大学附属第二医院,其中男性31例,女性29例;年龄34~70岁,平均(52.1±18.2)岁。①纳入标准:符合2000年9月中华医学会传染病寄生虫病学会肝病学分会西安会议联合修订的失代偿期肝硬化诊断标准;Child-Pugh分级为B、C级;HE按Ⅰ~Ⅳ级分类:Ⅰ期为前驱期,Ⅱ期为昏迷前期,Ⅲ期为昏睡期,Ⅳ期为昏迷期。②剔除标准:排除轻型HE、近期(4周内)有反复感染、上消化道大出血、合并肝癌、肿瘤转移、胆汁淤积性黄疸、难治性腹水、肝肾综合征、重要器官衰竭及精神病患者。
2. 研究方法:
(1)分组:60例患者采用随机数字表法随机分成3组,入组前均签署知情同意书,3组患者性别、年龄、肝硬化病因分布、病程、Child-Pugh分级等的差异均无统计学意义(P>0.05),具有可比性。
(2)治疗:3组患者均给予常规(休息、保肝降酶、利尿等)治疗措施,在此基础上同时给予相应的营养支持对症治疗。第一组给予微生态制剂联合肠内营养(联合治疗组);第二组仅给予微生态制剂;第三组不给予微生态制剂和肠内营养,仅予静脉营养支持(静脉营养组)。微生态制剂选用培菲康(上海信谊制药有限公司),420 mg口服,每8 h一次;肠内营养制剂选用百普力(荷兰纽迪西亚公司生产),1 000 ml约1 000 kcal/d,恒温下(37 ℃)间断定量经空肠营养管匀速泵入(开始时速度宜慢),100~125 ml/h;静脉营养支持为经外周静脉输注相同热量的营养液1 000 ml,蛋白质用支链氨基酸,与百普力中蛋白含量相同,脂类选用中长链脂肪乳,糖脂能量比为3 ∶ 2。疗程均为2周,分别于治疗前后第7、第14天清晨采集患者空腹静脉血10 ml用于指标检测,治疗前1周及治疗期间不使用抗生素及其他影响肠道菌群的药物。
(3)观察指标及检测方法:采用偶氮显色基质法检测血清内毒素水平;采用ELISA 双抗体夹心法检测TNF-α和IL-18水平;采用干片法检测血氨浓度;采用特定蛋白分析仪(BN ProSpec)以散射比浊法检测血清白蛋白水平。
3. 统计学方法:建立Excel数据库,采用SPSS 17.0统计软件整理和分析数据,数值变量用x±s表示,3组间均数比较采用单因素方差分析,组间两两比较采用Least-Significant Difference(LSD)法,P<0.05为差异有统计学意义。 结果
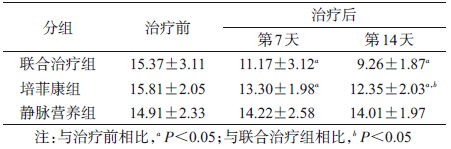
1. 血清内毒素水平的变化:治疗前,3组间血清内毒素水平差异无统计学意义(P>0.05);治疗7 d后,联合治疗组和培菲康组血清内毒素水平降低,但两组间的差异无统计学意义;第14天时,两组血清内毒素水平均显著低于治疗前,且联合治疗组较培菲康组降低更为明显;而静脉营养组治疗前后血清内毒素水平无明显变化(P>0.05)(表 1)。
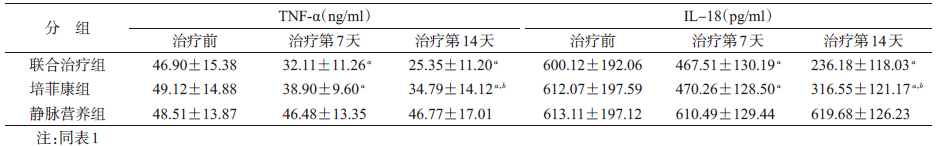
2. TNF-α和IL-18水平的变化:治疗前,3组间血清TNF-α和IL-18水平的差异无统计学意义(P>0.05);治疗7 d后,联合治疗组和培菲康组血清TNF-α水平降低,但两组间的差异无统计学意义;第14天时,两组血清内毒素水平均显著低于治疗前,且联合治疗组较培菲康组降低更为明显;而静脉营养组治疗前后血清TNF-α水平无明显变化(P>0.05)。3组治疗前后血清IL-18变化趋势与TNF-α相同(表 2)。
3. 血氨水平的变化:治疗前,3组间血氨水平的差异无统计学意义(P0.05);治疗7 d后,联合治疗组和培菲康组血氨水平降低,但两组间的差异无统计学意义;至第14天时,两组血氨水平均显著低于治疗前,且联合治疗组较培菲康组降低更为明显(表 3)。
4. 白蛋白水平的变化:治疗前,3组间白蛋白水平的差异无统计学意义(P>0.05);治疗7 d后,联合 治疗组和静脉营养组白蛋白水平升高,且联合治疗组效果更优;第14天时,3组间白蛋白水平均显著高于治疗前,而联合治疗组较其他两组升高更为明显(表 3)。 讨论
HE的发病机制为多因素,并涉及多种物质的代谢异常,其中“氨中毒学说”已被国内外学者所接受[1, 2]。研究发现,几乎所有HE患者中,血氨水平均明显增高。血氨与肝功能、肠道菌群、肠道功能密切相关[2],对疾病发生发展起着至关重要的作用,因此“降氨”是临床对HE治疗不可或缺的重要手段。
目前对于肝硬化后HE仍以综合治疗为主。肝硬化失代偿期的HE患者中大部分存在营养不良,而营养物质的代谢与肝脏再生之间密切关联,合理有效的营养支持治疗将有助于改善患者营养状况和免疫功能,并在治疗中显得格外重要。临床营养支持通常有肠内营养和肠外营养两种手段。近年来对营养支持的策略也相应发生变化,营养支持不再以单纯提供营养物质为目的,更重要是使机体细胞获得所需的营养物质,并提供进行正常新陈代谢合成所需要的营养,从而保持或改善组织、器官的结构及其功能。肠黏膜具有屏障功能,能够阻断肠腔内细菌、内毒素透过肠壁进入血液。研究表明,若肠道发生缺血缺氧或其他原因导致肠道功能障碍时,肠黏膜的结构和功能也会受损,对细菌的防御能力减弱,肠道内细菌和毒素可透过肠黏膜屏障形成肠源性感染(enterogenic infection)或肠道菌群易位(enteric bacterial translocation),进而引发全身炎性反应综合征、多器官功能障碍综合征,甚至脓毒症[3, 4]。
肠内营养(enteral nutrition)已成为HE患者营养支持治疗的首选方式。然而肝硬化失代偿期HE患者常因并发门脉高压导致肠黏膜瘀血水肿,增加通透性,肠道蠕动减慢,消化吸收功能下降,再行肠内营养治疗易并发消化道反应,降低治疗依从性和疗效[5, 6]。此外患者因肠道黏膜屏障受损、肠内pH值改变等,肠腔微生态环境遭到破坏,引起肠道菌群易位和比例失调,加之严重的肝功能损害,肝脏对内毒素清除能力下降,发生内毒素血症,而后者又可能直接加重肝损伤,形成恶性循环,加重疾病的进展[7]。很多学者已证实肠源性内毒素血症与肝硬化时肝损伤密切相关,内毒素可直接诱导肝细胞凋亡,内毒素水平又与诱导肝细胞凋亡程度正相关。内毒素导致的肝损害与时间紧密关联,早期主要引起肝细胞凋亡,而晚期则主要表现为凋亡和细胞坏死,发生肠源性内毒素血症时,肝内血窦受累,毛细血管内膜受损,血小板聚集,进而引起弥漫性血管内凝血,造成微循环障碍,致使肝细胞缺血坏死和再生障碍[8, 9]。
肠道菌群是由寄生于胃肠道微生物组成的一个复杂微生态体系。目前对于肠道菌群失调以及肠源性内毒素血症在HE病程中的分子学作用机制尚不明确。肝硬化患者网状内皮吞噬系统功能受损,肝脏的清除能力受损,内毒素和细胞因子水平升高,易透过肠壁达到外周循环。肝硬化因自身肝细胞受损可导致肝内单核巨噬细胞浸润,内毒素与后者具有高度亲和力,与其表面的CD14受体相结合后,可刺激单核巨噬细胞产生TNF-α、IL-18、NO等细胞因子,进一步加重肝肾功能损害[8, 10]。TNF-α是一种多功能的细胞因子,可能主要通过损害肠黏膜微循环,导致其他细胞因子、炎性介质和氧自由基等的大量释放,导致肠黏膜屏障功能的破坏。IL-18作为一种重要促炎因子,在肝硬化患者中主要是由活化的单核巨噬细胞产生,可促进Th1细胞分化,诱导Th1和NK细胞分泌IFN-γ、TNF-α等炎症因子,并介导Fas配体的细胞毒效应,进一步加重炎症程度[11];同时肝硬化失代偿期患者细胞免疫功能抑制,T、B淋巴细胞调节紊乱,细胞因子的调节功能也受到影响,也可以引起TNF-α、IL-18、NO等细胞因子水平升高,启动细胞因子的级联反应,因此肠道菌群失调以及肠源性内毒素血症导致的肠道黏膜屏障受损在肝硬化进程中发挥着重要作用。
目前国外已有研究表明肠道微生态制剂可抑制肠道细菌失调,酸化肠腔内环境,对防止氨和有毒物质的吸收有一定的作用。例如Sharma等[12]和Bajaj等[13]研究表明给予微生态制剂治疗,HE患者粪中非产尿素酶的乳酸菌菌量明显增加,血氨水平降低,使轻症患者智能测试恢复正常,认识功能改进;Malaguarnera等[14]研究表明给予双歧杆菌以及低聚果糖治疗HE患者在降低空腹血氨浓度及心理测试评分方面明显优于安慰剂组,亦有研究同样发现微生态制剂在恢复肠道菌群平衡,减少有毒代谢物质对肠黏膜屏障的损害,并促进肠道免疫功能及正常生理功能的恢复,并可以有效预防和减少恶心呕吐、腹胀腹泻等消化道并发症[15, 16]。
目前国外对于HE的综合治疗,极其重视肠外营养支持治疗,并趋向于使用微生态制剂。而国内采用微生态制剂联合肠内营养治疗HE的相关临床研究则未见报道。本研究发现,联合疗法能明显下调血清内毒素水平、抑制细胞因子TNF-α、IL-18的产生,显著降低血氨水平并促进血浆白蛋白的生成,由此发挥清除血氨、保护肠黏膜屏障及改善机体营养状态的作用,与单用培菲康及单用静脉营养治疗相比具有卓越的优势,是临床治疗HE的一项安全而高效的方法。
| [1] Shawcross DL, Damink SW, Butterworth RF,et al. Ammonia and hepatic encephalopathy:the more things change,the more they remain the same[J]. Metab Brain Dis,2005,20(3):169- 179. |
| [2] Kramer L, Tribl B, Gendo A, et al. Partial pressure of ammoniaversus ammonia in hepatic encephalopathy[J]. Hepatology,2000,31(1):30-34. |
| [3] Jinillo E,Caccavo D,Magrone T,et al. The role of the liver in the response to LPS:experimental and clinical findings[J]. Endotoxin Res,2002,8(5):319-327. |
| [4] Gatt M, Reddy BS, MacFie J. Bacterial translocation in the critically ill-evidence and methods of prevention [J]. Aliment Pharmacol Ther,2007,25(7):741-757. |
| [5] Zhao VM,Ziegler TR. Nutrition support in end-stage liver diseas[J]. Crit Care Nurs Clin North Am,2010,22(3):369-380. |
| [6] Kalaitzakis E,Simren M,Abrahamsson H,et al. Role of gastric sensorimotor dysfunction in gastrointestinal symptoms and energy intake in liver cirrhosis[J]. Scand J Gastroenterol,2007,42(2):237-246. |
| [7] Wiest R,Garcia-Tsao G. Bacterial translocation (BT) incirrhosis[J]. Hepatology,2005,41(3):422-433. |
| [8] Nolan JP. The role of intestinal endotoxin in liver injury:a long and evolving history[J]. Hepatology,2010,52(5):1829-1835. |
| [9] Kristina N, Matthias P. Gastrointestinal tract in liver disease:which organ is sick?[J]. Curr Opin Clin Nutr Metab Care,2008,11(5):613-619. |
| [10] Nagata K, Suzuki H, Sakaguchi S. Common pathogenic mechanism in development progression of liver injury caused by non-alcoholic or alcoholic steatohepatitis[J]. J Toxicol Sci,2007,32(5):453-468. |
| [11] Sun Y,Chen HY,Xin SJ. Effect of IL-18 on peripheral blood mononuclear cells of chronic hepatitis B and hepatitis B virus DNA released by HepG2.2.15 cell lines[J]. Hepatobiliary Pancreat Dis Int,2004,3(2):230-234. |
| [12] Sharma P,Sharma BC,Puri V,et al. An open-label randomized controlled trial of lactulose and probiotics in the treatment of minimal hepatic encephalopathy[J]. Eur J Gastroenterol Hepatol,2008,20(3):506-511. |
| [13] Bajaj JS,Saeian K,Christensen KM,et al. Probiotic yogurt for the treatment of minimal hepatic encephalopathy[J]. Am J Gastroenterol,2008,103(1):1707-1715. |
| [14] Malaguarnera M, Greco F,Barone G,et al. Bifidobacterium longum with fructo-oligosaccharide(FOS) treatment in minimal hepatic encephalopathy:a randomized double-blind placebo controlled study[J]. Dig Dis Sci,2007,52(11):3259-3265. |
| [15] Gibson GR,Wang X. Regulatory effects of bifidobacteria on the growth of other colonic bacteria[J]. App Bacteria,1994,77(4):412-420. |
| [16] Loguercio C, de Simone T,Federico A,et al. Gut-liver axis:a new point of attack to treat chronic liver damage?[J]. Am J Gastroenterol,2002,97(8):2144-2146. |
 2014, Vol. 35
2014, Vol. 35