文章信息
- 效拟, 李柏生, 刘谢, 肖媛, 黄嘉盈, 柯碧霞, 谭海玲, 柯昌文, 俞守义. 2014.
- Xiao Ni, Li Baisheng, Liu Xie, Xiao Yuan, Huang Jiaying, Ke Bixia, Tan Hailing, Ke Changwen, Yu Shouyi. 2014.
- 广东省2013年副溶血弧菌暴发与散发菌株的病原学特征
- Etiologic characteristics of Vibrio parahaemolyticus strains causing outbreaks and sporadic cases in Guangdong,2013
- 中华流行病学杂志, 2014, 35(12): 1379-1383
- Chinese Journal of Epidemiology, 2014, 35(12): 1379-1383
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2014.12.015
-
文章历史
- 投稿日期:2014-08-07
2 广东省疾病预防控制中心病原微生物检验所;
3 广州市荔湾区疾病预防控制中心
2 Institute of Pathogenic Microbiology Bacteriology Laboratory, Guangdong Provincial Center for Disease Control and Prevention;
3 Center for Disease Control and Prevention of Liwan District of Guangzhou
副溶血弧菌(VP)作为我国食源性疾病暴发的首要病原菌,在广东地区引发的食物中毒事件无论是在发生次数和规模上均呈明显上升趋势[1, 2]。为了解2013年广东地区副溶血弧菌的暴发分离株与散发分离株的病原学特征及其相关性,本研究拟对79株VP进行血清分型、药敏试验、毒力基因检测,并结合脉冲场凝胶电泳(PFGE)分型技术进行分子特征研究。 材料与方法
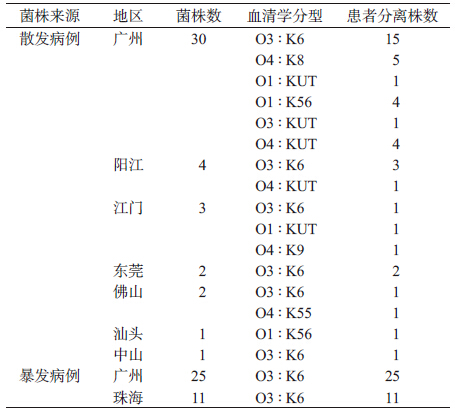
1. 菌株来源:散发菌株来源于2013年广东省食源性疾病监测中各哨点医院采集腹泻患者粪便标本。暴发菌株分离自广州和珠海地区的2起副溶血弧菌引起的食物中毒事件,总计53株,从中挑选36株具有代表性的菌株进行研究。
2. 研究方法:
(1)仪器与试剂:药敏纸片分配器(英国Oxoid公司);PCR仪(德国Eppendorf公司);CHEE MAPPER脉冲场凝胶电泳仪和Gel Doc EQ凝胶成像系统(美国Bio-Rad公司);比浊仪(美国DADE BEHRING公司)。诊断血清(日本Denka Seiken公司);Oxide抗生素纸片(广州市乐通泰生物科技有限公司);PCR试剂[宝生物工程(大连)有限公司],PCR引物由上海生工生物工程有限公司合成;NotⅠ酶和XbaⅠ酶(美国Promega公司),SeaKem Gold琼脂糖(美国Cambrex公司),蛋白酶K(Merck公司)。所有试剂均在有效期内使用。
(2)血清学分型:用3%NaCl TSA培养物上的菌苔进行玻片凝集检测K抗原。取新鲜培养物至3% NaCl灭菌盐水试管中研磨制成均匀浓厚的菌悬液,经121 ℃灭菌1 h,4 000 r/min离心10 min,吸弃上清液,再用3% NaCl灭菌盐水重悬,此菌悬浮液用于检测O抗原。同时用生理盐水作对照。
(3)药敏试验:参照《全国临床检验操作规程》和美国临床实验室标准化协会(CLSI)推荐的纸片扩散法进行检测。
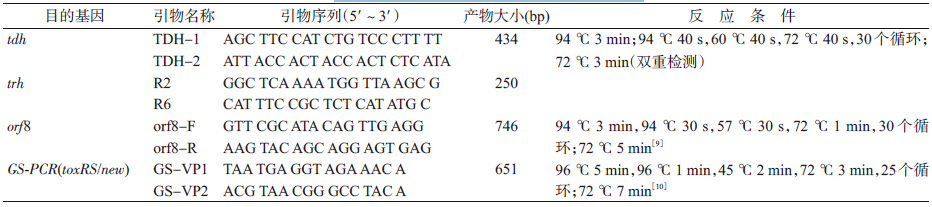
(4)细菌PCR鉴定:用水煮法粗提DNA,经复苏的分离株接种于3%NaCl TSA斜面培养基,37 ℃培养18~24 h后,挑取1环菌苔于200 μl灭菌水中充分研磨,菌悬液于100 ℃水浴10 min后冰浴5 min,10 000 r/min离心5 min,上清即为菌株DNA稀释液。使用Premix Ex TaqTM[宝生物工程(大连)有限公司]配制25 μl的反应体系检测tdh和trh、GS-PCR和orf8片段,引物序列和反应条件见表 1。
(5)PFGE:参照美国PulseNet的副溶血弧菌PFGE标准操作方法。胶块内染色体DNA的酶切使用内切酶NotⅠ酶切(标准菌株H9812使用XbaⅠ酶切),在CHEE MAPPER脉冲场电泳仪(美国Bio- Rad公司)上电泳(温度14 ℃、起始转换时间为10 s,终止转换时间为35.03 s)18 h。电泳结束后,1%的EB染色30 min,脱色90 min后,使用Gel Doc EQ拍摄图像。获得的图像通过BioNumerics V5.01软件(Applied Maths BVBA)分析图谱,得到菌株带型相似性的聚类分析树图。 结果
1. 血清学分型:2013年广东省食源性疾病监测网络共分离得到副溶血弧菌43株(散发株)。主要分离自广州(30株)、阳江(4株)等地,通过血清学分型主要为O3 ∶ K6型(23株,53.49%),其次为O4 ∶ K8型(5株,11.63%)、O1 ∶ K56型(5株,11.63%)和O4 ∶ KUT型(5株,11.63%),O1 ∶ KUT型2株,O3 ∶ KUT、O4 ∶ K9和O4 ∶ K55型各1株。36株暴发株分离自广州(25株)和珠海(11株)的2起食物中毒事件,均分离自病例,经鉴定血清型全部为O3 ∶ K6型,未获得可疑的食品分离株(表 2)。
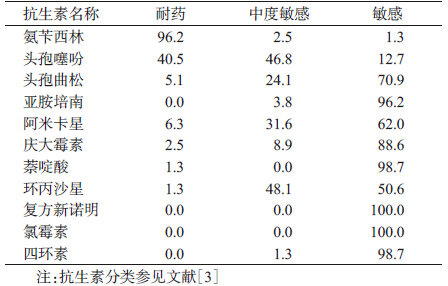
2. 药敏试验:79株副溶血弧菌分离株对氨苄西林的耐药率最高,达96.2%,其次为头孢噻吩(40.5%),对其他抗生素的耐药率均低于10.0%。对环丙沙星的耐药率为1.3%,中度敏感率为48.1%(表 3)。多重耐药分析显示,83.3%(30/36)的暴发分离株对≥3种抗菌药同时耐受,其中6株对≥6种抗菌药物耐药,这些菌株均分离自广州。散发分离株中37.2%(16/43)对≥3种抗菌药物同时耐受(表 4)。
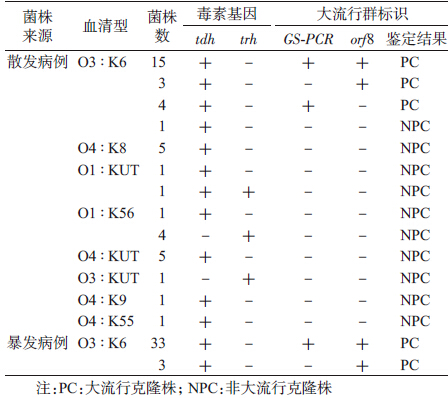
3. 毒力基因检测:86.05%(37/43)的散发分离株为tdh+trh-菌株,11.63%(5/43)为tdh-tdh+菌株,1株为tdh+tdh+菌株。暴发分离株的毒力基因携带情况一致,均为tdh-tdh+菌株。如表 5所示,36株暴发分离株均携带GS-PCR和/或orf8基因,散发分离株中51.6%(22/43)携带GS-PCR和/或orf8基因。携带GS-PCR和/或orf8基因的菌株的血清型全部为O3 ∶ K6型。10.34%(6/58)的菌株仅携带orf8基因,6.90%(4/58)菌株仅携带GS-PCR基因,2种菌株均缺失其中1种标识。
4. PFGE:使用NotⅠ酶对79株副溶血弧菌进行PFGE分型,结果显示菌株间的相似值为59.8%~100.0%,可分为3个聚类(Ⅰ~Ⅲ),优势血清型O3 ∶ K6主要集中于ClusterⅡ中,ClusterⅠ和Ⅲ主要为非O3 ∶ K6型分离株。3大聚类可再细分为32种不同的PFGE型别。暴发分离株主要聚集在Cluster Ⅱ上,散发分离株分散在不同的聚类中(图 1) 。
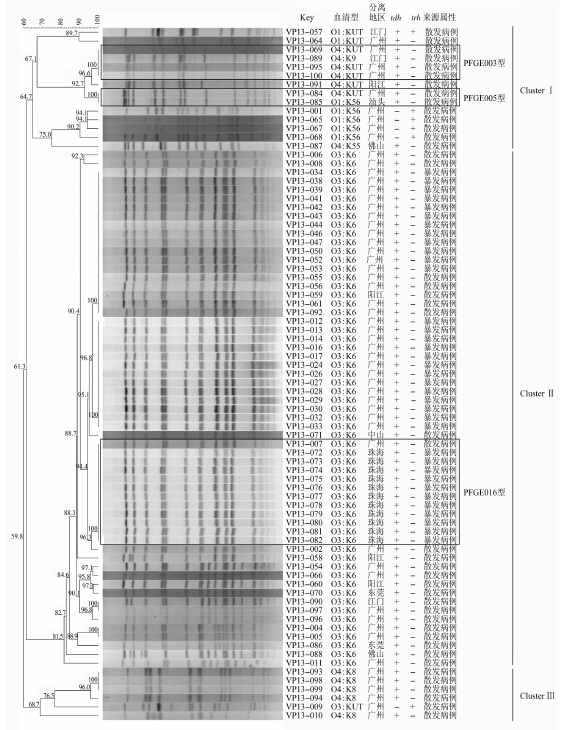 |
| 图 1 2013 年广东省79 株副溶血弧菌的PFGE图谱及聚类分析 |
2013年广东省流行的副溶血弧菌无论是散发还是暴发均以O3 ∶ K6血清型为主,与近年来我国其他地区的腹泻患者分离得到的副溶血弧菌的主要血清型别分布一致[4]。而广东地区报道的另外一种优势血清型O4 ∶ K8型在2013年仅在散发分离株中检测发现[5],在全部分离株中所占比例仅为6.33%(5/79),比2009年的30%大幅下降,提示2013年O4 ∶ K8型副溶血弧菌尚未成为本地区稳定的优势血清型。
副溶血弧菌“大流行克隆株”特指1996年以后分离的tdh+tdh-,GS-PCR阳性(group-specific PCR)和/或orf8+的副溶血弧菌[6]。近几年,鉴定为大流行克隆株的包括O3 ∶ K6,O4 ∶ K8等在内的20多种血清型。本研究显示,除了82.76%(48/58)的“大流行克隆株”为GS-PCR+orf8+外,还有10.34%(6/58)的“大流行克隆株”为GS-PCR-orf8+,6.90%(4/58)的“大流行克隆株”为GS-PCR+orf8-,以上2种菌株均缺失了其中1种标识,这种缺失情况不仅在中国也在孟加拉国等地的研究中发现过[7, 8]。而有研究认为,1株副溶血弧菌同时拥有tdh和toxRS/new基因才能被称为“大流行克隆株”[9],另一方面,orf8基因位于f237噬菌体上,而此噬菌体被认为是1996年后出现的“大流行克隆株”所特有的,是检测“大流行克隆株”的1种有用的遗传标记物[10]。但结合本研究结果提示,单独检测orf8或toxRS/new基因可能存在漏检,同时检测更有助于鉴别“大流行克隆株”。
PFGE结果显示,2013年发生在广州和珠海的2起副溶血弧菌引起的食物中毒暴发事件的临床分离株虽均为O3 ∶ K6血清型,但PFGE型别不一致,提示这2个地区引起食物中毒的副溶血弧菌存在差异,但相关性较高。在同一起暴发事件的分离株中出现2种不同的PFGE型别,但相似性极高,结合患者的发病时间、就餐情况、临床表现以及暴露因素等流行病学资料可以判断这起食物中毒事件为一次暴发事件,是由同一感染源所引起。这也表明,PFGE分型技术在食源性疾病的主动监测和暴发调查中显示了绝对的优势,对处理、预防和控制细菌性传染病流行发挥了重要作用。有些散发株与暴发株的PFGE型别一致,提示在广东省可能存在某些优势PFGE型别的副溶血弧菌持续流行,不断引起散发和暴发。由于本研究未能取得相关的食品和外环境样本,无法及时进行溯源分析,后续研究和监测应结合分析临床患者、食品和外环境分离株之间的相关性,找到该时期流行的优势菌群及其来源途径,这有利于切断传播途径,真正发挥食源性疾病监测网络的预警与控制作用。
| [1] Mao XD,Hu JF,Liu XM. Epidemiological characteristics of bacterial foodborne disease during the year 2003-2007 in China[J]. Chin J Food Hygiene,2010,22(3):224-228. (in Chinese)毛雪丹,胡俊峰,刘秀梅. 2003-2007年中国1 060起细菌性食源性疾病流行病学特征分析[J]. 中国食品卫生杂志,2010,22(3):224-228. |
| [2] Li JS,Liang JH,Ke BX,et al. Surveillance of forborne disease in Guangdong,2012[J]. South Chin J Prev Med,2013,39(6):10-16. (in Chinese)李剑森,梁骏华,柯碧霞,等. 2012年广东省食源性疾病监测结果分析[J]. 华南预防医学,2013,39(6):10-16. |
| [3] Magiorakos AP,Srinivasan A,Carey RB,et al. Multidrug- resistant,extensively drug-resistant and pandrug-resistant bacteria:an international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect,2012,18(3):268-281. |
| [4] Zhang H,Sun S,Shi W,et al. Serotype, virulence, and genetic traits of foodborne and clinical Vibrio parahaemolyticus isolates in Shanghai,China[J]. Foodborne Pathog Dis,2013,10(9):796- 804. |
| [5] Ke BX,Tan HL,Li BS,et al. Etiologic characteristics of Vibrio parahaemolyticus strains causing outbreaks and sporadic cases in Guangdong,2009[J]. Chin J Epidemiol,2011,32(12):1237- 1241. (in Chinese)柯碧霞,谭海玲,李柏生,等. 广东省2009年副溶血弧菌暴发与散发菌株的病原学特征分析[J]. 中华流行病学杂志,2011,32(12):1237-1241. |
| [6] Nair GB, Ramamurthy T, Bhattacharya SK, et al. Global dissemination of Vibrio parahaemolyticus serotype O3:K6 and its serovariants[J]. Clin Microbiol Rev,2007,20(1):39-48. |
| [7] Ma C,He DM,Deng XL, et al. Molecular characteristic of dominant serotypes of Vibrio parahaemolyticus isolated from foodborne disease outbreaks in Guangdong province[J]. Chin J Microbiol Immunol,2011,31(12):1093-1098. (in Chinese)马聪,何冬梅,邓小玲,等. 广东地区副溶血性弧菌暴发分离优势血清型菌株的分子特征[J]. 中华微生物学和免疫学杂志,2011,31(12):1093-1098. |
| [8] Bhuiyan NA,Ansaruzzaman M,Kamruzzaman M,et al. Prevalence of the pandemic genotype of Vibrio parahaemolyticus in Dhaka,Bangladesh,and significance of its distribution across different serotypes[J]. J Clin Microbiol,2002,40(1):284-286. |
| [9] Okura M,Osawa R,Iguchi A,et al. Genotypic analyses of Vibrio parahaemolyticus and development of a pandemic group-specific multiplex PCR assay[J]. J Clin Microbiol,2003,41(10):4676- 4682. |
| [10] Nasu H,Iida T,Sugahara T,et al. A filamentous phage associated with recent pandemic Vibrio parahaemolyticus O3:K6 strains[J]. J Clin Microbiol,2000,38(6):2156-2161. |
 2014, Vol. 35
2014, Vol. 35