文章信息
- 冯录召, 杨鹏, 张涛, 杨娟, 傅传喜, 秦颖, 张奕, 马春娜, 刘兆秋, 王全意, 赵根明, 余宏杰. 2014.
- Feng Luzhao, Yang Peng, Zhang Tao, Yang Juan, Fu Chuanxi, Qin Ying, Zhang Yi, Ma Chunna, Liu Zhaoqiu, Wang Quanyi, Zhao Genming, Yu Hongjie. 2014.
- 中国季节性流感疫苗应用技术指南(2014-2015)
- Technical guidelines for the application of seasonal influenza vaccine in China (2014-2015)
- 中华流行病学杂志, 2014, 35(12): 1295-1319
- Chinese Journal of Epidemiology, 2014, 35(12): 1295-1319
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2014.12.001
-
文章历史
- 投稿日期:2014-11-05
2 北京市疾病预防控制中心;
3 复旦大学公共卫生学院;
4 广州市疾病预防控制中心;
5 清华大学附属北京华信医院
2 Beijing Center for Disease Control and Prevention;
3 School of Public Health, Fudan University;
4 Guangzhou Center for Disease Control and Prevention;
5 Huaxin Hospital, the First Affiliated Hospital of Tsinghua University
一、前言
流感是严重危害全球和我国公众健康的呼吸道传染病。根据WHO估计,每年流感的季节性流行可导致全球300万至500万重症病例,25万至50万死亡[1]。接种流感疫苗是预防流感的最有效手段。为促进我国流感预防控制工作,降低其所致的发病和死亡,中国疾病预防控制中心组织相关专家,综合国内外最新研究进展,制定了《中国季节性流感疫苗应用技术指南(2014-2015)》(指南)。
本指南是对中国疾病预防控制中心制定的2007、2008和2009年版《流感疫苗预防接种技术指导意见》更新,参考WHO 2012年发布的《流感疫苗立场文件》,基于现有科学证据,并结合我国实际提出了流感疫苗的应用建议。所引用的证据主要来自近期国内外发表的相关文献、WHO和美国免疫实施顾问委员会(Advisory Committee on Immunization Practices,ACIP)等权威机构关于流感疫苗的推荐建议。
本指南适用对象包括从事流感防控相关的各级疾病预防控制机构工作人员,预防接种点的接种人员,各级医疗机构儿科、内科、感染科等医务人员,以及各级妇幼保健机构的专业人员。今后根据流感的国内外研究进展,本指南还将不断更新、完善。
二、流感的病原学基础、临床特点和实验室诊断
流感是由流感病毒引起的一种急性呼吸道传染病。流感在不同的地区和人群所致疾病负担轻重不一,全球每年约有5%~10%的成人和20%~30%的儿童罹患季节性流感[2]。正是由于流感病毒基因多变和宿主多样的生物学特性,不断出现新的变异毒株,因此可在人群中广泛传播,造成反复感染和发病。
(一)病原学基础:流感病毒属于正黏病毒科,是单股、负链、分节段的RNA病毒。根据病毒核蛋白和基质蛋白,分为甲、乙、丙(或A、 B、 C)3型[3]。甲、乙型流感病毒均有8个不同的RNA节段,编码至少10~11种蛋白,而丙型流感病毒缺少一个编码神经氨酸酶蛋白的节段。分布于病毒表面的血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)在病毒感染复制过程中扮演着至关重要的角色。根据二者的蛋白结构和基因特性,又可将甲型流感病毒分成多个亚型。目前发现的HA和NA分别有18个(H1~18)和11个(N1~11)亚型[4]。
由于流感病毒的复制无RNA校正酶参与,所以RNA聚合酶每复制大约1万个核苷酸就会出错[5],致使其发生突变的频率高于其他病毒;并且流感病毒基因组的节段性使得不同型别病毒同时感染一个细胞时,就可能发生基因重配,导致病毒基因组的较大变化。所以,新复制的流感病毒大多都有突变[6]。流感病毒存在两种形式的变异方式,即抗原漂移和抗原转变[7]。抗原漂移是流感病毒在复制过程中HA基因和NA基因发生点突变后累积产生的结果,在甲 型流感病毒和乙型流感病毒中均可出现[8]。发生抗原漂移的流感病毒可再次感染先前已获得免疫的宿主,进而导致流感反复流行,如季节性流感[9, 10, 11]。抗原转变仅发生于甲型流感病毒,可产生新亚型。通常由人间流行的流感病毒和动物流感病毒重配后产生;或动物流感病毒发生重大变异后产生,这种情况可导致跨越种属屏障直接感染人类。如果发生抗原转变的新亚型流感病毒具备人与人之间的传播能力,由于人群普遍缺乏免疫力,即可致流感大流行[7]。例如,2009年流感大流行的甲型H1N1病毒[A(H1N1)pdm09]就是来源于禽、猪和人的重配株[12]。
甲型流感病毒在动物中广泛存在,所有亚型均可感染禽类,特别是水禽,同时还可以感染猪、马、海豹、鲸和水貂等哺乳动物。已发现人可感染多种亚型的甲型流感病毒,其中最常见的是H1~H3和N1、N2亚型[2, 13]。甲型流感病毒由于其宿主众多及其结构特点,常发生变异,在人群免疫压力下,每隔2~3年就会出现重要的抗原变异株,导致人群普遍易感,引起季节性流行。人是乙型流感病毒的自然宿主,在海豹和雪貂中也有发现,其变异较少,可引起季节性流行。丙型流感病毒感染人、犬和猪,其结构较甲乙两型稳定,80%的人在7~10岁时就已有丙型流感病毒的抗体,提示儿童期的普遍感染继而获得免疫,因此大多仅导致上呼吸道感染的散发病例,几乎仅有2岁以下儿童表现为下呼吸道感染,如支气管肺炎[14]。
患者和隐性感染者是季节性流感的主要传染源,主要通过其呼吸道分泌物的飞沫传播,也可以通过接触传播[2, 3]。常见潜伏期为1~4 d(平均2 d),从潜伏期末到发病的急性期均有传染性。一般感染者在临床症状出现前24~48 h即可排出病毒,排毒量在感染后0.5~1 d显著增加,在发病后24 h内达到高峰[15]。成人和较大年龄儿童一般持续排毒5(3~8)d,患者感染不同毒株的排毒时间也有差异。成人住院患者可在病后持续1周或更长时间排毒,排毒量也更大[16]。低龄儿童发病时的排毒量与成人相同,但排毒量下降更慢,排毒时间更长[17]。与成人相比,婴幼儿病例中,长期(1~3周)排毒很常见。老年人和HIV感染者等免疫功能低下或缺陷人群的病毒清除能力更差,排毒时间也更长[15, 18]。
(二)临床特点和实验室诊断:流感一般表现为急性起病、发热(可达39~40 ℃),伴畏寒、寒战、头痛、肌肉和关节酸痛、极度乏力、食欲减退等全身症状,常有咽痛、咳嗽,可有鼻塞、流涕、胸骨后不适、颜面潮红、眼结膜轻度充血,也可有呕吐、腹泻等症状[3]。轻症流感常与普通感冒表现相似,但其发热和全身症状更明显。重症病例可出现病毒性肺炎、继发细菌性肺炎、急性呼吸窘迫综合征、休克、弥漫性血管内凝血、心血管和神经系统等肺外表现及多种并发症[2, 3]。
流感的症状仍然是临床常规诊断和治疗的主要依据。常用的筛查标准——流感样症状(influenza- like illness,ILI:体温≥38 ℃,伴咳嗽或咽痛)具有一定的敏感性,但特异性欠佳[19, 20]。临床初诊时,需综合分析ILI的细节并结合其他信息,才能提高诊断流感的准确性。例如,在流感流行季节,如果某患者具有接触过ILI病例,并出现咳嗽、发病当日咳痰、鼻塞流涕、食欲下降且体温高于37.8 ℃ 5项特征,那么该患者确诊流感的可能性较其他ILI病例高3倍;而在非流行季节,如果无咳嗽和高于 37.8 ℃的发热,其患流感的可能性则降低14倍[21]。此外,感染流感后的症状出现时间也有一定规律性。一般在感染后的1 d开始出现症状,以全身症状(发热、肌肉酸痛、疲乏和头痛)2~3 d最明显,但其恢复比鼻部不适和呼吸道症状快,所有症状可持续8~9 d。只有约1/4~2/3的感染者会出现症状,且与感染的病毒型别或亚型无关[18, 22]。其中耳部不适是最常见症状,33%~73%的患者报告耳压异常,33%~47%的成年患者主诉耳痛,其次有58.8%的感染者出现包括鼻塞、流涕、咽痛、喷嚏、声嘶等上呼吸道症状。有21%的患者出现咳嗽、呼吸困难和胸部不适等下呼吸道症状。上述症状也与流感病毒型别无关。34.9%的流感患者发热高于37.8 ℃,其中甲型流感病毒感染者的比例高于乙型。由于细胞免疫与病毒清除和症状缓解直接相关,因此老年人和免疫功能低下人群的症状持续时间更长;相反,如果曾通过主动或被动免疫获得了针对流行毒株的免疫或部分免疫,就可能抵御病毒感染,或在感染后症状较轻,或持续时间较短[18, 23]。
流感的病原学诊断需要经实验室确诊,包括分离病毒和病毒抗原、核酸及抗体检测[3, 24, 25]。分离病毒是实验室检测的“金标准”,但对标本取样、转运等有较高要求,且检测时间较长。病毒核酸检测可用于早期诊断,以RT-PCR(real-time RT-PCR为最佳)检测呼吸道标本(咽拭子、鼻拭子、鼻咽或气管抽取物、痰)中的流感病毒核酸。病毒核酸检测的特异性和敏感性最好,且能快速区分病毒型别和亚型,一般可在4~6 h内获得结果。病毒抗原检测也可用于早 期诊断,采用免疫荧光法快速检测呼吸道标本中的抗原,使用单克隆抗体区分甲、乙型流感,一般可在数小时内获得结果。其他方法还有胶体金试验,一般可在10~30 min获得结果。近年来,研制了多种快速诊断试剂,与病毒分离和RT-PCR比较,其特异性可达90%~95%,敏感性为50%~70%,但儿童和甲型流感病例的敏感性要高于成人和乙型流感病例,而且对其结果的解释应结合患者的流行病史和临床症状综合考虑:在非流行期,阳性筛查结果可能是假阳性;在流行期,阴性的筛选检测结果可能是假阴性;这两种情况均应考虑使用RT-PCR或病毒分离培养进一步确认。抗体检测可以用于回顾性调查,对病例早期诊断的意义不大。
三、流行病学
不同型别、亚型的流感病毒在全球共同循环,流感活动强度和优势毒株在不同季节或不同时期、同一时期的不同地区不尽相同。流感在不同的地理、气候区域其流行特点和季节性规律不同,与纬度及气象等因素有关。每年流感在人群中流行导致较重的健康和经济负担,不同人群的流感疾病负担差异较大,孕妇、婴幼儿、老年人和有慢性基础疾病患者等高危人群,患流感后出现严重疾病和死亡的风险较高。
(一)循环毒株及与疫苗株的匹配:自1952年WHO建立了全球流感监测网络(Global Influenza Surveillance Network,GISN),至今已经运行超过半个世纪。2011年GISN更名为全球流感监测和响应体系(Global Influenza Surveillance and Response System,GISRS)。目前GISRS包含6个WHO流感参比和研究合作中心、4个WHO基础规范实验室和111个WHO成员国的141个国家流感中心。GISRS通过开展全球性监测,监控流感病毒的变异,并根据监测结果为实验室诊断、生产疫苗、抗病毒药物及风险评估提供推荐建议。自2009年起,我国流感监测网络已覆盖全国所有地市,包括554家哨点医院和408家流感监测网络实验室。
2009年以来,A(H1N1)pdm09、A(H3N2)、B型Yamagata系和Victoria系在人群中共同循环。同一时期的不同地区,流感病毒的活动强度和优势毒株不尽相同[26]。WHO根据全球流感监测结果,每年2月和9月,分别针对南北半球下一个流感季节的季节性流感疫苗候选株进行预测性推荐[27]。在一个流行季内,若监测显示越来越多的流感分离株为本流行季流感疫苗株的低反应株,WHO则会考虑在下一个流感流行季更换疫苗推荐株[28]。所谓疫苗低反应株,即使用流感疫苗株免疫雪貂获得免疫后血清,分别针对监测分离的毒株和流感疫苗株进行血凝抑制试验,二者血凝抑制滴度差异≥8倍,则此分离株为低反应株[29, 30]。由于WHO对流感疫苗株为预测性推荐,因此可能出现疫苗株与流行株不匹配的情况;当一个流行季分离的大部分流感毒株为低反应株时,则认为本流行季的疫苗株与流行株不匹配[31]。A型流感病毒不匹配主要是由抗原漂移所致;B型流感病毒则包括2个原因,即抗原漂移,或三价疫苗中的B型流感疫苗株系与实际流行株系不同[31]。例如,在2003-2004年和2007-2008年流感流行季出现了A型流感疫苗株与流行株不匹配[28, 32];而2000-2011年,有6个流感流行季出现了B型流感疫苗株与流行株不匹配[31]。
(二)我国流感的流行特点和季节性:流感在温带地区每年冬春季周而复始随季节性循环已有广泛研究,然而在热带和亚热带地区的季节性及其驱动因素一直是困扰国际科学界的难题[33, 34, 35]。越来越多研究表明,热带地区尤其在亚洲,流感的季节性呈高度多样化,既有半年或全年周期性流行,也有全年循环[34, 35, 36, 37]。
2013年余宏杰等开展的一项针对我国不同区域流感季节性研究显示,A型流感的年度周期性随纬度增加而增强,且呈多样化的空间模式和季节性特征:在≥33°N的北方地区,呈冬季流行模式,每年1-2月单一年度高峰;在<27°N的最南方地区,呈每年4-6月单一年度高峰;两者之间的中纬度地区,为每年1-2月和6-8月的双周期高峰。而B型流感在我国大部分地区呈单一冬季高发[38]。这为我国将来分区域确定流感疫苗免疫接种的最佳时机提供了证据。研究还发现,气候变量和纬度是与流感季节性特征相关性最强的因素。低温是北方地区冬季流感发生和年度周期性强度的预测因子,而南方地区春季的流感活动与降雨量有关。
(三)疾病负担:
1. 健康负担及间接负担:据估计,流感的季节性流行在全球每年导致5%~10%的成人和20%~30%的儿童罹患流感[2],导致300万至500万重症病例和25万至50万死亡[1]。流感的住院和死亡主要发生在孕妇、婴幼儿、老年人和慢性基础疾病患者等高危人群。医务人员由于其职业特点,感染流感病毒的风险较高,也容易将病毒传播给就诊的高危人群。
(1)全年龄组:研究表明,流感每年在我国的季 节性流行导致大量发病、住院和死亡。余宏杰等在湖北省荆州市开展的一项基于人群住院严重急性呼吸道感染病例(severe acute respiratory infection,SARI)监测发现,2010-2011和2011-2012年度实验室确诊流感相关SARI住院率分别达115/10万和142/10万,主要集中在<5岁儿童[39]。1996-2000年香港特区流感相关急性呼吸道感染、肺炎、脑血管疾病和缺血性心脏病的超额住院分别为60.6(95%CI:52.8~67.2)/10万、29.3(95%CI:25.8~32.6)/10万、3.5(95%CI:1.4~5.8)/10万和4.2(95%CI:1.2~7.0)/10万,其中<15岁儿童和≥75岁老年人超额住院率最高[40]。
余宏杰等在我国8个城市开展的流感相关超额死亡研究显示,2003-2008年北方和南方城市平均每年流感相关呼吸和循环系统疾病的超额死亡率分别为12.4/10万和8.8/10万,其中86%以上发生在≥65岁老年人[41]。在另一项利用有全国代表性的死因监测数据评估流感死亡负担的研究发现,2004-2009年我国年均流感相关呼吸系统疾病、呼吸和循环系统疾病及全死因超额死亡率分别为5.0/10万、11.1/10万和13.8/10万,其中85%的流感相关超额死亡发生在≥65岁老年人[42]。以上研究表明,我国流感相关超额死亡的估计结果与欧美发达国家及热带、亚热带地区类似。
(2)孕妇:流感对孕妇的健康危害比较严重。孕期由于机体免疫和生理变化,感染流感病毒后容易出现呼吸系统、心血管系统和其他器官的并发症。美国一项研究表明,1974-1993年流感流行季节,孕妇比产后和未孕的育龄妇女更易发生因急性心肺疾病而住院治疗,其中孕晚期妇女因心肺疾病的住院率最高,是产后妇女的3~4倍[43]。美国另一项研究发现,1998-2002年流感流行季节,孕妇因呼吸系统疾病住院的比例高于非流行季节(3.4 vs. 1.8/1 000名住院孕妇)[44]。与无基础性疾病的孕妇相比,有哮喘史的孕妇感染流感而住院的风险增加10倍(OR=10.6)[45]。加拿大一项研究显示,与怀孕前一年相比,无基础性疾病的孕早期、孕中期和孕晚期孕妇,在流感流行季节因呼吸系统疾病住院风险均升高,OR值分别为1.7(95%CI:1.0~2.8)、2.1(95%CI:1.3~3.3)和5.1(95%CI:3.6~7.3);如果孕妇患1种以上基础性疾病,住院风险则更高,孕晚期OR值可达7.9(95%CI:5.0~12.5)[46]。美国一项1998-2005年孕妇流感死亡负担研究显示,孕晚期妇女流感相关死亡率最高,约为3.1/100万活产[47]。
大量研究表明,流感大流行期间孕妇因流感住院、入住ICU和死亡的风险显著增加[48, 49, 50, 51, 52]。余宏杰等对我国2009年大流行期间A(H1N1)pdm09住院病例的研究发现,虽然孕妇仅占育龄妇女人口数的3%,但育龄妇女因A(H1N1)pdm09住院的严重病例(入住ICU或死亡)和非严重病例中,孕妇分别占51%和31%;A(H1N1)pdm09死亡病例中,20%为孕妇,其中仅7%患有慢性基础性疾病;与未孕的健康育龄妇女相比,孕妇出现严重疾病的风险增加至3.3倍(95%CI:2.7~4.0),孕中期(OR=6.1)和孕晚期(OR=7.6)出现严重疾病的风险进一步增加[50]。
有限的研究显示,孕妇患流感可对胎儿和新生儿产生影响,出现死产、婴儿死亡、早产和低出生体重等[53, 54]。近期一项Meta分析显示,孕早期感染流感使婴儿发生多种先天性疾病的风险显著增加,如各种先天畸形(OR=2.0)、神经管缺陷(OR=3.3)、 先天性心脏病(OR=1.6)、唇裂(OR=3.1)等[53]。美国一项研究表明,孕期感染流感导致婴儿罹患躁郁症的风险增加(OR=3.8)[55]。
(3)儿童:流感对全人群易感,但流行季节儿童感染率和发病率通常最高,随年龄的增长而略有下降[56]。血清抗体检测发现,绝大多数儿童(93%)从出生至6岁至少感染过一次流感病毒[57]。在某些高流行季节,儿童流感年感染率可高达约50%[58, 59]。儿童感染流感后,体内抗体滴度水平往往更高,排毒时间更长,因而儿童在流感的流行和传播中具有重要作用,经常将流感病毒传给家庭成员,或作为传染源带入学校和社区[60, 61]。
大量证据表明,流感是导致儿童就诊和住院的重要原因。据估计,每年约有10%~15%的儿童因流感感染而需就诊[62, 63]。<5岁儿童感染流感后并发重症疾病的风险较高,流感相关疾病住院率可达921/10万人年;通常<2岁儿童的流感住院率最高,香港特区<1岁婴儿流感住院率高达2 785/10万人年[64, 65, 66]。余宏杰等在湖北省荆州市开展的基于人群的研究表明,流感导致的SARI住院患者主要集中在<5岁儿童,该年龄组流感相关SARI住院率达2 021/10万人年至2 349/10万人年,其中6~11月龄婴儿住院率最高(3 603/10万人年至3 805/10万人年)[39]。香港特区另一项研究表明[67],2~6月龄婴儿流感住院率最高,可达1 762/10万人年。
流感流行可引起大量学龄儿童缺课和父母缺勤。美国一项研究发现,一个流行季节,每100名学生有28名发病,致缺课63 d,父母旷工20 d和22个 家庭出现继发病例[68]。2003-2006年香港特区每年每1万人中因A型和B型流感导致学生缺课662~1 046 d,父母缺勤214~336 d[69]。<5岁儿童中,41%的流感患儿平均需就诊2次以上[70]。
国内一系列儿童急性呼吸道感染(ARI)的病原学研究表明,门(急)诊就诊儿童流感样病例或ARI病例中流感检测阳性率为3.2%~25.8%[70, 71, 72, 73, 74, 75],住院儿童ARI或SARI病例为1.4%~35.4%[76, 77, 78, 79, 80, 81]。
儿童感染流感可导致死亡,患基础性疾病儿童的死亡风险显著高于健康儿童。然而,儿童流感相关超额死亡率较老年人和成年人低,香港特区一项研究估计,1998-2009年0~4岁儿童A(H1N1)和A(H3N2)相关超额死亡率分别为0.91/10万人年和0.18/10万人年[82]。
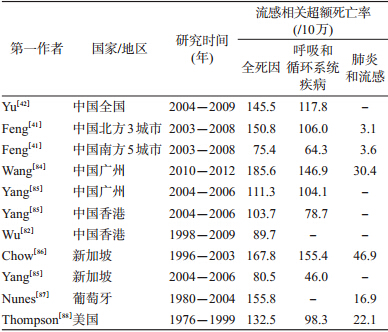
(4)老年人:流感是老年人的重要死因。1999-2010年英国≥75岁老年死亡病例中2.5%~8.1%是由流感所致[83]。我国全国范围及广州、香港等地的流感超额死亡研究显示,≥65岁老年人流感相关的呼吸和循环系统疾病、全死因超额死亡率分别为64/10万至147/10万、75/10万至186/10万[41, 82, 84, 85],与新加坡[85, 86]、葡萄牙[87]、美国[88]和欧美发达国家接近(表 1)。
与其他年龄组相比,流感相关死亡风险在老年人最高。我国内地和香港特区的研究均显示,≥65岁老年人流感相关超额死亡率远高于0~64岁组,84%~95%的流感相关超额死亡发生在≥65岁老年人[41, 42, 82, 84, 85]。同样,美国1976-2007年流感相关超额死亡中,≥65岁老年人约占90%[89]。高年龄组老年人的死亡风险更高。新加坡≥65岁老年人流感相关死亡率是全年龄组的11.3倍[86];美国≥85岁老年人流感相关的全死因死亡风险为65~69岁组的16倍[88]。
流感对老年人除了导致显著的超额死亡外,还导致出现相当高的住院负担。余宏杰等2010-2012年在湖北省荆州市基于人群的研究发现,≥65岁老年人中确诊流感导致的SARI病例住院率为89/10万至141/10万[39]。1996-2000年香港特区一项关于流感相关超额住院的研究发现,65~74岁和≥75岁老年人中流感相关超额住院率分别为急性呼吸道感染(84/10万和266/10万)、流感及肺炎(59/10万和176/10万)、糖尿病(24/10万和54/10万)、脑血管病(16/10万和55/10万)、缺血性心脏病(10/10万和56/10万)[40]。美国一项研究显示,诊断“流感及肺炎”患者中,患慢性病的≥65岁老年人流感相关超额住院率为476/10万至636/10万,为同样具有慢性病青年人的6~8倍;无慢性病病史老年人流感相关超额住院率为150/10万至172/10万,为无慢性病病史青年人的6~7倍[90]。
此外,比利时、澳大利亚、法国等针对养老院、疗养院等机构开展的流感暴发调查提示,集体机构容易出现暴发,这些机构的老年人全年均存在流感感染的风险[91, 92, 93, 94, 95]。
(5)慢性基础性疾病患者:此类患者比同龄健康成年人感染流感病毒后,更易出现严重疾病或死亡,其流感相关住院率和超额死亡率明显高于未患病者。高危基础性疾病包括呼吸系统疾病(哮喘、慢性支气管炎和肺气肿及其他肺部疾病)、心脏病(动脉粥样硬化性心脏病、心肌病、慢性充血性心衰、先天性心脏病)、神经发育障碍(脑瘫、肌肉营养不良、认知障碍)、代谢性疾病(糖尿病)、免疫功能障碍(HIV/AIDS及化疗、使用免疫抑制剂的器官移植患者和慢性皮质激素治疗者)、采用透析治疗的慢性肾功能不全、慢性肝病(特别是肝硬化)、肥胖、血液系统疾病(镰状细胞性贫血、地中海贫血)及长期服用阿司匹林的青少年(有发生Reye’s综合征的风险)。
1996-2000年美国≥65岁老年人中,患和未患慢性基础疾病者流感相关住院率分别为560/10万和190/10万[96]。2001-2007年英国慢性病患者的流感相关住院率为71/10万,是健康对照人群的2.6倍;英国每年流感相关死亡中,慢性病患者占72%[97]。韩国研究显示,糖尿病患者感染流感后发生严重并发症的风险是未患糖尿病人群的3.63倍(95%CI:1.15~11.51)[98]。1999-2005年我国台湾地区癌症患者流感相关住院率为70.1/10万,显著高于未患癌 症人群(44.4/10万)(P<0.000 1)[99]。
(6)医务人员:由于医务人员在日常诊疗活动中接触流感患者的机会较多,因而暴露于流感病毒的风险高于普通人群。一项对1957-2009年全球29项研究数据进行汇总的Meta分析显示,未接种流感疫苗的医务人员每个季节实验室确诊的流感发病率为18.7%(95%CI:15.8%~22.1%),是健康成年人的3.4倍(95%CI:1.2~5.7)[100]。医院内发生流感暴发疫情时,医务人员感染流感病毒的风险更高,护理流感患者的医务人员罹患率高达11%~59%[101]。此外,医院内不同科室、不同类型医务人员的流感感染风险也不相同,临床科室医务人员的罹患率明显高于其他部门[102],护士的罹患率高于其他医务人员[103]。
我国针对医务人员也开展了流感疾病负担的调查。2008年12月至2009年1月,在北京市开展的一项前瞻性整群随机临床试验显示,未佩戴口罩、佩戴医用口罩和佩戴N95口罩的医务人员中,实验室确诊流感4周发病率分别为1.3%、1.0%和0.3%[104]。2004年10月至2005年5月,台湾地区开展的回顾性调查显示,未接种疫苗的医务人员流感样病例的发病率为15.0%[105]。此外,流感还造成医务人员劳动力的损失,香港特区一项回顾性队列研究显示,2005年1-10月未接种流感疫苗的医务人员平均每人因流感样病例而缺勤1.75 d[106]。
医务人员感染流感病毒可增加院内感染和社区传播的风险。研究显示,在感染流感病毒的医务人员中,35%为无症状感染者[107],75%以上的医务人员在出现流感样症状后仍继续工作[101, 108]。因此,如果不采取有效的防护措施,会增加其他医务人员[109]和就诊、住院患者及其家属的感染风险[101],尤其对婴幼儿、老年人和慢性病患者等高危人群产生较大影响,感染后容易引起重症或和死亡。
2. 流感的经济负担:我国流感经济负担相关研究数量有限,且多集中在经济发达的城市地区,仅有一项尚未发表的研究覆盖到除西藏和辽宁以外的全国29个省(自治区、直辖市)[63, 69, 70, 110, 111, 112]。研究提示,流感门诊病例的直接医疗成本为156~398元/人,间接成本为198~244元/人[63, 69, 70, 110]。流感住院病例的经济负担明显高于门诊病例,29个省(自治区、直辖市)调查结果显示直接医疗成本为4 783元/人(IQR:2 949~7 286元/人)、直接非医疗成本为1 307元/人(IQR:706~2 193元/人)、间接成本为626元/人(IQR:322~1 053元/人)。上海市≥60岁流感住院患者直接医疗成本为(10 934±12 409)元/人,患慢性基础疾病者的医疗成本(15 072元/人±16 654元/人)显著高于无基础疾病者(7 624元/人±5 997元/人)(P<0.05)[110]。苏州市<5岁流感住院患儿直接医疗成本为3 931元/人(IQR:3 024~5 216元/人);收入重症监护室治疗患儿的直接医疗成本(M=8 335元/人,IQR:7 075~9 986元/人)高于普通病房就诊病例(M=3 875元/人,IQR:3 018~5 078元/人)(P<0.05)[111]。长沙、成都和济南三市的流感住院病例医疗成本调查显示,<15岁儿童、16~64岁成年人和≥65岁老年人直接医疗成本M值分别为1 541、5 696和15 094元/人,高危人群的直接医疗成本是低危人群的6倍[112]。
珠海市2008、2009年估计的流感门诊患者分别为5 568例和26 275例,直接经济负担分别为137万和616万元[63]。2003-2005年香港特区<18岁儿童流感住院的直接和间接经济负担为288万和365万美元[69]。
四、流感疫苗
(一)历史和现状:
1. 疫苗组分的演变:流感疫苗的研发随着流感病毒分离和培养技术的成熟,以及流行毒株的变化而不断演变[113]。1933年首次在雪貂体内分离到A型流感病毒,1940年首次分离到B型流感病毒。1945年在美国开始广泛应用二价全病毒灭活流感疫苗[A(H1N1)和B型]。1958年,随着A(H2N2)代替A(H1N1)在人间流行,随后研制了含有A(H2N2)和B型病毒的新型二价流感疫苗。1968年,A(H3N2)出现导致大流行,并替代A(H2N2)成为季节性流感,1970年二价流感疫苗的毒株也随之替换为A(H3N2)和B型。1978年,A(H1N1)重新出现,并与A(H3N2)和B型流感病毒在人间共同循环。随后,三价流感疫苗[A(H1N1)+A(H3N2)+B型]问世,以提高疫苗对同时循环的2种A型病毒的预防作用。1987和1988年B型Victoria系和Yamagata系毒株出现后,2种B型流感病毒共同循环,但流感疫苗一直仍为三价疫苗,其中B型毒株根据全球流感监测结果在B(Victoria)和B(Yamagata)2个系中选择。2012年起,WHO在推荐三价疫苗毒株[A(H1N1)+A(H3N2)+B(Victoria)或B(Yamagata)]的同时,也推荐另外一个系的B型毒株用于四价流感疫苗的生产,即同时包括B(Victoria)和B(Yamagata)2个系。
2. 疫苗生产工艺的研发史:1936年鸡胚培养流感病毒获得成功,这使得大量生产人用疫苗成为可 能。通过鸡胚培养制成的全病毒灭活疫苗于1941年首次在美国获准使用[114]。1968年流感病毒裂解疫苗上市。由于裂解疫苗保留了病毒的免疫原性同时极大降低了反应原性,采用裂解技术制备的裂解疫苗成为常规使用的疫苗[115, 116, 117, 118, 119]。在裂解的基础上使用额外的纯化步骤去除内抗原(即核衣壳和基质蛋白)而成为亚单位疫苗。
为了增加亚单位疫苗的免疫原性,部分厂家还研制了佐剂流感疫苗。佐剂是与特异性抗原共同使用后,能产生比抗原单独使用更强免疫效果的物质。因此,佐剂可以起到节约抗原的作用,从而增加疫苗产量,这在流感大流行时具有潜在好处。目前已上市的有MF59水包油乳状液型佐剂流感疫苗、病毒小体(virosome)流感疫苗和单磷酰脂质A(Monophosphoryl lipid,MPL)佐剂大流行流感疫苗。但2010年芬兰和瑞典有关含佐剂的甲型H1N1流感大流行疫苗可能与嗜睡症相关的报道,对佐剂的安全性提出了更高的评估要求。
为进一步提高流感疫苗在高危人群中的免疫原性,近年来国外还研发并上市了皮内注射疫苗、高剂量疫苗和鼻喷减毒活疫苗等。
3. 疫苗株的来源和疫苗生产:早在1947年,也就是流感疫苗商业化2年后,人们就认识到流感病毒HA的抗原性改变(即抗原漂移)将显著降低疫苗的效果[120, 121],因此疫苗组分需每年更新,以有效针对南北半球的新流行毒株[122, 123]。流感疫苗毒株来源于WHO全球流感监测和响应系统得到的分离株,原始分离株经过传代制备为参考株,然后分发到厂家制备种子批。通常情况下,原始野生病毒株在鸡胚中生长性能不佳,因此需要研究数个抗原性相近的备选株,分析其制备高产重配株的潜能、生长特性和最优的培养条件(如时间和温度)。
鸡胚流感疫苗自1945年开始在美国上市,经过几十年的生产经验,已成为世界公认的最成熟、最安全的生产方法。传统的流感疫苗生产大致分为6个步骤,包括病毒培养、收获、纯化、裂解、灭活和终过滤,成为单价流感疫苗原液,这些步骤因不同厂家的工艺不同可有所不同。各国法规对用于生产流感疫苗的鸡胚蛋均有特别的要求,如毒种传代和制备用鸡胚应来源于无特殊病原体(specific pathogen free,SPF)鸡群,疫苗生产用鸡胚应来源于封闭式房舍内饲养的健康鸡群,选用9~11日龄无畸形、血管清晰、活动的鸡胚。灭活流感疫苗中加入的抗生素不是活性成分,在终成品中已降至痕量或无法检测的水平。大多数单剂型流感疫苗不含硫柳汞,即无防腐剂疫苗。
近年来,针对使用哺乳动物细胞,如犬肾细胞(Madin-Darby canine kidney,MDCK细胞)或非洲绿猴肾细胞(African green monkey kidney cell,Vero细胞)作为灭活流感病毒培养的基质细胞做了大量研究。经细胞培养的流感病毒其抗原多样性优于鸡胚培养,细胞培养工艺的生产时间短,在流感大流行时具有独特优势。
4. 全球已上市的流感疫苗:目前国际上已经上市的流感疫苗有流感灭活疫苗(inactivated influenza vaccine,IIV)、流感减毒活疫苗(live attenuated influenza vaccine,LAIV),均包括三价或四价疫苗。三价流感疫苗组分含有A(H3N2)、A(H1N1)和B型毒株的一个系,四价流感疫苗组分含A(H3N2)、A(H1N1)、B(Victoria)和B(Yamagata)[2]。流感灭活疫苗有全病毒疫苗、裂解病毒疫苗和亚单位疫苗3种[2],标准剂量的疫苗通过肌肉注射或深度皮下注射,0.5 ml剂型(适用于≥3岁人群)含每种组分毒株HA 15 μg,0.25 ml剂型(适用于6~35月龄婴幼儿)含每种组分毒株HA 7.5 μg;目前尚无批准在<6月龄婴儿中使用的灭活流感疫苗。在大多数国家,全病毒疫苗已被安全性更好的裂解病毒疫苗和亚单位疫苗所取代[2]。
近年来,开发和上市了皮内接种的流感灭活疫苗,供18~59岁成年人接种,每剂各含HA 9 μg,免疫原性与15 μg HA肌肉内接种相同;供≥60岁老年人接种的每剂各含HA 15 μg,免疫原性好于15 μg HA肌肉内接种,与佐剂疫苗类似[124, 125, 126, 127]。2010年高剂量灭活流感疫苗在美国上市,每剂各含HA 60 μg,供≥65岁老年人接种,效果明显高于标准剂量疫苗[128, 129, 130]。目前,欧洲批准了3种佐剂亚单位疫苗,其中2种是水包油乳剂MF59和MPL系列的AS03佐剂,第三种是脂质体样颗粒(liposom-like particle)病毒小体佐剂。
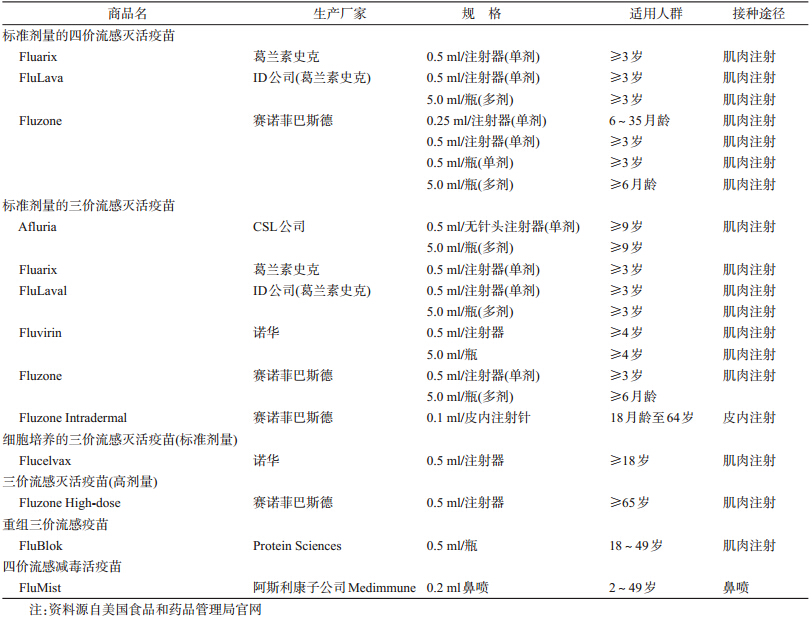
LAIV是由不引起流感的减毒活病毒通过冷适应工艺制成,通过鼻喷途径接种。2012年,一种四价LAIV在美国获许上市[2]。减毒活疫苗可诱导黏膜免疫反应,模仿自然感染。制备流感减毒活疫苗的关键是找到变异抗原快速减毒的途径,而冷适应技术能可靠而有效地对人用疫苗进行减毒。将病毒株从36~25 ℃逐步降温传代培养至获得冷适应株[流感病毒冷适应原型株A/Ann Arbor/6/60(H2N2)和B/Ann Arbor/1/66],其特点是在25~33 ℃培养能 正常复制至适应常温培养的滴度,而在38~39 ℃下培养病毒复制受限。冷适应株在体内37 ℃下不能有效复制,故对人体无致病性,但其有限的复制仍可诱发机体免疫应答。目前在美国已上市的流感疫苗见表 2。
5. 我国现有疫苗:我国已上市的流感疫苗均为三价灭活流感疫苗(trivalent inactivated influenza vaccine,TIV),目前有16家国内外厂家供应季节性流感疫苗,主要是裂解疫苗和亚单位疫苗(表 3)。
(二)TIV接种后的免疫反应和免疫持久性:欧盟药品评价局和美国食品药品管理局的标准要求流感疫苗接种后[131, 132]:①血凝素抑制(hemagglutination inhibition,HI)抗体≥1 ∶ 40;②血清阳转率,即免疫接种前HI抗体<1 ∶ 10,免疫后HI抗体≥1 ∶ 40,或免疫接种前HI抗体≥1 ∶ 10,免疫接种后HI抗体几何平均滴度(geometric mean titers,GMT)增长≥4倍。
流感疫苗既诱导体液免疫又诱导细胞免疫。体液免疫中,流感疫苗接种主要诱导针对主要表面糖蛋白即HA和NA的抗体。人体对灭活疫苗产生血清抗体的强弱与年龄和接种前抗体水平有关。在外周血中流感病毒特异性抗体产生细胞的数量在接种后1周达到高峰,而血清抗体水平在流感病毒感染或健康人群接种疫苗后2~4周达到高峰,但是可能在未接触过流感抗原者和老年人中需要4周或更长时间,才能达到高峰[133, 134]。CD4+T和CD8+T淋巴细胞也同样在流感免疫中起重要作用,与特异性抗体应答相比,细胞免疫能识别病毒表面/内部单位的更多保守位点,对不同亚型病毒有更好的交叉反应[135]。
在健康的年轻人中灭活疫苗可诱导快速的全身和局部免疫应答[134]。在疫苗接种2周内,有90%正常个体产生1 ∶ 40或更高的HI抗体,第二针使抗体滴度很少增加。在接种后4~6周血清抗体水平达到高峰。人体对感染流感病毒或接种流感疫苗后获得的免疫力会随时间衰减,其程度与年龄和身体状况、疫苗抗原等因素有关,临床试验证据提示,接种灭活流感疫苗对抗原类似毒株的保护作用可维持6~8个月[116]。接种1年后血清抗体水平显著降低, 但部分毒株的保护作用持续时间可更长。为匹配不断变异的流感病毒,由WHO推荐的流感疫苗组分在多数季节会更新1个或多个毒株,也存在3种疫苗毒株与前一季节完全相同的情况。为保证接种人群得到最大程度的保护,即使流感疫苗组分与前一季节完全相同,鉴于多数接种者抗体滴度已显著下降,因此无论前一季节是否接种流感疫苗,仍建议在当年流感季节来临前进行接种。
(三)TIV的免疫原性、效力和效果:疫苗的效力(efficacy)用于衡量某种疫苗在设对照的临床试验中是否收效良好;效果(effectiveness)则指疫苗在常规免疫规划中应用时收效是否良好。流感疫苗的效力和效果受诸多因素影响,包括受种者年龄、免疫力、疫苗株与循环毒株的匹配程度及研究设计、测量指标等。测量流感疫苗效力和效果的指标较为广泛,包括对实验室确诊流感、就诊的急性呼吸道疾病(medically attended acute respiratory illness,MAARI)或流感样病例、流感和肺炎相关住院或死亡、循环毒株的血清阳转率等结局的预防作用。利用特异性指标(如实验室确诊流感)评价疫苗的效力和效果,通常高于非特异性指标(如MAARI)[136]。观察性研究比较接种组和未接种组测量结局的差异时,利用非特异性指标比实验室确诊结局更易出现偏倚。另外,利用实验室确诊结局评价疫苗效力的研究中,也可能受到诊断方法灵敏度的影响。2012年一项模拟研究发现,流感感染诊断的灵敏度每降低1%,疫苗效果将低估4%[137]。
1. 健康成人:流感灭活疫苗在健康成人中有良好的免疫原性。国内随机对照试验(randomized controlled trial,RCT)的Meta分析表明,接种国产与进口流感病毒裂解疫苗后的血清抗体阳转率的差异无统计学意义[138, 139]。
2012年一项流感疫苗RCT的系统综述估计,TIV对18~65岁健康成人预防确诊流感的效力为59%(95%CI:51%~67%)[140]。2014年另一项关于健康成人接种流感疫苗RCT的系统综述,纳入的研究更新至2013年5月,估计16~65岁健康成人接种TIV,对确诊流感的预防效力为60%(95%CI:53%~66%),对ILI的预防效果为16%(95%CI:5%~25%);当疫苗株和循环株匹配时,接种TIV可减少42%(95%CI:9%~63%)的ILI就诊[141]。
我国关于流感疫苗效力和效果的RCT研究较少,多为队列研究。一项对1998年3月至2008年5月国内文献的系统综述纳入了2项RCT和11项队列研究[142],其中1项RCT发现流感疫苗对20~50岁成人ILI的预防效果为73%[143],而队列研究的Meta分析估计流感疫苗对成人ILI的预防效果为30%(95%CI:17%~41%)。由于观察性研究易受偏倚影响,以实验室确诊流感为研究结局的RCT的Meta分析的结果是疫苗效力的最佳证据。
2. 孕妇:妊娠期接种流感疫苗,既可保护孕妇,也可通过胎传抗体保护其新生儿免于罹患流感[144]。2004-2005年度一项在孟加拉国开展的随机对照临床试验,纳入了340名孕晚期的孕妇,其中172名孕妇接种TIV,168名孕妇接种23价肺炎多糖疫苗作为对照,随访整个孕期及婴儿出生后6个月。结果发现,与对照组相比,接种TIV能降低孕妇36%和婴儿29%的发热呼吸道疾病,TIV接种组的婴儿出生6个月内实验室确诊流感感染减少63%[145]。2011-2012年南非针对194名感染HIV的孕妇及2 116名未感染HIV的孕妇开展的随机对照临床试验发现,流感疫苗在感染和未感染HIV的孕妇中免疫原性均较好,两组孕妇及其婴儿接种TIV一个月后,血清阳转率均高于安慰剂对照组。接种TIV可为两组孕妇及未暴露HIV的婴儿的流感感染提供一定的保护,对未感染HIV的孕妇及其婴儿疫苗效力分别为50.4%(95%CI:14.5%~71.2%)和48.8%(95%CI:11.6%~70.4%);对感染HIV的孕妇疫苗效力为57.7%(95%CI:0.2%~82.1%)[146]。美国一项前瞻性观察队列研究显示,孕期接种流感疫苗,使婴儿 实验室确诊流感和ILI住院的风险分别降低41%和39%,接种组孕妇的婴儿在2~3月龄时流感抗体滴度也显著高于未接种组[147]。然而,1997-2002年美国一项回顾性研究显示,TIV接种组的孕妇及其婴儿ILI发病无明显降低[148],1995-2001年一项回顾性队列研究,也未发现接种组孕妇的婴儿呼吸系统疾病就诊率的显著下降[149]。
3. 儿童:6月龄以上儿童按推荐的免疫程序接种流感疫苗后可产生对流感病毒感染的保护作用。8岁以下儿童首次接种时,接种2剂次比1剂次能提供更好的保护作用,如5~8岁儿童接种2剂流感疫苗后,针对A(H1N1)、A(H3N2)和B型流感病毒产生的抗体滴度显著高于仅接种1剂次者[150]。
儿童接种流感疫苗的效力和效果存在季节间差异,与研究设计、流感活动强度等有关,目前以病毒培养或RT-PCR确诊流感作为测量结局的研究不多。2007-2008、2008-2009年度在欧洲开展的一项以流脑结合疫苗或乙脑疫苗为对照的临床试验发现,接种无佐剂和MF59佐剂的流感疫苗对6~71月龄儿童确诊流感的效力分别为43%(95%CI:15%~61%)和86%(95%CI:74%~93%)[151]。一项设置安慰剂对照的临床试验发现,接种流感疫苗对3~9岁儿童确诊流感的保护效力为56%,10~18岁则为100%[152]。1985-1990年开展的一项随机对照试验表明,1~15岁儿童接种流感疫苗可减少91%的A(H1N1)和77%的A(H3N2)流感病例[153]。美国一项随机、双盲、安慰剂对照试验共纳入786名6~24月龄儿童,以病毒培养确诊流感作为观察指标,发现1999-2000年度疫苗效力为66%(95%CI:34%~82%),但在流感活动强度较低的2000-2001年度,未显著降低流感发病[154]。以血清学诊断为测量结局的研究,成人可能因曾经发生流感的自然感染或被动免疫而产生“抗体天花板”效应,即相对于未接种者不易发生抗体滴度4倍增高,而导致疫苗效力的高估;但儿童中是否存在此效应尚不明确。
2012年一项对流感疫苗效果的Meta分析指出,在覆盖8个流行季节的6项研究中,流感疫苗对3个流行季节的6~59月龄儿童具有中等保护效果[140]。国内开展的2008-2013流行季节以RT-PCR确诊流感为观察结局的疫苗效果病例对照研究,也表明接种流感疫苗对6~59月龄儿童具有中等的保护效果,2010-2011、2011-2012年度疫苗效果分别为73.2%和52.9%(表 4)[155, 156],2012-2013年度对8~83月龄儿童A(H1N1)pdm09亚型的保护效果为67%(95%CI:58%~74%)。
流感疫苗对大龄儿童的保护效果可能优于低龄儿童[151, 157]。2012年流感疫苗效力和效果的Meta分析显示,6~23月龄儿童的疫苗效果为40%(95%CI:6%~61%),24~59月龄儿童为60%(95%CI:30%~78%)[140]。我国2011-2012年度流感疫苗对36~59月龄及6~35月龄的保护效果分别为58.2%和49.5%(表 4)[155]。
6~35月龄儿童接种2剂次流感疫苗的效果优于仅接种1剂次。2008-2009、2009-2010年度接种2剂次的疫苗效果分别为61.0%(95%CI:44.1%~72.8%)和73.4%(95%CI:54.7%~84.3%),但接种1剂次未显示明确保护效果[156]。2010-2012两个年度结果也提示类似现象(表 4)[155]。因此,低龄儿童首次接种流感疫苗应接种2剂,才能获得最大程度的保护。
儿童接种流感疫苗后其保护效果随时间可有一定衰减,未发现往年接种流感疫苗对当前季节接种效果有干扰作用。2010-2012两个年度接种流感疫苗后(两年度疫苗组分相同),疫苗效果从接种后1~3个月的68.9%(95%CI:57.5%~77.2%)下降至4~6个月的48.4%(95%CI:33.8%~59.7%),两个季节均接种与仅当前季节接种的保护效果相近(分别为55.9%和56.8%)[155]。
罹患慢性基础性疾病的儿童其免疫原性显著低于健康儿童[158],但有研究提示,患哮喘的儿童对流感疫苗的免疫原性与健康儿童相近,即使在其哮喘发作需皮质激素治疗时影响也不大[159]。
4. 学生:学生接种流感疫苗可有效降低流感发病率。2000年11月至2001年6月,国内对某学校400名7~12岁小学生进行为期7个月的观察,发现接种流感疫苗组的学生ILI发生率为9.5%(19/200), 在校学生接种流感疫苗可提高直接保护作用及群体免疫,后者可阻断流感在家庭和社区中的传播,从而产生对社区人群的间接保护作用。2010-2011年度美国开展的一项对4所接种流感疫苗和4所未组织接种的对照小学共4 455名对象的研究,以PCR确诊流感为测量结局,接种学校和对照学校的流感疫苗接种率分别为32.7%和2.7%,疫苗效果为67.0%(95%CI:45.4%~80.1%)。与对照学校相比,接种学校的流感发病率降低30.8%(95%CI:10.1%~46.8%),未接种疫苗的学生比接种的学生缺课显著增加(4.3 vs. 2.8天/100学日);同时,与对照学校相比,近50%的疫苗覆盖率可对该学校内未接种疫苗的儿童产生间接保护作用[161]。美国另一项对28所中小学进行的流感疫苗干预研究表明,在流感高峰期,疫苗干预学校(接种率为47%)的家庭儿童流感样症状的发生率(17%)低于对照学校(26%),家庭成人ILL发生率在疫苗干预学校(8%)也显著低于对照组(13%)[162]。美国一项对2所小学(流感疫苗接种率为52%)及附近2所学校(为对照组,接种率28%)的对比研究发现,以因发热或咳嗽缺勤≥1 d为观察指标,高接种率学校的缺勤率(26.5%)显著低于对照组(38.9%)[163]。
5. 老年人:老年人可能由于免疫系统退化,导致其对流感疫苗的免疫原性下降[164]。一项对1986-2002年31项≥58岁人群HAI抗体反应性研究的综述表明,与年轻人接种流感疫苗后对A(H1N1)、A(H3N2)及B型病毒60%、62%和58%的血清抗体阳转率相比,老年人仅为42%、51%和35%;以血清保护(HAI抗体滴度≥1 ∶ 40)作为观察指标时,老年人对3种亚型的保护率分别为69%、74%和67%,年轻人则为83%、84%和78%[165]。尽管HAI抗体滴度≥1 ∶ 40对健康年轻人可达到近50%的临床保护效果,但在老年人中的情况可能不同。
美国一项≥60岁社区居民的随机对照试验表明,在疫苗株和循环毒株匹配的季节中,接种流感疫苗对血清学诊断确诊流感的保护效力为58%(95%CI:26%~77%);但由于“抗体天花板”效应,该项研究可能高估疫苗效力[166]。养老院中接种流感疫苗对老年人急性呼吸道疾病的预防效果为20%~40%[167, 168]。然而,护理机构中老年人暴发流感表明,当流行株发生抗原漂移时,接种流感疫苗无明显效果[169, 170]。
接种流感疫苗可降低≥65岁老年人流感相关并发症发生率,减少流感相关住院及死亡。1995年一篇对20项队列研究的Meta分析发现,老年人接种流感疫苗能预防53%(95%CI:35%~66%)的肺炎、50%(95%CI:28%~65%)的住院和68%(95%CI:56%~76%)的死亡[171]。2007年一篇对18项社区老年人队列研究的汇总分析提示,接种流感疫苗可减少27%的肺炎住院和48%的死亡[172]。但这些研究利用非特异的临床结局而非实验室确诊流感作为评价指标,可能影响结论的准确性。
6. 慢性基础性疾病患者:在CD4+T淋巴细胞计数较低的HIV感染者中,TIV免疫原性较差,疫苗效果可能降低[173, 174, 175],接种第2剂也不能提高其免疫反应[174]。对于癌症患者和器官移植接受者,接种1剂TIV(含或不含佐剂)在成人和儿童中仅能诱导中等的免疫应答[176, 177];部分研究发现,接种第2剂可显著提高达到血清学抗体保护水平的比例[176]。对感染HIV的成人和儿童中使用含MF59佐剂的季节性流感疫苗的研究表明,在此类患者中使用含佐剂疫苗可能更有益[178]。
2011年一篇汇总不同人群接种流感疫苗效果的系统综述[179],表明流感疫苗在多种基础性疾病患者中有效[180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190],但有关肺炎、住院和死亡等重要结局的高质量证据较少。2006年一项系统综述[186]对2个RCT[191, 192]的Meta分析表明,慢性阻塞性肺病(COPD)患者接种TIV预防流感的效力为81%(95%CI:52%~93%),可平均减少0.37(95%CI:0.11~0.64)次COPD恶化。我国开展的队列研究也表明,接种TIV可以减少COPD和慢性支气管炎的急性感染和住院[193, 194, 195, 196]。成都市一项队列研究发现,与未接种疫苗的对照组相比,TIV接种3个月、6个月后COPD急性加重的住院天数分别减少3.3 d和7.1 d[193]。仅1项RCT研究了哮喘患者接种流感疫苗的效果[183, 197, 198],未发现其减少哮喘发病或降低流感相关哮喘发作的持续时间和严重性的作用。
2013年一项流感疫苗与心血管疾病相关RCT研究的Meta分析表明,心血管疾病患者接种流感疫苗可降低主要心血管事件风险(RR=0.64,95%CI:0.48~0.86),对急性冠脉综合征患者的预防效果(RR=0.45,95%CI:0.32~0.63)比非急性冠脉综合征患者更大[180]。未发现有关肝病、肾病和糖尿病患者接种流感疫苗效果的系统综述。仅有1项韩国肝硬化患者接种流感疫苗的RCT,估计在该人群中对确诊流感的预防效力为76%(95%CI:18%~93%),但对ILI的预防效果无显著性[199]。
WHO对两项HIV感染者中的RCT研究汇总分析,发现接种流感疫苗对预防确诊流感的效力为75%(95%CI:9%~96%)[200, 201, 202]。一项评估血液系统恶性肿瘤患者中流感疫苗效果的系统综述,纳入了2个低质量RCT,Meta分析显示对流感病毒感染的预防效果为44%(95%CI:28%~56%),对肺炎和住院的预防效果分别为61%(95%CI:22%~81%)和83%(95%CI:69%~91%)[190]。
7. 医务人员:医务人员多数是健康成人,所以流感疫苗在医务人员中的免疫原性、效力和效果可参考健康成人。根据健康成人中的研究结果,TIV在医务人员中的免疫原性也应良好。
2011年一项医务人员流感疫苗效果研究的系统综述认为,流感疫苗直接减少医务人员实验室确诊流感感染的证据有限[203]。医务人员中以实验室确诊流感为观察结局的高质量RCT仅有1项1999年发表的研究,发现流感疫苗在医务人员中预防确诊流感的血清学效力为88%(95%CI:59%~96%)[204]。还有两项RCT和一项队列研究报告了医务人员接种流感疫苗后的其他结局,包括ILI发病数、ILI症状持续天数和呼吸道感染导致的缺勤,但研究中的随机化、分组隐匿、盲法、ILI定义等多个环节可能存在问题,且均未进行任何流感实验室检测,因此研究结果可能受到偏倚影响[205, 206, 207]。我国有两项相关队列研究[208, 209],认为医务人员接种流感疫苗可减少缺勤、ILI和呼吸系统疾病的发生和就诊,降低心脑血管疾病和糖尿病的就诊率,但研究中未采用盲法措施和未进行流感实验室检测。其中,2004年北京市朝阳、宣武区医务人员的队列研究估计,接种流感疫苗后3~6个月内,对ILI和呼吸系统疾病保护率为17.3%,相对减少了29.9%的相关就诊;对心脑血管疾病和糖尿病的保护率为67.1%,相对减少了75.5%的相关就诊[209]。2006年在北京市宣武区开展的另一项医务人员队列研究估计,接种疫苗后3个月内,流感疫苗对ILI的保护率为39.5%;接种组和对照组ILI患者平均病程有显著差别,接种组为1.7 d,对照组为3.0 d[208]。
医务人员罹患流感,一方面可能导致院内流行而直接感染患者,另一方面医务人员出勤不足可影响医疗系统运转。因此,医务人员接种流感疫苗的重要作用在于减少患者的流感相关疾病,对此我国尚无相关研究报道。国外开展了若干RCT和队列研究[210, 211, 212, 213, 214, 215, 216],但研究中存在未采用盲法、统计效力低、未考虑失访或病例选择偏倚等问题,偏倚风险均较大。Cochrane系统综述对相关RCT进行的Meta分析发现[210, 211, 212, 213, 217],医务人员接种流感疫苗对长期医疗护理机构中老年患者的血清学确诊流感(OR=0.86,95%CI:0.44~1.68)、肺炎发病(OR=0.71,95%CI:0.29~1.71)和肺炎死亡(OR=0.87,95%CI:0.47~1.64)缺少预防效力,但可显著降低其ILI发病(RR=0.71,95%CI:0.58~0.88)、 ILI就诊(OR=0.48,95%CI:0.33~0.69)和全死因死亡率(OR=0.68,95%CI:0.55~0.84)。此外有模型分析显示,在长期医疗护理机构或普通医院中,医务人员流感疫苗接种人数与患者流感感染例数有线性关系,且不存在群体免疫阈值,当医务人员接种比例由0%提高到100%时,最多可预防患者中约60%的流感感染[218, 219]。
(四)TIV的安全性:一般认为TIV是安全的,但注射部位一过性局部反应也很常见(>1%);既往无流感疫苗抗原暴露史的受种者(如幼儿)可出现发热、全身不适、肌痛及其他全身性不良事件[2]。通常情况下,此类不良事件较少在成人中发生[220]。
疑似预防接种异常反应(adverse events following immunization,AEFI)系在预防接种过程中或接种后发生可能造成受种者机体组织器官功能损害,且怀疑与预防接种有关的反应或事件。我国AEFI监测系统自2005年开始试点监测,2008年覆盖到全国。2005-2012年的8年间,共计收到季节性流感疫苗(包括裂解、全病毒及亚单位疫苗)相关不良事件报告7 095例[221, 222, 223, 224, 225, 226]。自2010年对收到的不良事件进行分类,2010-2012年共计收到不良事件报告5 092例,其中严重AEFI 98例,非严重AEFI 4 994例[224, 225, 226]。
1. 儿童:我国目前针对儿童流感疫苗接种后的安全性研究多为上市前后的RCT。研究发现,国产和进口流感疫苗相比,安全性的差异无统计学意义,主要表现为局部反应(接种部位红晕、肿胀、硬结、疼痛、烧灼感等)和全身反应(发热、头痛、头晕、嗜睡、乏力、肌痛、周身不适、恶心、呕吐、腹痛、腹泻等),且程度均较轻微,极少出现重度反应[227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239]。国外研究发现,接种灭活流感疫苗后的高热惊厥常见于低龄儿童,当儿童同时接受肺炎链球菌结合疫苗时风险更高,但>4岁儿童中未发现此风险增高[96]。
2. 成年人:我国目前针对成年人流感疫苗接种后的安全性研究也多为上市前后的RCT。常见反应多为接种局部的红、肿、热、痛等局部反应以及一过性的发热、头痛、肌痛等全身反应[143, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241]。美国针 对成年人的安慰剂对照研究以及美国疾病预防控制中心疫苗不良事件报告系统分析表明,成年人接种灭活流感疫苗后最常见的不良事件是接种部位的疼痛、发热、肌痛及头痛[242, 243]。
3. 孕妇和新生儿:国外大量数据表明,孕妇接种流感疫苗后不会对孕妇的妊娠结局及胎儿造成危害[244, 245, 246, 247, 248, 249, 250, 251]。江苏省一项前瞻性队列研究[纳入122名接种A(H1N1)pdm09单价疫苗的孕妇,104名未接种任何疫苗的孕妇为对照] 发现,接种组的AEFI发生率为3.3%,两组孕妇的自然流产、过期妊娠等发生率的差异无统计学意义,两组孕妇的所有新生儿均健康(Apgar评分≥7)[252]。由于国内孕妇季节性流感疫苗接种率极低,迄今尚无系统的关于孕妇接种流感疫苗后针对孕妇和及其新生儿的安全性报道。
4. 慢性疾病患者:2000年9-11月美国一项包含1 952例哮喘儿童和成人的盲法随机交叉研究显示,流感疫苗接种后2周内,任何年龄组均无增加哮喘加重率的报告[253]。1999年10-12月美国一项前瞻性队列研究发现,≥65岁或18~64岁患有一种或以上慢性病的住院患者不良事件发生率与门诊患者相似[254]。国内有限的研究表明,尽管接种流感疫苗组相对于未接种组,出现不良反应,但发生率较低(约为5%~16%),且通常轻微短暂[195, 255, 256]。
5. 免疫功能低下人群:接种流感疫苗对HIV感染人群的安全性数据有限,但还无证据表明其对HIV感染或免疫能力具有重要临床意义[96]。关于其他免疫功能低下人群的数据也相对有限。研究表明,在肾、心或肝脏移植的受体中,接种疫苗并不影响移植脏器的功能也不导致排异反应[257, 258, 259, 260]。但国内尚缺乏此类人群的安全性数据。
6. 速发型超敏反应:个别人可能对流感疫苗成分过敏,引起速发型超敏反应。全身性过敏反应表现包括但不限于全身性荨麻疹,喘鸣,口腔、舌和咽喉水肿,呼吸困难,呕吐,血压下降,意识水平减退以及休克,也可存在一些轻微症状,如眼结膜充血或声音嘶哑[261, 262]。但罕见全身性过敏反应[263, 264]。根据香港地区报道大约为每接种100万剂,出现0.9例速发型超敏反应[265]。
7. 眼部及呼吸道症状(ocular and respiratory symptoms,ORS):ORS是一种由灭活流感疫苗引起的急性、自限性反应,突出表现为眼部和呼吸道症状,在2000-2001流行季节首次由加拿大报道。ORS原始病例定义为接种灭活流感疫苗后2~24 h内出现一种或多种症状 ,如眼红、咳嗽、喘鸣、胸闷、呼吸困难、咽痛或颜面水肿,且症状可在随后48 h内缓解[266]。ORS仅与加拿大2000-2001年流感流行季节使用的疫苗密切相关[267],改善相关生产工艺后,加拿大ORS发病率大幅下降[268],且症状更为轻微,且24 h内缓解,通常无需治疗[269]。但一些安慰剂随机对照研究显示,接种流感疫苗后观察到的ORS通常属于耦合反应并与疫苗接种无相关性[96]。
8. 格林巴利综合征(Guillain-Barré syndrome,GBS):据报道,具有GBS病史的人群比无类似病史的人群更易再患GBS[270]。因此,曾有GBS病史的人群在接种流感疫苗后发生GBS的可能性预期高于无该病史人群。关于接种灭活流感疫苗与GBS发病之间的相关性,不同研究结果间有差异,部分研究提示接种灭活流感疫苗可导致GBS发病率增加[271, 272];但也有研究表明,接种流感疫苗后GBS的发病风险并未显著升高[273, 274, 275, 276, 277, 278];甚至个别研究提示,接种流感疫苗与GBS发病率降低有关[279]。基于部分流感疫苗接种与GBS存在相关的研究结果,GBS的预计风险较低,大约为每接种100万人群额外出现1例GBS病例[271, 276]。作为预防措施,曾在接种流感疫苗后6周内出现GBS的人群不建议接种,可考虑替代使用抗流感病毒药物[96]。
未发现国内有关接种TIV后发生GBS的报道,但2009年9月至2010年3月我国共计接种了8 960万剂A(H1N1)pdm09单价疫苗,共接到8 067例不良事件报告。其中6 552例被判定为疫苗相关不良反应;1 083例为罕见或严重不良事件(包括1 050例过敏反应);共发生11例GBS,发生率仅为0.1/100万剂,远低于2008-2010年我国GBS的基线发病率(1.9/100万名成年人至2.7/100万名成年人)[280]。
9. 硫柳汞:硫柳汞是一种含汞的抗菌化合物,使用在灭活流感疫苗的制备中,以降低细菌生长的可能性。尽管越来越多证据表明接种含有硫柳汞的疫苗并不增加发生不良事件的风险[281, 282, 283, 284, 285, 286, 287, 288, 289, 290],但国外部分公共卫生机构还是建议,应采取措施以杜绝或减少疫苗制剂中的硫柳汞,作为从各个方面减少汞暴露的策略之一[281, 282]。我国现行的药典对于单剂量制剂疫苗中硫柳汞的含量有明确限制(≤100 μg/ml),但尚未完全禁止使用。目前国内的进口流感疫苗均不含硫柳汞,约半数国产流感疫苗仍含有硫柳汞,但均符合国家药典的要求。
10. 与其他疫苗联合接种的安全性:原则上,灭活疫苗不会干扰机体对其他灭活疫苗或减毒活疫苗 的免疫反应。目前对于流感疫苗与其他减毒活疫苗联合接种的证据非常有限。对于≥50岁人群,带状疱疹疫苗与TIV同时接种或间隔4周序贯接种的安全性和免疫原性相似[96]。对于所有推荐接种肺炎球菌多糖疫苗与TIV的人群,同时接种在诱导出保护性抗体反应的同时,不会增加不良反应发生概率和程度;无细胞百白破疫苗与TIV也可以在成年人中同时接种[291]。
(五)流感疫苗接种的卫生经济学评价:接种流感疫苗能有效减少流感相关门急诊、住院和死亡人数,继而降低治疗费用,产生明显的经济效益。此外,接种流感疫苗的经济效益还包括减少发病而降低误工所致的生产力损失。
最新一篇总结全球51项流感疫苗接种卫生经济学评价的系统综述[292],发现其中22项研究(分别有12、8和2项研究评估儿童、老年人和孕妇接种流感疫苗的成本效果)认为接种流感疫苗可节省成本(即从社会角度考虑,接种流感疫苗人群与不接种相比,其费用成本更低);13项研究的成本效果<1万美元或成本效益比接近1(WHO推荐的成本效果评价标准:当成本效果比小于所在国家人均GDP时,认为干预措施极具有成本效果;当成本效果比为1~3倍人均GDP时,认为干预措施具有成本效果;当成本效果比>3倍人均GDP时,干预措施不具有成本效果);13项研究的成本效果为1万美元至5万美元或者成本效益比<6;3项研究的成本效果>5万美元。绝大部分研究认为儿童接种流感疫苗可节省成本或具有成本效果,在老年人和孕妇中接种流感疫苗具有较好的成本效果。
上述系统综述中51项接种流感疫苗的卫生经济学评价均源自高收入和中等收入国家或地区[292],我国类似研究较少。其中香港特区一项研究显示,若对社区≥65岁老年人接种流感疫苗,当接种率达到90%时,其社会净效益可达37.8亿港元;若对10-12月间因其他疾病(除外感冒或发热)就医的老年人进行机会性接种,当65~74岁和≥75岁就诊人群的接种率分别为62%和76%时,接种流感疫苗的社会净效益为30.1亿港元[293]。该地区另一项研究显示,若每年对长期在疗养院居住的≥65岁老年人接种流感疫苗,与不接种者相比具有较好成本效果,在节省成本(成本减少334元/人)的情况下获得更好的健康收益(增加0.058质量调整生命年/人),效益成本比达到6.39[294]。
2000-2001年台北市一项基于人群的前瞻性队列研究显示[295],当地226 997名≥65岁老年人中35.6%接种了流感疫苗,使该人群流感和肺炎相关住院下降15%,流感相关死亡较未接种人群下降29%;接种人群与未接种人群相比,每挽救一个生命年和避免一例死亡的增量成本效果比(接种人群与未接种人群的总成本之差/接种人群与未接种人群的生命年或死亡人数之差)分别为309美元和3 899美元。与该人群开展的其他健康干预项目相比(如肿瘤筛查,其增量成本效果超过2万美元),表明接种流感疫苗具有很好的成本效果。台湾地区另一项研究显示,如2002年该地区34 112名20~64岁肿瘤患者流感疫苗接种率为57%时,与不接种流感疫苗相比,可减少110例流感相关死亡、391例流感相关住院、159例急诊和563例门诊病例,产生2 230万美元的社会净效益[296]。
五、2014-2015年度接种建议
目前,在我国季节性流感疫苗属于二类疫苗,公民自费、自愿接种。部分地区(如广东省珠海、浙江省宁波和江苏省苏州等地)将流感疫苗纳入医疗或社会保险的报销范围,个别地区(如北京市、新疆维吾尔自治区克拉玛依市等)通过政府财政补助实施了特定人群免费接种政策。为提高公众对流感危害及疫苗作用的认识,逐步提高高危人群的疫苗覆盖率,各级疾病预防控制中心要积极组织开展宣传和健康教育活动、人员培训,在组织指导疫苗接种时,应重点把握好剂型选择、优先接种人群、接种程序、禁忌症和接种时机等技术环节。由于疫苗产品说明书的批准要基于临床试验结果,其更新需一定周期,如产品说明书的适用人群、接种剂次、禁忌症等事项与本指南内容不一致,建议接种时参考产品说明书。
(一)抗原组分及适用年龄组:WHO推荐的2014-2015年度北半球三价流感疫苗组分为:A/California/7/2009(H1N1)类似株、A/Texas/50/2012(H3N2)类似株和B/Massachusetts/2/2012(Yamagata系)类似株。WHO推荐的四价流感疫苗组分包含B型毒株的2个系,为上述3个毒株及B/Brisbane/60/2008(Victoria系)类似株。
我国批准上市的流感疫苗均为TIV,可用于≥6月龄人群接种,包括0.25 ml和0.5 ml两种剂型。0.25 ml剂型含每种组分血凝素7.5 μg,适用于6~35月龄婴幼儿;0.5 ml剂型含每种组分血凝素15.0 μg,适用于≥36月龄的人群。
(二)建议优先接种人群:流感疫苗安全、有效。原则上,接种单位应为≥6月龄所有愿意接种疫苗 且无禁忌症者提供免疫服务。国内外大量流感疾病负担的科学证据表明,不同人群患流感后的临床严重程度和结局不同,借鉴WHO立场和其他国家多年的应用经验,结合我国国情,推荐以下人群为优先接种对象:
1. 孕妇:在妊娠任何阶段,孕妇均应接种流感疫苗。该建议基于以下证据:孕妇罹患严重流感的风险高,在整个孕期接种流感疫苗均为安全,可有效预防孕妇及婴儿罹患流感,而流感在<6月龄婴儿的疾病负担也非常高,且现有疫苗不可直接给<6月龄婴儿接种预防流感。
2. <6月龄婴儿的家庭成员和看护人员:由于现有流感疫苗不可以直接给<6月龄婴儿接种,该人群可通过母亲孕期接种和对婴儿的家庭成员和看护人员接种流感疫苗预防流感。
3. 6~23月龄婴幼儿:该年龄儿童患流感后出现重症的风险高,流感住院负担重,应优先接种流感疫苗。疫苗在该年龄组的效果高度依赖于疫苗株与循环毒株的匹配程度。
4. 2~5岁儿童:该年龄组儿童流感疾病负担也较高,但低于<2岁儿童。该年龄组儿童接种流感疫苗后,其免疫应答通常优于<2岁儿童。
5. ≥60岁老年人:该年龄人群患流感后死亡风险最高,是流感疫苗接种的重要目标人群。虽然较多证据表明,现有流感疫苗在老年人中的效果不如成年人,但疫苗接种仍是目前保护老年人免于罹患流感的最有效手段。
6. 特定慢性病患者:心血管疾病(单纯高血压除外)、慢性呼吸系统疾病、肝肾功能不全、血液病、神经系统疾病、神经肌肉功能障碍、代谢性疾病(包括糖尿病)等慢性病患者及患免疫抑制疾病或免疫功能低下者,患重症流感的风险很高,应优先接种流感疫苗。
7. 医务人员:是流感疫苗接种的重要优先人群,不仅可保护其自身,维持流感流行季节医疗服务的正常运转,同时也可有效减少将病毒传给流感高危人群的机会。
(三) 接种剂次:
1. 6月龄至8岁儿童:研究证实,从未接种过流感疫苗的6月龄至8岁儿童,首次接种需2剂次(间隔≥4周)才能达到有效保护。因此,首次接种流感疫苗的6月龄至8岁儿童应接种2剂次,间隔≥4周;2013-2014年度或以前接种过1剂次或以上流感疫苗的儿童,则建议接种1剂。
2. >8岁儿童和成人:仅需接种1剂。
(四)接种时机:通常接种流感疫苗2~4周后,可产生具有保护水平的抗体,6~8个月后抗体滴度开始衰减。我国各地每年流感活动高峰出现和持续时间不同,为保证受种者在流感高发季节前获得免疫保护,建议各地在疫苗可及后尽快安排接种,整个流行季节均可以为未接种的对象提供免疫服务。
孕妇在孕期的任一阶段均可接种流感疫苗,建议只要本年度的流感疫苗开始供应,应尽早安排孕妇接种。
(五)接种部位及方法:TIV应肌肉或深度皮下注射。成人和大年龄儿童首选上臂三角肌接种疫苗,婴幼儿和小龄儿童的接种部位以大腿前外侧为最佳。因为血小板减少症或其他出血性疾病患者在肌肉注射时可能发生出血危险,应采用皮下注射。
(六)禁忌症:对鸡蛋或对疫苗中任一成分过敏者不宜接种流感疫苗。伴或不伴发热症状的轻中度急性疾病者,建议症状消退后再接种。上次接种流感疫苗后6周内出现GBS者,不作为禁忌症,但应特别注意。具体产品的禁忌症,应参考产品说明书和医生的建议。
(七)与其他疫苗的联合接种:灭活流感疫苗与其他灭活疫苗及减毒活疫苗可同时在不同部位接种,或者间隔时间接种,未发现可影响流感疫苗和联合接种疫苗的免疫原性和安全性。
(八)部分地区的特殊接种政策:目前我国个别地区通过政府财政补助实施了特定人群的免费接种政策。如北京市自2007年开始,免费为≥60岁老年人和中小学生接种流感疫苗;新疆维吾尔自治区克拉玛依市自2008年开始免费为≥60岁老年人和3~7岁儿童接种;辽宁省2013年在抚顺、锦州、铁岭市的8个县区实施了≥65岁老年人免费接种的试点项目。还有部分地区将流感疫苗纳入医疗保险、社会保险或新型农村合作医疗的报销范围,如陕西省西安、广东省珠海、浙江省宁波和江苏省苏州等地。
(九)流感疫苗预防接种服务实施:
1. 接种条件:有接种流感疫苗意愿的接种对象,应到当地卫生行政部门指定并向大众公布、具有疫苗接种资质的接种点接种流感疫苗。接种门诊的接种流程建议如下:
(1)登记处:严格掌握并筛选流感疫苗接种的适用年龄和禁忌症,儿童需查验儿童接种证,告知接种对象疫苗接种后可能出现的不良反应和注意事项,并要求接种对象签署《流感疫苗接种知情同意书》。
(2)接种室:由接种医生实施流感疫苗安全接种。
(3)观察室:接种后留下观察30 min。
2. 接种注意事项:
(1)接种医生在疫苗接种时严格执行“三查七对”制度。
(2)使用本疫苗时应充分摇匀,如出现摇不散的沉淀、异物,疫苗曾经冻结,疫苗瓶有裂纹或标签不清者,均不得使用。
(3)疫苗应于2~8 ℃冰箱或冷藏箱保存和运输,严禁冻结。接种前从冷藏容器内取出。冷藏容器内冰排溶化后应及时更换。
(4)接种时用75%的乙醇由内向外螺旋式对接种部位皮肤消毒,涂擦直径≥5 cm,待晾干后立即接种。
(5)应在接种点、接种室/台设置醒目的流感疫苗接种标识。
(6)注射现场应备有1 ∶ 1 000肾上腺素等药品和其他抢救设施,以备偶有发生严重过敏反应时供急救使用。
(7)接种后注射器等相关废弃物应按规定及时回收并销毁。
(8)接种完成后应告知接种对象留下观察30 min再离开。回家后注意休息,注意观察接种后反应。向接种对象公布接种点咨询电话,有任何不适随时咨询报告。
3. 接种记录:接种完成后,如接种对象为儿童,接种医生应将疫苗名称、剂量、批号、生产厂家、接种时间、接种单位、接种医生签名记录在儿童接种证上,对于其他自费或免费接种者需要按照相关要求采集上报受种者信息,并登记造册。接种者信息和流感疫苗接种汇总数据需在规定时间内上报《免疫规划信息管理系统》。
4. 不良反应监测与评估:为保障流感疫苗的安全接种,各级疾病预防控制机构和接种单位要做好流感疫苗AEFI监测。一旦出现不良反应或事件应及时启动AEFI监测系统,并按照《全国疑似预防接种异常反应监测方案》要求,开展AEFI的监测报告、调查诊断、处置等工作。接种单位在获知由于流感疫苗接种后出现疑似不良反应后,需尽快报告属地疾病预防控制机构。AEFI报告流程:
(1)在获知受种者异常反应发生后24 h内上报AEFI报告卡。
(2)除明确诊断的一般反应以外的AEFI,均要求在上报之后48 h内开展调查,并在调查开始的3 d内上报个案调查表。
(3)报告内容要明确包括主要临床经过,尤其是接种与症状发生的时间间隔,同时收集相关临床及预防接种资料等。
(4)发现怀疑与接种有关的死亡、严重残疾、群体性疑似预防接种异常反应、对社会有重大影响的疑似预防接种异常反应时,应在发现后2 h上报。
(5)将填写完成的报告卡及个案调查表上报属地疾病预防控制机构,并电话通知其主管部门。
属地疾病预防控制机构接到AEFI报告后,应立即组织专业人员组成疑似预防接种不良反应调查诊断专家小组进行调查、分析,尽快给出初步结论,并撰写调查报告。对结论出现异议时,需要上报接种单位所在地的市级医学会进行鉴定,做出最终结论。在判定预防接种异常反应时,以下情形不属于预防接种异常反应:①因疫苗本身特性引起的接种后一般反应;②因疫苗质量不合格给受种者造成的损害;③因接种单位违反预防接种工作规范、免疫程序、疫苗使用指导原则及接种方案给受种者造成的损害;④受种者在接种时正处于某种疾病的潜伏期或者前驱期,接种后耦合发病;⑤受种者有疫苗说明书规定的接种禁忌,在接种前受种者或者其监护人未如实提供受种者的健康状况和接种禁忌等,接种后受种者原有疾病急性复发或者病情加重;⑥因心理因素发生的个体或者群体的心因性反应。
处理AEFI病例时,接种单位要搜集并整理好临床就诊的各种资料,同时备好流感疫苗接种的相关资料,以备上级组织的AEFI调查诊断专家组使用。需要强调的是临床医疗和接种单位的任何个人不具有AEFI诊断的资格。
(本指南于2014年10月24日由中国疾病预防控制中心通过正式文件印发)
| [1] World Health Organization. Influenza[EB/OL]. http://www.who.int/immunization/topics/influenza/en/index.html,2008. |
| [2] World Health Organization. Vaccines against influenza WHO position paper-November 2012[J]. Wkly Epidemiol Rec,2012,87(47):461-476. |
| [3] Ministry of Health of the People's Republic of China. Diagnosis and treatment guideline on influenza(2011)[Z]. Beijing:Ministry of Health of the People's Republic of China,2011. (in Chinese) 中华人民共和国卫生部. 流行性感冒诊断与治疗指南(2011)[Z]. 北京:中华人民共和国卫生部,2011. |
| [4] Centers for Disease Control and Prevention. Types of influenza viruses[EB/OL]. Flu[2014-08-19] http://www.cdc.gov/flu/about/viruses/types.htm,2014. |
| [5] Drake JW. Rates of spontaneous mutation among RNA viruses[J]. Proc Natl Acad Sci USA,1993,90(9):4171-4175. |
| [6] Hay AJ,Gregory V,Douglas AR,et al. The evolution of human influenza viruses[J]. Philos Trans R Soc Lond B Biol Sci,2001,356(1416):1861-1870. |
| [7] Cox NJ,Subbarao K. Influenza[J]. Lancet,1999,354(9186):1277-1282. |
| [8] Koelle K,Cobey S,Grenfell B,et al. Epochal evolution shapes the phylodynamics of interpandemic influenza A (H3N2) in humans[J]. Science,2006,314(5807):1898-1903. |
| [9] Wolf YI, Viboud C, Holmes EC,et al. Long intervals of stasis punctuated by bursts of positive selection in the seasonal evolution of influenza A virus[J]. Biol Direct,2006,1:34. |
| [10] Cox NJ,Subbarao K. Global epidemiology of influenza:past and present[J]. Annu Rev Med,2000,51:407-421. |
| [11] Glezen WP. Emerging infections:pandemic influenza[J]. Epidemiol Rev,1996,18(1):64-76. |
| [12] World Health Organization. Characteristics of the emergent influenza A (H1N1) viruses and recommendations for vaccine development[EB/OL]. http://www.who.int/csr/resources/publications/swineflu/H1N1Vaccinevirusrecommendation26May2009.pdf,2009. |
| [13] Lynch JP 3rd,Walsh EE. Influenza:evolving strategies in treatment and prevention[J]. Semin Respir Crit Care Med,2007,28(2):144-158. |
| [14] Matsuzaki Y,Ikeda T,Abiko C,et al. Detection and quantification of influenza C virus in pediatric respiratory specimens by real- time PCR and comparison with infectious viral counts[J]. J Clin Virol,2012,54(2):130-134. |
| [15] Bell D, Nicoll A, Fukuda K, et al. Non-pharmaceutical interventions for pandemic influenza,international measures[J]. Emerg Infect Dis,2006,12(1):81-87. |
| [16] Bischoff WE,Swett K,Leng I,et al. Exposure to influenza virus aerosols during routine patient care[J]. J Infect Dis,2013,207(7):1037-1046. |
| [17] Lau LL,Ip DK,Nishiura H,et al. Heterogeneity in viral shedding among individuals with medically attended influenza A virus infection[J]. J Infect Dis,2013,207(8):1281-1285. |
| [18] Carrat F,Vergu E,Ferguson NM,et al. Time lines of infection and disease in human influenza:a review of volunteer challenge studies[J]. Am J Epidemiol,2008,167(7):775-785. |
| [19] World Health Organization. WHO surveillance case definitions for ILI and SARI[EB/OL]. Available from:http://www.who.int/influenza/surveillance_monitoring/ili_sari_surveillance_case_ definition/en/,2014. |
| [20] Navarro-Mari JM, Perez-Ruiz M, Cantudo-Munoz P,et al. Influenza-like illness criteria were poorly related to laboratory- confirmed influenza in a sentinel surveillance study[J]. J Clin Epidemiol,2005,58(3):275-279. |
| [21] Michiels B,Thomas I,van Royen P,et al. Clinical prediction rules combining signs,symptoms and epidemiological context to distinguish influenza from influenza-like illnesses in primary care:a cross sectional study[J]. BMC Fam Pract,2011,12:4. |
| [22] Hayward AC,Fragaszy EB,Bermingham A,et al. Comparative community burden and severity of seasonal and pandemic influenza:results of the Flu Watch Cohort Study[J]. Lancet Respir Med,2014,2(6):445-454. |
| [23] Peiris JS, Hui KP,Yen HL. Host response to influenza virus:protection versus immunopathology[J]. Curr Opin Immunol,2010,22(4):475-481. |
| [24] Centers for Disease Control and Prevention. Guidance for Clinicians on the Use of Rapid Influenza Diagnostic Tests[EB/OL]. http://www.cdc.gov/flu/pdf/professionals/diagnosis/clinician_ guidance_ridt.pdf,2013. |
| [25] World Health Organization. WHO Global Influenza Surveillance Network,Manual for the laboratory diagnosis and virological surveillance of influenza[M]. Malta:WHO Press,2011. |
| [26] World Health Organization. Recommended composition of influenza virus vaccines for use in the 2014-2015 northern hemisphere influenza season[J]. Wkly Epidemiol Rec,2014,89(10):93-104. |
| [27] World Health Organization. Global Influenza Surveillance and Response System (GISRS) [EB/OL]. http://www.who.int/influenza/gisrs_laboratory/en/,2014. |
| [28] Recommended composition of influenza virus vaccines for use in the 2004-2005 influenza season[J]. Wkly Epidemiol Rec,2004,79(9):88-92. |
| [29] Centers for Disease Control and Prevention. Antigenic Characterization[EB/OL]. http://www.cdc.gov/flu/professionals/laboratory/antigenic.htm,2014. |
| [30] Barr IG,Russell C,Besselaar TG,et al. WHO recommendations for the viruses used in the 2013-2014 Northern Hemisphere influenza vaccine:epidemiology,antigenic and genetic characteristics of influenza A(H1N1)pdm09,A(H3N2) and B influenza viruses collected from October 2012 to January 2013[J]. Vaccine,2014,32(37):4713-4725. |
| [31] Tricco AC,Chit A,Soobiah C,et al. Comparing influenza vaccine efficacy against mismatched and matched strains:a systematic review and meta-analysis[J]. BMC Med,2013,11:153. |
| [32] Recommended composition of influenza virus vaccines for use in the 2008-2009 influenza season[J]. Wkly Epidemiol Rec,2008,83(9):81-87. |
| [33] Lipsitch M,Viboud C. Influenza seasonality:lifting the fog[J]. Proc Natl Acad Sci USA,2009,106(10):3645-3646. |
| [34] Viboud C,Alonso WJ,Simonsen L. Influenza in tropical regions[J]. PLoS Med,2006,3(4):e89. |
| [35] Azziz Baumgartner E,Dao CN,Nasreen S,et al. Seasonality,timing,and climate drivers of influenza activity worldwide[J]. J Infect Dis,2012,206(6):838-846. |
| [36] Bloom-Feshbach K, Alonso WJ,Charu V,et al. Latitudinal variations in seasonal activity of influenza and respiratory syncytial virus (RSV):a global comparative review[J]. PLoS One,2013,8(2):e54445. |
| [37] Zou J,Yang H,Cui H,et al. Geographic divisions and modeling of virological data on seasonal influenza in the Chinese mainland during the 2006-2009 monitoring years[J]. PLoS One,2013,8(3):e58434. |
| [38] Yu H, Alonso WJ, Feng L,et al. Characterization of regional influenza seasonality patterns in China and implications for vaccination strategies:spatio-temporal modelling of surveillance data[J]. PLoS Med,2013,10(11):e1001552. |
| [39] Yu H,Huang J,Huai Y,et al. The substantial hospitalization burden of influenza in central China:surveillance for severe,acute respiratory infection,and influenza viruses,2010-2012[J]. Influenza Other Respir Viruses,2014,8(1):53-65. |
| [40] Wong CM,Yang L,Chan KP,et al. Influenza-associated hospitalization in a subtropical city[J]. PLoS Med,2006,3(4):e121. |
| [41] Feng L,Shay DK,Jiang Y,et al. Influenza-associated mortality in temperate and subtropical Chinese cities,2003-2008[J]. Bull WHO,2012,90(4):279B-288B. |
| [42] Yu H,Feng L,Viboud CG,et al. Regional variation in mortality impact of the 2009 A(H1N1) influenza pandemic in China[J]. Influenza Other Respir Viruses,2013,7(6):1350-1360. |
| [43] Neuzil KM,Reed GW,Mitchel EF, et al. Impact of influenza on acute cardiopulmonary hospitalizations in pregnant women[J]. Am J Epidemiol,1998,148(11):1094-1102. |
| [44] Cox S,Posner SF,McPheeters M, et al. Influenza and pregnant women:hospitalization burden,United States,1998-2002[J]. J Womens Health (Larchmt),2006,15(8):891-893. |
| [45] Hartert TV,Neuzil KM,Shintani AK,et al. Maternal morbidity and perinatal outcomes among pregnant women with respiratory hospitalizations during influenza season[J]. Am J Obstet Gynecol,2003,189(6):1705-1712. |
| [46] Dodds L,McNeil SA,Fell DB,et al. Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women[J]. CMAJ,2007,176(4):463-468. |
| [47] Callaghan WM,Chu SY,Jamieson DJ. Deaths from seasonal influenza among pregnant women in the United States,1998-2005[J]. Obstet Gynecol,2010,115(5):919-923. |
| [48] Siston AM,Rasmussen SA, Honein MA,et al. Pandemic 2009 influenza A(H1N1) virus illness among pregnant women in the United States[J]. JAMA,2010,303(15):1517-1525. |
| [49] Ailes EC,Newsome K,Williams JL,et al. CDC pregnancy flu line:monitoring severe illness among pregnant women with influenza[J]. Matern Child Health J,2014,18(7):1578-1582. |
| [50] Yu H,Feng Z,Uyeki TM,et al. Risk factors for severe illness with 2009 pandemic influenza A (H1N1) virus infection in China[J]. Clin Infect Dis,2011,52(4):457-465. |
| [51] Jamieson DJ, Honein MA, Rasmussen SA,et al. H1N1 2009 influenza virus infection during pregnancy in the USA[J]. Lancet,2009,374(9688):451-458. |
| [52] Zhang P,Li X,Cao B,et al. Clinical features and risk factors for severe and critical pregnant women with 2009 pandemic H1N1 influenza infection in China[J]. BMC Infect Dis,2012,12:29. |
| [53] Luteijn JM, Brown MJ,Dolk H. Influenza and congenital anomalies:a systematic review and meta-analysis[J]. Hum Reprod,2014,29(4):809-823. |
| [54] Steinhoff MC,MacDonald N,Pfeifer D,et al. Influenza vaccine in pregnancy:policy and research strategies[J]. Lancet,2014,383(9929):1611-1613. |
| [55] Parboosing R,Bao Y,Shen L,et al. Gestational influenza and bipolar disorder in adult offspring[J]. JAMA Psychiatry,2013,70(7):677-685. |
| [56] Webster RG,Monto AS,Braciale TJ,et al. Textbook of influenza[M]. Hoboken:Wiley-Blackwell,2013. |
| [57] Sauerbrei A,Schmidt-Ott R,Hoyer H,et al. Seroprevalence of influenza A and B in German infants and adolescents[J]. Med Microbiol Immunol,2009,198(2):93-101. |
| [58] Monto AS,Koopman JS,Longini IM Jr. Tecumseh study of illness. ⅩⅢ. Influenza infection and disease,1976-1981[J]. Am J Epidemiol,1985,121(6):811-822. |
| [59] Cowling BJ,Perera RA,Fang VJ,et al. Incidence of influenza virus infections in children in Hong Kong in a three year randomised placebo-controlled vaccine study,2009-12[J]. Clin Infect Dis,2014. |
| [60] Cowling BJ,Chan KH,Fang VJ,et al. Comparative epidemiology of pandemic and seasonal influenza A in households[J]. N Engl J Med,2010,362(23):2175-2184. |
| [61] Klick B,Nishiura H,Ng S,et al. Transmissibility of seasonal and pandemic influenza in a cohort of households in Hong Kong in 2009[J]. Epidemiology,2011,22(6):793-796. |
| [62] Poehling KA, Edwards KM, Weinberg GA, et al. The underrecognized burden of influenza in young children[J]. N Engl J Med,2006,355(1):31-40. |
| [63] Guo R,Zheng H,Huang L,et al. Epidemiologic and economic burden of influenza in the outpatient setting:a prospective study in a subtropical area of China[J]. PLoS One,2012,7(7):e41403. |
| [64] Chan PK,Chan MC,Cheung JL, et al. Influenza B lineage circulation and hospitalization rates in a subtropical city,Hong Kong,2000-2010[J]. Clin Infect Dis,2013,56(5):677-684. |
| [65] Chiu SS,Chan KH,Chen H,et al. Virologically confirmed population-based burden of hospitalization caused by influenza A and B among children in Hong Kong[J]. Clin Infect Dis,2009,49(7):1016-1021. |
| [66] Chiu SS,Lau YL,Chan KH,et al. Influenza-related hospitalizations among children in Hong Kong[J]. N Engl J Med,2002,347(26):2097-2103. |
| [67] Nelson EA,Ip M,Tam JS,et al. Burden of influenza infection in hospitalised children below 6 months of age and above in Hong Kong from 2005 to 2011[J]. Vaccine,2014. [Epub ahead of print]. |
| [68] Neuzil KM, Hohlbein C, Zhu Y. Illness among schoolchildren during influenza season:effect on school absenteeism,parental absenteeism from work,and secondary illness in families[J]. Arch Pediatr Adolesc Med,2002,156(10):986-991. |
| [69] Chiu SS, Chan KH, So LY,et al. The population based socioeconomic burden of pediatric influenza-associated hospitalization in Hong Kong[J]. Vaccine,2012,30(10):1895-1900. |
| [70] Wang D, Zhang T, Wu J,et al. Socio-economic burden of influenza among children younger than 5 years in the outpatient setting in Suzhou,China[J]. PLoS One,2013,8(8):e69035. |
| [71] Feng L,Li Z,Zhao S,et al. Viral etiologies of hospitalized acute lower respiratory infection patients in China,2009-2013[J]. PLoS One,2014,9(6):e99419. |
| [72] Ju X,Fang Q,Zhang J,et al. Viral etiology of influenza-like illnesses in Huizhou,China,from 2011 to 2013[J]. Arch Virol,2014,159(8):2003-2010. |
| [73] Li H,Wei Q,Tan A,et al. Epidemiological analysis of respiratory viral etiology for influenza-like illness during 2010 in Zhuhai,China[J]. Virol J,2013,10:143. |
| [74] Wang X,Cheng X,Ma H,et al. Influenza surveillance in Shenzhen,the largest migratory metropolitan city of China,2006-2009[J]. Epidemiol Infect,2011,139(10):1551-1559. |
| [75] Wang W, Cavailler P, Ren P, et al. Molecular monitoring of causative viruses in child acute respiratory infection in endemo- epidemic situations in Shanghai[J]. J Clin Virol,2010,49(3):211-218. |
| [76] He Y,Lin G,Wang Q,et al. A 3-year prospective study of the epidemiology of acute respiratory viral infections in hospitalized children in Shenzhen,China[J]. Influenza Other Respir Viruses,2014,8(4):443-451. |
| [77] Chen Z,Zhu Y,Wang Y,et al. Association of meteorological factors with childhood viral acute respiratory infections in subtropical China:an analysis over 11 years[J]. Arch Virol,2014,159(4):631-639. |
| [78] Wu Z,Li Y,Gu J,et al. Detection of viruses and atypical bacteria associated with acute respiratory infection of children in Hubei,China[J]. Respirology,2014,19(2):218-224. |
| [79] Wei M,Yan Z,Wang C,et al. Eight-hospital based influenza like illness surveillance from April,2009 to March,2011 in China[J]. Influenza Other Respir Viruses,2013,7(6):997-998. |
| [80] Ji W,Zhang T,Zhang X,et al. The epidemiology of hospitalized influenza in children,a two year population-based study in the People's Republic of China[J]. BMC Health Serv Res,2010,10:82. |
| [81] Zhang H,Li Z,Zhang G,et al. Respiratory viruses in hospitalized children with acute lower respiratory tract infections in harbin,China[J]. Jpn J Infect Dis,2009,62(6):458-460. |
| [82] Wu P,Goldstein E,Ho LM,et al. Excess mortality associated with influenza A and B virus in Hong Kong,1998-2009[J]. J Infect Dis,2012,206(12):1862-1871. |
| [83] Hardelid P,Pebody R,Andrews N. Mortality caused by influenza and respiratory syncytial virus by age group in England and Wales 1999-2010[J]. Influenza Other Respir Viruses,2013,7(1):35-45. |
| [84] Wang H,Fu C,Li K,et al. Influenza associated mortality in Southern China,2010-2012[J]. Vaccine,2014,32(8):973-978. |
| [85] Yang L,Ma S,Chen P,et al. Influenza associated mortality in the subtropics and tropics:results from three Asian cities[J]. Vaccine,2011,29(48):8909-8914. |
| [86] Chow A,Ma S,Ling AE,et al. Influenza-associated deaths in tropical Singapore[J]. Emerg Infect Dis,2006,12(1):114-121. |
| [87] Nunes B,Viboud C,Machado A,et al. Excess mortality associated with influenza epidemics in Portugal,1980 to 2004[J]. PLoS One,2011,6(6):e20661. |
| [88] Thompson WW,Shay DK,Weintraub E,et al. Mortality associated with influenza and respiratory syncytial virus in the United States[J]. JAMA,2003,289(2):179-186. |
| [89] Centers for Disease Control Prevention. Estimates of deaths associated with seasonal influenza-United States,1976-2007[J]. MMWR Morb Mortal Wkly Rep,2010,59(33):1057-1062. |
| [90] Barker WH,Mullooly JP. Impact of epidemic type A influenza in a defined adult population[J]. Am J Epidemiol,1980,112(6):798-811. |
| [91] Burette P,Bouuaert C,Melin P,et al. Influenza outbreak in a well-vaccinated nursing home population in Belgium[J]. Acta Clin Belg,2009,64(4):324-328. |
| [92] Camilloni B,Neri M,Lepri E,et al. An influenza B outbreak during the 2007/2008 winter among appropriately immunized elderly people living in a nursing home[J]. Vaccine,2010,28(47):7536-7541. |
| [93] Iorio AM,Neri M,Lepri E,et al. An influenza A/H3 outbreak during the 2004/2005 winter in elderly vaccinated people living in a nursing home[J]. Vaccine,2006,24(44/46):6615-6619. |
| [94] Ferson MJ,Morgan K,Robertson PW,et al. Concurrent summer influenza and pertussis outbreaks in a nursing home in Sydney,Australia[J]. Infect Control Hosp Epidemiol,2004,25(11):962-966. |
| [95] Gaillat J,Dennetiere G,Raffin-Bru E,et al. Summer influenza outbreak in a home for the elderly:application of preventive measures[J]. J Hosp Infect,2008,70(3):272-277. |
| [96] Centers for Disease Control Prevention. Prevention and control of seasonal influenza with vaccines. Recommendations of the advisory committee on immunization practices-United States,2013-2014[J]. MMWR Recomm Rep,2013,62(RR-07):1-43. |
| [97] Cromer D,van Hoek AJ,Jit M,et al. The burden of influenza in England by age and clinical risk group:a statistical analysis to inform vaccine policy[J]. J Infect,2014,68(4):363-371. |
| [98] Hong KW,Cheong HJ,Choi WS,et al. Clinical courses and outcomes of hospitalized adult patients with seasonal influenza in Korea,2011-2012:Hospital-based Influenza Morbidity & Mortality (HIMM) surveillance[J]. J Infect Chemother,2014,20(1):9-14. |
| [99] Tai Y,Lee TC,Chang HL,et al. Epidemiology and outcomes of hospitalization of influenza in the cancer population in Taiwan[J]. J Cancer Res Clin Oncol,2009,135(8):1061-1066. |
| [100] Kuster SP, Shah PS,Coleman BL,et al. Incidence of influenza in healthy adults and healthcare workers:a systematic review and meta-analysis[J]. PLoS One,2011,6(10):e26239. |
| [101] Salgado CD,Farr BM,Hall KK,et al. Influenza in the acute hospital setting[J]. Lancet Infect Dis,2002,2(3):145-155. |
| [102] Balkhy HH,El-Saed A,Sallah M. Epidemiology of H1N1 (2009) influenza among healthcare workers in a tertiary care center in Saudi Arabia:a 6-month surveillance study[J]. Infect Control Hosp Epidemiol,2010,31(10):1004-1010. |
| [103] Chen MI,Lee VJ,Barr I,et al. Risk factors for pandemic (H1N1) 2009 virus seroconversion among hospital staff,Singapore[J]. Emerg Infect Dis,2010,16(10):1554-1561. |
| [104] MacIntyre CR,Wang Q,Cauchemez S,et al. A cluster randomized clinical trial comparing fit-tested and non-fit-tested N95 respirators to medical masks to prevent respiratory virus infection in health care workers[J]. Influenza Other Respir Viruses,2011,5(3):170-179. |
| [105] Chan AL,Shie HJ, Lee YJ,et al. The evaluation of free influenza vaccination in health care workers in a medical center in Taiwan[J]. Pharm World Sci,2008,30(1):39-43. |
| [106] Chan SS. Does vaccinating ED health care workers against influenza reduce sickness absenteeism?[J]. Am J Emerg Med,2007,25(7):808-811. |
| [107] Kumar S,Fan J,Melzer-Lange M,et al. H1N1 hemagglutinin- inhibition seroprevalence in Emergency Department Health Care workers after the first wave of the 2009 influenza pandemic[J]. Pediatr Emerg Care,2011,27(9):804-807. |
| [108] Elder AG,O'Donnell B, McCruden EA,et al. Incidence and recall of influenza in a cohort of glasgow healthcare workers during the 1993-4 epidemic:results of serum testing and questionnaire[J]. BMJ,1996,313(7067):1241-1242. |
| [109] Srinivasan A, Perl TM. Respiratory protection against influenza[J]. JAMA,2009,302(17):1903-1904. |
| [110] Chen J,Li YT,Gu BK,et al. Estimation of the direct cost of treating people aged more than 60 years infected by influenza virus in Shanghai[J]. Asia Pac J Public Health,2012. [Epub ahead of print]. |
| [111] Zhang T,Zhu Q,Zhang X,et al. The clinical characteristics and direct medical cost of influenza in hospitalized children:a five-year retrospective study in Suzhou,China[J]. PLoS One,2012,7(9):e44391. |
| [112] Zhou L,Situ S,Huang T,et al. Direct medical cost of influenza- related hospitalizations among severe acute respiratory infections cases in three provinces in China[J]. PLoS One,2013,8(5):e63788. |
| [113] Hannoun C. The evolving history of influenza viruses and influenza vaccines[J]. Expert Rev Vaccines,2013,12(9):1085-1094. |
| [114] Francis T. The development of the 1943 vaccination study of the commision on influenza[J]. Am J Hyg,1945,42:1-11. |
| [115] Cate TR, Couch RB, Kasel JA, et al. Clinical trials of monovalent influenza A/New Jersey/76 virus vaccines in adults:reactogenicity,antibody response,and antibody persistence[J]. J Infect Dis,1977,136 Suppl:S450-455. |
| [116] Cate TR,Couch RB,Parker D,et al. Reactogenicity,immunogenicity,and antibody persistence in adults given inactivated influenza virus vaccines-1978[J]. Rev Infect Dis,1983,5(4):737-747. |
| [117] Quinnan GV,Schooley R,Dolin R,et al. Serologic responses and systemic reactions in adults after vaccination with monovalent A/USSR/77 and trivalent A/USSR/77,A/Texas/77,B/Hong Kong/72 influenza vaccines[J]. Rev Infect Dis,1983,5(4):748-757. |
| [118] Wright PF,Thompson J,Vaughn WK,et al. Trials of influenza A/New Jersey/76 virus vaccine in normal children:an overview of age-related antigenicity and reactogenicity[J]. J Infect Dis,1977,136 Suppl:S731-741. |
| [119] Wright PF, Cherry JD,Foy HM, et al. Antigenicity and reactogenicity of influenza A/USSR/77 virus vaccine in children—a multicentered evaluation of dosage and safety[J]. Rev Infect Dis,1983,5(4):758-764. |
| [120] Kilbourne ED, Smith C, Brett I, et al. The total influenza vaccine failure of 1947 revisited:major intrasubtypic antigenic change can explain failure of vaccine in a post-World War Ⅱepidemic[J]. Proc Natl Acad Sci USA,2002,99(16):10748-10752. |
| [121] Meyer HM Jr,Hopps HE,Parkman PD, et al. Review of existing vaccines for influenza[J]. Am J Clin Pathol,1978,70(1 Suppl):146-152. |
| [122] Recommended composition of influenza virus vaccines for use in the 2003 influenza season[J]. Wkly Epidemiol Rec,2002,77(41):344-348. |
| [123] Recommended composition of influenza virus vaccines for use in the 2002-2003 season[J]. Wkly Epidemiol Rec,2002,77(8):62-66. |
| [124] Arnou R,Icardi G,De Decker M,et al. Intradermal influenza vaccine for older adults:a randomized controlled multicenter phase Ⅲ study[J]. Vaccine,2009,27(52):7304-7312. |
| [125] Leroux-Roels I,Vets E, Freese R, et al. Seasonal influenza vaccine delivered by intradermal microinjection:a randomised controlled safety and immunogenicity trial in adults[J]. Vaccine,2008,26(51):6614-6619. |
| [126] van Damme P, Arnou R, Kafeja F,et al. Evaluation of non- inferiority of intradermal versus adjuvanted seasonal influenza vaccine using two serological techniques:a randomised comparative study[J]. BMC Infect Dis,2010,10:134. |
| [127] Morelon E, Pouteil Noble C,Daoud S,et al. Immunogenicity and safety of intradermal influenza vaccination in renal transplant patients who were non-responders to conventional influenza vaccination[J]. Vaccine,2010,28(42):6885-6890. |
| [128] DiazGranados CA,Dunning AJ, Jordanov E,et al. High-dose trivalent influenza vaccine compared to standard dose vaccine in elderly adults:safety,immunogenicity and relative efficacy during the 2009-2010 season[J]. Vaccine,2013,31(6):861-866. |
| [129] Robertson CA, Greenberg DP, Decker MD. Safety and Immunogenicity Comparison of 2011-2012 High-Dose and Standard Intramuscular Influenza Vaccines in Older Adults[Z]. 2012. |
| [130] Sanofi Pasteur Inc. Data on file (Annual release study GRC50)[Z]. 2009. |
| [131] European Agency for the Evaluation of Medicinal Products. Guideline on dossier structure and content for pandemic influenza vaccine marketing authorisation application(CPMP/VEG/4717/03)[EB/OL]. http://www.emea.europa.eu/pdfs/human/vwp/471703enfin.pdf,2004-4. |
| [132] US Food and Drug Administration. Guidance for Industry:clinical data needed to support the licensure of pandemic influenza vaccines[EB/OL]. http://www.fdagov/cber/gdlns/panfluvac.htm,2007. |
| [133] Cox RJ,Brokstad KA,Zuckerman MA,et al. An early humoral immune response in peripheral blood following parenteral inactivated influenza vaccination[J]. Vaccine,1994,12(11):993-999. |
| [134] Brokstad KA,Cox RJ,Olofsson J,et al. Parenteral influenza vaccination induces a rapid systemic and local immune response[J]. J Infect Dis,1995,171(1):198-203. |
| [135] Jameson J,Cruz J, Ennis FA. Human cytotoxic T-lymphocyte repertoire to influenza A viruses[J]. J Virol,1998,72(11):8682-8689. |
| [136] Nichol KL. Heterogeneity of influenza case definitions and implications for interpreting and comparing study results[J]. Vaccine,2006,24(44-46):6726-6728. |
| [137] Ferdinands JM,Shay DK. Magnitude of potential biases in a simulated case-control study of the effectiveness of influenza vaccination[J]. Clin Infect Dis,2012,54(1):25-32. |
| [138] Zhao YW, Feng ZJ. The Meta analysis on the safety and immunogenicity of domestic and imported split influenza virus vaccines[J]. Chin J Vacc Immun,2009,15(1):19-26. (in Chinese) 赵艳伟,冯子健. 国产与进口流行性感冒病毒裂解疫苗安全性和免疫原性的Meta分析[J]. 中国疫苗和免疫,2009,15(1):19-26. |
| [139] Ren JP, Shen JH, Chen WH, et al. Meta analysis on the immunogenicity of domestic influenza virus vaccines[J]. Chin J Cell Molecul Immunol,2013,29(9):981-985. (in Chinese)任江萍,沈金花,陈文花,等. 国产流行性感冒病毒疫苗免疫原性研究的meta分析[J]. 细胞与分子免疫学杂志,2013,29(9):981-985. |
| [140] Osterholm MT, Kelley NS, Sommer A, et al. Efficacy and effectiveness of influenza vaccines:a systematic review and meta-analysis[J]. Lancet Infect Dis,2012,12(1):36-44. |
| [141] Jefferson T,Di Pietrantonj C,Rivetti A,et al. Vaccines for preventing influenza in healthy adults[J]. Cochrane Database Syst Rev,2014,3:CD001269. |
| [142] Xing Y,Liu M. Meta analysis on the effectiveness of inactivated influenza vaccine[J]. Chin J Epidemiol,2009,30(4):368-370. (in Chinese).星一,刘民. 流感灭活疫苗在中国应用效果的Meta分析[J]. 中华流行病学杂志,2009,30(4):368-370. |
| [143] Xu TQ, Li YT, Wu HY, et al. Observation on safety and immunogenicity of inactivated influenza vaccine[J]. Shanghai J Prev Med,2000,12(9):432-434. (in Chinese) 徐天强,李燕婷,吴寰宇,等. 流感疫苗安全性和免疫效果观察[J]. 上海预防医学杂志,2000,12(9):432-434. |
| [144] Steinhoff MC, Omer SB,Roy E,et al. Influenza immunization in pregnancy—antibody responses in mothers and infants[J]. N Engl J Med,2010,362(17):1644-1646. |
| [145] Zaman K,Roy E,Arifeen SE,et al. Effectiveness of maternal influenza immunization in mothers and infants[J]. N Engl J Med,2008,359(15):1555-1564. |
| [146] Madhi SA,Cutland CL,Kuwanda L,et al. Influenza vaccination of pregnant women and protection of their infants[J]. N Engl J Med,2014,371(10):918-931. |
| [147] Eick AA, Uyeki TM, Klimov A, et al. Maternal influenza vaccination and effect on influenza virus infection in young infants[J]. Arch Pediatr Adolesc Med,2011,165(2):104-111. |
| [148] Black SB,Shinefield HR, France EK, et al. Effectiveness of influenza vaccine during pregnancy in preventing hospitalizations and outpatient visits for respiratory illness in pregnant women and their infants[J]. Am J Perinatol,2004,21(6):333-639. |
| [149] France EK,Smith-Ray R,McClure D,et al. Impact of maternal influenza vaccination during pregnancy on the incidence of acute respiratory illness visits among infants[J]. Arch Pediatr Adolesc Med,2006,160(12):1277-1283. |
| [150] Neuzil KM, Jackson LA,Nelson J,et al. Immunogenicity and reactogenicity of 1 versus 2 doses of trivalent inactivated influenza vaccine in vaccine-naive 5-8-year-old children[J]. J Infect Dis,2006,194(8):1032-1039. |
| [151] Vesikari T,Knuf M, Wutzler P, et al. Oil-in-water emulsion adjuvant with influenza vaccine in young children[J]. N Engl J Med,2011,365(15):1406-1416. |
| [152] Clover RD,Crawford S, Glezen WP, et al. Comparison of heterotypic protection against influenza A/Taiwan/86 (H1N1) by attenuated and inactivated vaccines to A/Chile/83-like viruses[J]. J Infect Dis,1991,163(2):300-304. |
| [153] Neuzil KM,Dupont WD,Wright PF,et al. Efficacy of inactivated and cold-adapted vaccines against influenza A infection,1985 to 1990:the pediatric experience[J]. Pediatr Infect Dis J,2001,20(8):733-740. |
| [154] Hoberman A,Greenberg DP,Paradise JL,et al. Effectiveness of inactivated influenza vaccine in preventing acute otitis media in young children:a randomized controlled trial[J]. JAMA,2003,290(12):1608-1616. |
| [155] Fu C,He Q,Li Z,et al. Seasonal influenza vaccine effectiveness among children,2010-2012[J]. Influenza Other Respir Viruses,2013,7(6):1168-1174. |
| [156] Yang Z,Dong Z, Fu C. Seasonal influenza vaccine effectiveness among children aged 6 to 59 months in southern China[J]. PLoS One,2012,7(1):e30424. |
| [157] Zangwill KM, Belshe RB. Safety and efficacy of trivalent inactivated influenza vaccine in young children:a summary for the new era of routine vaccination[J]. Pediatr Infect Dis J,2004,23(3):189-197. |
| [158] Groothuis JR,Lehr MV,Levin MJ. Safety and immunogenicity of a purified haemagglutinin antigen in very young high-risk children[J]. Vaccine,1994,12(2):139-141. |
| [159] Park CL,Frank AL,Sullivan M,et al. Influenza vaccination of children during acute asthma exacerbation and concurrent prednisone therapy[J]. Pediatrics,1996,98(2 Pt 1):196-200. |
| [160] Wang J,Dai FQ, Liu M. Clinical effect and economic performance of influenza vaccine among elementary school students[J]. Chin J Epidemiol,2001,22(6):447. (in Chinese) 王君,戴富强,刘敏. 流行性感冒疫苗在小学生中临床效果及经济效益评估[J]. 中华流行病学杂志,2001,22(6):447. |
| [161] Pannaraj PS,Wang HL,Rivas H,et al. School-located influenza vaccination decreases laboratory-confirmed influenza and improves school attendance[J]. Clin Infect Dis,2014,59(3):325-332. |
| [162] King JC Jr, Stoddard JJ, Gaglani MJ, et al. Effectiveness of school-based influenza vaccination[J]. N Engl J Med,2006,355(24):2523-2532. |
| [163] Kjos SA,Irving SA,Meece JK, et al. Elementary school-based influenza vaccination:evaluating impact on respiratory illness absenteeism and laboratory-confirmed influenza[J]. PLoS One,2013,8(8):e72243. |
| [164] Reber AJ, Chirkova T,Kim JH, et al. Immunosenescence and challenges of vaccination against influenza in the aging population[J]. Aging Dis,2012,3(1):68-90. |
| [165] Goodwin K, Viboud C, Simonsen L. Antibody response to influenza vaccination in the elderly:a quantitative review[J]. Vaccine,2006,24(8):1159-1169. |
| [166] Govaert TM, Thijs CT, Masurel N, et al. The efficacy of influenza vaccination in elderly individuals. a randomized double- blind placebo-controlled trial[J]. JAMA,1994,272(21):1661-1665. |
| [167] Monto AS,Hornbuckle K,Ohmit SE. Influenza vaccine effectiveness among elderly nursing home residents:a cohort study[J]. Am J Epidemiol,2001,154(2):155-160. |
| [168] Ohmit SE,Arden NH, Monto AS. Effectiveness of inactivated influenza vaccine among nursing home residents during an influenza type A (H3N2) epidemic[J]. J Am Geriatr Soc,1999,47(2):165-171. |
| [169] Libow LS,Neufeld RR,Olson E,et al. Sequential outbreak of influenza A and B in a nursing home:efficacy of vaccine and amantadine[J]. J Am Geriatr Soc,1996,44(10):1153-1157. |
| [170] Coles FB,Balzano GJ,and Morse DL. An outbreak of influenza A (H3N2) in a well immunized nursing home population[J]. J Am Geriatr Soc,1992,40(6):589-592. |
| [171] Gross PA,Hermogenes AW, Sacks HS, et al. The efficacy of influenza vaccine in elderly persons. A meta-analysis and review of the literature[J]. Ann Intern Med,1995,123(7):518-527. |
| [172] Nichol KL,Nordin JD,Nelson DB,et al. Effectiveness of influenza vaccine in the community-dwelling elderly[J]. N Engl J Med,2007,357(14):1373-1381. |
| [173] Fine AD, Bridges CB, De Guzman AM, et al. Influenza A among patients with human immunodeficiency virus:an outbreak of infection at a residential facility in New York city[J]. Clin Infect Dis,2001,32(12):1784-1791. |
| [174] Kroon FP,van Dissel JT,de Jong JC,et al. Antibody response after influenza vaccination in HIV-infected individuals:a consecutive 3-year study[J]. Vaccine,2000,18(26):3040- 3049. |
| [175] Staprans SI,Hamilton BL,Follansbee SE, et al. Activation of virus replication after vaccination of HIV-1-infected individuals[J]. J Exp Med,1995,182(6):1727-1737. |
| [176] de Lavallade H,Garland P,Sekine T,et al. Repeated vaccination is required to optimize seroprotection against H1N1 in the immunocompromised host[J]. Haematologica,2011,96(2):307-314. |
| [177] Meier S, Bel M, L'Huillier A, et al. Antibody responses to natural influenza A/H1N1/09 disease or following immunization with adjuvanted vaccines,in immunocompetent and immunocompromised children[J]. Vaccine,2011,29(19):3548-3557. |
| [178] Palma P,Romiti ML,Bernardi S,et al. Safety and immunogenicity of a monovalent MF59(R)-adjuvanted A/H1N1 vaccine in HIV- infected children and young adults[J]. Biologicals,2012,40(2):134-139. |
| [179] Michiels B,Govaerts F,Remmen R,et al. A systematic review of the evidence on the effectiveness and risks of inactivated influenza vaccines in different target groups[J]. Vaccine,2011,29(49):9159-9170. |
| [180] Udell JA,Zawi R,Bhatt DL,et al. Association between influenza vaccination and cardiovascular outcomes in high-risk patients:a meta-analysis[J]. JAMA,2013,310(16):1711-1720. |
| [181] Anema A,Mills E,Montaner J,et al. Efficacy of influenza vaccination in HIV-positive patients:a systematic review and meta-analysis[J]. HIV Med,2008,9(1):57-61. |
| [182] Atashili J, Kalilani L, Adimora AA. Efficacy and clinical effectiveness of influenza vaccines in HIV-infected individuals:a meta-analysis[J]. BMC Infect Dis,2006,6:138. |
| [183] Cates CJ,Rowe BH. Vaccines for preventing influenza in people with asthma[J]. Cochrane Database Syst Rev,2013,2:CD000364. |
| [184] Goossen GM, Kremer LC, van de Wetering MD. Influenza vaccination in children being treated with chemotherapy for cancer[J]. Cochrane Database Syst Rev,2013,8:CD006484. |
| [185] Keller T,Weeda VB,van Dongen CJ,et al. Influenza vaccines for preventing coronary heart disease[J]. Cochrane Database Syst Rev,2008(3):CD005050. |
| [186] Poole PJ,Chacko E,Wood-Baker RW,et al. Influenza vaccine for patients with chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev,2006(1):CD002733. |
| [187] Eliakim-Raz N,Vinograd I,Zalmanovici TA,et al. Influenza vaccines in immunosuppressed adults with cancer[J]. Cochrane Database Syst Rev,2013,10:CD008983. |
| [188] Mastalerz-Migas A, Gwiazda E, Brydak LB. Effectiveness of influenza vaccine in patients on hemodialysis-a review[J]. Med Sci Monit,2013,19:1013-1018. |
| [189] Dharmaraj P, Smyth RL. Vaccines for preventing influenza in people with cystic fibrosis[J]. Cochrane Database Syst Rev,2014,3:CD001753. |
| [190] Cheuk DK,Chiang AK,Lee TL,et al. Vaccines for prophylaxis of viral infections in patients with hematological malignancies[J]. Cochrane Database Syst Rev,2011(3):CD006505. |
| [191] Howells CH,Tyler LE. Prophylactic use of influenza vaccine in patients with chronic bronchitis. A pilot trial[J]. Lancet,1961,2(7218):1428-1432. |
| [192] Wongsurakiat P,Maranetra KN,Wasi C,et al. Acute respiratory illness in patients with COPD and the effectiveness of influenza vaccination:a randomized controlled study[J]. Chest,2004,125(6):2011-2020. |
| [193] Huang YD, Zhao XP, Wan T, et al. Effects of influenza vaccination in chronic obstructive pulmonary disease[J]. Hainan Med J,2011,22(4):29-31. (in Chinese) 黄远东,赵晓平,万涛,等. 慢性阻塞性肺病人群流感疫苗接种的效果观察[J]. 海南医学,2011,22(4):29-31. |
| [194] Wang XY. Efficacy of two vaccination in patients at stable status with chronic obstructive pulmonary diseases in Xining area:an observational study[J]. Qinghai Med J,2010,40(7):75-76. (in Chinese) 王学英. 西宁地区慢性阻塞性肺病患者稳定期接种2种疫苗的效果观察[J]. 青海医药杂志,2010,40(7):75-76. |
| [195] Zhang QY. The effectiveness of seasonal influenza and pneumococcal vaccination in the prevention of COPD exacerbations:an observational study[J]. Zhejiang J Integrat Tradit Chin West Med,2014(7):597-599. (in Chinese) 章琴莺. 流感疫苗和肺炎球菌疫苗预防COPD急性发作疗效观察[J]. 浙江中西医结合杂志,2014(7):597-599. |
| [196] Gao ZC,Li JT,Zhan S. Preventive and curative effects of Card Shu Ning combined with influenza vaccine on senile chronic bronchitis complicated with acute infection[J]. Chin J Biol,2011,24(10):1214-1216. (in Chinese) 高忠翠,李江涛,展胜. 卡舒宁联合流感疫苗对老年性慢性支气管炎合并急性感染的防治效果[J]. 中国生物制品学杂志,2011,24(10):1214-1216. |
| [197] World Health Organization. Grading of scientific evidence (asthma) [EB/OL]. http://www.who.int/immunization/position_ papers/influenza_grad_efficacy_asthma.pdf?ua=1,2012. |
| [198] Bueving HJ,Bernsen RM, de Jongste JC, et al. Influenza vaccination in children with asthma:randomized double-blind placebo-controlled trial[J]. Am J Respir Crit Care Med,2004,169(4):488-493. |
| [199] Song JY,Cheong HJ,Ha SH,et al. Clinical impact of influenza immunization in patients with liver cirrhosis[J]. J Clin Virol,2007,39(3):159-163. |
| [200] World Health Organization. Grading of scientific evidence (HIV positive individuals)[EB/OL]. http://www.who.int/immunization/ position_papers/influenza_grad_efficacy_HIV.pdf?ua=1,2012. |
| [201] Madhi SA, Maskew M, Koen A,et al. Trivalent inactivated influenza vaccine in African adults infected with human immunodeficient virus:double blind,randomized clinical trial of efficacy,immunogenicity,and safety[J]. Clin Infect Dis,2011,52(1):128-137. |
| [202] Tasker SA,Treanor JJ, Paxton WB,et al. Efficacy of influenza vaccination in HIV-infected persons. A randomized,double- blind,placebo-controlled trial[J]. Ann Intern Med,1999,131(6):430-433. |
| [203] Ng AN,Lai CK. Effectiveness of seasonal influenza vaccination in healthcare workers:a systematic review[J]. J Hosp Infect,2011,79(4):279-286. |
| [204] Wilde JA,McMillan JA, Serwint J, et al. Effectiveness of influenza vaccine in health care professionals:a randomized trial[J]. JAMA,1999,281(10):908-913. |
| [205] Saxen H, Virtanen M. Randomized, placebo-controlled double blind study on the efficacy of influenza immunization on absenteeism of health care workers[J]. Pediatr Infect Dis J,1999,18(9):779-783. |
| [206] Weingarten S, Riedinger M, Bolton LB, et al. Barriers to influenza vaccine acceptance. A survey of physicians and nurses[J]. Am J Infect Control,1989,17(4):202-207. |
| [207] Kheok SW,Chong CY, McCarthy G,et al. The efficacy of influenza vaccination in healthcare workers in a tropical setting:a prospective investigator blinded observational study[J]. Ann Acad Med Singapore,2008,37(6):465-469. |
| [208] Wu CF,Zheng XX, Sun F,et al. Effect analysis of influenza vaccination among medical staff[J]. Chin J Pract Nurs,2008,24(17):57-59. (in Chinese) 吴承菊,郑修霞,孙菲,等. 医务人员接种流感疫苗的效果分析[J]. 中国实用护理杂志,2008,24(17):57-59. |
| [209] Liu M,Liu GF, Zhao W, et al. An effect and cost-benefit analysis of influenza vaccine among the healthcare worker[J]. Chin Gen Pract,2006,9(9):708-711. (in Chinese) 刘民,刘改芬,赵伟,等. 医务人员接种流感疫苗的效果及效益研究[J]. 中国全科医学,2006,9(9):708-711. |
| [210] Carman WF,Elder AG,Wallace LA,et al. Effects of influenza vaccination of health-care workers on mortality of elderly people in long-term care:a randomised controlled trial[J]. Lancet,2000,355(9198):93-97. |
| [211] Hayward AC,Watson J. Effectiveness of influenza vaccination of staff on morbidity,and mortality of residents of long term care facilities for the elderly[J]. Vaccine,2011,29(13):2357-2358. |
| [212] Lemaitre M,Meret T, Rothan-Tondeur M, et al. Effect of influenza vaccination of nursing home staff on mortality of residents:a cluster-randomized trial[J]. J Am Geriatr Soc,2009,57(9):1580-1586. |
| [213] Potter J,Stott DJ,Roberts MA,et al. Influenza vaccination of health care workers in long-term-care hospitals reduces the mortality of elderly patients[J]. J Infect Dis,1997,175(1):1-6. |
| [214] Oshitani H,Saito R,Seki N, et al. Influenza vaccination levels and influenza-like illness in long-term-care facilities for elderly people in Niigata,Japan,during an influenza A (H3N2) epidemic[J]. Infect Control Hosp Epidemiol,2000,21(11):728-730. |
| [215] Shugarman LR,Hales C,Setodji CM,et al. The influence of staff and resident immunization rates on influenza-like illness outbreaks in nursing homes[J]. J Am Med Dir Assoc,2006,7(9):562-567. |
| [216] Stevenson CG,McArthur MA,Naus M,et al. Prevention of influenza and pneumococcal pneumonia in Canadian long-term care facilities:how are we doing?[J]. CMAJ,2001,164(10):1413-1419. |
| [217] Thomas RE,Jefferson T,Lasserson TJ. Influenza vaccination for healthcare workers who work with the elderly[J]. Cochrane Database Syst Rev,2010(2):CD005187. |
| [218] van den Dool C,Bonten MJ, Hak E,et al. The effects of influenza vaccination of health care workers in nursing homes:insights from a mathematical model[J]. PLoS Med,2008,5(10):e200. |
| [219] van den Dool C,Bonten MJ,Hak E,et al. Modeling the effects of influenza vaccination of health care workers in hospital departments[J]. Vaccine,2009,27(44):6261-6267. |
| [220] Fiore AE,Uyeki TM,Broder K,et al. Prevention and control of influenza with vaccines:recommendations of the Advisory Committee on Immunization Practices(ACIP),2010[J]. MMWR Recomm Rep,2010,59(RR-8):1-62. |
| [221] Wu WD,Liu DW,Wu BB, et al. Analysis on the surveillance of adverse events following immunization in China,2007-2008[J]. Chin J Vacc Immun,2009,15(6):481-490. (in Chinese) 武文娣,刘大卫,吴冰冰,等. 全国2007-2008年疑似预防接种异常反应监测分析[J]. 中国疫苗和免疫,2009,15(6):481-490. |
| [222] Wu WD, Liu DW, Li KL,et al. Analysis on adverse events following immunization surveillance in China,2009[J]. Chin J Vacc Immun,2011,17(2):99-108. (in Chinese) 武文娣,刘大卫,李克莉,等. 全国2009年疑似预防接种异常反应监测分析[J]. 中国疫苗和免疫,2011,17(2):99-108. |
| [223] Liu DW, Guo B, Cao LS,et al. Study on the surveillance of adverse events following immunization in China,2005-2006[J]. Chin J Vacc Immun,2007,13(6):505-513. (in Chinese) 刘大卫,郭飚,曹玲生,等. 全国2005-2006年疑似预防接种异常反应监测分析[J]. 中国计划免疫,2007,13(6):505-513. |
| [224] Wu WD,Liu DW,Li KL,et al. Analysis on surveillance data of adverse events following immunization in China,2012[J]. Chin J Vacc Immun,2014,20(1):1-12. (in Chinese) 武文娣,刘大卫,李克莉,等. 中国2012年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2014,20(1):1-12. |
| [225] Wu WD,Liu DW, Li KL, et al. Analysis on adverse events following immunization surveillance in China,2010[J]. Chin J Vacc Immun,2012,18(5):385-397. (in Chinese) 武文娣,刘大卫,李克莉,等. 中国2010年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2012,18(5):385-397. |
| [226] Wu WD,Li KL,Zheng JS,et al. Analysis on surveillance data of adverse events following immunization in China,2011[J]. Chin J Vacc Immun,2013,19(2):97-109. (in Chinese) 武文娣,李克莉,郑景山,等. 中国2011年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫,2013,19(2):97-109. |
| [227] Chen YZ, Wu JF, Wang B, et al. Research on safety and immunogenicity of the domestic split influenza virus vaccine[J]. Chin J Dis Control Preve,2010,14(7):683-685. (in Chinese) 陈胤忠,吴巨飞,王标,等. 国产流行性感冒病毒裂解疫苗的安全性和免疫原性研究[J]. 中华疾病控制杂志,2010,14(7):683-685. |
| [228] Huang QX,Guo Q, Zhou HC. An evaluation on safety and immunogenicity of domestic trivalent split influenza vaccine[J]. Chin J Dis Control Prev,2010,14(4):324-326. (in Chinese)黄清霄,郭强,周宏超. 国产流感病毒裂解疫苗的免疫原性及安全性效果评价[J]. 中华疾病控制杂志,2010,14(4):324-326. |
| [229] Li YP, Li RC,Chen JT, et al. Research on safety and immunogenicity of trivalent split influenza vaccine[J]. Chin J Vacc Immun,2005,11(5):343-347. (in Chinese) 李艳萍,李荣成,陈江婷,等. 流行性感冒裂解疫苗安尔来福TM的安全性和免疫原性研究[J]. 中国计划免疫,2005,11(5):343-347. |
| [230] Liang Y,Zhang HY, Lu YL,et al. Investigation of influenza vaccine safety[J]. Adv Drug React J,2005,7(2):95-97. (in Chinese) 梁雁,张海燕,鲁云兰,等. 流感疫苗安全性的调查[J]. 药物不良反应杂志,2005,7(2):95-97. |
| [231] Liu ZH,Chang J,Zhang XJ,et al. Clinical safety investigation of split influenza virus vaccine[J]. J Community Med,2010,8(7):18. (in Chinese) 刘志华,常婕,张希军,等. 流行性感冒裂解疫苗临床安全性调查[J]. 社区医学杂志,2010,8(7):18. |
| [232] Wu JD,Fang HH,Tan WW,et al. Evaluation on safety and immunogenicity of inflexal berna subunit influenza virus vaccine[J]. Chin J Vacc Immun,2006,12(5):411-414. (in Chinese)吴俊东,方捍华,谭文文,等. 流行性感冒亚单位疫苗(类病毒体)临床安全性和免疫原性研究[J]. 中国计划免疫,2006,12(5):411-414. |
| [233] Zhang Y,Wu XF,Tian WL,et al. Safety and immunogenicity of domestic influenza virus subunit vaccine[J]. Chin J Biol,2012,25(8):1013-1016. (in Chinese) 张艳,吴徐锋,田文莉,等. 国产流感病毒亚单位疫苗的安全性及免疫原性[J]. 中国生物制品学杂志,2012,25(8):1013-1016. |
| [234] Zhang ZL,Guo XH,Kong M,et al. Evaluation on the safety and immunogenicity of inactivated influenza vaccine (VAXIGRIP)[J]. Chin J Vacc Immun,2001,7(2):79-81. (in Chinese) 张之伦,郭晓华,孔梅,等. 流行性感冒疫苗的安全性和免疫原性观察[J]. 中国计划免疫,2001,7(2):79-81. |
| [235] Zhu CL,Fang HH,Zhu FC,et al. Safety and immunogenicity of split vaccines of influenza viruses[J]. Chin J Exp Clin Virol,2004,18(3):207-209. (in Chinese) 朱昌林,方捍华,朱凤才,等. 流行性感冒病毒裂解疫苗的安全性和免疫原性研究[J]. 中华实验和临床病毒学杂志,2004,18(3):207-209. |
| [236] Li RC,Li YP,Fang HH, et al. Research on safety and immunogenicity of the domestic split influenza virus vaccine[J]. Guangxi J Prev Med,2005,11(5):298-301. (in Chinese) 李荣成,李艳萍,方捍华,等. 国产流行性感冒病毒裂解疫苗的安全性和免疫原性研究[J]. 广西预防医学,2005,11(5):298-301. |
| [237] Pan HX, Zhan YJ,Xu AL, et al. Evaluation of safety and immunogenicity of two defferent-type split influenza virus vaccines[J]. Jiangsu J Prev Med,2009,20(4):14-17. (in Chinese)潘红星,张艺飓,徐爱玲,等. 两种流行性感冒病毒裂解疫苗安全性与免疫原性研究[J]. 江苏预防医学,2009,20(4):14-17. |
| [238] Guo AH. The clinical evaluation on efficacy and safety of influenza vaccine [J]. Contemp Med,2013,19(33):162-163. (in Chinese) 郭爱华. 流感疫苗预防效果及安全性临床观察[J]. 当代医学,2013,19(33):162-163. |
| [239] Bian GL,Lin YX,Huang ML,et al. Evaluation on the safety and immunogenicity of domestic split influenza virus vaccine after inoculation[J]. Chin J Health Lab Technol,2012,22(8):1961-1963. (in Chinese) 边国林,林永兴,黄美林,等. 国产流感裂解疫苗接种人体后安全性和免疫原性评价[J]. 中国卫生检验杂志,2012,22(8):1961-1963. |
| [240] Ao R,Fang G,Ma QL,et al. Safety of domestic influenza split virion vaccine for adult use[J]. Chin J Biol,2014,27(6):825-828. (in Chinese) 敖睿,方刚,马千里,等. 国产成人流感裂解疫苗的安全性观察[J]. 中国生物制品学杂志,2014,27(6):825-828. |
| [241] Jiang FC,Lv SL, Jia XR, et al. Safety and immunogenicity of seasonal inactivated influenza vaccine(Split Virion)and cross-reactive antibody responses to the 2009 pandemic H1N1 influenza virus[J]. Chin J Vacc Immun,2011,17(2):143-146. (in Chinese) 姜法春,吕思禄,贾晓蓉,等. 季节性灭活流行性感冒病毒裂解疫苗安全性和免疫原性及与甲型H1N1流行性感冒病毒的交叉免疫反应研究[J]. 中国疫苗和免疫,2011,17(2):143-146. |
| [242] Hambidge SJ,Glanz JM,France EK,et al. Safety of trivalent inactivated influenza vaccine in children 6 to 23 months old[J]. JAMA,2006,296(16):1990-1997. |
| [243] Glanz JM,Newcomer SR,Hambidge SJ,et al. Safety of trivalent inactivated influenza vaccine in children aged 24 to 59 months in the vaccine safety datalink[J]. Arch Pediatr Adolesc Med,2011,165(8):749-755. |
| [244] Heinonen OP,Shapiro S,Monson RR,et al. Immunization during pregnancy against poliomyelitis and influenza in relation to childhood malignancy[J]. Int J Epidemiol,1973,2(3):229-235. |
| [245] Munoz FM, Greisinger AJ, Wehmanen OA, et al. Safety of influenza vaccination during pregnancy[J]. Am J Obstet Gynecol,2005,192(4):1098-1106. |
| [246] Irving SA,Kieke BA,Donahue JG,et al. Trivalent inactivated influenza vaccine and spontaneous abortion[J]. Obstet Gynecol,2013,121(1):159-165. |
| [247] Haberg SE,Trogstad L,Gunnes N,et al. Risk of fetal death after pandemic influenza virus infection or vaccination[J]. N Engl J Med,2013,368(4):333-340. |
| [248] Pool V, Iskander J. Safety of influenza vaccination during pregnancy[J]. Am J Obstet Gynecol,2006,194(4):1200-1201. |
| [249] Mak TK,Mangtani P,Leese J,et al. Influenza vaccination in pregnancy:current evidence and selected national policies[J]. Lancet Infect Dis,2008,8(1):44-52. |
| [250] Moro PL,Tepper NK, Grohskopf LA,et al. Safety of seasonal influenza and influenza A (H1N1) 2009 monovalent vaccines in pregnancy[J]. Expert Rev Vacc,2012,11(8):911-921. |
| [251] Munoz FM. Safety of influenza vaccines in pregnant women[J]. Am J Obstet Gynecol,2012,207(3 Suppl):S33-37. |
| [252] Ma F,Zhang L,Jiang R,et al. Prospective cohort study of the safety of an influenza A(H1N1) vaccine in pregnant Chinese women[J]. Clin Vacc Immunol,2014,21(9):1282-1287. |
| [253] The safety of inactivated influenza vaccine in adults and children with asthma[J]. N Engl J Med,2001,345(21):1529-1536. |
| [254] Berry BB,Ehlert DA,Battiola RJ,et al. Influenza vaccination is safe and immunogenic when administered to hospitalized patients[J]. Vaccine,2001,19(25/26):3493-3498. |
| [255] Yang Y, Huang JO. The effect of influenza vaccination in the elderly retired cadres aged over 75 of retired cadres[J]. Chin J Health Care Med,2011,13(1):58-59. (in Chinese) 杨媛,黄建鸥. 干休所75岁以上老年人接种流感疫苗效果观察[J]. 中华保健医学杂志,2011,13(1):58-59. |
| [256] Mao R, Chen Y. Observation on the intervention effect of influenza vaccination against chronic obstructive pulmonary disease among elderly patients[J]. Chin Prev Med,2012,13(7):524-526. (in Chinese) 茅蓉,陈莺. 流感疫苗对老年慢性阻塞性肺疾病患者干预效果观察[J]. 中国预防医学杂志,2012,13(7):524-526. |
| [257] Scharpe J,Evenepoel P,Maes B,et al. Influenza vaccination is efficacious and safe in renal transplant recipients[J]. Am J Transplant,2008,8(2):332-337. |
| [258] Edvardsson VO, Flynn JT, Deforest A, et al. Effective immunization against influenza in pediatric renal transplant recipients[J]. Clin Transplant,1996,10(6 Pt 1):556-560. |
| [259] Fraund S,Wagner D,Pethig K,et al. Influenza vaccination in heart transplant recipients[J]. J Heart Lung Transplant,1999,18(3):220-225. |
| [260] Lawal A,Basler C,Branch A,et al. Influenza vaccination in orthotopic liver transplant recipients:absence of post administration ALT elevation[J]. Am J Transplant,2004,4(11):1805-1809. |
| [261] Wood RA,Berger M, Dreskin SC, et al. An algorithm for treatment of patients with hypersensitivity reactions after vaccines[J]. Pediatrics,2008,122(3):e771-777. |
| [262] Ruggeberg JU,Gold MS,Bayas JM,et al. Anaphylaxis:case definition and guidelines for data collection,analysis,and presentation of immunization safety data[J]. Vaccine,2007,25(31):5675-5684. |
| [263] Vellozzi C,Burwen DR,Dobardzic A,et al. Safety of trivalent inactivated influenza vaccines in adults:background for pandemic influenza vaccine safety monitoring[J]. Vaccine,2009,27(15):2114-2120. |
| [264] Izurieta HS,Haber P,Wise RP,et al. Adverse events reported following live,cold-adapted,intranasal influenza vaccine[J]. JAMA,2005,294(21):2720-2725. |
| [265] Centre of Health Protection of Hong Kong. Scientific Committee on Vaccine Preventable Diseases. Recommendations on Seasonal Influenza Vaccination for the 2014/15 Season[Z]. Hong Kong,2014. |
| [266] National Advisory Committee on Immunization. An Advisory Committee Statement (ACS). National Advisory Committee on Immunization (NACI). Supplementary statement on influenza vaccination:continued use of fluviral influenza vaccine in the 2000-2001 season[J]. Can Commun Dis Rep,2001,27:1-3. |
| [267] Boulianne N,De Serres G,Duval B,et al. Clinical manifestations and incidence of oculo-respiratory syndrome following influenza vaccination—Quebec,2000[J]. Can Commun Dis Rep,2001,27(10):85-90. |
| [268] Oculo-respiratory syndrome following influenza vaccination:review of post-marketing surveillance through four influenza seasons in Canada[J]. Can Commun Dis Rep,2005,31(21):217-225. |
| [269] Scheifele DW,Duval B,Russell ML,et al. Ocular and respiratory symptoms attributable to inactivated split influenza vaccine:evidence from a controlled trial involving adults[J]. Clin Infect Dis,2003,36(7):850-857. |
| [270] Ropper AH. The Guillain-Barré syndrome[J]. N Engl J Med,1992,326(17):1130-1136. |
| [271] Haber P,DeStefano F,Angulo FJ,et al. Guillain-Barré syndrome following influenza vaccination[J]. JAMA,2004,292(20):2478-2481. |
| [272] Lasky T,Terracciano GJ,Magder L,et al. The Guillain-Barré syndrome and the 1992-1993 and 1993-1994 influenza vaccines[J]. N Engl J Med,1998,339(25):1797-1802. |
| [273] Hurwitz ES,Schonberger LB,Nelson DB,et al. Guillain-Barré syndrome and the 1978-1979 influenza vaccine[J]. N Engl J Med,1981,304(26):1557-1561. |
| [274] Kaplan JE,Katona P,Hurwitz ES,et al. Guillain-Barré syndrome in the United States,1979-1980 and 1980-1981. Lack of an association with influenza vaccination[J]. JAMA,1982,248(6):698-700. |
| [275] Chen R,Kent J,Rhodes P,et al. Investigations of a possible association between influenza vaccination and Guillain-Barré syndrome in the United States,1990-1991 [J]. Post Market Surveill,1992,6:5-6. |
| [276] Juurlink DN,Stukel TA,Kwong J,et al. Guillain-Barré syndrome after influenza vaccination in adults:a population-based study[J]. Arch Intern Med,2006,166(20):2217-2221. |
| [277] Hughes RA,Charlton J,Latinovic R,et al. No association between immunization and Guillain-Barré syndrome in the United Kingdom,1992 to 2000[J]. Arch Intern Med,2006,166(12):1301-1304. |
| [278] Stowe J,Andrews N,Wise L,et al. Investigation of the temporal association of Guillain-Barré syndrome with influenza vaccine and influenzalike illness using the United Kingdom General Practice Research Database[J]. Am J Epidemiol,2009,169(3):382-388. |
| [279] Tam CC,O'Brien SJ,Petersen I,et al. Guillain-Barré syndrome and preceding infection with campylobacter,influenza and Epstein-Barr virus in the general practice research database[J]. PLoS One,2007,2(4):e344. |
| [280] Liang X,Li L,Liu D,et al. Safety of influenza A (H1N1) vaccine in postmarketing surveillance in China[J]. N Engl J Med,2011,364(7):638-647. |
| [281] Centers for Disease Control Prevention. Summary of the joint statement on thimerosal in vaccines. American Academy of Family Physicians,American Academy of Pediatrics,Advisory Committee on Immunization Practices,Public Health Service[J]. MMWR Morb Mortal Wkly Rep,2000,49(27):622,631. |
| [282] McCormick M,Bayer R,Berg A,et al. Report of the Institute of Medicine. Immunization safety review:vaccines and autism[M]. Washington,DC:Institute of Medicine,2004. |
| [283] Pichichero ME,Gentile A,Giglio N, et al. Mercury levels in newborns and infants after receipt of thimerosal-containing vaccines[J]. Pediatrics,2008,121(2):e208-214. |
| [284] Verstraeten T,Davis RL,DeStefano F,et al. Safety of thimerosal- containing vaccines:a two-phased study of computerized health maintenance organization databases[J]. Pediatrics,2003,112(5):1039-1048. |
| [285] Tozzi AE, Bisiacchi P, Tarantino V,et al. Neuropsychological performance 10 years after immunization in infancy with thimerosal- containing vaccines[J]. Pediatrics,2009,123(2):475-482. |
| [286] Schechter R, Grether JK. Continuing increases in autism reported to California's developmental services system:mercury in retrograde[J]. Arch Gen Psychiatry,2008,65(1):19-24. |
| [287] Pichichero ME, Cernichiari E, Lopreiato J, et al. Mercury concentrations and metabolism in infants receiving vaccines containing thiomersal:a descriptive study[J]. Lancet,2002,360(9347):1737-1741. |
| [288] Thompson WW, Price C,Goodson B,et al. Early thimerosal exposure and neuropsychological outcomes at 7 to 10 years[J]. N Engl J Med,2007,357(13):1281-1292. |
| [289] Stratton K,Gable A,McCormick MC,et al. Report of the Institute of Medicine. Immunization safety review:thimerosal containing vaccines and neurodevelopmental disorders[M]. Washington,DC:National Academy Press,2001. |
| [290] Croen LA,Matevia M,Yoshida CK,et al. Maternal Rh D status,anti-D immune globulin exposure during pregnancy,and risk of autism spectrum disorders[J]. Am J Obstet Gynecol,2008,199(3):234 e1-6. |
| [291] National Center for Immunization Respiratory Diseases. General recommendations on immunization-recommendations of the Advisory Committee on Immunization Practices (ACIP) [J]. MMWR Recomm Rep,2011,60(2):1-64. |
| [292] Peasah SK,Azziz-Baumgartner E,Breese J,et al. Influenza cost and cost-effectiveness studies globally—a review[J]. Vaccine,2013,31(46):5339-5348. |
| [293] Schooling CM,Wong LC,Chau J,et al. Cost-effectiveness of influenza vaccination for elderly people living in the community[J]. Hong Kong Med J,2009,15 Suppl 6:44-47. |
| [294] You JH,Wong WC,Ip M, et al. Cost-effectiveness analysis of influenza and pneumococcal vaccination for Hong Kong elderly in long-term care facilities[J]. J Epidemiol Community Health,2009,63(11):906-911. |
| [295] Wang ST,Lee LT,Chen LS,et al. Economic evaluation of vaccination against influenza in the elderly:an experience from a population-based influenza vaccination program in Taiwan[J]. Vaccine,2005,23(16):1973-1980. |
| [296] Lin HH,Hsu KL,Ko WW,et al. Cost-effectiveness of influenza immunization in adult cancer patients in Taiwan[J]. Clin Microbiol Infect,2010,16(6):663-670. |
 2014, Vol. 35
2014, Vol. 35