文章信息
- 郭万申, 徐瑾, 吴俊燏, 赵升, 何红霞, 师文俊, 于丹, 李晶, 高虹, 陈江婷. 2014.
- Guo Wanshen, Xu Jin, Wu Junyu, Zhao Sheng, He Hongxia, Shi Wenjun, Yu Dan, Li Jing, Gao Hong, Chen Jiangting. 2014.
- 季节性流感裂解疫苗安尔来福®up>®的安全性、免疫原性及与H7N9禽流感病毒的交叉免疫研究
- Safety and immunogenicity of seasonal inactivated influenza vaccine(split virion)and cross- reactive antibody responses to the H7N9 avian influenza virus
- 中华流行病学杂志, 2014, 35(8): 949-952
- Chinese Journal of Epidemiology, 2014, 35(8): 949-952
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2014.08.016
-
文章历史
- 投稿日期:2014-3-5
2. 北京科兴生物制品有限公司;
3. 河南省原阳县疾病预防控制中心
2 Sinovac Biotech Co., Ltd;
3 Yuanyang Country Center for Disease Control and Prevention, Henan
流感是首个实行全球监测的传染病[1]。流感病 毒表面抗原易发生变异,且感染一种流感病毒后产 生的免疫力不能够完全保护机体免遭同亚型或同型 的其他病毒抗原或基因型变异株侵袭。因此全球每 年均有流感暴发。接种流感疫苗是预防控制流感 最有效方法。根据WHO建议,流感病毒疫苗应含 有两种A型病毒(H3N2和H1N1)和一种B型病毒 (B/Victoria或B/Yamagata),并按照全球流感监测工 作网络提供的信息,每年两次分别对南北半球推荐 季节性流感疫苗生产用病毒株。北京科兴生物制品 有限公司根据WHO发布的2012/2013年北半球流 行病毒株生产了相应的季节性流感疫苗——三价灭 活流感病毒裂解疫苗(TIV)。为确证其免疫原性和 安全性,于2012年11-12月在河南省原阳县健康人 群中开展本研究。由于自2013年4月以来,一种新 禽流感病毒(H7N9)在我国东南部沿海及中部地区 肆虐并引起广泛关注。考虑到目前尚无针对性疫 苗,为了探索性考察季节性流感裂解疫苗免疫后能 否针对H7N9禽流感病毒产生交叉保护,本研究在 人群中也进行了交叉免疫评价。 对象与方法
1. 研究对象:本研究采取开放性设计,经河南省 疾病预防控制中心医学伦理委员会批准后,在原阳 县招募健康受试者。选择6~35月龄健康婴幼儿、 18~60岁成年人和>60岁老年人为研究对象。入 选标准为近3年内无季节性流感疫苗接种史,排除 对鸡蛋或疫苗任何成分过敏及发热或患急性疾病、 恶性肿瘤活动期或治疗后复发、免疫缺陷病、格林巴 利综合征患者。所有受试者在参与本临床研究前由 本人或监护人签署知情同意书。
按照欧盟流感疫苗临床研究标准(欧盟标准),在 评价每年新上市季节性流感疫苗安全性和免疫原性 的临床研究中,成年人和老年人受试者人数均不应低 于50人。考虑到20%的受试者脱落率,故本研究规 定入组的儿童、成年人和老年人的人数不应少于65 人。为了体现年龄层的差异,老年组中>65岁受试 者不得低于45人。婴幼儿组接种2针灭活流感裂解 疫苗,仅用于安全性评价;成年组和老年组接种1针 灭活流感裂解疫苗,用于安全性和免疫原性评价。
2.研究方法:
(1)疫苗与接种:采用WHO推荐的2012/2013 年北半球流感流行株作为毒种由北京科兴生物制品 有限公司生产的流感病毒裂解疫苗(安尔来福)。 甲 型H1N1株 为NYMC X-179A(A/California/7/ 2009),甲 型H3N2株 为IVR-165(A/Victoria/361/ 2011),B型株为NYMC BX-39。成年人剂型为每支 0.5ml,含3种抗原各15μg,1针次接种;儿童剂型为 每支0.25ml,含3种抗原各7.5μg,2针次接种,间隔 4周。疫苗接种部位均为上臂三角肌内注射。
(2)标本检测及判定标准:成年组和老年组在疫 苗 接 种 前 后21d各 采 集5ml血 样 本,分 离 血 清,-20℃保存。取上述两组受试者接种前后的配 对血清,分别针对流感疫苗3个型别病毒株和H7N9 禽流感病毒株(NIBRG-268,亲代病毒A/Anhui/1/ 2013)进行微量血凝抑制试验(HI)抗体检测[2]。计 算HI抗体阳转率(血清HI抗体免疫前<1∶ 10,免疫 后≥1∶ 40;免疫前≥1∶ 10,免疫后呈4倍增长者判 定为抗体阳转)、抗体保护率(血清HI抗体≥1∶ 40 者在人群中的率)和抗体GMT增长倍数。在接种疫 苗后第21天,该3项评价指标中任意一项达到此标 准(HI抗体阳转率:成年组>40%,老年组>30%;抗 体保护率:成年组>70%,老年组>60%;GMT增长 倍数:成年组>2.5倍,老年组>2.0倍),即判定为符 合欧盟标准。其中免疫前HI抗体滴度<1∶ 40的受 试者定义为易感人群;免疫前HI抗体滴度≥1∶ 40 定义为非易感人群。血清抗体滴度<1∶ 10按1∶ 5 进行统计学分析。
(3)安全性观察与判定标准:依据国家食品药品 监督管理总局《预防用疫苗临床试验不良反应分级 标准指导原则》(国食药监注[2005]493号)进行评 价,临床观察指标包括生命体征(发热)、局部反应 (红肿、疼痛、硬结、瘙痒等)和全身反应(皮疹、头痛、 头晕、乏力、肌肉疼痛、关节痛、恶心、呕吐、腹泻、腹 痛等)。接种疫苗后进行30min即时反应观察,并在 日志卡记录接种后0~72h发生的局部和全身不良 反应,以及用药情况。受试者在接种后第3天返回 接种点,由研究者核对回收日志卡,并问询及核实不良反应或临床症状。如试验期间发生严重不良反 应,应收集和记录药物治疗及医学处理信息,并跟踪 至不良反应缓解或痊愈。
3. 统计学分析:采用SPSS15.0软件进行统计 学分析。所有接种至少1针流感疫苗的受试者均被 纳入安全性分析集。按照方案要求完成疫苗接种且 采集配对血清样本的受试者,被纳入到符合方案分 析集(PPS)用于免疫原性评价。血清HI抗体阳转 率、抗体保护率的组间比较采用χ2检验或Fisher精确 检验,抗体GMT的组间比较采用t检验或方差分析, 以P<0.05为差异有统计学意义。 结 果
1. 基本特征:共202(婴幼儿组65、成年组69、老 年组68)人入组且接种第1针疫苗。婴幼儿组为6~ 35月龄,平均(20.1±8.6)月龄,男女性比例为1.32∶1; 成年组年龄22~60岁,平均(48.3±10.1)岁,性别比 例为0.5∶ 1;老年组年龄60~84岁,平均 (68.3±5.1)岁,性别比例为0.7∶ 1。在完成 第1针接种后,所有受试者均接受了安全性 观察。其中婴幼儿组共60人接种了第2针 疫苗并完成安全性观察。成年组和老年组 分别64人和60人完成接种前后2次血样采 集。所有脱落的受试者均为自愿退出,且 无人因与疫苗有关的不良反应而退出。
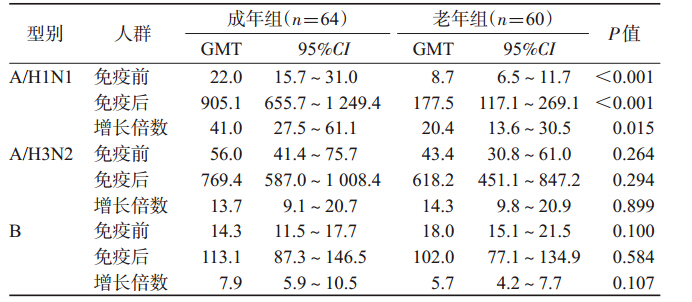
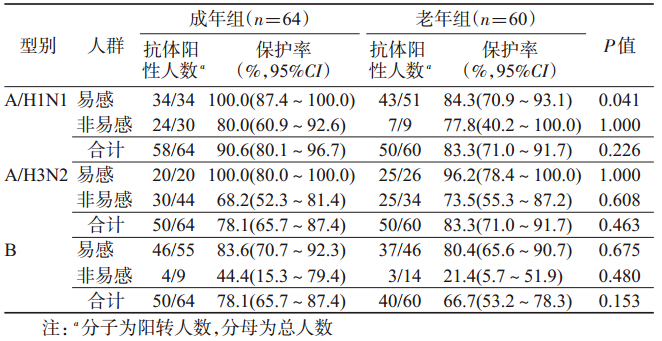
2.血清抗体水平分析: (1)免疫原性:成年组免疫前3个型别 (A/H1N1、A/H3N2和B)的抗体GMT(1∶) 分别为22.0、56.0、14.3,抗体保护率分别为 46.9%、68.8%、14.1%;老年组3个型别的抗 体GMT(1∶ )分别为8.7、43.4、18.0,抗体保 护率分别为15.0%、56.7%、23.3%。成年组 H1N1型抗体GMT和保护率均高于老年 组,差异有统计学意义(t=4.083,P<0.001; χ2=14.594,P<0.001)。接种疫苗后第21 天,成年组3个型别抗体阳转率分别为 90.6%、78.1%、78.1%,GMT增长分别为41.0 倍、13.7倍、7.9倍,保护率分别为100.0%、 100.0%、92.2%;老年组3个型别抗体阳转率 分别为83.3%、83.3%、66.7%,GMT增长分 别为20.4倍、14.3倍、5.7倍,保护率分别为 86.7%、100.0%、86.7%。成年组A/H1N1型 抗体的GMT和保护率均高于老年组,差异 有 统 计 学 意 义(t=6.206,P=0.023;χ2=7.046,P=0.008)。两年龄组3个型别HI抗体阳转率、 GMT增长倍数及保护率均超过欧盟标准(表 1~3)。 (2)易感人群与非易感人群比较:成年组3个 型别(A/H1N1、A/H3N2和B)易感人群比例分别 为53.1%、31.2%、85.9%;老年组3个型别易感人群 比例分别为85.0%、43.3%、76.7%。老年组免疫前 A/H1N1型易感率高于成年组,差异有统计学意义(老 年组免疫前保护率低于成年组,P<0.001),其他2个 型别免疫前易感率(保护率)老年组与成年组差异无统 计学意义。流感疫苗免疫后,成年组易感人群和非易 感人群3个型别抗体阳转率分别为100.0%和80.0%、 100.0%和68.2%、83.6%和44.4%;老年组易感人群和 非易感人群3个型别抗体阳转率分别为84.3%和 77.8%、96.2%和73.5%、80.4%和21.4%(表 3)。
3. 交叉免疫反应:成年组和老年组免疫前后 H7N9禽流感病毒血清抗体检测结果显示,接种前保 护性抗体阳性率均为0%,GMT(1∶)分别为2.6和2.5;接种后,两组人群抗体阳性率和阳转率仍均为0%,且 GMT也无明显改变,分别仅增长1.4倍和1.2倍。
4. 疫苗安全性:所有入组的137名成年及老年 受试者均完成接种和安全性观察,共发生13例 (9.5%)不良反应。其中局部不良反应发生率为 1.5%(2/137),接种部位硬结和皮肤发红各1例;全 身不良反应发生率为8.8%(12/137)均为发热。两组 间不良反应发生率及各症状发生率的差异均无统计 学意义。所有入组的65名婴幼儿受试者均完成2针 接种及接种后安全性观察,共发生12例(18.5%)不 良反应。其中局部不良反应发生率为1.5%(1/65), 症状均为接种部位皮肤发红;全身不良反应发生率 为20.0%(13/65),症状为发热、腹泻和哭闹不安。整 个临床研究期间未见发生严重不良反应。 讨 论
接种流感疫苗是预防控制流感的有效方法之 一。2009-2012年广东省疾病预防控制中心连续4 年跟踪广州市数千名6~35月龄儿童流感样病例的 发病情况,发现2针流感疫苗接种的保护率分别为 51.8%、57.8%、74.4%和68.8%,1针流感疫苗接种的 保护率分别为32.4%、32.5%、69.3%和28.1% [3, 4]。 2010-2011年香港地区多家医院对1859名≥65岁 老年人全病因所致死亡率和肺炎所致死亡率监测, 结果表明接种季节性流感疫苗能显著降低老年人全 病因所致死亡率和肺炎所致死亡率。其中全病因所 致死亡,疫苗组死亡率为14.6%,非疫苗接种组死亡 率为20.2%(方差分析显示合并风险比为0.72,且差 异有统计学意义);而肺炎所致死亡,疫苗组死亡率 为9.4%,非疫苗组死亡率为12.7%(方差分析显示合 并风险比为0.80,差异有统计学意义)[5]。
本研究表明2012/2013年流行季安尔来福在不 同年龄组受试者中均表现出良好的安全性,且接种 该疫苗后21d,成年组及老年组3个型别HI抗体阳 转率、GMT增长倍数以及保护性抗体阳性率均超过 欧盟标准。这与既往临床研究结果一致[2, 6, 7, 8],表明 安尔来福流感病毒裂解疫苗多年来保持一致的且 良好的安全性及免疫原性。虽然本研究未评价安尔 来福在婴幼儿人群中的免疫原性,但前期临床研究 显示,婴幼儿接种该疫苗后3个型别HI抗体阳转率 均超过40%,对H1N1和H3N2的抗体保护率超过 80%,对B型抗原的抗体保护率超过50% [9, 10, 11]。
研究显示成年组和老年组在疫苗接种前,对 A/H1N1型和B型流感病毒的HI抗体阳性率分别为 46.9%和15.0%、14.1%和23.3%。表明受试人群对 A/H1N1型和B型流感病毒仍普遍易感。这与当地 的流感疫情监测数据基本一致[12, 13]。
2013年3月在我国暴发的人感染H7N9型禽流 感引起全球关注。鉴于当前针对H7N9禽流感病毒 疫苗尚在研制中,本研究评价了受试人群免疫前针 对H7N9禽流感病毒的抗体水平及接种安尔来福 后对该病毒的交叉保护能力。结果表明,不论免疫 前后,成年组和老年组受试者对H7N9禽流感病毒 的抵抗力几乎为零,且季节性流感疫苗对H7N9禽 流感病毒感染未表现出任何保护效果。因此有必要 研发针对H7N9禽流感病毒的疫苗。
| [1] World Health Organization. WHO position paper on influenza vaccine,2005[R/OL]. http://www.who.int/wer/2005/wer8033.pdf. |
| [2] Wang P,Zhang XW,Song YF,et al. Safety and immunogenicity on the formulation of trivalent split influenza vaccine among healthy people aged over 18 years [J]. Chin J Epidemiol,2011,32(2):124-128.(in Chinese)王萍,张昕伟,宋宇飞,等. 流行性感冒病毒裂解疫苗在18 岁以上健康人群中应用的安全性及免疫原性研究[J]. 中华流行病学杂志,2011,32(2):124-128. |
| [3] Yang Z,Dong Z,Fu C. Seasonal influenza vaccine effectiveness among children aged 6 to 59 months in southern China [J]. PLoS One,2012,7(1):e30424. |
| [4] Fu C,He Q,Li Z,et al. Seasonal influenza vaccine effectiveness among children,2010-2012[J]. Influenza Other Respir Viruses,2013,7(6):1168-1174. |
| [5] Chan TC,Fan-Ngai Hung I,Ka-Hay Luk J,et al. Efficacy of trivalent seasonal influenza vaccination in reducing mortality and hospitalization in Chinese nursing home older adults [J]. J Am Med Dir Assoc,2013,14(12):889-894. |
| [6] Liu Y, Wu JY, Wang X, et al. Review of 10 years of clinical experience with Chinese domestic trivalent influenza vaccine Anflu [J]. Hum Vaccin Immunother,2014,10(1):73-82. |
| [7] Jiang FC,Lyu SL,Jia XR,et al. Safety and immunogenicity of seasonal inactivated influenza vaccine (split virion) and cross- reactive antibody responses to the 2009 pandemic H1N1 influenza virus [J]. Chin J Vaccin Immun,2011,17(2):143-146.(in Chinese)姜法春,吕思禄,贾晓蓉,等. 季节性灭活流行性感冒病毒裂解疫苗安全性和免疫原性及与甲型H1N1 流行性感冒病毒的交叉免疫反应研究[J]. 中国疫苗和免疫,2011,17(2):143-146. |
| [8] Zhang ZL,Wang X,Zhu XJ,et al. Safety and immunogenicity on three lots of influenza split vaccine among adults [J]. Chin J Epidemiol,2009,30(6):583-587.(in Chinese)张之伦,王旭,朱向军,等. 成人连续三批次流感裂解疫苗接种的安全性、免疫原性观察[J]. 中华流行病学杂志,2009,30(6):583-587. |
| [9] Li YP,Li RC,Chen JT,et al. Research on safety and immunogenicity of trivalent split influenza vaccine [J]. Chin J Vaccin Immun,2005,11(5):343-347.(in Chinese)李艳萍,李荣成,陈江婷,等. 流行性感冒裂解疫苗安尔来福®全性和免疫原性研究[J]. 中国计划免疫,2005,11(5):343-347. |
| [10] Li YP, Li W,Liang XF,et al. Immunogenicity and safety of a 2009 pandemic influenza A (H1N1) monovalent vaccine in Chinese infants aged 6-35 months:a randomized,double-blind,controlled phase Ⅰ clinical trial [J]. Influenza Other Respi Viruses,2013,7(6):1297-1307. |
| [11] Luo F,Yang L,Ai X,et al. Immunogenicity and safety of three 2010-2011 seasonal trivalent influenza vaccines in Chinese toddlers,children and older adults:A double-blind and randomized trial [J]. Hum Vaccin Immunother,2013,9(8):1725-1734. |
| [12] Seng MH,Jiang HL,Feng XH,et al. Analysis and surveillance of influenza in Henan from 2009 to 2010 [J]. Henan J Prev Med,2012,23(1):62-64.(in Chinese)僧明华,蒋红丽,封秀红,等. 2009-2010年河南省流感监测分析[J]. 河南预防医学杂志,2012,23(1):62-64. |
| [13] Yang Z,Ye ZH,Li X,et al. Analysis of the seasonality characteristics of influenza based on concentration degree and circular distribution methods in Henan [J]. Med Soc,2013,26(2):6-9.(in Chinese)杨召,叶中辉,李星,等. 基于集中度和圆形分布法的河南省流感发病季节性特征分析[J]. 医学与社会,2013,26(2):6-9. |
 2014, Vol. 35
2014, Vol. 35