文章信息
- 张文婷, 刘丹, 谢朝军, 申动, 陈宗遒, 李志浩, 刘远, 张希如, 陈沛良, 钟文芳, 杨佩, 黄清湄, 罗雷, 毛琛.
- Zhang Wenting, Liu Dan, Xie Chaojun, Shen Dong, Chen Zongqiu, Li Zhihao, Liu Yuan, Zhang Xiru, Chen Peiliang, Zhong Wenfang, Yang Pei, Huang Qingmei, Luo Lei, Mao Chen
- 广州市新型冠状病毒肺炎病例密切接触者核酸检测灵敏度和特异度分析
- Sensitivity and specificity of nucleic acid testing in close contacts of COVID-19 cases in Guangzhou
- 中华流行病学杂志, 2021, 42(0): 0-0
- Chinese Journal of Epidemiology, 2021, 42(0): 0-0
- http://dx.doi.org/10.3760/cma.j.cn112338-20201211-01400
-
文章历史
收稿日期: 2020-12-11
2. 广州市疾病预防控制中心 511430
2. Guangzhou Municipal Center for Disease Control and Prevention, Guangzhou 511430, China
自2019年底至今,新型冠状病毒肺炎(COVID-19)已扩散至100多个国家,呈全球大流行[1-7]。2020年1月19日,广东省报告首例湖北省输入型COVID-19确诊病例[8],1月20日我国将其纳入乙类传染病并按甲类管理[9]。2020年1月31日,WHO宣布COVID-19疫情列为传染病应急机制中的最高等级,即国际关注的突发公共卫生事件(PHEIC),这次疫情是全球第6次PHEIC。广州市政府采取了严格的社区排查、密切接触者管理、医院主动排查等一系列病例筛查措施,有效阻止了疫情的扩散。
广州市的总体疫情防控分3个阶段:一是2020年1月21日至3月10日(国内输入阶段),以国内输入及其家庭聚集疫情防控为主;二是3月11日至4月1日(境外输入阶段),本土病例防控效果良好,以境外输入性疫情为主;三是4月2日报告首例境外输入关联病例至9月22日(境外输入关联阶段),以高风险国家关联病例及其引发的社区疫情防控为主。本研究分析广州市COVID-19疫情防控不同阶段的密切接触者新型冠状病毒(新冠病毒)核酸检测的灵敏度和特异度,为优化疫情防控策略提供科学依据。
对象和方法1. 研究对象:COVID-19确诊病例的密切接触者。2020年2月24日至9月22日,基于广州市CDC的COVID-19防控数据库,共追踪到密切接触者20 348例。
2. 调查方法:
(1)流行病学个案调查:查找有密切接触或共同暴露史的确诊病例、疑似病例、临床诊断病例或无症状感染者。辖区CDC在24 h内完成对这些病例的流行病学调查,进行追踪和登记,对密切接触者实行集中隔离或居家隔离医学观察。密切接触者医学观察期为与病例末次接触后14 d。收集研究对象的社会人口学特征、最后接触日期、开始隔离日期、隔离时间、核酸检测时间、核酸检测结果、接触方式等信息。
(2)新冠病毒核酸检测:对密切接触者进行连续核酸检测(至少间隔24 h)。CDC工作人员收集密切接触者上呼吸道(鼻咽或口咽拭子)和下呼吸道(痰)分泌物,并送至广州市CDC实验室进行核酸检测。采用新冠病毒核酸检测试剂盒[硕世生物核酸检测试剂盒(注册号:国械标准20203400384);伯杰医疗核酸检测试剂盒(注册号:国械标准20203400065)],通过实时荧光RT-PCR法检测新冠病毒核酸的N基因和开放读码框1ab基因(ORF1ab)。病毒水平以循环阈值(Ct值)表示:①阳性:Ct值< 37;②阴性:无Ct值或Ct值> 40;③灰度区间:Ct值范围37~40则重复实验,若Ct值< 40,扩增曲线有明显起峰,样本判断为阳性,否则为阴性。
3. COVID-19相关定义[10-11]:以文献[10]诊断标准作为金标准。对于RT-PCR法检测结果为阳性的密切接触者,在定点医院进行电子计算机X射线断层扫描技术(CT)诊断、血液学检查及隔离治疗。
(1)确诊病例:疑似病例同时具备以下病原学或血清学证据之一者:①实时荧光RT-PCR检测新冠病毒核酸阳性;②病毒基因测序,与已知的新冠病毒高度同源;③新冠病毒特异性IgM抗体和IgG抗体阳性;④新冠病毒特异性IgG抗体由阴性转为阳性或恢复期时,抗体滴度比急性期时升高≥4倍。
(2)无症状感染者:无临床症状,呼吸道等标本、新冠病毒病原学或血清特异性IgM抗体检测阳性者。主要通过密切接触者筛查、聚集性疫情调查和传染源追踪调查等途径发现。
(3)COVID-19密切接触者:从疑似病例和确诊病例症状出现前48 h开始,或无症状感染者标本采样前48 h开始,与其有近距离接触,但未采取有效防护的人员。
4. 统计学分析:采用SPSS 25.0软件进行数据整理和分析,存在缺失数据做删除处理。计数资料以例数和构成比(%)表示;计量资料符合正态分布以x±s表示,符合偏态分布则以M(P25,P75)表示。双侧检验,检验水准α=0.05。
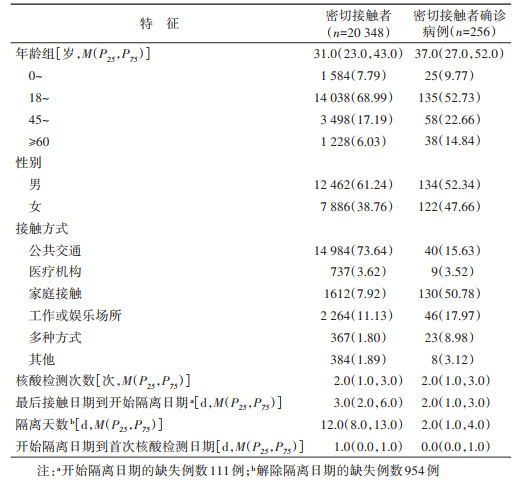
结果1. 密切接触者基本特征:共20 348例密切接触者,年龄M(P25,P75)为31.0(23.0,43.0)岁,男性12 462例(61.24%)、女性7 886例(38.76%),以18~59岁为主(86.18%)。密切接触者最主要接触方式为公共交通(73.64%),其次为工作或娱乐场所(11.13%),核酸检测次数M(P25,P75)为2.0(1.0,3.0)次,最后接触日期到开始隔离日期天数M(P25,P75)为3.0(2.0,6.0)d,隔离天数M(P25,P75)为12.0(8.0,13.0)d。密切接触者开始隔离日期到首次核酸检测日期的天数M(P25,P75)为1.0(0.0,1.0)d。见表 1。
2. 密切接触者中确诊病例基本特征:确诊病例256例,续发率为1.26%(256/20 348),年龄M(P25,P75)为31.0(23.0,43.0)岁,年龄范围11月龄~90岁,以18~59岁为主(75.39%)。最常见接触方式为家庭接触(50.78%),其次为工作或娱乐场所(17.97%);核酸检测次数M(P25,P75)为2.0(1.0,3.0)次,最后接触日期到开始隔离日期天数M(P25,P75)为2.0(1.0,3.0)d,确诊病例隔离天数M(P25,P75)为2.0(1.0,4.0)d,开始隔离日期到首次核酸检测日期天数M(P25,P75)为0.0(0.0,1.0)d。见表 1。
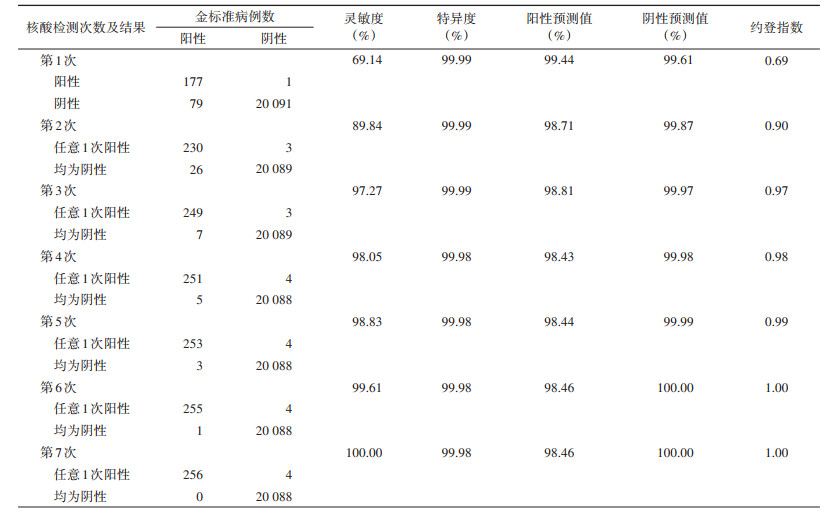
3. 不同核酸检测次数的灵敏度和特异度比较:第1、2、3、4和第7次核酸检测的灵敏度与特异度分别为72.44%与99.99%(确诊177例)、89.84%与99.99%(确诊230例)、97.27%与99.99%(确诊249例)、98.05%和99.98%(确诊251例)、100.00%与99.98%。256例密切接触者病例均被确诊。随着检测次数的增加,病例的确诊数增多,灵敏度稳定上升,特异度保持平稳,约登指数上升。见表 2。
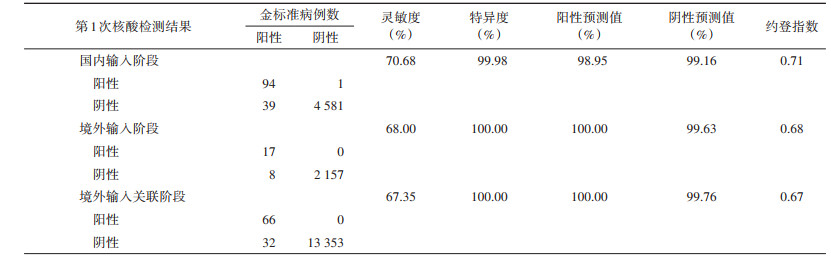
4. 不同疫情防控阶段密切接触者的灵敏度和特异度比较:在密切接触者第一次核酸检测后,国内输入、境外输入和境外输入关联3个阶段的灵敏度分别为70.68%、68.00%和67.35%,特异度分别为99.98%、100.00%和100.00%。见表 3。
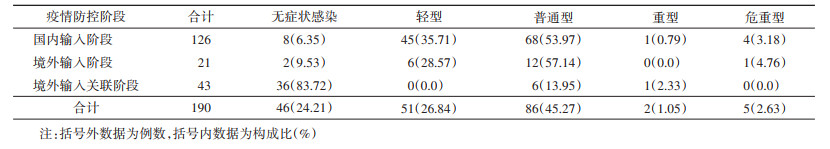
5. 不同疫情防控阶段的密切接触者确诊病例临床分型:在确诊的256例COVID-19病例中,190例有临床分型资料,其中包括无症状感染者46例(24.21%),有症状感染者144例(75.79%)。国内输入与境外输入阶段主要为普通型病例(53.97%和57.14%);境外输入关联阶段主要为无症状感染(83.72%)。见表 4。
本研究分析广州市COVID-19病例的密切接触者20 348例数据,结果显示,密切接触者以男性为主(61.24%),在各年龄阶段均有分布,以18~59岁青壮年为主,主要接触方式为公共交通(73.64%)和工作或娱乐场所(11.13%)。青壮年人群在日常工作和生活中与外界交流较多,接触感染的风险也增加,需要重视青壮年人群的健康宣传工作,做好公共场所环境通风、佩戴口罩和密切接触者筛查工作[12-16]。
密切接触者中确诊病例的最常见接触方式为家庭接触(50.78%),家庭成员的共同生活、居住和聚餐等行为,存在着密切接触机会,容易引发家庭聚集性疫情,国内外相关研究结果也证实[17-21]。需加强COVID-19疫情期间的家庭防护的健康宣传和指导,预防聚集性疫情的发生。
不同疫情防控阶段中,密切接触者的灵敏度和特异度分析结果显示,第1、2、3次核酸检测的灵敏度分别为72.44%、89.84%和97.27%。随着检测次数的增加,灵敏度稳定上升,建议进行3次核酸检测以避免漏检。如果前两次核酸检测阴性结果,并不能完全排除新冠病毒感染,多次核酸检测结合流行病史及临床表现,能够降低无症状感染者的漏检率,相关文献也与本研究结果一致[22-23]。
在第1次核酸检测后,在国内输入、境外输入和境外输入关联3个不同疫情防控阶段,密切接触者核酸检测的灵敏度结果较为一致(分别为70.68%、68.00%和67.35%),略有降低。可能与疫情防控的后期阶段中,无症状感染者比例增多有关。针对密切接触者256例确诊病例的临床分型分析发现,国内输入与境外输入阶段主要为普通型病例(53.97%和57.14%);境外输入关联阶段主要为无症状感染(83.72%)。一方面与我国疫情防控效果良好,隔离治疗措施效果明显有关;另一方面,扩大核酸检测策略,多个地区在疫情防控工作中缩短核酸检测时间间隔,并增加核酸检测次数,能够早筛查和早发现更多的、排毒量更低的无症状感染者,这也是无症状感染者比例增多的一个原因。客观上,核酸检测结果存在一定的假阴性或假阳性概率,无症状感染者体内病毒可能尚未快速释放,鼻咽部等上呼吸道的病毒量很少,主要集中于肺部,若采集鼻咽拭子,容易出现阴性检测结果,需多次检测,这可能是核酸检测灵敏度略有降低的一个原因。
根据PCR引物和探针设计的原理,出现假阳性的概率极低,但在实际工作中,存在检测样品交叉污染、PCR扩增产物污染、气溶胶污染和PCR试剂污染等原因,容易出现假阳性[24-25]。本研究发现4例样本是核酸检测假阳性结果。对于核酸检测假阴性结果,除了核酸检测流程中的采样、运输、核酸提取、PCR检测等环节因素外,也有可能与无症状感染者的比例增多相关,采集样本的病毒量较少,容易出现假阴性。建议开展针对新冠病毒的发病机制、病毒载量和临床进程等相关研究,减少假阴性或假阳性错误,提高核酸检测的灵敏度与特异度[26-30]。
鉴于目前疫情防控阶段以境外输入为主,重点人群主要为无症状感染者。需做好主动筛查和扩大核酸检测,针对聚集性疫情调查和溯源工作的高感染风险人群尽早开展筛查和核酸检测,预防和减少家庭等聚集性疫情的发生[31-32]。
综上所述,建议做核酸检测3次,可提高灵敏度并降低假阴性风险。尽早发现无症状感染者,对预防聚集性疫情具有公共卫生意义。对于广州市COVID-19疫情防控3个阶段,密切接触者核酸检测的灵敏度结果较为一致,但略有降低趋势,这可能与疫情防控后期阶段的无症状感染者比例增多相关。
利益冲突 所有作者均声明不存在利益冲突
本文编辑 斗智
| [1] |
武汉市卫生健康委员会. 武汉市卫健委关于当前我市肺炎疫情的情况通报[EB/OL]. (2019-12-31)[2020-11-20]. http://wjw.wuhan.gov.cn/xwzx_28/gsgg/202004/t20200430_1199576.shtml. Wuhan Municipal Health Commission.Notification on the current epidemic of pneumonia of Wuhan Municipal Health Commission in Wuhan[EB/OL]. (2019-12-31)[2020-11-20]. http://wjw.wuhan.gov.cn/xwzx_28/gsgg/202004/t20200430_1199576.shtml. |
| [2] |
Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2[J]. Nat Microbiol, 2020, 5(4): 536-544. DOI:10.1038/s41564-020-0695-z |
| [3] |
Chen NS, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [4] |
Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [5] |
Wang C, Horby PW, Hayden FG, et al. A novel coronavirus outbreak of global health concern[J]. Lancet, 2020, 395(10223): 470-473. DOI:10.1016/S0140-6736(20)30185-9 |
| [6] |
Holshue ML, DeBolt C, Lindquist S, et al. First Case of 2019 Novel Coronavirus in the United States[J]. N Engl J Med, 2020, 382(10): 929-936. DOI:10.1056/NEJMoa2001191 |
| [7] |
Wang DW, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China[J]. JAMA, 2020, 323(11): 1061-1069. DOI:10.1001/jama.2020.1585 |
| [8] |
广东省卫生健康委员会. 国家卫生健康委确认我省首例输入性新型冠状病毒感染的肺炎确诊病例[EB/OL]. (2020-01-20)[2020-11-20]. http://wsjkw.gd.gov.cn/zwyw_yqxx/content/post_2876057.html. Guangdong Provincial Health Commission.The first imported case of COVID-19 by National Health Commission confirmed in Guangdong province[EB/OL]. (2020-01-20)[2020-11-20]. http://wsjkw.gd.gov.cn/zwyw_yqxx/content/post_2876057.html. |
| [9] |
国家卫生健康委员会. 国家卫生健康委员会公告[EB/OL]. (2020-01-20)[2020-11-20]. http://www.nhc.gov.cn/jkj/s7916/202001/44a3b8245e8049d2837a4f27529cd386.shtml. National Health Commission.Announcement of the National Health Commission[EB/OL]. (2020-01-20)[2020-11-20]. http://www.nhc.gov.cn/jkj/s7916/202001/44a3b8245e8049d2837a4f27529cd386.shtml. |
| [10] |
国家卫生健康委员会办公厅, 国家中医药管理局办公室. 新型冠状病毒肺炎诊疗方案(试行第八版)[J]. 中国医药, 2020, 15(10): 1494-1499. Office of National Health Commission, Office of National Administration of Traditional Chinese Medicine. Protocol of diagnosis and treatment for COVID-19(trial version 8)[J]. China Med, 2020, 15(10): 1494-1499. DOI:10.3760/j.issn.1673-4777.2020.10.002 |
| [11] |
国家卫生健康委员会办公厅. 新型冠状病毒肺炎防控方案(第七版)的通知[EB/OL]. (2020-09-15)[2021-01-27]. http://www.nhc.gov.cn/jkj/s3577/202009/318683cbfaee4191aee29cd774b19d8d.shtml. General Office of National Health Commission.Protocol of prevention and control for COVID-19(version 7)[EB/OL]. (2020-09-15)[2021-01-27]. http://www.nhc.gov.cn/jkj/s3577/202009/318683cbfaee4191aee29cd774b19d8d.shtml. |
| [12] |
Cheng VCC, Wong SC, Chuang VWM, et al. The role of community-wide wearing of face mask for control of coronavirus disease 2019(COVID-19) epidemic due to SARS-CoV-2[J]. J Infect, 2020, 81(1): 107-114. DOI:10.1016/j.jinf.2020.04.024 |
| [13] |
Zhong BL, Luo W, Li HM, et al. Knowledge, attitudes, and practices towards COVID-19 among Chinese residents during the rapid rise period of the COVID-19 outbreak: a quick online cross-sectional survey[J]. Int J Biol Sci, 2020, 16(10): 1745-1752. DOI:10.7150/ijbs.45221 |
| [14] |
Ngwewondo A, Nkengazong L, Ambe LA, et al. Knowledge, attitudes, practices of/towards COVID 19 preventive measures and symptoms: A cross-sectional study during the exponential rise of the outbreak in Cameroon[J]. PLoS Negl Trop Dis, 2020, 14(9): e0008700. DOI:10.1371/journal.pntd.0008700 |
| [15] |
Wake AD. Knowledge, attitude, practice, and associated factors regarding the novel coronavirus disease 2019(COVID-19) pandemic[J]. Infect Drug Resist, 2020, 13: 3817-3832. DOI:10.2147/IDR.S275689 |
| [16] |
Morawska L, Tang JW, Bahnfleth W, et al. How can airborne transmission of COVID-19 indoors be minimised?[J]. Environ Int, 2020, 142: 105832. DOI:10.1016/j.envint.2020.105832 |
| [17] |
Xia XY, Wu J, Liu HL, et al. Epidemiological and initial clinical characteristics of patients with family aggregation of COVID-19[J]. J Clin Virol, 2020, 127: 104360. DOI:10.1016/j.jcv.2020.104360 |
| [18] |
Ghinai I, Woods S, Ritger KA, et al. Community transmission of SARS-CoV-2 at two family gatherings-Chicago, Illinois, February-March 2020[J]. MMWR Morb Mortal Wkly Rep, 2020, 69(15): 446-450. DOI:10.15585/mmwr.mm6915e1 |
| [19] |
Cheng HY, Jian SW, Liu DP, et al. Contact tracing assessment of COVID-19 transmission dynamics in Taiwan and risk at different exposure periods before and after symptom onset[J]. JAMA Intern Med, 2020, 180(9): 1156-1163. DOI:10.1001/jamainternmed.2020.2020 |
| [20] |
Li W, Zhang B, Lu JH, et al. Characteristics of household transmission of COVID-19[J]. Clin Infect Dis, 2020, 71(8): 1943-1946. DOI:10.1093/cid/ciaa450 |
| [21] |
Grijalva CG, Rolfes MA, Zhu YW, et al. Transmission of SARS-COV-2 infections in households-Tennessee and Wisconsin, April-September 2020[J]. MMWR Morb Mortal Wkly Rep, 2020, 69(44): 1631-1634. DOI:10.15585/mmwr.mm6944e1 |
| [22] |
张文佳, 廖璞. 1例新型冠状病毒肺炎多次核酸检测异同结果的原因分析[J]. 重庆医学, 2020, 49(17): 2834-2836. Zhang WJ, Liao P. Analysis of the reasons for similarities and differences of multiple times of nucleic acid testing for one case of COVID-19[J]. Chongqing Med, 2020, 49(17): 2834-2836. DOI:10.3969/j.issn.1671-8348.2020.17.013 |
| [23] |
关明, 王文静, 王惠英. 新型冠状病毒无症状感染者的实验室检测及防控风险评估[J]. 中华预防医学杂志, 2020, 54(12): 1310-1314. Guan M, Wang WJ, Wang HY. Laboratory testing, prevention and control of asymptomatic carriers of coronavirus disease 2019[J]. Chin J Prev Med, 2020, 54(12): 1310-1314. DOI:10.3760/cma.j.cn112150-20200610-00861 |
| [24] |
李振昊, 高小玲, 杨小娟, 等. 新型冠状病毒核酸检测分析[J]. 检验医学与临床, 2020, 17(10): 1313-1315. Z H, Gao XL, Yang XJ, et al. Detection and analysis of SARS-CoV-2 nucleic acid[J]. Lab Med Clinic, 2020, 17(10): 1313-1315. DOI:10.3969/j.issn.1672-9455.2020.10.001 |
| [25] |
郑甲兰. PCR检测中的假阳性和假阴性问题分析[J]. 中国医药指南, 2012, 10(22): 390-391. J L. Analysis of false positive and false negative in PCR detection[J]. Guide China Med, 2012, 10(22): 390-391. DOI:10.3969/j.issn.1671-8194.2012.22.296 |
| [26] |
Hao W, Ma B, Li ZH, et al. Binding of the SARS-CoV-2 spike protein to glycans[J]. Sci Bull, 2021. DOI:10.1016/j.scib.2021.01.010 |
| [27] |
Rajawat J, Chandra A. Role of Poly (ADP-ribose) polymerase (PARP1) in viral infection and its implication in SARS-CoV-2 pathogenesis[J]. Curr Drug Targets, 2021. DOI:10.2174/1389450122666210120142746 |
| [28] |
Corley MJ, Pang APS, Dody K, et al. Genome-wide DNA methylation profiling of peripheral blood reveals an epigenetic signature associated with severe COVID-19[J]. J Leukoc Biol, 2021. DOI:10.1002/JLB.5HI0720-466R |
| [29] |
Combes AJ, Courau T, Kuhn NF, et al. Global absence and targeting of protective immune states in severe COVID-19[J]. Nature, 2021. DOI:10.1038/s41586-021-03234-7 |
| [30] |
Quilty BJ, Clifford S, Hellewell J, et al. Quarantine and testing strategies in contact tracing for SARS-CoV-2:a modelling study[J]. Lancet Public Health, 2021. DOI:10.1016/S2468-2667(20)30308-X |
| [31] |
Spencer KD, Chung CL, Stargel A, et al. COVID-19 case investigation and contact tracing efforts from health departments-United States, June 25-July 24, 2020[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(3): 83-87. DOI:10.15585/mmwr.mm7003a3 |
| [32] |
Liu HZ, Ye CC, Wang YP, et al. The effectiveness of active surveillance measures for COVID-19 cases in Pudong New Area Shanghai, China, 2020[J]. J Med Virol, 2021. DOI:10.1002/jmv.26805 |
 2021, Vol. 42
2021, Vol. 42