文章信息
- 中华预防医学会.
- Chinese Preventive Medicine Association
- 预防接种知情告知专家共识(下)
- Expert consensus on informed consent for vaccination (part two)
- 中华流行病学杂志, 2021, 42(3): 369-399
- Chinese Journal of Epidemiology, 2021, 42(3): 369-399
- http://dx.doi.org/10.3760/cma.j.cn112338-20210220-00129
-
文章历史
收稿日期: 2021-02-20
流感病毒是单股、负链、分节段的RNA病毒,包括甲、乙、丙、丁(或A、B、C、D)四型,具有易于发生变异的特点,特别是甲型流感病毒。目前引起全球人间流感季节性流行的病毒是甲型H1N1、H3N2亚型和乙型Victoria和Yamagata系[1-2]。
1.1.2 临床特征轻症流感常与普通感冒表现相似,但其发热和全身症状更明显。重症病例可出现病毒性肺炎、继发细菌性肺炎、急性呼吸窘迫综合征、休克、弥漫性血管内凝血、心血管和神经系统等肺外表现和多种并发症[3]。
1.1.3 流行病学特征全人群对流感普遍易感。婴幼儿、老年人、孕妇和心血管疾病(单纯高血压除外)、慢性呼吸系统疾病、肝肾功能不全、血液病、神经系统疾病、神经肌肉功能障碍、代谢性疾病(包括糖尿病)等慢性病患者、免疫抑制疾病或免疫功能低下者,患流感后出现重症的风险较高。流感在温带地区表现为每年冬春季的季节性流行和高发。热带地区尤其在亚洲,流感的季节性呈高度多样化,呈半年或全年周期性流行,或全年循环。北半球通常在每年10月至次年5月间发生季节性流感流行,1-2月为高峰。中国南方省份夏季也可流行。
(1.2) 疫苗简介全球已上市的流感疫苗分为流感灭活疫苗(inactivated influenza vaccine,IIV)、流感减毒活疫苗(live attenuated influenza vaccine,LAIV)和重组流感疫苗(recombinant influenza vaccine,RIV)。根据生产工艺,可分为基于鸡胚、基于细胞培养和重组流感疫苗。国外还有针对特定人群的高抗原含量IIV、佐剂疫苗、皮内接种疫苗等。
中国批准上市的流感疫苗包括IIV和LAIV,均为基于鸡胚的疫苗:(1)IIV:包括三价IIV(IIV3)和四价IIV(IIV4),其中IIV3又分为裂解疫苗和亚单位疫苗,IIV4为裂解疫苗。IIV3疫苗组分包括甲型H1N1、H3N2和B型的一个系,IIV4在IIV3组分基础上增加了B型的另一个系。(2)LAIV:鼻喷三价LAIV(LAIV3)于2020年3月2日在中国获批上市。LAIV3鼻腔接种后活流感病毒疫苗株可在鼻咽部复制,疫苗株病毒具有毒力衰减(限制其反应原性和致病性)、温度敏感性(限制其在下呼吸道复制)和冷适应性(允许其在鼻咽部复制)3个特点。经鼻腔接种LAIV3后可诱导血清和鼻黏膜均产生抗体,也可诱导细胞介导的免疫反应。
1.2.1 疫苗免疫原性中国一项Ⅳ期临床试验显示,≥6月龄人群接种IIV3后血清抗体保护率≥88%,几乎所有年龄组所有菌株血清血凝抑制抗体阳转率或几何平均滴度(geometric mean titer,GMT)均升高≥78.2%[4]。在≥18岁成人中,IIV3与IIV4相同疫苗株的血清保护率和抗体阳转率均无显著性差异,IIV4的B型流感系的抗体保护率和抗体阳转率明显高于IIV3[5-6]。根据研究发表数据,LAIV3在婴幼儿、学龄儿童的免疫反应较成年人好[7-8],具有良好免疫原性[9-10]。
人体感染流感病毒或接种流感疫苗后获得的免疫力会随时间衰减[11],衰减程度与人的年龄和身体状况、疫苗抗原等因素有关。临床试验证据提示,接种IIV对抗原类似毒株的保护性抗体水平可维持6~8个月[12],接种1年后血清抗体水平显著降低,但部分毒株的保护性抗体持续时间可更长。为匹配不断变异的流感病毒,世界卫生组织(WHO)在多数季节推荐的流感疫苗组分会更新一个或多个毒株,有时疫苗毒株与前一季节完全相同。为保证接种人群得到最大程度的保护,即使流感疫苗组分与前一季节完全相同,鉴于多数接种者抗体滴度已显著下降[13-15],无论前一季节是否接种流感疫苗,仍建议在当年流感季节来临前接种。
1.2.2 疫苗保护效力或效果在健康成人中,IIV可预防约59%的实验室确诊流感[16]。妊娠期间接种疫苗不仅能够有效保护妊娠女性,也能对出生后6个月内无法接种流感疫苗的婴儿起到保护作用[17]。流感疫苗高覆盖(> 50%)时,学校流感暴发风险显著降低84%[18]。有研究显示老年人接种流感疫苗后预防流感的保护效力为58%[19],同时可减少慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)、慢性支气管炎、哮喘、冠心病等慢性基础性疾病的感染和发作[20-23]。一项2016-2017流行季在中国东部地区3~17岁儿童中开展的随机、双盲、对照试验显示[24],LAIV3对所有亚型流感的效力为62.5%(95%CI:27.6%~80.6%),对A(H3N2)亚型流感的效力为63.3%(95%CI:27.5%~81.5%)。对6项安慰剂对照试验研究的Meta分析显示,LAIV3对6~83月龄儿童实验室确诊流感合并急性中耳炎的保护效果为85%(95%CI:78%~90%)[25]。
1.2.3 疫苗安全性(1)IIV 肌内注射接种IIV常见的局部反应为接种部位红晕、肿胀、硬结、疼痛、烧灼感等,常见的全身反应为发热、头痛、头晕、嗜睡、乏力、肌痛、周身不适、恶心、呕吐、腹痛、腹泻等。反应通常是轻微的,并在几天内自行消失,极少出现重度反应。研究表明IIV3与IIV4在安全性上没有显著性差异[26-27]。
中国2015-2018年疑似预防接种异常反应(AEFI)监测分析显示,IIV报告不良反应以发热(腋温≥37.1 ℃)最多,其中高热(腋温≥38.6 ℃)发生率为4.27/10万剂,儿童型疫苗(4.47/10万剂)略高于成人型疫苗(4.17/10万剂);在非严重异常反应中,过敏性皮疹(442例,0.53/10万剂)和血管性水肿(70例,0.08/10万剂)报告最多;严重异常反应报告发生率低,为0.14/10万剂,其中热性惊厥(27例,0.03/10万剂)和过敏性紫癜(21例,0.03/10万剂)最多[28]。
(2)LAIV 儿童接种LAIV3后报告不良反应包括流鼻涕或鼻塞、头痛、发热、呕吐、腹痛、肌痛等[29-33],多为首次接种LAIV3发生,并且为自限性。中国鼻喷LAIV3的一项Ⅲ期临床试验显示,4 500名3~17岁受试者接种1剂次LAIV3后安全性观察至接种后6个月以上,十分常见不良反应包括发热、流涕/鼻塞,常见不良反应包括咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、肌肉痛、恶心、烦躁,偶见不良反应包括变态反应、关节痛、鼻咽炎和寒战。
无论是儿童还是成年人,在接种LAIV后出现部分受种者排出疫苗株病毒的情况,排毒量和排毒时长均要少于自然感染流行毒株[34-35]。偶有报道LAIV疫苗株病毒发生从受种者向未接种者的传播,但尚未发现被疫苗株病毒感染的未接种者发生严重疾病的报告[36]。
(1.3) 接种建议 1.3.1 疫苗种类、剂型和适用人群所有≥6月龄愿意接种疫苗且无禁忌证的人均可接种流感疫苗。现有流感疫苗不可以直接给6月龄以下婴儿接种,该人群可通过母亲孕期和哺乳期接种和对婴儿的家庭成员和看护人员接种流感疫苗,而预防流感。建议60岁以上老年人接种流感疫苗[1]。
中国批准上市的IIV3用于≥6月龄人群接种,其中0.25 ml剂型(含每种组分血凝素7.5 μg)用于6~35月龄婴幼儿,0.5 ml剂型(含每种组分血凝素15 μg)用于≥36月龄人群;IIV4用于≥6月龄人群接种,每剂次0.5 ml(含每种组分血凝素15 μg);LAIV3为冻干制剂,每剂次0.2 ml,含甲型H1N1、A(H3N2)亚型、B(Victoria)系减毒病毒滴度分别不低于6.9、6.9、6.4 lgEID50,用于3~17岁人群。受种者可自愿选择接种任一种流感疫苗,无优先推荐[1]。
1.3.2 接种剂次[1]6月龄~8岁儿童:既往年度接种 < 2剂次流感疫苗者应接种2剂次IIV3、IIV4或LAIV,间隔≥4周;既往年度接种过≥2剂流感疫苗者接种1剂。≥9岁儿童和成人:接种1剂IIV3、IIV或LAIV。
1.3.3 接种时机通常接种流感疫苗2~4周后可产生具有保护水平的抗体,6~8个月后抗体滴度开始衰减。中国各地每年流感活动高峰出现的时间和持续时间不同,为保证受种者在流感高发季节前获得免疫保护,最好在10月底前完成免疫接种;10月底前未接种的对象,整个流行季节都可以接种。同一流感流行季节已按照免疫程序完成全程接种的人员,无需重复接种[1]。孕妇在孕期的任一阶段均可接种IIV,只要本年度流感疫苗开始供应,可尽早接种[1]。
1.3.4 接种部位和途径IIV接种采用肌内注射(皮内注射制剂除外)。成人和 > 1岁儿童首选上臂三角肌接种疫苗,6月龄至1岁婴幼儿的接种部位以大腿前外侧为最佳[4, 37]。LAIV3的接种采用鼻内喷雾法,严禁注射。
1.3.5 接种禁忌[1]对疫苗中所含任何成分包括辅料、甲醛、裂解剂、抗生素等过敏者禁止接种。伴或不伴发热症状的急性疾病者,建议症状消退后再接种。以下人群不建议接种LAIV:接种前48 h服用过流感抗病毒药物者;患有哮喘的2~4岁儿童;因使用药物、人类免疫缺陷病毒(HIV)感染等原因造成免疫功能低下者;需要与严重免疫功能低下者进行密切接触的人群;孕妇和使用阿司匹林或含有水杨酸成分药物治疗的儿童和青少年。
(1.4) 预防接种不良反应和使用任何药物一样,接种疫苗有可能造成严重的过敏反应、其他严重损伤或死亡,但是可能性极小。
1.4.1 裂解IIV(1)常见不良反应 全身反应为发热、寒颤、头痛、头昏、关节痛、疲劳/乏力、瘙痒、皮疹,局部反应为接种部位出现红、肿、痛、硬结等。一般在注射后1~2 d内自行消失,不需处理。
(2)罕见不良反应 可出现一过性感冒症状和全身不适,可自行消失,不需特别处理;重度发热应采用物理方法或药物对症处理,以防高热惊厥。
(3)极罕见不良反应 过敏性皮疹:一般在接种疫苗后72 h内出现荨麻疹,应及时就诊,给予抗过敏治疗;过敏性紫癜:出现过敏性紫癜反应要及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎;过敏性休克:一般在接种疫苗后1 h发生,应及时采取注射肾上腺素等抢救措施;血管性水肿:肿胀通常出现在头颈部,包括面部、嘴唇、舌、咽喉或身体其他部位。
1.4.2 亚单位IIV(1)常见不良反应 同裂解IIV。
(2)偶见过敏反应 一般为皮肤反应,如瘙痒、荨麻疹或特异性皮疹。
(3)罕见不良反应 神经痛、感觉异常、惊厥、一过性血小板减少。
(4)极罕见不良反应 过敏性休克、脑脊髓膜炎、神经炎、吉兰-巴雷综合征。
1.4.3 LAIV(1)十分常见不良反应 发热(≥37 ℃)、流涕/鼻塞等。
(2)常见不良反应 咽痛、头痛、乏力或嗜睡、呕吐、食欲下降、咳嗽、上呼吸道感染、肌肉痛、恶心、易激惹或烦躁。
(3)偶见不良反应 变态反应、关节痛、鼻咽炎、寒颤。
(1.5) 注意事项 1.5.1 慎用情况(1)上次接种流感疫苗后6周内出现吉兰-巴雷综合征不是禁忌证,但应特别注意[1]。(2)多数鸡蛋过敏者可安全接种流感疫苗[1],但对曾发生除荨麻疹外的鸡蛋过敏者,例如血管性水肿、呼吸窘迫、头晕、反复呕吐或需要紧急医疗干预措施等情况,建议在具备识别和治疗严重过敏性疾病条件的专业医疗机构接种。(3)国外同类产品显示哮喘患者(任何年龄)、活动性喘息或反复喘息发作的 < 5岁儿童接种LAIV后喘息发作的风险增高,中国临床试验没有此类受试者的数据,建议此类人群慎用LAIV[1]。(4)家族和个人有惊厥史者、患慢性疾病者、有癫痫史者及过敏体质者不是禁忌证,但应特别注意。
1.5.2 特定事项(1)免疫抑制剂(如皮质类激素、细胞毒性药物或放射治疗)的使用可能影响接种后的免疫效果[38-39]。(2)服用流感抗病毒药物预防和治疗期间可以接种IIV,但不可以接种LAIV[4, 38-39]。(3)LAIV与其他减毒活疫苗接种应至少间隔4周[4, 38-39]。(4)IIV与其他灭活疫苗或减毒活疫苗可同时在不同部位接种[40]。
2、肺炎球菌疫苗 (2.1) 疫苗针对疾病 2.1.1 病原学肺炎球菌疾病(pneumococcal disease,PD)由肺炎球菌(Streptococcus pheumoniae,Spn)引起。Spn是革兰阳性双球菌,有荚膜多糖和菌体抗原。外覆荚膜多糖是Spn血清分型的依据,已鉴定出90余种血清型。荚膜多糖是Spn致病的重要毒力因子,也是制备肺炎球菌疫苗的最主要抗原[41-42]。
2.1.2 临床特征根据Spn感染部位不同,PD可分为侵袭性肺炎球菌疾病(invasive pneumococcal disease,IPD)和非侵袭性肺炎球菌疾病(non-invasive pneumococcal disease,NIPD)两大类。IPD指Spn侵入原本无菌的部位和组织所引发的感染,常见的有菌血症性肺炎、胸膜炎和脑膜炎;NIPD即Spn感染到原本与外环境相通的部分所引起的疾病,如中耳炎、鼻窦炎和非菌血症性肺炎等[41, 43]。
2.1.3 流行病学特征Spn广泛分布于自然界,除大猩猩外[44],人类是其唯一宿主。Spn是一种条件致病菌,可长期定植于人的鼻咽部而不引起临床疾病。一旦机体抵抗力下降时,Spn透过黏膜防御体系发生侵袭性感染[41, 45]。在中国 < 5岁呼吸道感染儿童中,Spn携带率为28.6%[46]。
Spn在人与人之间传播,一般经由呼吸道飞沫传播或由定植菌导致自体感染[5]。Spn是引起中国婴幼儿和老年人发病和死亡的重要病因[47-49]。2岁以下儿童是PD高发人群。平均75%的IPD病例和83%的肺炎球菌脑膜炎病例发生在 < 2岁儿童[50]。
WHO把PD和疟疾列为需“极高度优先”使用疫苗预防的疾病。WHO估计,2015年中国 < 5岁儿童肺炎球菌肺炎严重病例数近20万例,病死率为1%,死亡率为6.43/10万;肺炎球菌脑膜炎8 000余例,病死率为13%,死亡率为1.35/10万,其他严重病例近万例,病死率为10%,死亡率为1.21/10万[45]。
(2.2) 疫苗简介中国目前使用的肺炎球菌疫苗有13价肺炎球菌多糖结合疫苗(13-valent pneumococcal polysaccharide conjugate vaccine,PPCV13)和23价肺炎球菌多糖疫苗(23-valent pneumococcal polysaccharide vaccine,PPV23)。
2.2.1 疫苗免疫原性(1)PPCV13 用于婴幼儿的主动免疫,以预防由92个肺炎球菌血清型中的13种血清型(1、3、4、5、6A、6B、7F、9V、14、18C、19A、19F和23F)引起的侵袭性疾病,包括菌血症性肺炎、脑膜炎、败血症和菌血症等,但不能预防该疫苗以外的血清型别和其他微生物导致的侵袭性疾病。目前中国有三种不同载体的PPCV13上市或即将上市,即无毒白喉类毒素突变体(CRM197)、破伤风类毒素(TT)和破伤风/白喉类毒素(TT/DT)载体疫苗。
(2)PPV23 系采用23种最广泛流行、最具侵袭性的血清型肺炎球菌,包括1、2、3、4、5、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、I8C、19A、19F、20、22F、23F和33F血清型,经培养、提纯制成的多糖疫苗。PPV23为非T细胞依赖性抗原,在 < 2岁婴幼儿体内难以产生有效的保护性抗体。≥2岁儿童一般在疫苗接种后产生明显的抗体水平升高。中国一项在≥2岁儿童中开展的PPV23免疫原性研究表明,PPV23可诱导明显的免疫应答,23种血清型抗体的2倍增长率在51.49%~97.01%之间,8、9N、18C和33F型血清型增长率超过90%。在具有免疫能力的成年人中,用PPV23进行免疫接种可以诱导血清型特异性抗荚膜抗体水平显著增高。PPV23在≥65岁人群中能诱导出12种疫苗血清型(1、3、4、5、6B、7F、9V、14、18C、19A、19F、23F)的功能性免疫应答。老年人首次接种疫苗后4年以上复种疫苗,其抗荚膜抗体水平明显升高[51]。
2.2.2 疫苗效力或效果CRM197载体PPCV13在加拿大引入3年后,< 5岁儿童IPD发生率由18/10万降至14.2/10万。美国引入PPCV13后社区获得性肺炎住院率明显下降,< 2岁、2~4岁儿童和18~39岁成人中分别下降21%、17%和12%[45]。2010年美国波士顿开展的一项 < 60月龄儿童Spn携带率监测研究发现,与未接种者相比,PPCV13接种者中PPCV13血清型定植下降74%[52]。PPCV13对中国≤5岁儿童IPD致病菌株血清型覆盖率达87.7%[53]。
TT载体PPCV13上市临床试验为非劣性试验,2020年初上市,效果数据仍在积累中。TT/DT载体PPCV13上市临床试验为非劣性试验,目前尚未上市。
PPV23接种后可预防IPD的发生,但在老年人群中,其保护效力随着接种对象年龄的增加而下降,< 55岁人群中效力最高,≥85岁人群中效力最低,并随着时间的增长而下降(接种后 < 3年效果最好,接种后 > 5年效果最差)[54]。
(2.3) 接种建议 2.3.1 PPCV13(1)CRM197载体PPCV13免疫程序 基础免疫在2、4、6月龄各接种1剂,加强免疫在12~15月龄接种1剂。基础免疫首剂最早可以在6周龄接种,之后各剂间隔4~8周。目前,中国尚无本品应用于6月龄以上婴幼儿相应免疫程序的临床试验数据。
(2)TT载体PPCV13免疫程序 ①2~6月龄(最小满6周龄)婴儿:共接种4剂,首剂在2月龄(最小满6周龄)接种,基础免疫接种3剂,每剂次接种间隔2个月;于12~15月龄时加强接种第4剂。推荐首剂在3月龄接种,基础免疫接种3剂,每剂次接种间隔1个月;于12~15月龄时加强接种第4剂。②7~11月龄婴儿:基础免疫接种2剂,接种间隔至少2个月;于12月龄以后加强接种1剂(第3剂),与第2剂接种至少间隔2个月。③12~23月龄幼儿:接种2剂,接种间隔至少2个月。④2~5岁儿童:接种1剂。
(3)接种部位、途径和剂量 PPCV13仅供肌内注射。首选部位婴儿为大腿前外侧(股外侧肌),幼儿及儿童为上臂三角肌。肌内注射剂量为0.5 ml,注意避免神经和血管中或其附近部位注射PPCV13。
(4)接种禁忌 ①CRM197载体PPCV13:对产品中任何活性成分、辅料或白喉类毒素过敏者。②TT载体PPCV13:对产品中任何成分包括辅料、破伤风类毒素等过敏者。
2.3.2 PPV23(1)免疫程序 推荐用于2岁以上的易感人群,尤其是以下重点人群:①50岁以上(含50岁)者可作常规接种;②患有可增加肺炎球菌感染性疾病危险的慢性疾病者,如心血管疾病、肺部疾患、肝脏及肾脏功能受损者;③免疫缺陷患者,如脾切除者或是由镰状细胞性疾病及其他原因引起的脾功能障碍者;④患有其他慢性疾病而可能感染肺炎球菌的高危人群(如乙醚滥用)及并存如糖尿病、慢性脑脊髓液渗漏、免疫抑制等疾病患者,或是反复发作的上呼吸道疾病,包括中耳炎、副鼻窦炎等疾病患者;⑤何杰金氏病患者;⑥群体接触密切者,如寄宿学校、养老院及其他相似场所的人群;⑦具有发生流行性感冒并发症,特别是肺炎的高危人群;⑧当疫苗中含有的某型肺炎球菌在社区人群爆发流行时的高危人群。
推荐常规免疫接种程序:①何杰金氏病患者如需接种疫苗,可在治疗开始前两周给予。治疗期间不主张免疫接种;②免疫缺陷患者,应于术前两周接种;③脾切除者,每5年加强免疫一次,每次注射剂量0.5 ml;④对10岁以下脾切除或患有镰状细胞性贫血的儿童,应每隔3~5年加强免疫一次。
(2)接种部位、途径和剂量 上臂外侧三角肌皮下或肌内注射。每次注射0.5 ml。PPV23还可于大腿中外侧皮下或肌内注射。
(3)接种禁忌 对疫苗中任何成分过敏者禁用。
(2.4) 预防接种不良反应 2.4.1 PPCV13(1)常见不良反应 ①CRM197载体PPCV13:十分常见:食欲下降、易激惹、嗜睡/睡眠增加、入睡困难/睡眠减少、发热,注射部位发红、硬结/肿胀或疼痛/触痛,幼儿接种后注射部位发红或硬结/肿胀可达2.5~7.0 cm。常见:腹泻、呕吐、皮疹、超过39 ℃的发热,婴儿接种后注射部位发红或硬结/肿胀可达2.5~7.0 cm,注射部位疼痛/触痛并影响运动。偶见:哭闹、惊厥(包括热性惊厥)、荨麻疹或荨麻疹样皮疹、注射部位硬结/肿胀或发红 > 7.0 cm。②TT载体PPCV13:十分常见:发热、腹泻、局部发红。常见:哭闹、咳嗽、恶心/呕吐、乏力/嗜睡、变态反应,局部肿胀、疼痛、硬结,偶见肌肉痛、局部瘙痒。
(2)罕见不良反应 CRM197载体PPCV13:过敏反应(包括面部水肿、呼吸困难和支气管痉挛)、低张力-低反应发作。
2.4.2 PPV23(1)常见不良反应 注射部位出现暂时的疼痛、红肿、硬结和短暂的全身发热反应等轻微反应,一般均可自行缓解,必要时可给予对症治疗。
(2)罕见不良反应 头痛、不适、虚弱无力、淋巴结炎、关节痛、肌痛,皮疹、荨麻疹、血清病或其他过敏性反应。对稳定的特发性血小板减少性紫癜的患者,会极偶然地在接种后2~14 d出现血小板减少复发,可持续2周。罕有神经系统异常的报道,如感觉异常、急性神经根病变等,但与接种疫苗的因果关系尚未被证实。
(2.5) 注意事项 2.5.1 PPCV13(1)处于发热、急性病、慢性病急性发作期者应暂缓接种。(2)血小板减少症、任何凝血障碍或接受抗凝血剂治疗者和免疫功能受损者(例如恶性肿瘤、肾病综合征患者)慎用。(3)不能保证所有受种者不会罹患肺炎球菌性疾病。(4)暂不推荐CRM197载体PPCV13与其他免疫规划疫苗或常规儿童疫苗同时接种。(5)在任何情况下,TT载体PPCV13中的破伤风类毒素不能代替常规破伤风类毒素的免疫接种。(6)在≥24月龄的镰刀型细胞贫血症、无脾、HIV感染、慢性疾病或其他免疫功能受损的儿童中,使用PPCV13不能代替PPV23。
2.5.2 PPV23(1)处于发热、急性病、慢性病急性发作期者应暂缓接种。(2)血小板减少症、任何凝血障碍或接受抗凝血剂治疗者和免疫功能受损者(例如恶性肿瘤、肾病综合征患者)慎用。(3)孕期和哺乳妇女不应接种。(4)用于正在进行免疫抑制治疗的患者时,血清中可能不出现所期望的抗体反应。(5)有严重心脏和肺部疾病的患者接种时应极为慎重,需严密监测全身不良反应的发生。
3、含b型流感嗜血杆菌成分疫苗 (3.1) 疫苗针对疾病 3.1.1 病原学流感嗜血杆菌是嗜血杆菌属中最常见的对人有致病性的细菌,可引起原发性化脓性感染和呼吸道继发感染。流感嗜血杆菌是一种革兰阴性杆菌,根据荚膜多糖化学成分的不同,可分为a、b、c、d、e和f六个血清型,其中b型流感嗜血杆菌(hemophilus influenzae b,Hib)致病力最强,约95%的侵袭性流感嗜血杆菌疾病由Hib引起。Hib的荚膜含磷酸多聚核糖基核糖醇(PRP),能逃避补体介导的杀菌作用和脾的清除作用,躲避细胞吞噬,利于通过血流传播,是侵袭性疾病发病机制中的一个重要决定因素。< 24月龄儿童对纯多糖抗原尚不具备有效免疫应答能力,因此极易罹患侵袭性Hib疾病[55-57]。
3.1.2 临床特征Hib疾病主要经呼吸道飞沫传播,在鼻咽部定植后引起感染性疾病。Hib进入血液继发传播至其他部位,可引起侵袭性脑膜炎、肺炎、会厌炎、化脓性关节炎、心包炎、骨髓炎、蜂窝组织炎等[58-59];直接传播至邻近部位通常引起非侵袭性中耳炎、鼻窦炎、结膜炎等[58]。侵袭性Hib疾病多为脑膜炎,主要表现为发热、头痛、抽搐等,部分幸存者可患失明、耳聋、癫痫、学习障碍等精神和神经系统后遗症。肺炎主要表现为发热、咳嗽、呼吸急促等。会厌炎在发展中国家主要出现在幼龄儿童中,可有高热、咽痛、吞咽困难、喘鸣等[58]。
3.1.3 流行病学特征人类是Hib的唯一宿主[57]。主要传染源为病例和鼻咽部Hib携带者。Hib是人体常见寄生菌,鼻咽部Hib携带者是该菌的重要传播者,健康人群鼻咽部Hib携带率是侵袭性Hib疾病发生的重要影响因素。Hib主要经呼吸道飞沫传播,新生儿亦可因吸入羊水或出生时接触产道分泌物而感染Hib[60]。Hib疾病在秋冬季高发[61],常感染 < 5岁儿童,尤其是 < 2岁儿童发病风险最高[56],且发生在亚洲和非洲欠发达国家的病例居多[59]。患有某些免疫功能低下的基础疾病者也是Hib疾病发生的高危人群[56]。
(3.2) 疫苗简介中国目前使用的预防Hib疾病的疫苗包括单价Hib疫苗、AC群脑膜炎球菌(结合)b型流感嗜血杆菌(结合)联合疫苗(MPCV-AC/Hib)、无细胞百白破b型流感嗜血杆菌联合疫苗(DTaP-Hib)、无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗(DTaP-IPV/Hib)四种,均为非免疫规划疫苗。MPCV-AC/Hib还可预防A群和C群流行性脑脊髓膜炎,DTaP-Hib还可预防百日咳、白喉和破伤风,DTaP-IPV/Hib还可预防百日咳、白喉、破伤风和脊髓灰质炎。
3.2.1 疫苗免疫原性(1)Hib疫苗 对侵袭性Hib疾病具备短期保护效果的血清学抗体水平为抗PRP IgG > 0.15 μg/ml。在完成含Hib成分疫苗基础免疫1个月后,抗PRP IgG≥1.0 μg/ml,表明对侵袭性Hib疾病具备了长期抵御能力[55]。根据载体蛋白不同,目前上市使用的Hib疫苗包括破伤风类毒素载体(PRP-T)、白喉类毒素无毒突变体载体(PRP-CRM197)和脑膜炎球菌外膜蛋白复合体载体(PRP-OMP)疫苗。
PRP-T和PRP-CRM197载体疫苗的免疫原性相似,在基础免疫后95%以上受种者抗PRP IgG > 0.15 μg/ml,且大部分受种者的抗体水平超过1.0 μg/ml,具有很好的免疫原性[57];在第二年加强接种1剂后两种疫苗均可诱导良好的加强免疫应答,97%以上受试者抗PRP IgG≥1.0 μg/ml,具备长期抵御能力[57, 60, 62]。接种1剂或2剂PRP-OMP载体疫苗后即可在更多儿童中诱导出超过阈值(0.15 μg/ml或1.0 μg/ml)抗PRP IgG;12~15月龄加强免疫1剂PRP-OMP载体疫苗后也可诱导明显的加强免疫应答,但弱于PRP-T和PRP-CRM197载体疫苗,因此更适用于早发性Hib疾病高发的人群[55, 57]。
(2)MPCV-AC/Hib 根据上市前临床研究数据,2~5月龄、6~11月龄、12~71月龄儿童分别完成3剂次、2剂次、1剂次免疫后,抗A群脑膜炎球菌抗体阳转率分别为100%、99.63%、97.93%,抗C群脑膜炎球菌抗体阳转率分别为92.66%、99.27%、97.93%,抗Hib抗体≥1.0 μg/ml比例分别为95.75%、95.97%、92.76%,抗Hib抗体≥0.15 μg/ml比例分别为96.53%、96.34%、92.76%[63]。
(3)DTaP-Hib 根据上市前临床研究数据,完成3剂次基础免疫后,抗白喉抗体阳转率为100%,抗破伤风抗体阳转率为100%,抗Hib抗体阳转率为98.79%,抗百日咳毒素(PT)抗体阳转率为98.06%,抗百日咳丝状血凝素(FHA)抗体阳转率为97.33%[64]。
(4)DTaP-IPV/Hib 在中国开展的研究显示,DTaP-IPV/Hib完成2-3-4月龄和3-4-5月龄基础免疫后,抗破伤风抗体、抗白喉抗体、抗1型和2型脊髓灰质炎抗体、抗PT抗体阳转率均达100%,抗3型脊髓灰质炎抗体阳转率分别达100%和99.6%,抗PRP抗体≥0.15 μg/ml比例分别为97.6%和99.1%,抗PRP抗体≥1.0 μg/ml比例分别为92.1%和95.6%,抗FHA抗体阳转率分别为98.0%和99.6%[65]。
3.2.2 疫苗效力或效果系统综述发现,Hib疫苗对侵袭性Hib疾病的效力达到84%(95%CI:69%~92%)[66]。PRP-T、PRP-CRM197、PRP-OMP载体Hib疫苗的效力分别82%、86%、86%,没有显著性差异[66]。研究观察显示,接种3剂Hib疫苗对侵袭性Hib疾病的保护效果为95%(95%CI:82%~99%),对确诊Hib脑膜炎的保护效果为91%(95%CI:73%~97%)[67],接种Hib疫苗能产生良好的长期保护效果,可大幅降低Hib疾病的发生率。基础免疫的接种间隔均为1或2个月,接种间隔的不同基本上不影响疫苗效果[68],且含有加强剂次的Hib疫苗免疫程序的免疫持久性较好[69]。此外,接种含Hib成分的联合疫苗对Hib疾病的保护效果与接种单价Hib相似。
3.2.3 疫苗安全性(1)Hib疫苗 中国研究显示,Hib疫苗的不良反应很少见,且反应轻微[56, 58]。约20%~25%的受种者在接种后24 h内出现接种部位的疼痛或触痛,可在3 d内自行缓解,约2%的受种者接种后出现发热[62]。
(2)MPCV-AC/Hib 根据上市前临床试验观察和中国相关研究,受试者全身反应和局部反应均以轻、中度反应为主。常见全身不良反应为发热、烦躁、腹泻、厌食、呕吐、乏力、皮疹,其中消化道症状较为明显,常见的局部不良反应为发红、肿胀、硬结、疼痛,偶见水泡、瘙痒[70]。
(3)DTaP-Hib 中国DTaP-Hib大规模上市后安全性观察显示,DTaP-Hib不良反应/事件发生率低,全身反应多为发热和呕吐,局部反应多为发热和肿胀,随接种剂次数增加局部和全身不良反应发生率增加,疫苗具有良好的安全性[71];此外,中国研究显示,上臂三角肌、臀部肌肉和股外侧肌3个部位接种DTaP-Hib不良反应发生率均较低,均具有较好的安全性,其中股外侧肌接种的不良反应发生率最低[72]。
(4)DTaP-IPV/Hib DTaP-Hib-IPV安全性和免疫原性研究显示,DTaP-Hib/IPV多数主动监测的不良反应为轻度,采用2-3-4月龄或3-4-5月龄基础免疫或18~20月龄加强免疫接种DTaP-Hib/IPV主动监测注射部位发生任何反应的总例数小于分别同时接种的DTaP、IPV、Hib疫苗组[65]。常见的局部反应为注射部位触痛和发红,常见的全身反应为发热、异常哭闹、食欲下降等。
(3.3) 接种建议 3.3.1 免疫程序(1)Hib疫苗 6月龄以下儿童:基础免疫共3剂,2或3月龄开始接种,间隔1~2个月(至少4周),在18月龄加强免疫1剂;6~12月龄儿童,基础免疫共2剂,间隔1~2个月(至少4周),在18月龄加强免疫1剂;13~59月龄儿童:接种1剂。加强免疫与基础免疫最后1剂至少间隔8周[56]。
(2)MPCV-AC/Hib 适用于2~71月龄儿童。2~5月龄接种3剂;6~11月龄接种2剂;12~71月龄接种1剂。各剂次间隔至少1个月。
(3)DTaP-Hib 适用于≥3月龄婴幼儿。3月龄起,出生6个月内进行3剂基础免疫,间隔1个月,18~24月龄加强免疫1剂。
(4)DTaP-IPV/Hib 适用于≥2月龄婴幼儿。2-3-4或3-4-5月龄进行3剂基础免疫;18月龄加强免疫1剂。
3.3.2 接种部位、途径和剂量Hib疫苗每剂次0.5 ml,于上臂外侧三角肌或大腿前外侧(婴幼儿)肌内注射。
3.3.3 接种禁忌已知对Hib疫苗任何成分过敏特别对破伤风类毒素过敏者;既往接种Hib疫苗后有过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;严重心脏疾病、高血压者;患肝脏疾病、肾脏疾病者。
(3.4) 预防接种不良反应(1)常见不良反应 接种Hib疫苗后可出现发热,注射部位可出现轻微红肿、硬结和压痛,偶有局部瘙痒感、烦躁、嗜睡、呕吐、腹泻、食欲不振、头痛和皮疹。
(2)罕见不良反应 高热[73]。
(3)极罕见不良反应 过敏性皮疹、血管神经性水肿、过敏性休克和热性惊厥[73]。
(3.5) 注意事项(1)慎用情况 家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女慎用Hib疫苗。
(2)特定事项 部分人群罹患侵袭性Hib疾病风险较高,包括早期补体成分缺乏症、免疫球蛋白缺乏症、功能性或解剖性无脾症、HIV感染者,造血干细胞移植受体、接受化疗或放疗的恶性肿瘤病例,这些特殊人群需尽早接种Hib疫苗[56]。
4、肠道病毒71型灭活疫苗 (4.1) 疫苗针对疾病 4.1.1 病原学肠道病毒71型(enterovirus type 71,EV71)是人类肠道病毒的一种,具有脊髓前角神经组织嗜性,可以引起中枢神经系统感染(无菌性脑炎和脑膜炎、脊髓灰质炎样麻痹)。基于全长VP1区核苷酸序列的差异,目前将EV71分为A、B、C、D、E、F和G七个基因型,B和C基因型分布较广,C4基因型为中国1998年以来EV71流行的优势基因型,分为C4a和C4b两个亚型,其中C4a亚型为2007年来引起中国手足口病(hand,foot and mouth disease,HFMD)重症和死亡病例的绝对优势亚型[74]。中国的EV71灭活疫苗是以C4a分支病毒株为基础研发的。
4.1.2 临床特征EV71感染临床表现差异较大,可呈隐性感染[75-76],也可发展为临床病例,其中以HFMD、疱疹性咽峡炎和神经系统感染最常见[77],部分患者可发生严重并发症,甚至死亡。EV71感染相关HFMD急性起病,以发热和手、足、口等部位斑丘疹或疱疹为主要特征,可伴有咳嗽、流涕、食欲不振、恶心、呕吐、头痛等症状,部分病例皮疹表现不典型。少数病例(尤其是 < 3岁者)病情进展迅速,在发病1~5 d左右出现脑膜炎、脑炎(以脑干脑炎最为凶险)、脑脊髓炎、肺水肿、循环障碍等,极少数病例病情危重,可致死亡,存活病例可留有后遗症。
4.1.3 流行病学特征EV71流行范围遍布全球。中国各地全年均有HFMD发生,夏季是主要流行季节,不同年度HFMD病原构成存在差异,但重症病例和死亡病例中始终以EV71为主[78]。EV71可通过粪-口途径以及接触患者的粪便、呼吸道分泌物(如打喷嚏喷的飞沫等)和疱疹液及被其污染的物品传播。患者和隐性感染者均可成为传染源,患者潜伏期也具有传染性。通常以发病后一周内传染性最强。HFMD主要发生在 < 5岁儿童,其中1岁组发病水平最高,年龄别发病率、情严重程度均随着年龄增长而下降,< 6月龄婴儿病情最重。由于儿童普遍易感且隐性感染比例较高,接触传播途径容易实现,因此2剂次易引起暴发。
(4.2) 疫苗简介 4.2.1 疫苗免疫原性EV71灭活疫苗具有良好的免疫原性[79-82],EV71灭活疫苗接种后28 d,血清抗体阳转率为88.1%~100%。目前关于EV71疫苗免疫持久性研究数据有限,根据对Ⅲ期临床研究对象的跟踪观察[79-80],接种后56 d至8个月,EV71中和抗体滴度有所下降,8~14个月抗体水平处于相对稳定状态,但抗体阳性率未见下降。免疫后两年的观察结果显示,中和抗体水平和临床保护效力仍然维持在较高水平[83]。
4.2.2 疫苗效力或效果接种EV71灭活疫苗可刺激机体产生抗EV71的免疫力,用于预防EV71感染所致的HFMD。接种2剂次EV71灭活疫苗对于EV71感染相关HFMD的保护效力为90.00%~97.45%,对于EV71引起的相关疾病的保护效力为80.4%~88.0%。受样本量限制,对EV71感染所致重症病例的保护效力尚缺乏准确估计。对柯萨奇病毒A16型(CV-A16)和其他肠道病毒感染HFMD无保护效力[84-85]。不同基因型毒株的免疫原性研究结果显示,疫苗株对EV71不同基因型和亚型具有交叉保护作用[85-86]。
4.2.3 疫苗安全性EV71灭活疫苗具有良好的安全性,接种后的局部反应主要表现为接种部位红、硬结、疼痛、肿胀、瘙痒等,以轻度为主,持续时间不超过3 d,可自行缓解。全身反应主要表现为发热、腹泻、食欲不振、恶心、呕吐、易激惹等,呈一过性。严重程度达到3级以上的所有症状(如发热、腹泻、恶心、呕吐等)的发生率在疫苗接种组和对照组之间无显著性差异。
(4.3) 接种建议EV71灭活疫苗为非免疫规划疫苗,需在受种者或其监护人的知情同意下自愿自费接种。
4.3.1 免疫程序EV71型灭活疫苗(Vero细胞):接种对象为6月龄至3岁EV71易感者,基础免疫程序为2剂次,间隔1个月。EV 71型灭活疫苗(人二倍体细胞):接种对象为6月龄至5岁EV71病毒易感者,基础免疫程序为2剂次,间隔1个月。
4.3.2 接种部位、途径和剂量上臂三角肌肌内注射,每1人次剂量为0.5 ml。
4.3.3 接种禁忌对EV71灭活疫苗中任何一种成分过敏者;发热、急性疾病期患者和慢性疾病急性发作者;严重慢性疾病、过敏体质者。
(4.4) 预防接种不良反应 4.4.1 常见不良反应常见全身不良反应包括发热、腹泻、食欲不振/厌食、烦躁/易激惹、腹泻、恶心、呕吐、嗜睡、乏力等,常见局部不良反应包括注射部位疼痛、发红、肿胀、硬结等,必要时可对症治疗。
4.4.2 罕见不良反应罕见全身不良反应包括变态反应/过敏反应、咳嗽、流涕、感冒/上呼吸道感染症状等,罕见局部不良反应包括瘙痒等,通常不需特殊处理,必要时及时到医院就诊。
(4.5) 注意事项 4.5.1 慎用情况患有血小板减少症或者出血性疾病者,肌内注射EV71灭活疫苗可能会引起注射部位出血,应慎重接种。正在接受免疫抑制治疗或免疫功能缺陷的患者,接种EV71灭活疫苗产生的免疫应答可能会减弱,接种应推迟到治疗结束后或确保其得到了很好的保护。对慢性免疫功能缺陷的患者,即使基础疾病可能会使免疫应答受限,也应推荐接种。未控制的癫痫患者和其他进行性神经系统疾病(如吉兰-巴雷综合征等)患者,应慎重考虑是否接种。
4.5.2 特定事项接种EV71灭活疫苗与注射人免疫球蛋白应至少间隔1个月以上,以免影响免疫效果。
5、轮状病毒疫苗 (5.1) 疫苗针对疾病 5.1.1 病原学轮状病毒属呼肠孤病毒科,病毒颗粒分为3层,内含11个双股RNA片段组成的病毒基因组,11个基因片段可发生重配,导致自然界中有大量不同病毒株[87-88]。病毒外层衣壳含有结构蛋白VP7和VP4,可诱导产生中和抗体。VP7蛋白目前确定有14种VP7抗原(G血清型),是免疫保护的主要决定型。VP4蛋白目前有26种VP4抗原(P血清型),不同P血清型之间会发生普遍的交叉反应[88-89]。目前采用G和P血清型双命名系统确定毒株类型。根据内层衣壳蛋白VP6抗原特征将轮状病毒分为10个组群(A~J组)。A组轮状病毒可感染人和多数哺乳动物,也是5岁以下儿童急性胃肠炎最常见的病原体。
5.1.2 临床特征轮状病毒感染的临床表现为急性胃肠炎,呈渗透性腹泻病,潜伏期为1~3 d,起病急,发热,呕吐,水样腹泻[88, 90]。胃肠症状通常会在3~7 d后消失,一般会完全痊愈,但严重者可出现脱水症状、电解质失衡、休克甚至死亡。轮状病毒初次感染引起的轮状病毒胃肠炎(rotavirus gastroenteritis,RVGE)严重程度明显重于重复感染,初次感染可以减少后续感染的次数和严重程度[91]。
5.1.3 流行病学特征轮状病毒感染途径为粪-口途径,也可以通过人-人直接传播,或经污染的物品间接传播。全球绝大多数儿童在3岁以前已感染过轮状病毒,以6月龄至2岁为主[88],多数发展中国家儿童在1岁以前大多已经感染。轮状病毒是全球5岁以下儿童严重的脱水性腹泻的主要致病原因,全世界因急性胃肠炎而住院的儿童中,50%~60%是轮状病毒感染引起的。轮状病毒胃肠炎每年造成44万~60万儿童死亡,主要集中在发展中国家[92]。在温带地区,轮状病毒胃肠炎发病呈典型的冬季高峰,而在热带地区全年均有发病。中国轮状病毒腹泻主要流行高峰期为每年9月至次年2月,南北方地区相差1~2个月[88]。
(5.2) 疫苗简介中国目前使用的轮状病毒疫苗有单价口服轮状病毒疫苗(monovalent oral rotavirus vaccine,RV1)和五价口服轮状病毒疫苗(pentavalent oral rotavirus vaccine,RV5)。
5.2.1 疫苗免疫原性RV1为口服减毒活疫苗,系用羊源轮状病毒减毒株(LLR株)[88],接种新生小牛肾细胞,经培养、收获病毒液并加入蔗糖和乳糖保护剂制成,可刺激机体产生针对A群轮状病毒的免疫力。RV5用于预防轮状病毒G1、G2、G3、G4和G9血清型感染导致的婴幼儿RVGE,包含5种人-牛的轮状病毒重配株,其中4种重配株表达人源毒株VP7蛋白(血清型G1、G2、G3、G4之一)和牛毒株VP4蛋白(血清型P7),1种重配毒株表达人毒株的VP4蛋白(血清型P1A[8])和牛毒株的VP7蛋白(血清型G6)[88, 93]。
5.2.2 疫苗效力或效果轮状病毒疫苗保护率存在明显的地区差异性,且对不同血清型RVGE的保护率也有所差异[94]。口服轮状病毒疫苗可以不同程度地降低轮状病毒感染性腹泻的发病,减少重症病例和缩短病程[92]。在发达国家,RV5对轮状病毒(不分血清型别)感染所致急性肠炎的保护效果达87%;在中等发展水平国家,RV5对轮状病毒(不分血清型别)感染所致急性肠炎的保护效果略低,仅为62%[95]。RV5的效力已经在工业化国家和拉丁美洲部分发展中国家得到证实。在国外Ⅲ期临床试验中,给予3剂RV5,预防任何血清型导致的任何程度RVGE、重度RVGE的保护效力分别为71.8%、98%。中国Ⅲ期临床数据显示,完成3剂次RV5接种预防任何血清型导致的任何程度RVGE、重度RVGE的效力分别为69.3%、95.5%。在欧洲和美洲一些国家大规模接种RV5后,2岁以内幼儿的腹泻就诊率减少86%、腹泻急诊率减少94%、因RVGE住院率减少96%[96]。
基于目前已发表文献,未见RV1上市前Ⅲ期临床试验保护效力的数据,只有对于上市后保护效果的评估。广州市、正定市和北京市进行的三项病例对照研究显示,接种1剂及以上RV1对预防任何程度RVGE的保护效果为35%,对重度RVGE的保护效果为52%~88%[97]。在中国一项对3 550名0~5岁儿童接种国产RV1的研究结果显示,该国产RV1可诱导机体产生G1、G4型血清中和抗体,保护率为68%[98]。
5.2.3 疫苗安全性有研究显示,儿童接种RV1的总体不良反应率为3.66%,不良反应包括发热1.88%、消化道症状(如呕吐、腹泻、食欲下降)1.71%、皮疹0.05%,均为一过性反应,且预后良好,相关肠套叠或死亡病例未见报道[99]。RV5在7万多健康婴儿的Ⅲ期临床试验中,未发现疫苗相关的严重不良事件,包括肠套叠[96]。
(5.3) 接种建议 5.3.1 免疫程序RV1主要用于2月龄至3岁婴幼儿,每年应服一次。RV5接种对象为6 ~32周龄婴幼儿,全程免疫共3剂,6~12周龄开始口服第1剂,每剂接种间隔4~10周;第3剂接种不应晚于32周龄。
5.3.2 接种部位、途径和剂量RV1开启瓶盖,用吸管吸取本疫苗,直接喂于婴幼儿,用量为每人一次3 ml。RV5仅限口服,不能用于注射,每支2 ml,用量为每人一次2 ml。
5.3.3 接种禁忌有如下情况者不得接种疫苗:对该疫苗所含任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者。
(5.4) 预防接种不良反应(1)常见不良反应 一过性轻度呕吐和腹泻,一过性发热。
(2)罕见不良反应 重度发热,持续呕吐、腹泻超过3 d或腹泻超过5次/d。
(3)极罕见不良反应 过敏性皮疹、过敏性休克、过敏性紫癜和肠套叠。
(5.5) 注意事项 5.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、过敏体质者;接受类固醇等药物治疗;癌症或使用X射线或药物的癌症治疗;存在胃肠道功能紊乱的婴儿,包括活动性胃肠道疾病、慢性腹泻和生长发育迟缓,以及先天性腹部异常和腹部手术史的婴儿;有肠套叠既往史的婴儿[100]。
5.5.2 特定事项RV1说明书建议接受注射免疫球蛋白者应至少间隔3个月以上服用该疫苗。RV5可以在注射免疫球蛋白之前、同时或之后的任何时间接种:目前已证实免疫球蛋白(包括肌肉、静脉注射)不会干扰口服轮状病毒疫苗的免疫应答,其主要原因在于被动获得的抗体(免疫球蛋白)可能难以灭活黏膜表面接种的疫苗[101]。
6、水痘减毒活疫苗 (6.1) 疫苗针对疾病 6.1.1 病原学水痘由水痘-带状疱疹病毒(varicella zoster virus,VZV)感染引起。VZV属于疱疹病毒科,仅有一个血清型。VZV对外界抵抗力弱,不耐热和酸,不能在痂皮中存活,能被乙醚等消毒剂灭活。人是VZV唯一的自然宿主[102]。
6.1.2 临床特征水痘是一种高度传染性疾病,可经空气途径和接触传播,易感家庭接触者的继发感染率在61%以上[103-104]。典型的水痘患者出现广泛的水疱样皮疹,集中于头部和躯干,并伴有发热。皮疹分批出现,每一批皮疹通常在24 h内从斑点进展为丘疹、小疱、脓疱并最终结痂。新一批皮疹于随后几天陆续发生,因而病程中患处可见处于不同愈合阶段的皮疹,伴有瘙痒并可结痂[57]。除瘙痒性皮疹外,VZV还会引起疲劳、食欲不振、头痛等不适。在极罕见的情况下,还可能出现皮肤感染、肺炎、脑炎、血管炎等并发症[105]。
6.1.3 流行病学特征水痘在全球均有发生,未实施疫苗接种之前,几乎所有人至中年期都受过感染,学龄前儿童或刚入小学的儿童水痘发病率最高。冬、春季为水痘发病高峰。局部的水痘暴发多见于儿童聚集场所,如儿童保育中心和学校,但也有报道发生于医院、难民营、军队等成年人为主的场所[106]。中国水痘多暴发于儿童聚集场所,与国外报道一致,学生(52%)、幼托儿童(19%)和散居儿童(17%)为水痘高发人群[107]。根据2007年在山东省、甘肃省和湖南省开展的入户调查结果估算,中国全人口水痘发病率为358/10万,水痘发病从3岁开始升高,7~9岁达到峰值[108]。
(6.2) 疫苗简介1997年进口水痘减毒活疫苗(varicella attenuated live vaccine,VarV)在中国上市,2000年后多个国产VarV陆续上市,采用与国外一致的Oka株。目前中国使用的VarV均为国产,除天津市、上海市、苏州市、青岛市、广州市等地区将VarV纳入免疫规划外,大部分地区仍将VarV作为非免疫规划疫苗实施自愿接种。
6.2.1 疫苗免疫原性国外研究显示,接种1剂次VarV后,85%~89%的受种者达到保护性抗体水平;接种2剂次后,> 99%的受种者达到保护性抗体水平。首次接种后无论是间隔3个月还是3~5年接种第2剂,均可诱导体液免疫的显著增强[57]。
2012年一项中国儿童接种1剂次VarV获得的免疫原性系统评价显示,6个FAMA法研究的合并抗体阳转率为95.77%,抗体GMT为1:38.07;5个ELISA法研究的合并抗体阳转率为85.21%,GMT为1:831.79[109]。一项国产VarV在初次免疫不同间隔期后加强免疫的免疫原性研究显示,1~7岁的儿童初次免疫后1、3、5年接种第2剂VarV后抗体水平显著升高,血清抗体阳转率均为100%,GMT分别为1:84.82、1:40.65、1:47.03[110]。
6.2.2 疫苗效力或效果WHO对VarV的流行病学保护效果系统综述显示,儿童接种1剂次VarV对预防任何程度、中度或重度、重度水痘的保护效果分别约为80%、95%、99%;儿童接种2剂次VarV对任何程度的水痘的保护效果优于1剂次[106]。中国研究发现,儿童接种1剂次VarV后1个月血清抗体阳转率为98%,两年后下降至85%[111],存在突破病例发生风险[112]。
(6.3) 接种建议 6.3.1 免疫程序[113-114]无VarV免疫史的1~12岁儿童接种2剂次VarV,分别为12~18月龄、3~4岁各接种1剂次。未完成接种的目标儿童,尽快补齐2剂次,接种间隔不少于3个月。≥13岁人群接种2剂次VarV,接种间隔4~8周(仅适用提供≥13岁接种程序的疫苗)。
6.3.2 接种部位、途径和剂量上臂外侧三角肌下缘附着处皮下注射。每1剂次人用剂量为0.5 ml。
6.3.3 接种禁忌已知对VarV所含任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;妊娠期妇女;免疫缺陷、免疫功能低下或正在接受免疫抑制治疗者;患先天性免疫病或密切接触的家庭成员中有先天性免疫疾病史者;未控制的脑病、癫痫和其他进行性神经系统疾病者。
(6.4) 预防接种不良反应全国AEFI监测数据表明,VarV具有良好的安全性,不良反应报告发生率在预期范围内,主要以发热和过敏性皮疹为主,绝大多数病例均治愈或好转[115]。
6.4.1 常见不良反应十分常见:发热。常见:接种部位发红、肿胀、瘙痒、疼痛、硬结;全身不良反应有腹泻、皮疹、哭闹、嗜睡、厌食、头痛、乏力。
6.4.2 罕见不良反应重度发热。
6.4.3 极罕见不良反应过敏性皮疹、过敏性休克、过敏性紫癜、血小板减少性紫癜。
(6.5) 注意事项 6.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女。
6.5.2 特定事项注射免疫球蛋白者应至少间隔3个月以上接种VarV,以免影响免疫效果;育龄妇女注射VarV后应至少避孕3个月;在接种VarV后6周内避免使用水杨酸盐类药物。
7、带状疱疹疫苗 (7.1) 疫苗针对疾病 7.1.1 病原学带状疱疹是潜伏在人体感觉神经节的水痘-带状疱疹病毒(varicella-zoster virus,VZV)再激活后所引起的以皮肤损害为主的疾病。VZV属疱疹病毒科,仅有一个血清型。VZV对外界抵抗力弱,不耐热和酸,不能在痂皮中存活,能被乙醚等消毒剂灭活。人是已知自然界中的唯一宿主[102]。
7.1.2 临床特征带状疱疹发病时会出现沿某一周围神经区域呈带状排列的成簇水疱,多发生在身体的一侧,并伴有局部剧烈疼痛[116]。极罕见的情况下可能导致肺炎、听力障碍、失明、脑炎或死亡。带状疱疹最常见的并发症是带状疱疹后神经痛(postherpetic neuralgia,PHN)。即使在皮疹消失后,神经痛也会发生在带状疱疹出现的区域,可能持续数月或数年[117]。
7.1.3 流行病学特征带状疱疹是皮肤科常见病,一般认为带状疱疹主要不是通过外源性感染,而是婴幼儿期患水痘后病毒潜伏性感染的再激活所致。带状疱疹常出现在年龄较大、免疫抑制或免疫缺陷的人群中,疾病痊愈后仍可复发,复发率为1%~6%[116]。研究证实,带状疱疹发病率与年龄增加紧密相关,全球普通人群、60岁人群、80岁人群带状疱疹发病率分别为每1 000人年3~5例、6~8例、8~12例[116, 118]。带状疱疹的严重性也随年龄增长而增加,表现为随年龄增加PHN发生率增加、持续时间延长和其他并发症增多[116-118]。一项调查结果显示,中国每年新增带状疱疹患者约277万例[119]。
(7.2) 疫苗简介目前中国使用的带状疱疹疫苗为进口的重组带状疱疹疫苗(recombinant zoster vaccine,RZV)(CHO细胞),属于非免疫规划疫苗。
7.2.1 疫苗免疫原性针对VZV的T细胞介导的免疫应答(VZV-T cell-mediated immunity,VZV-CMI)是维持病毒潜伏和预防带状疱疹的充分必要条件[120]。两项关键Ⅲ期临床研究的事后分析结果显示,97.8%的RZV受试者和2.0%的安慰剂受试者表现出体液免疫应答;93.3%的RZV受试者和0.0%的安慰剂受试者表现出细胞免疫应答[121]。
7.2.2 疫苗效力全球18个国家和地区入组超过3万名受试者的两项关键Ⅲ期临床试验对≥50岁和≥70岁人群的疫苗效力进行评估,受试者以1:1的比例随机接受疫苗或生理盐水安慰剂[122-123]。结果显示,RZV在≥50岁人群中产生的保护效力为97.2%(95%CI:93.7%~99.0%),50~59岁和60~69岁年龄组人群中保护效力无显著性差异;在≥70岁人群中产生的保护效力为91.3%(95%CI:86.8%~94.5%),且疫苗接种4年内一直保持高水平保护效力。
7.2.3 免疫持久性长期随访研究表明,RZV诱导的免疫原性在首次疫苗接种后至少10年仍高于疫苗接种前水平。10年后体液免疫水平是接种前的6.0倍,细胞免疫水平是接种前的3.5倍。基于10年的观察数据建立数学模型,预测免疫原性在20年后仍高于接种前水平[124]。
(7.3) 接种建议RZV(CHO细胞)接种对象为≥50岁成年人,适用于预防带状疱疹,不适用于预防原发性水痘。
7.3.1 免疫程序接种两剂,第2剂与第1剂间隔2个月接种。如需改变免疫程序,第2剂在第1剂后2~6个月之间接种。
7.3.2 接种部位、途径和剂量首选接种部位为上臂三角肌肌内注射,每剂0.5 ml。
7.3.3 接种禁忌对疫苗中任一活性成分或辅料成分过敏者禁用。
(7.4) 预防接种不良反应[11] 7.4.1 常见不良反应常见的全身反应包括肌痛、疲乏、头痛、发热(≥37.5 ℃)、寒颤、胃肠道症状(恶心、呕吐、腹泻和腹痛)等;局部反应包括注射部位疼痛、发红、肿胀。大部分不良反应为轻至中度,且1~3 d可自行缓解。
7.4.2 罕见不良反应包括血管性水肿、皮疹、荨麻疹等超敏反应。由于这些事件为规模不详人群的自发报告,因此不一定能够可靠地估计其发生率或确定其与疫苗之间的因果关系。
(7.5) 注意事项 7.5.1 慎用情况血小板减少症患者或任何凝血功能紊乱患者。
7.5.2 特定人群接种(1)具有带状疱疹史的个体 临床数据显示,具有带状疱疹史的个体接种RZV后能够产生并维持较高的免疫应答。2剂次疫苗接种1个月后有90.2%(95%CI:81.7%~95.7%)的受试者产生免疫应答[125]。
(2)免疫功能低下人群 免疫功能低下人群是带状疱疹的高危人群,该人群接种带状疱疹疫苗具有重要意义。临床试验结果显示,受试者在自体造血干细胞移植后50~70 d接种RZV可以产生68.2%(95%CI:55.6%~77.5%)的保护效力[126];肾移植后4~18个月[127]、血液系统恶性肿瘤正在接受或已经完成免疫抑制治疗[128]、实体瘤正在接受或准备接受免疫抑制治疗[129]和HIV感染[130]的受试者接种RZV后均达到了主要免疫原性目标。
(3)妊娠期和哺乳期妇女 不能确定妊娠期和哺乳期接种RZV存在的相关风险,因此妊娠期和哺乳期妇女应避免接种。
7.5.3 与其他疫苗联合接种临床研究结果显示[131-133],RZV可以在不同部位与其他成人疫苗同时接种,如在实际工作中不能同时接种,可按照灭活疫苗的接种间隔原则接种。
8、人乳头瘤病毒疫苗 (8.1) 疫苗针对疾病 8.1.1 病原学人乳头瘤病毒(human papilloma virus,HPV)属乳头瘤病毒科,无包膜双链环状DNA病毒,由病毒蛋白衣壳和核心单拷贝的病毒基因组DNA构成。病毒衣壳由主要衣壳蛋白L1和次要衣壳蛋白L2组成,根据L1序列,目前HPV约有200种型别。
HPV呈高度组织特异性,可感染皮肤和黏膜的上皮细胞。根据HPV致癌性分为高危型HPV和低危型HPV,高危型HPV持续感染可引起子宫颈、阴道、外阴、肛门、阴茎、头颈等部位的癌前病变,病变可最终发展为浸润性癌;高危型HPV包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68。子宫颈癌主要由高危型HPV持续感染所致,在99.7%的子宫颈癌中都可检测到高危型HPV[134];高危型HPV的E6和E7蛋白在子宫颈癌组织内持续表达,是致癌的关键分子[135]。不同型别的高危型HPV致癌性不同[136],HPV16致癌性最强,其次是HPV18、31、33。低危型HPV感染可引起皮肤疣、肛门‑生殖器疣和复发性呼吸道乳头状瘤等疾病,大约90%的肛门-生殖器疣由HPV6、11引起[137]。
8.1.2 临床特征高危型HPV持续感染引起的最常见疾病是下生殖道和肛周的上皮内病变,包括低级别和高级别病变。其中,子宫颈、阴道、外阴和肛周的高级别上皮内病变是恶性肿瘤的癌前病变。高级别病变未及时诊治,有可能导致相应部位肿瘤的发生。低危型HPV持续感染会引起上述部位的良性病变、生殖器疣的发生。
8.1.3 流行病学特征HPV的传染源是患者和病毒感染者,传播途径主要为性途径传播、其次为母婴传播和皮肤黏膜接触传播。性生活过早、多性伴、吸烟、长期口服避孕药等是HPV感染的主要危险因素。HPV感染率高低主要取决于人群的年龄和性行为习惯,年轻的性活跃女性子宫颈部位HPV感染率最高,感染高峰年龄在20岁左右,第二个HPV感染高峰在40~45岁左右。
8.1.4 疾病负担据WHO/国际癌症研究署(International Agency for Research on Cancer,IARC)2018年数据显示,高危型HPV感染与全球约4.5%的癌症新发病例相关(约63万例),其中女性57万例、男性6万例[138]。HPV对子宫颈癌的归因危险度百分比可达到100%[139-140],而且全球每年由HPV导致的癌症中子宫颈癌所占比例最高,约占83%[141]。中国也面临着严峻的子宫颈癌疾病负担,据估计,2018年中国子宫颈癌新发病例近11万例,死亡近5万例,分别约占全球发病和死亡总数的20%和16%;且近年来发病率和死亡率呈现上升趋势。虽然HPV感染型别分布在不同地区、不同人群、不同级别子宫颈病变中有差别,但随着病变严重程度的升高,HPV16、18的比例显著升高;此外,与其他国家和地区相比,HPV 52和58在亚洲人群中更为常见,研究表明,2级及以上子宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)HPV阳性妇女有24.1%归因于HPV33、52、58感染[142]。
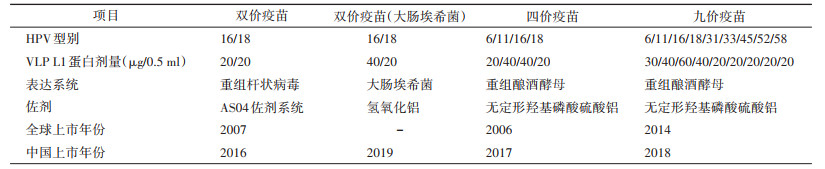
(8.2) 疫苗简介中国已上市使用的HPV疫苗信息见表 1。
(1)双价HPV疫苗 中国9~45岁女性按照0、1、6个月的免疫程序接种3剂双价HPV疫苗1个月后,HPV16、18抗体阳转率可达99.4%~100%[143];9~17岁女性接种后的抗体浓度是18~25岁女性的2~3倍[143]。
(2)双价HPV疫苗(大肠埃希菌) 中国9~45岁女性按照0、1、6个月免疫程序接种3剂疫苗后1个月,HPV16、18抗体阳转率均为100%,且9~17岁人群的抗体浓度均高于18~26岁人群[144-145]。9~14岁人群按照0、6个月接种2剂疫苗后HPV16、18血清抗体阳转率均为100%[145]。
(3)四价HPV疫苗 中国9~45岁女性按照0、2、6个月的免疫程序接种3剂四价HPV疫苗1个月后,20~45岁人群HPV6、11、16、18抗体阳转率均高于96%[146],9~19岁人群HPV6、11、16、18抗体阳转率均为100%[147]。
(4)九价HPV疫苗 国外16~26岁女性按照0、2、6个月龄接种3剂九价HPV疫苗后HPV6、11、16、18免疫反应与接种四价HPV疫苗相当,所有受种者HPV31、33、45、52、58型血清阳转率均高于98.4%[148-149]。对韩国、中国香港、中国台湾等地区女性的数据进行进一步分析发现了相似的结果[150]。
中国尚无HPV疫苗与其他疫苗同时接种的免疫原性数据和在特殊人群接种的免疫原性数据。
8.2.2 疫苗效力(1)双价HPV疫苗 双价HPV疫苗在中国的疫苗上市前临床试验研究中显示出良好的保护效力[151]。在18~25岁HPV16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的女性人群中,疫苗对HPV16、18相关的CIN1+和CIN2+的保护效力分别为93.2%(95%CI:56.1%~99.8%)和87.3%(95%CI:5.3%~99.7%);对6个月和12个月持续性感染的保护效力分别为96.3%(95%CI:85.9%~99.6%)、96.9%(95%CI:81.1%~99.9%)。
(2)双价HPV疫苗(大肠埃希菌) 在18~45岁HPV16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的中国女性中,疫苗预防HPV16、18相关的CIN2/3、原位腺癌(adenocarcinoma in situ,AIS)或宫颈癌的保护效力为100%(95%CI:55.7%~100%),预防6个月和12个月持续感染的效力分别为97.7%(95%CI:86.2%~99.9%)和95.3%(95%CI:70.7%~99.9%)[145]。
(3)四价HPV疫苗 在20~45岁HPV6、11、16、18中和抗体和DNA检测均阴性且完成3剂次疫苗接种的中国女性中开展的临床试验显示[152],对HPV6、11、16、18相关的CIN1、2、3、AIS和子宫颈癌的保护效力为100%(95%CI:70.9%~100%);对HPV6、11、16、18相关的6个月和12个月子宫颈持续性感染的保护效力分别为91.6%(95%CI:66.0%~99.0%)、97.5%(95%CI:85.1%~99.9%),对HPV6、11、16、18相关的子宫颈细胞学异常的保护效力为94.0%(95%CI:81.5%~98.8%)。
(4)九价HPV疫苗 国外在16~26岁未进行巴氏试验或检测阴性的健康女性中开展的以四价HPV疫苗为对照的临床试验显示[149],九价HPV疫苗对HPV31、33、45、52、58引起的CIN2+、VIN2/3或VaIN2/3的保护效力为96.7%(95%CI:80.9%~99.8%),6个月子宫颈、阴道、外阴、肛门部位持续性感染的保护效力为96.0%(95%CI:94.4%~97.2%);在韩国、中国香港、中国台湾等地区女性中的结果为95.8%(95%CI:87.8%~98.9%)[150]。
8.2.3 疫苗效果疫苗上市后在真实世界中预防癌症的效果需要数十年才能观察到,截至目前的研究仅能观察到在预防感染、生殖器疣和癌前病变方面的效果。中国尚缺乏疫苗在真实世界使用的效果数据。
最新发表的系统综述显示,HPV疫苗接种后5~8年,13~19岁和20~24岁女性中HPV16、18感染率分别下降83%和66%,13~19岁女性中HPV31、33、45感染率也显著下降54%。15~19岁、20~24岁和25~29岁女性中生殖器疣发病率分别下降67%、54%和31%。15~19岁和20~24岁男性中生殖器疣发病分别下降48%和32%。疫苗接种后5~9年,15~19岁和20~24岁筛查的女性中CIN2+发生率分别下降51%和31%。疫苗在年轻人群中的效果均优于年长人群[153]。
接种HPV疫苗的最终目标是通过预防主要致癌类型HPV感染进而达到预防浸润性子宫颈癌的发生。2020年一项瑞典近170万10~30岁女性的真实世界研究数据显示,与未接种人群相比,至少接种1剂四价HPV疫苗的女性浸润性子宫颈癌发病率在 < 17岁和17~30岁女性中分别下降88%和53%[154]。
8.2.4 疫苗免疫持久性最新研究结果显示,4种HPV疫苗均表现出较好的免疫持久性和长期保护效果,研究对象双价[155]和四价[135]HPV疫苗接种后12年、九价[149]HPV疫苗接种后7.6年、国产双价HPV疫苗[145]接种后5年疫苗相关型别抗体阳性率仍 > 90%,且未发现HPV疫苗型别相关癌前病变。疫苗的免疫持久性仍需继续观察。
8.2.5 疫苗安全性HPV疫苗在国内外上市前临床试验中表现出良好的安全性,4种HPV疫苗的不良反应以局部反应为主,多表现为一过性轻至中度症状,常见局部反应包括疼痛、发红和肿胀,全身反应主要有发热、头痛、眩晕、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛)等[145, 151-152, 156-157]。
中国尚无上市后监测的安全性数据。全球其他国家在上市后安全性监测中有吉兰-巴雷综合征[158-159]、复杂性区域疼痛综合征、体位性心动过速综合征等疾病的报告[160-163],但尚未发现HPV疫苗接种与这些罕见疾病存在因果关系。此外,HPV疫苗在与其他疫苗同时接种[139, 164],或用于自身免疫性疾病患者[165-167]、HIV感染者[168-169]、妊娠妇女[170-171]等人群中也未发现安全性风险增加。
(8.3) 接种建议WHO立场文件建议,由于子宫颈癌和其他HPV相关疾病是全球重要公共卫生问题,对未开始性生活的女孩进行HPV疫苗接种,将获得最佳的预防效果[172]。
8.3.1 免疫程序(1)双价HPV疫苗 适用于9~45岁女性。推荐于0、1和6月分别接种1剂次,共接种3剂。第2剂可在首剂后1~2.5个月之间接种,第3剂可在首剂后5~12个月之间接种。
(2)双价HPV疫苗(大肠埃希菌) 适用于9~45岁女性。推荐于0、1和6月分别接种1剂次,共接种3剂。第2剂可在首剂后1~2个月内接种,第3剂可在首剂后5~8个月内接种。9~14岁女性可选择采用0、6月分别接种1剂次(间隔≥5个月)。
(3)四价和九价HPV疫苗 四价HPV疫苗适用于9~45岁女性,九价HPV疫苗适用于16~26岁女性。推荐于0、2和6月分别接种1剂次,共接种3剂。首剂与第2剂的接种间隔至少1个月,第2剂与第3剂的接种间隔至少为3个月,所有3剂应在1年内完成。
8.3.2 接种部位、途径和剂量上臂三角肌肌内注射,每剂次接种0.5 ml。
8.3.3 接种禁忌对疫苗的活性成分或任何辅料成分过敏者禁用;注射疫苗后发生过敏者不应再次接种疫苗。
(8.4) 预防接种不良反应 8.4.1 常见不良反应常见的局部不良反应包括接种部位疼痛、发红和肿胀。常见全身不良反应包括发热、头痛、头晕、肌肉痛、关节痛和胃肠道症状(恶心、呕吐、腹痛等)[172]。
8.4.2 罕见不良反应偶见上呼吸道感染、注射部位硬结、局部感觉异常、超敏反应、皮疹等症状。
8.4.3 极罕见不良反应上市前临床试验中报告的支气管痉挛等严重不良事件十分罕见。在上市后大规模人群接种监测中有吉兰-巴雷综合征、复杂性区域疼痛综合征、体位性心动过速综合征等不良事件,但全球疫苗安全咨询委员会仔细评估分析后认为,并无相关证据表明HPV疫苗与这些事件有明确因果关系。
(8.5) 注意事项 8.5.1 慎用情况在受种者患有急性严重发热疾病时应推迟接种HPV疫苗,仅有低热和轻度的上呼吸道感染并非接种的绝对禁忌;受种者为血小板减少症患者或者任何凝血功能紊乱患者时应谨慎使用。
8.5.2 特定事项(1)接种HPV疫苗前3个月内避免使用免疫球蛋白或血液制品。(2)妊娠期间应避免接种HPV疫苗。若女性已经或准备妊娠,建议推迟或中断接种程序,妊娠期结束后再进行接种。哺乳期妇女应谨慎接种HPV疫苗。HIV感染者和免疫力低下人群接种HPV疫苗可能无法诱导正常的免疫应答。(3)接种HPV疫苗不能取代常规子宫颈癌筛查。(4)不同厂家HPV疫苗不能互换使用[173]。
9、人用狂犬病疫苗 (9.1) 疫苗针对疾病 9.1.1 病原学狂犬病病毒属于单股负链病毒目、弹状病毒科、狂犬病病毒属。至少有14种狂犬病病毒,根据遗传距离和血清学交叉反应特性将其分为两个遗传系谱。狂犬病病毒是一种不分节段、有包膜的RNA病毒,属于遗传系谱I[174]。基因组编码5种蛋白质,构成病毒颗粒的功能和结构成分。核糖核蛋白复合物是病毒复制和蛋白质翻译的必需成分,它包括与核酸结合的核蛋白(N)、依赖RNA的RNA聚合酶(L)和磷蛋白(P)。基质蛋白(M)和糖蛋白(G)与宿主细胞的脂质包膜相连接形成与宿主细胞受体结合的结构。这些病毒蛋白质中最重要的是G蛋白。G蛋白包含狂犬病疫苗诱导的抗体和免疫球蛋白(RIG)的靶向抗原位点[175]。
9.1.2 临床特征狂犬病具有急性神经性综合症(脑炎),主要表现为机能亢进(狂躁型狂犬病)或麻痹体征(麻痹型狂犬病),随后出现由心脏或呼吸衰竭引起昏迷和死亡,通常发生在首发症状出现后7~10 d内[176]。狂犬病的症状体征包括恐水、恐风、畏光、感觉异常或局部疼痛、吞咽困难、局部无力、恶心或呕吐。大部分病例的潜伏期为1~3个月[177],也有1年以上潜伏期的记载[176]。
9.1.3 流行病学特征全球每年约有6万人死于狂犬病,是致死人数最多的动物源性传染病[178-179]。每年由狂犬病导致的经济负担约为40亿美元[180]。目前,大多数病例发生在非洲和亚洲,其中约40%是 < 15岁儿童。所有的哺乳动物对狂犬病病毒易感。在狂犬病流行地区,99%的人间狂犬病是经犬传播的,小部分是通过野生动物传播的(如狐狸、狼、豺狼、蝙蝠、浣熊、臭鼬或猫鼬)。野生食肉动物和蝙蝠(食肉目和翼手目)是狂犬病病毒的宿主,比其他野生动物具有更高的狂犬病病毒传播风险[180]。除了极少数通过受感染的组织和器官移植而实现的传播,人与人之间传播的狂犬病从未得到证实[176, 181]。
(9.2) 疫苗简介 9.2.1 疫苗免疫原性现代细胞培养和禽胚狂犬病疫苗(cell culture and embryonated egg-based rabies vaccine,CCEEV)是免疫原性较强的疫苗之一,对预防狂犬病非常有效[175]。CCEEV包含经禽胚(例如鸭胚或鸡卵)或细胞培养(例如原代鸡胚细胞、Vero细胞或人二倍体细胞)培养后灭活的狂犬病病毒。在Ⅱ级或Ⅲ级暴露于实验室确认的狂犬病动物后,暴露后预防的有效性可通过对CCEEV诱导的抗体水平进行评估。动物模型已被用于证明人工感染后CCEEV的效力[182]。所有CCEEV能对狂犬病病毒的G蛋白迅速诱导高水平的中和抗体[175]。
9.2.2 疫苗效力或效果WHO规定的最低血清抗狂犬病中和抗体浓度为0.5 IU/ml,该浓度被广泛用作衡量接种疫苗后血清转化是否充分的标准。在大多数个体中,无论年龄、营养状况、是否同时使用狂犬病免疫球蛋白,在暴露后完成狂犬病疫苗免疫程序的第7~14天,血清中和抗体浓度均可达到0.5 IU/ml。在接种后7 d出现中和抗体,接种14 d抗体阳转率达100%[183]。多项血清学研究显示,与狂犬病疫苗5剂次免疫程序相比,“2-1-1”免疫程序第7天抗体阳转率和血清抗体水平均更高,接种后14 d和42 d抗体水平无显著性差异[184-186]。中国国产纯化人Vero细胞狂犬病疫苗按照0、7、21 d各1剂次的程序进行暴露前免疫的研究显示,受试者血清中和抗体阳转率为100%,几何平均浓度(geometric mean concentration,GMC)为15.87 IU/ml[187]。
9.2.3 疫苗安全性WHO 2018年版《狂犬病疫苗立场文件》中指出[188],不同种类狂犬病疫苗的安全性和耐受性整体较好。不良反应的出现与狂犬病疫苗的纯度、制备工艺、处方成分和剂型有关,并可能与产品各批次间的差异相关。此外,疫苗的使用方式(如肌内注射或皮内注射)和受种者的个体差异也有影响。据统计,35%~45%的受种者接种部位出现一过性轻微红疹、疼痛和/或红肿,在接种加强剂次时尤为显著。5%~15%的受种者曾观察到一过性发热、头痛、头晕、胃肠道症状等轻微全身不良反应,过敏、神经系统症状等严重不良反应罕见。
(9.3) 接种建议 9.3.1 免疫程序(1)暴露前免疫 基础免疫:第0、7和21(或28)天分别接种1剂,共接种3剂。加强免疫:接触狂犬病病毒的实验室人员每6个月监测1次血清中和抗体水平,兽医、动物疫情控制部门等每2年监测1次血清中和抗体水平;当血清中和抗体浓度 < 0.5 IU/ml时需加强接种1剂。
(2)暴露后免疫 WHO 2018年版《狂犬病疫苗立场文件》推荐暴露后采用“简易4剂次程序”,在安全性和有效性方面证据充分。中国人用狂犬病疫苗质量标准均符合WHO要求,采用“简易4剂次程序”不会降低保护效果,因此中国国家免疫规划专家咨询委员会(NIAC)推荐暴露后狂犬病疫苗的免疫程序包括:①5剂次程序:第0、3、7、14、28天各接种1剂,共接种5剂;②“2-1-1”程序:第0天接种2剂(左右上臂三角肌各接种1剂),第7天和第21天各接种1剂,共接种4剂(此程序只适用于中国已批准可以使用“2-1-1”程序的狂犬病疫苗);③简易4剂次程序:第0、3、7、14天各接种1剂,共接种4剂。
(3)暴露后免疫预防处置 狂犬病暴露按照暴露性质和严重程度分为三级。在判定暴露级别后,应根据需要尽早进行伤口处理;在告知暴露者狂犬病危害和应当采取的处置措施并获得知情同意后,采取相应处置措施(表 2)[175-176, 188-190]。
(1)狂犬病疫苗:≥2岁儿童和成人在上臂三角肌肌内注射;< 2岁儿童可在大腿前外侧肌注射。禁止在臀部肌内注射。每剂0.5 ml或1.0 ml。(2)狂犬病被动免疫制剂:严格按照体重计算剂量,一次性足量使用。
9.3.3 同时接种当患者需要狂犬病疫苗与破伤风疫苗同时接种时,应在左右上臂三角肌内接种,如同侧接种,则需要间隔2.5 cm以上。
9.3.4 接种禁忌狂犬病为致死性疾病,暴露后狂犬病疫苗使用无任何禁忌,但接种前应充分询问受种者个体基本情况(如有无严重过敏史、其他严重疾病等)。即使存在不适合接种疫苗的情况,也应在严密监护下接种疫苗。如受种者对某品种疫苗的成分有明确过敏史,应更换无该成分的疫苗品种。
(9.4) 预防接种不良反应 9.4.1 常见不良反应(1)局部反应:接种疫苗后24 h内,注射部位可出现红肿、疼痛、发痒,一般不需处理即可自行缓解。(2)全身性反应:可有轻度发热、无力、头痛、眩晕、关节痛、肌肉痛、呕吐、腹痛等,一般不需处理即可自行消退。
9.4.2 罕见不良反应(1)中重度发热:可先采用物理降温方法,必要时可以使用解热镇痛剂。(2)过敏性皮疹:接种疫苗后72 h内出现荨麻疹,应及时就诊,给予抗过敏治疗。
9.4.3 极罕见不良反应(1)过敏性休克:一般在注射疫苗后数分钟至数十分钟内发生。由于死亡可发生于几分钟内,因此迅速处理十分重要。开始治疗的关键是维持呼吸道通畅和保持有效血液循环,尤其强调肾上腺素的紧急使用。(2)过敏性紫癜:出现过敏性紫癜时应及时就诊。(3)血管性水肿:可应用抗组织胺药物治疗,必要时可联合使用糖皮质激素类药物(如甲泼尼龙琥珀酸钠)给予抗过敏治疗[191-196]。
(9.5) 注意事项 9.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期、妊娠期妇女。
9.5.2 特定事项抗狂犬病血清或狂犬病病例免疫球蛋白不得与疫苗使用同一支注射器,不得在同侧肢体注射。使用皮质类固醇或免疫抑制剂治疗时可干扰抗体产生,并导致免疫接种失败。由于狂犬病是致死性疾病,无需注意与其他疫苗的接种间隔。暴露后免疫应遵循及时、足量、全程的原则,发生过敏者,可到医院就诊,进行抗过敏治疗,完成全程疫苗的注射。妊娠妇女几乎均能对狂犬病疫苗产生正常的免疫应答,且对胎儿不会造成不良影响[197]。
10、肾综合征出血热灭活疫苗 (10.1) 疫苗针对疾病 10.1.1 病原学肾综合征出血热由汉坦病毒属的各型病毒引起。汉坦病毒属布尼亚病毒科,为负性单链RNA病毒。根据其抗原结构不同,汉坦病毒至少可分20多个血清型,其中Ⅰ、Ⅱ、Ⅲ型和多布拉伐病毒-贝尔格莱德病毒(DOBV)可引起人类肾综合征出血热,通常Ⅰ型和DOBV引起人类疾病的临床症状较重,Ⅱ型次之,Ⅲ型多为轻型。中国流行以Ⅰ型和Ⅱ型病毒为主[102]。
10.1.2 临床特征肾综合征出血热潜伏期为4~46 d,一般为7~14 d。典型病例病程包括发热期、低血压休克期、少尿期、多尿期和恢复期的五期经过,但非典型病例明显增加。轻型病例可出现越期现象,重症患者则可出现发热期、休克期和少尿期之间的互相重叠[102]。
10.1.3 流行病学特征肾综合征出血热主要分布在亚洲,其次为欧洲和非洲,美洲病例较少。中国疫情最重,几乎各地均有病例报告,以丰水带、多水带和过渡带的农业区为主[102]。四季均有发病,有明显的高峰季节。姬鼠传播者以11-1月和5-7月为流行高峰;家鼠传播者以3-5月为高峰[102]。人群分布与接触传染源的机会多少有关;男性青壮年农民和工人发病较高,其他人群均可发病[102]。
(10.2) 疫苗简介 10.2.1 疫苗免疫原性双价肾综合征出血热灭活疫苗基础免疫2剂后血清Ⅰ、Ⅱ型中和抗体阳转率均可达90%,加强接种后血清抗体阳转率接近100%[198-201]。
10.2.2 疫苗效力或效果肾综合征出血热灭活疫苗具有较好的保护效果,全程免疫接种后保护率接近100%,6年内对人群保护率仍高达90%以上[198-203]。
10.2.3 疫苗安全性肾综合征出血热灭活疫苗具有非常好的安全性,接种后全身反应发生率极低,局部反应发生率较低[201, 204]。
(10.3) 接种建议 10.3.1 免疫程序建议肾综合征出血热疫区的居民和进入该地区的人员接种,主要对象为16~60岁高危人群。按0、14 d进行基础免疫接种2剂次,第6个月后加强接种1剂次[204]。
10.3.2 接种部位、途径和剂量上臂外侧三角肌肌内注射,每剂次1.0 ml。
10.3.3 接种禁忌已知对该疫苗所含任何成分包括辅料和抗生素过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;患未控制的癫痫和其他进行性神经系统疾病者;妊娠及哺乳期妇女。
(10.4) 预防接种不良反应 10.4.1 常见不良反应接种部位可出现局部疼痛、瘙痒、轻微红肿等,全身反应可有轻度发热、不适、疲倦等,一般不需处理可自行消退。
10.4.2 罕见不良反应短暂中度以上发热,应采用物理方法或药物对症处理,以防高热惊厥或继发其他疾病。局部中度以上红肿,一般3 d内即可自行消退,不需任何处理,适当休息即可恢复正常;反应较重的局部红肿可用干净毛巾热敷,每天数次,每次10~15 min可助红肿消退。
10.4.3 极罕见不良反应(1)过敏性皮疹:一般接种疫苗后72 h内出现荨麻疹,及时就诊,给予抗过敏治疗。(2)过敏性休克:一般接种疫苗后1 h内发生,应及时采取注射肾上腺素等抢救措施进行治疗。(3)过敏性紫癜:出现过敏性紫癜时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。(4)周围性神经炎:应及时就诊。
(10.5) 注意事项 10.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
10.5.2 特定事项注射免疫球蛋白应至少间隔1个月以上接种疫苗,以免影响接种效果。
11、钩端螺旋体疫苗 (11.1) 疫苗针对疾病钩端螺旋体病是由致病性钩端螺旋体(钩体)引起的动物源性传染病。
11.1.1 病原学钩体呈细长丝状,菌体的一端或两端弯曲成钩状,为革兰染色阴性、需氧型原核微生物。电镜下钩体结构包括圆柱形菌体、轴丝(又称鞭毛)和外膜3部分,外膜具有抗原性和免疫原性,其相应抗体为保护性抗体[102]。目前国际上将致病性钩体至少分为25个血清群、273个血清型,其中中国至少存在有19个血清群、75个血清型[205]。钩体的型别不同,其毒力和致病性也不同,某些钩体的细胞壁含有内毒素样物质,有较强的致病作用[102]。
11.1.2 临床特征钩体病的潜伏期为2~28 d,多为7~14 d。表现为急性起病,起病1~3 d早期表现为发热和全身感染中毒症状,全身酸痛,腓肠肌疼痛与压痛,腹股沟淋巴结肿大;起病后3~10 d为中期,为症状明显阶段,并发有肺出血、黄疸、肾损害、脑膜脑炎;起病后10 d为后期,多数患者热退之后各种症状逐渐消失趋于痊愈,少数患者退热后于恢复期可再次出现症状和体征(如后发热、眼后发症、反应性脑膜炎、闭塞性脑动脉炎等)[102]。
11.1.3 流行病学特征钩体可经皮肤或黏膜迅速侵入人和多种动物体内引起感染,并经污染的水源迅速传播,故钩体病是全球性流行、洪涝和地震等自然灾害时需重点防疫的人兽共患传染病[206-207]。鼠类和猪是钩体主要的储存宿主和传染源。中国除新疆维吾尔自治区、甘肃省、宁夏回族自治区、青海省外,其他地区均有钩体病散发或流行,尤以西南和南方各省多见。全年均可发病,且多流行于夏秋季。人群普遍易感,且多见于农民、渔民、屠宰工人、野外工作者、矿工等。流行方式有稻田型、雨水型和洪水型等[102]。
(11.2) 疫苗简介目前中国钩体疫苗通常选择当地主要流行菌型的钩体菌株,经培养、杀菌后,制成单价或多价疫苗[208],并推荐在发生钩体病疫情或发生洪涝灾害可能导致钩体病暴发流行时,对重点人群进行应急接种。
11.2.1 疫苗免疫原性钩体外膜的脂多糖是钩体灭活疫苗的主要成分,具有较强的免疫原性和保护性,可诱发机体产生体液免疫应答而发挥作用[209]。国内研究研究数据发现数据显示,两价和多价外膜疫苗和菌体疫苗免疫后1个月和3个月时,各型抗体阳转率达到89.19%~100%,免疫后3个月时,各型抗体阳转率有不同程度的下降[210]。国内外研究数据显示,钩体抗体滴度在1:10~1:100即有保护作用, 国内文献数据也发现抗体滴度≥1:20是保护人体不发病的最低滴度[211]。在钩体病4月底或5月初流行前1个月对易感人群完成接种,接种后约1个月产生免疫力,该免疫力可保持1年左右[102]。
11.2.2 疫苗效力或效果对自1986年以来在荆州地区开展的钩体疫苗预防接种进行的效果评价显示,钩体疫苗保护率达85.34%~100%,效果指数(对照组发病率/接种组发病率)达6.82~36.59[212]。
11.2.3 疫苗安全性目前中国钩体疫苗生产和检定的质量标准严格,疫苗生产用培养基、种子培养物、接种与培养、原液处理、半成品和成品等各环节均需按规程进行相应质量控制与检定,尤其在疫苗的安全性检查方面,要求检测无菌试验和异常毒性试验、效力试验[208]。钩体疫苗的接种反应和血清学效果观察数据显示,对2 037人接种不同钩体疫苗,全身反应轻微,中强反应不超过3%[213]。
(11.3) 接种建议 11.3.1 免疫程序全程共接种2剂次,间隔7~10 d。
11.3.2 接种对象流行地区内有可能接触疫水或动物的7~60岁人群。
11.3.3 接种部位、途径和剂量上臂外侧三角肌下缘附着处皮下注射;成人第1剂次注射0.5 ml,第2剂次注射1.0 ml;7~13周岁用量减半,必要时7周岁以下儿童可酌量注射,但不超过成人剂量的1/4;应在流行季节前完成注射。
11.3.4 接种禁忌已知对该疫苗的任何成分过敏者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;妊娠期和哺乳期妇女;患脑病、未控制的癫痫和其他进行性神经系统疾病者。
(11.4) 预防接种不良反应 11.4.1 常见不良反应接种后可出现短暂发热,注射部位可出现疼痛、触痛和红肿,多数情况2~3 d内自行消退。
11.4.2 极罕见不良反应出现过敏性皮疹应及时就诊。
(11.5) 注意事项 11.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
11.5.2 特定事项注射免疫球蛋白者应至少间隔1个月以上接种疫苗,以免影响免疫效果;月经期妇女暂缓注射。
12、炭疽疫苗 (12.1) 疫苗针对疾病 12.1.1 病原学[214]炭疽杆菌是革兰阳性需氧粗大杆菌,有芽孢,无动力,菌体较大。芽孢有很强的抵抗力,可在动物尸体和土壤中存活数年至数十年。细菌的繁殖体对热和普通消毒剂非常敏感。
12.1.2 临床特征炭疽杆菌侵入机体的途径不同,潜伏期亦有差异,皮肤炭疽一般为1~5 d,也可短至数小时,长至2周左右。皮肤炭疽最多见,首先出现暴露皮肤(面、颈、肩、手和脚等)发痒,以后出现斑疹或丘疹,然后形成黑色焦痂;如果不进行治疗,易发展为严重的败血症。肺炭疽较少见,通常是致死性的而且诊断困难;病初有短期非特异流感样表现,可发生休克并在24 h内死亡,常并发败血症和脑膜炎。肠道炭疽极罕见,易并发败血症休克而死亡。炭疽败血症的全身毒血症状更为严重,如高热、寒战、衰竭;易发生感染性体克、弥漫性血管内凝血、脑膜炎等,病情迅速恶化而死亡。
12.1.3 流行病学特征炭疽的传染源主要为患病的草食动物,如牛、羊、马和骆驼等,其次是猪和狗。人与人之间的传播极少见,炭疽患者作为传染源意义不大。人类炭疽主要通过接触传播,常因肢体直接接触病畜或污染的畜产品、土壤、用具等感染。通过呼吸道吸入带芽孢的粉尘或气溶胶可引起肺炭疽;进食被炭疽杆菌污染的肉类和乳制品可引起肠炭疽;吸血昆虫、牛虻等叮咬病畜后,再叮咬人类,亦可能传播炭疽,但较少见。人群对炭疽杆菌普遍易感,特别是参与动物屠宰、制品加工、动物饲养、兽医等高危人群更易感染。病后可获得持久的免疫力。
(12.2) 疫苗简介目前中国使用皮上划痕人用炭疽减毒活疫苗,采用中国选育的A16R菌株生产[208]。
12.2.1 疫苗免疫原性A16R菌株炭疽减毒活疫苗主要诱导体液免疫应答,而不能诱导有效的呼吸道和消化道黏膜免疫[215]。疫苗接种后1周开始产生免疫力,2周可达到保护水平,半年后开始下降,约可维持1年。
12.2.2 疫苗效力或效果经5年人群效果观察显示,炭疽减毒活疫苗划痕接种后人群保护率为80%~l00%,但皮肤划痕免疫对吸入性感染的保护效果不佳[216-217]。
12.2.3 疫苗安全性皮上划痕人用炭疽减毒活疫苗接种后的不良反应一般较轻微,接种后24 h内在划痕部位可出现疼痛和触痛,局部红肿浸润轻,多数情况2~3 d内自行消失。对出现不良反应者应注意观察,必要时给予适当对症治疗。
(12.3) 接种建议 12.3.1 免疫程序炭疽减毒活疫苗主要接种对象为牧民、兽医、屠宰牲畜人员、制革和皮毛加工人员、炭疽流行区的易感人群、参加防治工作的专业人员。发生炭疽疫情时,对病例或病畜间接触者和疫区周围高危人群接种1剂;对有感染危险者每年接种1次。
12.3.2 接种方法(1)接种前先将安瓿中的疫苗悬液充分摇匀,按无菌操作启开安瓿后,用灭菌注射器吸出疫苗。(2)于上臂外侧上部用75%乙醇棉球消毒皮肤,待干后于消毒部位滴疫苗2滴,相距3~4 cm。一手将皮肤绷紧,另一手持消毒划痕针在每滴疫苗处作"#"字划痕,每条痕长约1~1.5 cm,以划破表皮可见间断小血点为度。再用同一划痕针涂压10余次,使疫苗充分进入划痕皮肤。接种后局部应裸露5~10 min,然后用干棉球擦净。(3)接种后24 h划痕局部应有轻微红肿、浸润,若无任何反应(包括创伤反应),应重新接种。
12.3.3 接种禁忌已知对疫苗中任成分过敏者;患急性疾病、严重慢性疾病、慢性疾病急性发作期和发热者;免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者;妊娠期或6个月内哺乳期妇女;炭疽病例或病畜的直接接触者。
(12.4) 预防接种不良反应 12.4.1 常见不良反应接种后24 h内在划痕部位可出现疼痛和触痛,局部红肿浸润轻,多数情况2~3 d内自行消失。接种后可出现一过性发热,其中大多数为轻度发热,持续1~2 d后可自行缓解,一般不需处理;对于中度发热或发热时间超过48 h者,可给予对症处理。
12.4.2 罕见不良反应严重发热应给予对症处理,以防高热惊厥。
12.4.3 极罕见不良反应淋巴结肿大。
(12.5) 注意事项 12.5.1 慎用情况人用皮上划痕炭疽减毒活疫苗严禁作注射用;与抗生素同时使用时可能影响疫苗的免疫效果;注意保持划痕部位清洁卫生以避免感染。
12.5.2 特定事项注射免疫球蛋白者应至少间隔1个月以上才能接种炭疽减毒活疫苗。
13、戊型肝炎疫苗 (13.1) 疫苗针对疾病 13.1.1 病原学戊型肝炎病毒(hepatitis E virus,HEV)呈球形,直径为30~32 nm,是包含有7.2 kb的单正链核糖核酸基因组的无包膜病毒,是肝病毒属的一种。病毒基因由一个短的5’端非编码区的帽子、3个彼此编码框架不同的开放阅读框(ORF)和一个由腺苷残基的支链作终点的短的3’端非编码区构成。其中,ORF1编码病毒非结构性蛋白,ORF2编码衣壳蛋白,ORF3编码一种可能与病毒从细胞中释放有关的小蛋白质。目前已发现4种以感染哺乳类为宿主的基因型,且属于同一种血清型。其中1型和2型只存在于人类,3型和4型在人类和猪中发现[57]。HEV在外环境中相对稳定,对热、氯化物和紫外线敏感[142]。
13.1.2 临床特征临床上不易对戊型肝炎(戊肝)及其他类型的病毒性肝炎予以区别。戊肝的潜伏期一般为15~60 d,平均40 d。HEV感染的严重程度从无症状感染到急性黄疸性肝炎,再到暴发性肝炎不等[142]。戊肝的主要临床表现包括疲倦、食欲减退、腹部疼痛和压痛、恶心、呕吐、发热和黄疸[57]。流行期间,暴发性戊肝在孕妇中呈不成比例的高病死率,一般人群戊肝病死率为0.1%~4%,而孕晚期孕妇中戊肝病死率可达10%~50%。已有慢性肝病的患者感染HEV后更易发展为重型肝炎,免疫抑制人群或由其他原因引起的严重免疫缺陷患者,感染HEV后具有发展为慢性戊肝的风险。
13.1.3 流行病学特征戊肝在世界范围内引起暴发或散发,全球每年戊肝发病数约340万例,死亡约7万例[142]。在发展中国家,HEV 1型和2型是戊肝的主要病原,主要影响青壮年(15~39岁)。中国是HEV高流行国家,自1997年戊肝纳入法定传染病报告以来,中国戊肝发病率逐年上升,不同地区差异显著。2017年中国戊肝报告发病数为29 014例,发病率为2.1/10万,其中以65~69岁年龄组发病率最高(2012-2017年为5.22/10万)[218]。2006年中国1~59岁人群HEV抗体阳性率为23.46%[96],2014年全国1~29岁人群HEV抗体阳性率为8.12%,高于部分发达国家(如美国、德国),低于某些欠发达国家(如孟加拉国)[219]。
(13.2) 疫苗简介 13.2.1 疫苗免疫原性2012年全球唯一批准使用的戊肝疫苗(hepatitis E vaccine,HepE)在中国上市。根据在16~65岁健康人群开展的Ⅲ期临床试验结果,该疫苗具有很高的免疫原性,按0、1、6个月间隔接种3剂后,几乎所有受试对象均出现了抗体阳转。其中疫苗接种组的IgG抗体浓度呈≥4倍升高者占98.7%,而对照组仅有2.1%。疫苗接种组IgG抗体GMC从0.14 WU/ml增长到19.0 WU/ml(95%CI:18.6~19.4 WU/ml)[142]。另对65岁以上老年人开展的疫苗安全性和免疫原性的最新研究显示,65岁以上老年人接种HepE同样具有良好的免疫原性,其中第3剂免疫后1个月的抗体阳转率为96.7%[220]。
13.2.2 疫苗效力或效果目前上市的HepE免疫效果显示,该疫苗近期免疫效果和免疫后4.5年的长期效果较好[221-222],可避免戊肝病例发生。Ⅲ期临床试验观察对象免疫后4.5年随访,疫苗保护率达86.8%(95%CI:71.0%~94.0%),提示疫苗免疫后4.5年的长期效果良好[222]。目前尚缺乏 < 16岁人群、免疫抑制人群中的疫苗保护效果数据。需要指出的是,此保护效果数据主要针对HEV 4型所致的戊肝,针对其他型别HEV的免疫效果还有待研究,但根据体外试验的研究结果,推测疫苗对4种基因型均具有保护效果[142]。
13.2.3 疫苗安全性上市前的Ⅰ~Ⅲ期临床试验和上市后回顾性队列研究均提示疫苗安全性较好,接种后发生严重不良事件极为罕见[221-222]。大部分不良反应为接种部位的疼痛、红肿和发痒等。全球疫苗安全咨询委员会认为,从Ⅲ期临床试验数据来看,HepE在健康成人中具有安全性。2019年一项针对 > 65岁老年人接种HepE安全性研究结果显示,该人群与18~65岁人群的不良事件发生率接近,无疫苗相关的严重不良事件发生[220]。在 < 16岁、患有基础性疾病或其他情况人群(如免疫抑制、慢性肝病、器官移植等)的安全性有待评估[142]。
(13.3) 接种建议 13.3.1 免疫程序接种对象为16岁及以上易感人群。重点推荐用于HEV感染的重点高风险人群,如畜牧养殖者、餐饮业人员、学生或部队官兵、育龄期妇女、疫区旅行者等。按“0、1、6月”接种方案共接种3剂次,第1剂接种后1个月接种第2剂,第1剂接种后6个月接种第3剂。
13.3.2 接种部位、途径和剂量上臂三角肌肌内注射,接种剂量为30 μg/0.5 ml。
13.3.3 接种禁忌已知对该疫苗所含任何成分过敏者;有接种其他疫苗过敏史者;患血小板减少症或其他凝血障碍者;对卡他霉素或其他氨基糖甙类药物有过敏史者;患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者;未控制的癫痫和患其他进行性神经系统疾病者。
(13.4) 预防接种不良反应大部分不良反应为接种部位的局部反应,如疼痛、红肿和发痒,全身反应常见为发热、疲倦无力和头痛。女性的局部和全身不良反应发生率高于男性。不同年龄组不良反应发生无规律性,61~65岁老年组不良反应发生率相对较低。未发现疫苗相关的严重不良反应。
(13.5) 注意事项严禁静脉注射。家庭和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者应慎用。注射免疫球蛋白者应至少间隔1个月以上接种本疫苗,以免影响免疫效果。对于孕妇和哺乳期妇女,目前尚无相关人群的研究数据,应充分权衡利弊后决定是否使用本品。
14、霍乱疫苗 (14.1) 疫苗针对疾病 14.1.1 病原学霍乱弧菌为革兰阴性杆菌,无侵袭性,有耐热的菌体(O)抗原和不耐热的鞭毛(H)抗原。根据菌体抗原不同可将霍乱弧菌分出200多个血清群,但仅有O1和O139血清群可引发霍乱流行,尚无证据表明这两个血清群之间具有交叉保护作用。O1群包括古典生物型和埃尔托生物型(ElTor)。O139群是1992年10月在印度和孟加拉国发现的引起霍乱流行的新变异株[223-224],是埃尔托生物型的基因衍生株[225]。霍乱弧菌的致病力包括鞭毛运动、霍乱肠毒素、内毒素、黏蛋白溶解酶、黏附素、弧菌代谢产物和其他毒素[102]。
14.1.2 临床特征霍乱的潜伏期为1~3 d,多为急起发病,典型的临床表现是急性腹泻和剧烈呕吐,大多数以持续一天或几天的急性大量水样泻为特征。呕吐多在腹泻后出现,常为喷射性和连续性。由于频繁腹泻和呕吐,大量水和电解质丧失后患者会出现肾衰竭、代谢性酸中毒和低钾血症等并发症[226],如未予以治疗,可在24 h内死亡。
14.1.3 流行病学特征霍乱的主要传染源为患者和带菌者。患者发病期一般可连续排菌5 d,也有2周以上者,其泻吐物中可有大量霍乱弧菌[227-228]。霍乱的轻型患者和隐性感染者对疾病的传播有重要作用。霍乱是经口感染的肠道传染病,可通过水、食物、生活接触和苍蝇等传播。此外,霍乱弧菌能通过污染鱼、虾等水产品引起传播[229]。人群对霍乱弧菌普遍易感,隐性感染较多。病后可获得一定免疫力,亦有再感染的可能性。
(14.2) 疫苗简介目前在中国上市使用的霍乱疫苗为重组B亚单位/菌体霍乱疫苗(肠溶胶囊),含重组霍乱毒素B亚单位与霍乱弧菌灭活菌体成分。
14.2.1 疫苗免疫原性机体对霍乱的免疫保护主要是肠道分泌产生的抗菌、抗毒抗体作用的结果,接种霍乱毒素B亚单位-灭活霍乱弧菌全菌体(BS-WC)疫苗可刺激产生抗菌和抗毒抗体,并刺激肠道产生分泌性IgA抗体[230-231],观察显示口服霍乱疫苗是诱导产生这种抗体的最有效方式[232]。1993年6月到1994年1月对369人进行双盲法试验[233],采用高、低剂量重组霍乱毒素B亚单位-灭活霍乱弧菌全菌体(rBS-WC)疫苗免疫接种和安慰剂对照,接种后免疫组血清抗体和粪抗体阳转率、抗体水平均显著升高。1997年7月至1998年7月在广州军区、南京军区进行现场试验[234],将6 079人随机分为3组,采用双盲法分别接受高、低剂量rBS-WC疫苗和安慰剂,接种组83.4%~91.7%出现了抗体阳转,抗体阳转与国内另一项研究的结果相近[235]。霍乱疫苗对腹泻和产毒性大肠埃希菌感染也有交叉性保护作用[236]。
14.2.2 疫苗效力或效果WHO立场文件中指出,接种霍乱疫苗后2年内可对霍乱提供显著的防护效力,在接种霍乱疫苗后第4~6个月、第1年和第2年所提供的保护效力分别为85%、62%和58%。
14.2.3 疫苗安全性中国三项研究表明口服重组B亚单位/菌体霍乱疫苗(肠溶胶囊)具有良好的安全性,服苗组总不良反应发生率分别为0.4%[233]、0.84%[234]、0.38%[237],服苗组与服安慰剂组的不良反应发生率无显著性差异。霍乱疫苗具有很好的耐受性,可能会有轻微胃肠道不良反应,但发生率与服用安慰剂组无显著性差异,对≥2岁儿童是安全的[238-240]。目前尚无证据表明该疫苗可在孕期或哺乳期、HIV感染者和其他免疫功能低下人群中安全使用。
(14.3) 接种建议 14.3.1 免疫程序重组B亚单位/菌体霍乱疫苗(肠溶胶囊)用于≥2岁儿童、青少年和有接触或传播风险的成人。初次免疫者应接种3剂,分别于第0、7、28天口服,每次1粒,不能顺利吞咽的儿童可将疫苗与儿童用包装中附抗酸剂口服使用。接受过初次免疫的人员,可视疫情于流行季节前加强1次。
14.3.2 接种部位、途径和剂量重组B亚单位/菌体霍乱疫苗的剂型为肠溶胶囊,供口服用,人用剂量为1粒/次,每粒胶囊装量240 mg,含灭活霍乱弧菌菌体(rBS1 mg-WC)5×1010个和重组霍乱毒素B亚单位1 mg。
14.3.3 接种禁忌发热、严重高血压、心/肝/肾脏病,艾滋病、活动性肺结核患者;孕妇和 < 2岁婴幼儿;已知对疫苗任何成分过敏或使用疫苗后发生不良反应者。
(14.4) 预防接种不良反应 14.4.1 常见不良反应口服疫苗后一般无不良反应。常见不良反应主要以腹痛、腹泻等轻度胃肠功能障碍为主,也有部分出现荨麻疹等过敏反应和发热,不良反应呈一过性,持续时间较短,一般不需处理,短时间内即可自愈,如有严重不良反应,应及时诊治。
14.4.2 罕见不良反应服苗后个别人发生头晕、头痛、乏力、恶心、心慌、便秘等,由于不良反应发生以主观陈述为主要依据,且在同时服苗的人群中有集中出现的现象,所以不能排除心因性反应的可能。所有发生的不良反应均在短时间内自愈,未出现严重不良反应[239-240]。
14.4.3 极罕见不良反应目前尚无极罕见严重不良反应报告。
(14.5) 注意事项 14.5.1 慎用情况应于餐后2 h服苗,服苗后1 h勿进食;与抗酸剂配合使用时,服苗后1 h内勿服用饮料。服苗后2 d内忌食生冷、油腻、酸辣食品。疫苗在低温冻结后不能使用。疫苗胶囊经密封处理,裂开后不能使用。任何急性感染或发热性疾病患者需推迟口服疫苗,除非医生认为不服苗会导致更大危险。
14.5.2 特定事项其预防接种与免疫球蛋白使用的时间间隔无特殊要求。
15、伤寒疫苗 (15.1) 疫苗针对疾病 15.1.1 病原学伤寒是由肠道病原体伤寒杆菌引发的严重全身性感染[81, 241]。伤寒杆菌属于肠道沙门菌肠道亚种伤寒血清型,无芽孢,有鞭毛,能运动,多数有菌毛,体外有荚膜多糖。为杆状、革兰阴性、需氧或兼性厌氧,营养要求不高。伤寒杆菌除H抗原外,还有菌体O抗原和Vi(毒力)荚膜抗原,具有诊断意义的是O抗原和H抗原[81, 242]。
15.1.2 临床特征伤寒杆菌经摄入后可到达网状内皮系统并在巨噬细胞内繁殖[81, 243]。在5~21 d潜伏期后,患者可出现乏力、头痛、腹痛和发热。大龄儿童和成人通常有便秘,而幼龄儿童可出现腹泻[81]。以持续高热、全身痛、肝脾肿大、缓脉为主要体征,可出现玫瑰疹,严重者伴有脑功能障碍、谵妄和休克,偶有肠穿孔和出血。目前伤寒病例症状越来越不典型,发病周期和潜伏期长、易复发,且存在慢性带菌[244]。约1%~4%患者的其肠道和胆囊可继续携带伤寒杆菌达数月或数年(无症状带菌者)[81]。
15.1.3 流行病学特征患者和带菌者是伤寒的传染源,带菌时间可达数年之久。伤寒杆菌仅感染人类,通常因摄入被伤寒患者或无症状带菌者排泄物污染的食物或水而感染。2015年起伤寒发病率≤0.65/10万[245]。人群普遍易感,高发年龄段为20~40岁,水型暴发多见,食物型暴发为10%~15%。伤寒总发病率呈逐年下降趋势,但每年仍有相当的发病数,小规模暴发流行时有发生。伤寒在许多发展中国家仍然是一个公共卫生问题,全世界每年伤寒患者约为2 100万人,死亡约20万人[246],约90%的死亡病例发生在亚洲。≤4岁伤寒患儿病死率(4.0%)是 > 4岁伤寒患儿病死率的10倍(0.4%),在未经治疗的病例中病死率可高达10%~20%[81]。
(15.2) 疫苗简介目前全球获准使用的伤寒疫苗包括伤寒结合疫苗、伤寒Vi多糖疫苗和伤寒口服减毒活疫苗。中国目前使用的是ViPS,国产伤寒全细胞灭活疫苗已不再使用。
15.2.1 疫苗效力或效果伤寒Vi多糖疫苗可诱导非T细胞依赖性IgG应答,不能诱导肠黏膜免疫。伤寒Vi多糖疫苗在85%~95%的成人和2岁以上儿童中可诱导血清IgG Vi抗体应答。国产伤寒Vi多糖疫苗免疫1个月、6个月、12个月后抗Vi多糖抗体阳转率分别为98.36%、83.67%、83.67%[247]。江苏省2008年为810名5岁以上常住健康人群且无感染史和免疫史者接种伤寒Vi多糖疫苗,Vi抗体阳转率在85.96%~91.30%之间[248]。在中国西南部对13.1万名5~30岁人员接种剂量为30 μg的Vi多糖疫苗,接种19个月后69%的受种者具有保护力,第3年约50%仍有保护力[81]。
广西壮族自治区桂林市在1995-2006年期间每3年对学龄儿童、在校生、餐饮业者和暴发区居民复种一次伤寒Vi多糖疫苗,学生、其他目标人群平均接种率分别为60%~70%、80%~85%,总人群和学生的伤寒平均发病率从接种前的47/10万和61/10万,下降到2006年的0.2/10万~4.5/10万[81]。
15.2.2 疫苗安全性在南非、尼泊尔、中国和其他亚洲国家的34.3万名伤寒Vi多糖疫苗受种者中,未发生严重不良事件,仅有轻微的局部副作用[81]。当与其他儿童期常规疫苗同时接种时,伤寒Vi多糖疫苗表现出良好的耐受性和安全性。伤寒Vi多糖疫苗全身不良反应主要为发热,6~8 h和24 h有少量的弱和中反应,48 h不良反应消失;局部不良反应主要为红肿,24 h弱和中反应发生率分别为14.66%和2.58%,48 h不良反应消失[249]。
(15.3) 接种建议 15.3.1 免疫程序伤寒Vi多糖疫苗用于≥2岁人群接种,接种1剂次。建议每3年复种一次。可与其他供国际旅行人员使用的疫苗(如黄热病疫苗和甲型肝炎疫苗)同时接种,也可与常规儿童免疫规划中的疫苗同时接种[81]。
15.3.2 接种部位、途径和剂量上臂外侧三角肌肌内注射,每剂次接种0.5 ml[244]。
15.3.3 接种禁忌已知对该疫苗的任何成分过敏者;患急性疾病、严重慢性疾病(严重心脏疾病、高血压、肝脏疾病、肾脏疾病)、慢性疾病急性发作期(活动性结核)和发热者;妊娠期妇女。
(15.4) 预防接种不良反应 15.4.1 常见不良反应可出现短暂低热,局部稍有红肿、压痛感,有时有寒战、发热或头痛。一般可自行缓解,不需特殊处理。
15.4.2 罕见不良反应过敏性皮疹一般在接种疫苗后72 h内出现,应及时就诊。
15.4.3 极罕见不良反应未发现。
(15.5) 注意事项 15.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者、哺乳期妇女慎用。
15.5.2 特定事项伤寒Vi多糖疫苗不能用于 < 2岁儿童。多人份的伤寒Vi多糖疫苗开启后应立即使用,如需放置,应置2℃~8 ℃,并于1 h内用完,未用完者应废弃。
16、森林脑炎疫苗 (16.1) 疫苗针对疾病 16.1.1 病原学森林脑炎是由森林脑炎病毒所引起的急性中枢神经系统传染病,蜱为其传播媒介。森林脑炎病毒属于黄病毒科黄病毒属,为直径50 nm左右的球形颗粒,衣壳二十面体对称,外有包膜,含血凝素糖蛋白,核酸为单正链RNA,全长约10.7 kb,分子质量约为4×106 Da,沉降系数为218 S。
16.1.2 临床特征森林脑炎潜伏期为2~35 d,一般为10~15 d。前驱期一般数小时至3 d,部分患者和重型患者前驱期不明显。前驱期主要表现为低热、头晕、乏力、全身不适、四肢酸痛。大多数患者为急性发病,1~2 d内到高峰。急性期主要表现为发热、全身中毒症状、意识障碍和精神损害、脑膜受累、肌肉瘫痪、神经系统损害等。恢复期持续平均10~14 d,体温下降,肢体瘫痪逐步恢复,神志转清,各种症状消失。森林脑炎一般病程为14~28 d,少数患者可留有后遗症,如失语、痴呆、吞咽困难、不自主运动,少数病情迁延达数月或1~2年之久,表现为弛缓性瘫痪、癫痫和精神障碍。
16.1.3 流行病学特征森林脑炎是森林地区自然疫源性疾病,流行于中国东北和西北的原始森林地区、俄罗斯的远东地区和朝鲜北部林区。有严格的季节性,自5月上旬开始发病,6月高峰期,7-8月下降,呈散发状态。人群普遍易感,所有患者均有森林作业接触。
(16.2) 疫苗简介 16.2.1 疫苗免疫原性国内外研究结果显示,95%以上的受种者在接种完2剂次森林脑炎疫苗后,中和抗体滴度达免疫前的10倍以上[250-251]。多数受种者,即使接种过1剂次森林脑炎疫苗,甚至在加强免疫前血清反应呈阴性的人,体内均有免疫记忆。
16.2.2 疫苗效力或效果基础免疫后中和抗体GMT在第一年下降。加强免疫后,90%以上的受种者诱导的保护性抗体可维持3~5年[252-254]。受种者中发生“免疫保护突破病例”非常罕见,但有发生,特别是老年人中。
16.2.3 疫苗安全性接种后不良反应一般轻微,个别有发热、头晕、皮疹、局部疼痛。对出现不良反应者应注意观察,必要时给予适当对症治疗。
(16.3) 接种建议 16.3.1 免疫程序在有森林脑炎发生的地区居住和进入该地区的8周岁以上人员,基础免疫为2剂次,于第0、14 d各接种1剂次;以后可在流行季节前加强免疫1剂次。
16.3.2 接种部位、途径和剂量上臂外侧三角肌肌内注射,每次接种1.0 ml。
16.3.3 接种禁忌发热、患严重疾病、慢性疾病急性发作期;患过敏性疾病、对卡那霉素或生物制品有过敏史者(由于生物制品制造工艺、残留物质均有其相似性,如接种者已经有其他生物制品过敏史,在接种本疫苗时应谨慎);哺乳期、妊娠期妇女。
(16.4) 预防接种不良反应 16.4.1 常见不良反应注射部位可出现局部发痒、轻微红肿。全身可有轻度发热反应、不适、疲倦等,一般不需处理可自行消退。
16.4.2 罕见不良反应短暂中度以上发热,应采用物理方法或药物对症处理,以防高热惊厥或继发其他疾病。局部中度以上红肿,一般3 d内即可自行消退,不需任何处理,适当休息即可恢复正常;反应较重的局部红肿可用干净的毛巾热敷,每天数次,每次一般10~15 min,可助红肿消退[255-258]。
16.4.3 极罕见不良反应(1)过敏性皮疹:荨麻疹一般在接种疫苗后72 h内出现,应及时就诊,给予抗过敏治疗。(2)过敏性休克:一般在注射疫苗后1 h内发生。应采取及时注射肾上腺素等抢救措施。(3)过敏性紫癜:出现过敏性紫癜时应及时就诊,应用皮质固醇类药物给予抗过敏治疗,治疗不当或不及时有可能并发紫癜性肾炎。(4)周围神经炎:应及时就诊。
(16.5) 注意事项 16.5.1 慎用情况家族和个人有惊厥史者、患慢性疾病者、有癫痫史者、过敏体质者。
16.5.2 特定事项(1)由于疫苗中含有铝佐剂,使用时应充分摇匀,如出现摇不散的凝块、异物、疫苗瓶有裂纹、标签不清或失效者均不得使用,同时要注意严禁冻结。(2)疫苗瓶开启后应立即使用。(3)注射免疫球蛋白者应至少间隔1个月以上接种疫苗,以免影响免疫效果。(4)应备有肾上腺素等药物,以备偶有发生严重过敏反应时急救用。接种疫苗后应在现场观察至少30 min。
本共识撰写专家:(1)流感病毒疫苗:中国疾病预防控制中心秦颖、刘怡,浙江省杭州市萧山区社区卫生服务中心沈伊娜;(2)肺炎球菌疫苗:江苏省苏州市疾病预防控制中心栾琳,中国疾病预防控制中心叶家楷;(3)含b型流感嗜血杆菌成分疫苗:天津市疾病预防控制中心陈伟,中国疾病预防控制中心张丽娜;(4)肠道病毒71型灭活疫苗:浙江省杭州市疾病预防控制中心刘艳,浙江省疾病预防控制中心胡昱;(5)轮状病毒疫苗:广西壮族自治区南宁市疾病预防控制中心唐金芳;(6)水痘减毒活疫苗:中国疾病预防控制中心王淼,贵州省疾病预防控制中心杜雯;(7)带状疱疹疫苗:北京市疾病预防控制中心虞睿,贵州省疾病预防控制中心杜雯;(8)人乳头瘤病毒疫苗:中国疾病预防控制中心李燕,广东省疾病预防控制中心孙立梅,上海市疾病预防控制中心李智;(9)人用狂犬病疫苗:云南省疾病预防控制中心李颖,浙江省疾病预防控制中心胡昱;(10)肾综合征出血热疫苗:中国疾病预防控制中心崔健,黑龙江省疾病预防控制中心高士锐;(11)钩端螺旋体疫苗:黑龙江省哈尔滨市疾病预防控制中心胡丽楠,黑龙江省疾病预防控制中心高士锐;(12)炭疽疫苗:山东省济南市妇幼保健院杆石桥社区卫生服务中心苗智莹,黑龙江省疾病预防控制中心高士锐;(13)戊型肝炎疫苗:中国疾病预防控制中心李媛秋、王富珍;(14)霍乱疫苗:四川省疾病预防控制中心马千里;(15)伤寒疫苗:广西壮族自治区南宁市疾病预防控制中心唐金芳;(16)森林脑炎疫苗:黑龙江省疾病预防控制中心高士锐
本共识提供建议和指导专家:中国疾病预防控制中心刘大卫、尹遵栋、安志杰、王华庆、李克莉、李艺星、刘燕敏、郝利新、张国民,天津市疾病预防控制中心张颖,山东省疾病预防控制中心张丽,上海市疾病预防控制中心黄卓英,安徽省疾病预防控制中心唐继海,四川省疾病预防控制中心漆琪,重庆市疾病预防控制中心王青,河南省疾病预防控制中心张延炀,湖南省怀化市疾病预防控制中心瞿中武,北京大学第三医院朴梅花,四川大学华西第二医院刘兴会,浙江大学医学院附属妇产科医院海宁分院徐鑫芬
利益冲突 所有作者均声明不存在利益冲突
本文编辑 王岚
| [1] |
中国疾病预防控制中心, 国家免疫规划技术工作组流感疫苗工作组. 中国流感疫苗预防接种技术指南(2020-2021)[J]. 中华流行病学杂志, 2020, 41(10): 1555-1576. DOI:10.3760/cma.j.cn112338-20200904-01126 |
| [2] |
World Health Organization. Vaccines against influenza WHO position paper-November 2012[J]. Wkly Epidemiol Rec, 2012, 87(47): 461-476. |
| [3] |
中华人民共和国国家卫生和计划生育委员会. 流行性感冒诊疗方案(2018年版)[J]. 中华临床感染病杂志, 2018, 28(1): 1-5. DOI:10.3760/cma.j.issn.1674-2397.2018.01.001 |
| [4] |
Mo Z, Nong Y, Liu S, et al. Immunogenicity and safety of a trivalent inactivated influenza vaccine produced in Shenzhen, China[J]. Hum Vaccin Immunother, 2017, 13(6): 1-7. DOI:10.1080/21645515.2017.1285475 |
| [5] |
Moa AM, Chughtai AA, Muscatello DJ, et al. Immunogenicity and safety of inactivated quadrivalent influenza vaccine in adults:A systematic review and meta-analysis of randomised controlled trials[J]. Vaccine, 2016, 34(35): 4092-4102. DOI:10.1016/j.vaccine.2016.06.064 |
| [6] |
Bekkat-Berkani R, Ray R, Jain VK, et al. Evidence update:GlaxoSmithKline's inactivated quadrivalent influenza vaccines[J]. Expert Rev Vaccines, 2016, 15(2): 201-214. DOI:10.1586/14760584.2016.1113878 |
| [7] |
He XS, Holmes TH, Zhang C, et al. Cellular immune responses in children and adults receiving inactivated or live attenuated influenza vaccines[J]. J Virol, 2006, 80(23): 11756-11766. DOI:10.1128/JVI.01460-06 |
| [8] |
Mohn KGI, Brokstad KA, Islam S, et al. Early Induction of Cross-Reactive CD8+ T-Cell Responses in Tonsils After Live-Attenuated Influenza Vaccination in Children[J]. J Infect Dis, 2020, 221(9): 1528-1537. DOI:10.1093/infdis/jiz583 |
| [9] |
Lindsey BB, Jagne YJ, Armitage EP, et al. Effect of a Russian-backbone live-attenuated influenza vaccine with an updated pandemic H1N1 strain on shedding and immunogenicity among children in The Gambia:an open-label, observational, phase 4 study[J]. The Lancet Respiratory Medicine, 2019, 7(8): 665-676. DOI:10.1016/s2213-2600(19)30086-4 |
| [10] |
Coelingh K, Olajide IR, Macdonald P, et al. Efficacy and effectiveness of live attenuated influenza vaccine in school-age children[J]. Expert Rev Vaccines, 2015, 14(10): 1331-1346. DOI:10.1586/14760584.2015.1078732 |
| [11] |
Feng S, Chiu SS, Chan ELY, et al. Effectiveness of influenza vaccination on influenza-associated hospitalisations over time among children in Hong Kong:a test-negative case-control study[J]. The Lancet Respiratory Medicine, 2018, 6(12): 925-934. DOI:10.1016/s2213-2600(18)30419-3 |
| [12] |
Cate TR, Couch RB, Parker D, et al. Reactogenicity, immunogenicity, and antibody persistence in adults given inactivated influenza virus vaccines-1978[J]. Rev Infect Dis, 1983, 5(4): 737-747. DOI:10.1093/clinids/5.4.737 |
| [13] |
Ochiai H, Shibata M, Kamimura K, et al. Evaluation of the efficacy of split-product trivalent A(H1N1), A(H3N2), and B influenza vaccines:reactogenicity, immunogenicity and persistence of antibodies following two doses of vaccines[J]. Microbiol Immunol, 1986, 30(11): 1141-1149. DOI:10.1111/j.1348-0421.1986.tb03043.x |
| [14] |
Künzel W, Glathe H, Engelmann H, et al. Kinetics of humoral antibody response to trivalent inactivated split influenza vaccine in subjects previously vaccinated or vaccinated for the first time[J]. Vaccine, 1996, 14(12): 1108-1110. DOI:10.1016/0264-410x(96)00061-8 |
| [15] |
Song JY, Cheong HJ, Hwang IS, et al. Long-term immunogenicity of influenza vaccine among the elderly:Risk factors for poor immune response and persistence[J]. Vaccine, 2010, 28(23): 3929-3935. DOI:10.1016/j.vaccine.2010.03.067 |
| [16] |
Somes MP, Turner RM, Dwyer LJ, et al. Estimating the annual attack rate of seasonal influenza among unvaccinated individuals:A systematic review and meta-analysis[J]. Vaccine, 2018, 36(23): 3199-3207. DOI:10.1016/j.vaccine.2018.04.063 |
| [17] |
Steinhoff MC, Omer SB, Roy E, et al. Influenza immunization in pregnancy-antibody responses in mothers and infants[J]. N Engl J Med, 2010, 362(17): 1644-1646. DOI:10.1056/NEJMc0912599 |
| [18] |
孙树梅. 关注儿童流感, 重视疫苗接种——AAP感染性疾病委员会《儿童流感的预防与控制建议(2018-2019年)》解读[J]. 中国全科医学, 2019, 22(6): 621-626. |
| [19] |
Demicheli V, Jefferson T, Ferroni E, et al. Vaccines for preventing influenza in healthy adults[J]. Cochrane Database Syst Rev, 2018, 2: 001269. DOI:10.1002/14651858.CD001269.pub6 |
| [20] |
黄远东, 赵晓平, 万涛, 等. 慢性阻塞性肺病人群流感疫苗接种的效果观察[J]. 海南医学, 2011, 22(4): 29-31. |
| [21] |
高忠翠, 李江涛, 展胜. 卡舒宁联合流感疫苗对老年性慢性支气管炎合并急性感染的防治效果[J]. 中国生物制品学杂志, 2011, 24(10): 1214-1216. DOI:10.13200/j.cjb.2011.10.99.gaozhc.030 |
| [22] |
Vasileiou E, Sheikh A, Butler C, et al. Effectiveness of Influenza Vaccines in Asthma:A Systematic Review and Meta-Analysis[J]. Clin Infect Dis, 2017, 65(8): 1388-1395. DOI:10.1093/cid/cix524 |
| [23] |
Clar C, Oseni Z, Flowers N, et al. Influenza vaccines for preventing cardiovascular disease[J]. Cochrane Database Syst Rev, 2015(5): 005050. DOI:10.1002/14651858.CD005050.pub3 |
| [24] |
Wang S, Zheng Y, Jin X, et al. Efficacy and safety of a live attenuated influenza vaccine in Chinese healthy children aged 3-17 years in one study center of a randomized, double-blind, placebo-controlled phase 3 clinical trial, 2016/17 season[J]. Vaccine, 2020, 38(38): 5979-5986. DOI:10.1016/j.vaccine.2020.07.019 |
| [25] |
Block SL, Heikkinen T, Toback SL, et al. The efficacy of live attenuated influenza vaccine against influenza-associated acute otitis media in children[J]. Pediatr Infect Dis J, 2011, 30(3): 203-207. DOI:10.1097/INF.0b013e3181faac7c |
| [26] |
胡昱, 李倩, 陈雅萍, 等. 18岁以上人群接种四价流感病毒灭活疫苗免疫原性和安全性的Meta分析[J]. 国际流行病学传染病学杂志, 2017, 44(1): 47-52. DOI:10.3760/cma.j.issn.1673-4149.2017.01.010 |
| [27] |
Pepin S, Dupuy M, Borja-Tabora CFC, et al. Efficacy, immunogenicity, and safety of a quadrivalent inactivated influenza vaccine in children aged 6-35months:A multi-season randomised placebo-controlled trial in the Northern and Southern Hemispheres[J]. Vaccine, 2019, 37(13): 1876-1884. DOI:10.1016/j.vaccine.2018.11.074 |
| [28] |
武文娣, 李克莉, 许涤沙, 等. 中国2015-2018年3个流感季节流感疫苗疑似预防接种异常反应监测数据分析[J]. 中华预防医学杂志, 2019, 53(10): 987-992. DOI:10.3760/cma.j.issn.0253-9624.2019.10.007 |
| [29] |
Vesikari T, Fleming DM, Aristegui JF, et al. Safety, efficacy, and effectiveness of cold-adapted influenza vaccine-trivalent against community-acquired, culture-confirmed influenza in young children attending day care[J]. Pediatrics, 2006, 118(6): 2298-2312. DOI:10.1542/peds.2006-0725 |
| [30] |
Bergen R, Black S, Shinefield H, et al. Safety of cold-adapted live attenuated influenza vaccine in a large cohort of children and adolescents[J]. Pediatr Infect Dis J, 2004, 23(2): 138-144. DOI:10.1097/01.inf.0000109392.96411.4f |
| [31] |
Redding G, Walker RE, Hessel C, et al. Safety and tolerability of cold-adapted influenza virus vaccine in children and adolescents with asthma[J]. Pediatr Infect Dis J, 2002, 21(1): 44-48. DOI:10.1097/00006454-200201000-00010 |
| [32] |
Piedra PA, Yan L, Kotloff K, et al. Safety of the trivalent, cold-adapted influenza vaccine in preschool-aged children[J]. Pediatrics, 2002, 110(4): 662-672. DOI:10.1542/peds.110.4.662 |
| [33] |
Belshe RB, Ambrose CS, Yi T. Safety and efficacy of live attenuated influenza vaccine in children 2-7 years of age[J]. Vaccine, 2008, 26 Suppl 4: 10-16. DOI:10.1016/j.vaccine.2008.06.083 |
| [34] |
Block SL, Yogev R, Hayden FG, et al. Shedding and immunogenicity of live attenuated influenza vaccine virus in subjects 5-49 years of age[J]. Vaccine, 2008, 26(38): 4940-4946. DOI:10.1016/j.vaccine.2008.07.013 |
| [35] |
Mallory RM, Yi T, Ambrose CS. Shedding of Ann Arbor strain live attenuated influenza vaccine virus in children 6-59 months of age[J]. Vaccine, 2011, 29(26): 4322-4327. DOI:10.1016/j.vaccine.2011.04.022 |
| [36] |
Vesikari T, Karvonen A, Korhonen T, et al. A randomized, double-blind study of the safety, transmissibility and phenotypic and genotypic stability of cold-adapted influenza virus vaccine[J]. Pediatr Infect Dis J, 2006, 25(7): 590-595. DOI:10.1097/01.inf.0000220229.51531.47 |
| [37] |
Ezeanolue E, Harriman K, Hunter P, et al. General Best Practice Guidelines for Immunization[EB/OL].[2020-12-15]. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/.
|
| [38] |
Grohskopf LA, Alyanak E, Broder KR, et al. Prevention and Control of Seasonal Influenza with Vaccines:Recommendations of the Advisory Committee on Immunization Practices-United States, 2020-21 Influenza Season[J]. MMWR Recomm Rep, 2020, 69(8): 1-24. DOI:10.15585/mmwr.rr6908a1 |
| [39] |
Grohskopf LA, Alyanak E, Broder KR, et al. Prevention and Control of Seasonal Influenza with Vaccines:Recommendations of the Advisory Committee on Immunization Practices-United States, 2019-20 Influenza Season[J]. MMWR Recomm Rep, 2019, 68(3): 1-21. DOI:10.15585/mmwr.rr6803a1 |
| [40] |
Chiavenna C, Presanis AM, Charlett A, et al. Estimating age-stratified influenza-associated invasive pneumococcal disease in England:A time-series model based on population surveillance data[J]. PLoS Med, 2019, 16(6): 1002829. DOI:10.1371/journal.pmed.1002829 |
| [41] |
陈英虎, 华春珍, 俞蕙. 儿童肺炎链球菌性疾病诊治与防控建议[J]. 中华儿科杂志, 2018, 56(8): 564-570. |
| [42] |
Camargo DR, Pais FS, Volpini AC, et al. Revisiting molecular serotyping of Streptococcus pneumoniae[J]. BMC Genomics, 2015, 16(5 Suppl): 1. DOI:10.1186/1471-2164-16-S5-S1 |
| [43] |
Taylor SN, Sanders CV. Unusual manifestations of invasive pneumococcal infection[J]. Am J Med, 1999, 107(1A): 12-27. DOI:10.1016/s0002-9343(99)00103-5 |
| [44] |
Chi F, Leider M, Leendertz F, et al. New Streptococcus pneumoniae clones in deceased wild chimpanzees[J]. J Bacteriol, 2007, 189(16): 6085-6088. DOI:10.1128/JB.00468-07 |
| [45] |
王华庆, 安志杰. 肺炎球菌性疾病免疫预防专家共识(2017版)[J]. 中国预防医学杂志, 2018, 19(3): 161-191. |
| [46] |
李绍英, 沈叙庄, 王艳, 等. 5岁以下儿童门诊呼吸道感染常见病原携带及抗生素耐药的流行病学特征调查[J]. 中国实用儿科杂志, 2004, 19(4): 212-216. |
| [47] |
中华人民共和国卫生部. 中国妇幼卫生事业发展报告(2011)[J]. 中国妇幼卫生杂志, 2012, 3(2): 49-58. |
| [48] |
刘又宁, 陈民钧, 赵铁梅, 等. 中国城市成人社区获得性肺炎665例病原学多中心调查[J]. 中华结核和呼吸杂志, 2006, 29(1): 3-8. |
| [49] |
孙谨芳, 么鸿雁, 于石成, 等. 1990年和2010年中国3种细菌性脑膜炎疾病负担情况[J]. 疾病监测, 2015, 30(12): 1008-1013. DOI:10.3784/j.issn.1003-9961.2015.12.006 |
| [50] |
World Health Organization. Pneumococcal conjugate vaccines in infants and children under 5 years of age:WHO position paper-February 2019[J]. Wkly Epidemiol Rec, 2019, 94(8): 85-103. |
| [51] |
Lackner TE, Hamilton RG, Hill JJ, et al. Pneumococcal polysaccharide revaccination:immunoglobulin g seroconversion, persistence, and safety in frail, chronically ill older subjects[J]. J Am Geriatr Soc, 2003, 51(2): 240-245. DOI:10.1046/j.1532-5415.2003.51064.x |
| [52] |
Loughlin AM, Hsu K, Silverio AL, et al. Direct and indirect effects of PCV13 on nasopharyngeal carriage of PCV13 unique pneumococcal serotypes in Massachusetts' children[J]. Pediatr Infect Dis J, 2014, 33(5): 504-510. DOI:10.1097/INF.0000000000000279 |
| [53] |
韦宁, 安志杰, 王华庆. 中国≤ 18岁人群肺炎球菌相关病例中肺炎球菌血清型分布的系统评价[J]. 中国疫苗和免疫, 2014, 20(6): 547-555. |
| [54] |
Shapiro ED, Berg AT, Austrian R, et al. The protective efficacy of polyvalent pneumococcal polysaccharide vaccine[J]. N Engl J Med, 1991, 325(21): 1453-1460. DOI:10.1056/NEJM199111213252101 |
| [55] |
World Health Organization. Immunological basis for immunization series-module 9: Haemophilus influenzae type b[R]. Geneva: WHO, 2009.
|
| [56] |
Briere EC, Rubin L, Moro PL, et al. Prevention and control of haemophilus influenzae type b disease:recommendations of the advisory committee on immunization practices (ACIP)[J]. MMWR Recomm Rep, 2014, 63(RR-01): 1-14. |
| [57] |
Plotkin SA, Orenstein WA, Paul A, et al. Vaccines[M]. 6th edition. Philadelphia: ELSEVIER, 2011.
|
| [58] |
World Health Organization. Haemophilus influenzae type b (Hib) Vaccination WHO position paper:July 2013-Recommendations[J]. Vaccine, 2013, 31(52): 6168-6169. DOI:10.1016/j.vaccine.2013.10.045 |
| [59] |
Watt JP, Wolfson LJ, O'brien KL, et al. Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years:global estimates[J]. Lancet, 2009, 374(9693): 903-911. DOI:10.1016/S0140-6736(09)61203-4 |
| [60] |
Hamborsky J, Kroger A, Wolfe S. Epidemiology and Prevention of Vaccine-Preventable Diseases[M]. 13th Edition. Washington DC: Centers for Disease Control and Prevention, 2015: 199-133.
|
| [61] |
边兴艳, 崔振泽, 黄燕, 等. 大连地区儿童急性上呼吸道感染流感嗜血杆菌感染情况分析[J]. 中国卫生检验杂志, 2007, 17(1): 117-118. DOI:10.3969/j.issn.1004-8685.2007.01.051 |
| [62] |
Togashi T, Mitsuya N, Sumino S, et al. Safety, tolerability and immunogenicity of intramuscular administration of PRP-CRM197 Hib vaccine to healthy Japanese children:An open-label trial[J]. Vaccine, 2018, 36(21): 2968-2972. DOI:10.1016/j.vaccine.2018.04.040 |
| [63] |
李亚南, 梁丽, 李艳萍, 等. A、C群脑膜炎球菌-b型流感嗜血杆菌多糖结合疫苗免疫学效果观察[J]. 中国生物制品学杂志, 2012, 25(9): 1190-1194, 1197. |
| [64] |
Li G, Zhang H, Zhou W, et al. Safety and immunogenicity of a diphtheria, tetanus, acellular pertussis and Haemophilus influenzae Type b combination vaccine compared with separate administration of licensed equivalent vaccines in Chinese infants and toddlers for primary and booster immunization[J]. Vaccine, 2010, 28(25): 4215-4223. DOI:10.1016/j.vaccine.2010.03.061 |
| [65] |
李艳萍, 李凤祥, 侯启明, 等. 中国婴幼儿接种吸附无细胞百白破灭活脊髓灰质炎和b型流感嗜血杆菌(结合)联合疫苗的安全性和免疫原性研究[J]. 中华流行病学杂志, 2011, 32(8): 808-815. DOI:10.3760/cma.j.issn.0254-6450.2011.08.017 |
| [66] |
Obonyo CO, Lau J. Efficacy of Haemophilus influenzae type b vaccination of children:a meta-analysis[J]. Eur J Clin Microbiol Infect Dis, 2006, 25(2): 90-97. DOI:10.1007/s10096-006-0092-4 |
| [67] |
O'loughlin RE, Edmond K, Mangtani P, et al. Methodology and measurement of the effectiveness of Haemophilus influenzae type b vaccine:systematic review[J]. Vaccine, 2010, 28(38): 6128-6136. DOI:10.1016/j.vaccine.2010.06.107 |
| [68] |
Jackson C, Mann A, Mangtani P, et al. Effectiveness of Haemophilus influenzae type b vaccines administered according to various schedules:systematic review and meta-analysis of observational data[J]. Pediatr Infect Dis J, 2013, 32(11): 1261-1269. DOI:10.1097/INF.0b013e3182a14e57 |
| [69] |
Fitzwater SP, Watt JP, Levine OS, et al. Haemophilus influenzae type b conjugate vaccines:considerations for vaccination schedules and implications for developing countries[J]. Hum Vaccin, 2010, 6(10): 810-818. DOI:10.4161/hv.6.10.13017 |
| [70] |
范仁锋, 张吉凯, 廖玉宜, 等. 2~71月龄儿童接种AC群脑膜炎球菌(结合)b型流感嗜血杆菌(结合)联合疫苗后不良事件观察[J]. 中国疫苗和免疫, 2020, 26(5): 543-547. |
| [71] |
邓新娅, 李秀岭, 魏章华, 等. 无细胞百白破b型流感嗜血杆菌联合疫苗大规模上市后安全性观察[J]. 中国疫苗和免疫, 2018, 24(2): 182-185. |
| [72] |
白云骅, 李淑萍, 丁舒, 等. 北京市朝阳区12241名婴幼儿三个部位接种无细胞百白破b型流感嗜血杆菌联合疫苗安全性分析[J]. 中华预防医学杂志, 2020, 54(9): 953-957. DOI:10.3760/cma.j.cn112150-20200316-00342 |
| [73] |
李克莉, 张丽娜, 叶家楷, 等. 中国2017年疑似预防接种异常反应监测[J]. 中国疫苗和免疫, 2020, 26(1): 9-18. |
| [74] |
Guan D, van der Sanden S, Zeng H, et al. Population dynamics and genetic diversity of C4 strains of human enterovirus 71 in Mainland China, 1998-2010[J]. PLoS One, 2012, 7(9): 44386. DOI:10.1371/journal.pone.0044386 |
| [75] |
邓爱萍, 张永慧, 孙立梅, 等. 广东省健康人群手足口病病原隐性感染状况调查[J]. 中华流行病学杂志, 2012, 32(2): 189-191. |
| [76] |
张东晓, 杨帆, 王冰, 等. 深圳市社区人群EV71和CoxA16隐性感染的流行病学分析[J]. 中国热带医学, 2011, 11(11): 1332-1333. DOI:10.13604/j.cnki.46-1064/r.2011.11.00 |
| [77] |
Ho M, Chen ER, Hsu KH, et al. An epidemic of enterovirus 71 infection in Taiwan. Taiwan Enterovirus Epidemic Working Group[J]. N Engl J Med, 1999, 341(13): 929-935. DOI:10.1056/NEJM199909233411301 |
| [78] |
安志杰, 刘艳, 廖巧红, 等. 肠道病毒71型灭活疫苗使用技术指南[J]. 中国疫苗和免疫, 2016, 22(4): 458-464. |
| [79] |
Zhu F, Xu W, Xia J, et al. Efficacy, safety, and immunogenicity of an enterovirus 71 vaccine in China[J]. N Engl J Med, 2014, 370(9): 818-828. DOI:10.1056/NEJMoa1304923 |
| [80] |
Zhu FC, Meng FY, Li JX, et al. Efficacy, safety, and immunology of an inactivated alum-adjuvant enterovirus 71 vaccine in children in China:a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2013, 381(9882): 2024-2032. DOI:10.1016/S0140-6736(13)61049-1 |
| [81] |
Li R, Liu L, Mo Z, et al. An inactivated enterovirus 71 vaccine in healthy children[J]. N Engl J Med, 2014, 370(9): 829-837. DOI:10.1056/NEJMoa1303224 |
| [82] |
Hu YM, Wang X, Wang JZ, et al. Immunogenicity, safety, and lot consistency of a novel inactivated enterovirus 71 vaccine in Chinese children aged 6 to 59 months[J]. Clin Vaccine Immunol, 2013, 20(12): 1805-1811. DOI:10.1128/CVI.00491-13 |
| [83] |
Liu L, Mo Z, Liang Z, et al. Immunity and clinical efficacy of an inactivated enterovirus 71 vaccine in healthy Chinese children:a report of further observations[J]. BMC Med, 2015, 13(1): 226. DOI:10.1186/s12916-015-0448-7 |
| [84] |
Mao Q, Wang Y, Shao J, et al. The compatibility of inactivated-Enterovirus 71 vaccination with Coxsackievirus A16 and Poliovirus immunizations in humans and animals[J]. Hum Vaccin Immunother, 2015, 11(11): 2723-2733. DOI:10.1080/21645515.2015.1011975 |
| [85] |
Zhang H, An D, Liu W, et al. Analysis of cross-reactive neutralizing antibodies in human HFMD serum with an EV71 pseudovirus-based assay[J]. PLoS One, 2014, 9(6): 100545. DOI:10.1371/journal.pone.0100545 |
| [86] |
Mao Q, Cheng T, Zhu F, et al. The cross-neutralizing activity of enterovirus 71 subgenotype c4 vaccines in healthy chinese infants and children[J]. PLoS One, 2013, 8(11): 79599. DOI:10.1371/journal.pone.0079599 |
| [87] |
Estes MK. Rotaviruses and their replication[M]. 4th Edition. Philadelphia: Lippincott-Raven, 2001: 747-1786.
|
| [88] |
蔡莎, 朱庆雄. 轮状病毒感染的研究进展[J]. 中国临床研究, 2019, 32(8): 1132-1134. |
| [89] |
Estes MK, Cohen J. Rotavirus gene structure and function[J]. Microbiol Rev, 1989, 53(4): 410-449. |
| [90] |
Tallett S, Mackenzie C, Middleton P, et al. Clinical, laboratory, and epidemiologic features of a viral gastroenteritis in infants and children[J]. Pediatrics, 1977, 60(2): 217-222. |
| [91] |
Velazquez FR, Matson DO, Calva JJ, et al. Rotavirus infection in infants as protection against subsequent infections[J]. N Engl J Med, 1996, 335(14): 1022-1028. DOI:10.1056/NEJM199610033351404 |
| [92] |
杨海云. 口服轮状病毒疫苗免疫效果及安全性研究文献综述[J]. 中外医疗, 2014, 33(6): 186-188. |
| [93] |
Clements-Mann ML, Makhene MK, Mrukowicz J, et al. Safety and immunogenicity of live attenuated human-bovine (UK) reassortant rotavirus vaccines with VP7-specificity for serotypes 1, 2, 3 or 4 in adults, children and infants[J]. Vaccine, 1999, 17(20/21): 2715-2725. DOI:10.1016/s0264-410x(98)00497-6 |
| [94] |
代秋菊, 许红梅. 轮状病毒疫苗保护效果及其影响因素研究进展[J]. 儿科药学杂志, 2019, 25(12): 51-56. |
| [95] |
胡昱, 陈雅萍, 梁辉, 等. 口服人-牛(WC_3株)5价轮状病毒基因重配活疫苗保护效果的Meta分析[J]. 预防医学, 2018, 30(10): 992-996, 1001. DOI:10.19485/j.cnki.issn2096-5087.2018.10.005 |
| [96] |
Jia Z, Yi Y, Liu J, et al. Epidemiology of hepatitis E virus in China:results from the Third National Viral Hepatitis Prevalence Survey, 2005-2006[J]. PLoS One, 2014, 9(10): e110837. DOI:10.1371/journal.pone.0110837 |
| [97] |
段招军, 王华庆. 儿童轮状病毒胃肠炎免疫预防专家共识(2020版)[J]. 中华预防医学杂志, 2021, 55(1): 4-17. |
| [98] |
蒋雪峰, 郭林杰, 钟梦婷, 等. 国产单价口服轮状病毒活疫苗保护效果分析[J]. 预防医学, 2020, 32(2): 182-183, 186. |
| [99] |
黎明强, 吕榜军, 沈潘燕. 口服轮状病毒活疫苗罗特威保护效果及安全性Meta分析[J]. 中华疾病控制杂志, 2015, 19(10): 1038-1041, 1056. |
| [100] |
洪荣涛. 口服轮状病毒减毒活疫苗在婴幼儿人群使用中的挑战与对策[J]. 海峡预防医学杂志, 2019, 25(2): 87-90. |
| [101] |
American Academy of Pediatrics. Red Book:2012 Report of the Committee on Infectious Diseases[M]. Illinois: American Academy of Pediatrics, 2012.
|
| [102] |
李兰娟, 任红. 传染病学[M]. 第九版. 北京: 人民卫生出版社, 2018.
|
| [103] |
Asano Y, Yazaki T, Miyata T, et al. Application of a live attenuated varicella vaccine to hospitalized children and its protective effect on spread of varicella infection[J]. Biken J, 1975, 18(1): 35-40. |
| [104] |
Ceyhan M, Tezer H, Yildirim I. Secondary attack rate of hepatitis A, varicella and mumps in household settings and reliability of family history to detect seronegative children for necessity of vaccination[J]. Scand J Infect Dis, 2009, 41(6/7): 501-506. DOI:10.1080/00365540902968027 |
| [105] |
Centers for Disease Control and Prevention. Vaccine Information Statement-Varicella (Chickenpox) Vaccine[EB/OL].[2020-12-08]. https://www.cdc.gov/vaccines/hcp/vis/current-vis.html.
|
| [106] |
World Health Organization. Varicella and herpes zoster vaccines:WHO position paper, June 2014-Recommendations[J]. Vaccine, 2016, 34(2): 198-199. DOI:10.1016/j.vaccine.2014.07.068 |
| [107] |
随海田, 李锦成, 王淼, 等. 2005-2015年中国水痘流行病学特征[J]. 中国疫苗和免疫, 2019, 25(2): 155-159. |
| [108] |
殷大鹏, 宋立志, 张晓曙, 等. 鲁甘湘三省2007年水痘发病率调查[J]. 中国疫苗和免疫, 2009, 15(2): 119-122. |
| [109] |
李娜, 方凯, 马淑玲, 等. 国内水痘减毒活疫苗预防效果及其安全性的系统评价[J]. 中国疫苗和免疫, 2012, 18(1): 54-60. |
| [110] |
刘世科, 王帆, 章海斌, 等. 国产水痘减毒活疫苗不同时间加强免疫免疫原性观察[J]. 中国疫苗和免疫, 2015, 21(6): 620-622, 610. |
| [111] |
孙海燕, 袁家麟, 刘骁. 国产水痘减毒活疫苗接种的血清学免疫效果及成本效益分析[J]. 上海预防医学杂志, 2003, 15(9): 445-447. DOI:10.19428/j.cnki.sjpm.2003.09.012 |
| [112] |
潘兴强, 马瑞, 方挺, 等. 接种1剂次水痘疫苗水痘突破病例发生率及疫苗效果[J]. 中华预防医学杂志, 2015, 49(7): 611-614. |
| [113] |
Suo L, Lu L, Zhao D, et al. Impact of a 2-dose voluntary vaccination strategy on varicella epidemiology in Beijing, 2011-2017[J]. Vaccine, 2020, 38(20): 3690-3696. DOI:10.1016/j.vaccine.2020.01.087 |
| [114] |
卢莉, 索罗丹, 李娟. 北京市水痘疫苗使用技术指南[J]. 中华预防医学杂志, 2013, 47(1): 67-69. |
| [115] |
张军楠, 黄卓英, 王淼, 等. 中国水痘减毒活疫苗的安全性、免疫原性和保护效果[J]. 中国疫苗和免疫, 2018, 24(4): 487-491. |
| [116] |
中国医师协会皮肤科医师分会带状疱疹专家共识工作组. 带状疱疹中国专家共识[J]. 中华皮肤科杂志, 2018, 51(6): 403-408. |
| [117] |
于生元, 万有, 万琪, 等. 带状疱疹后神经痛诊疗中国专家共识[J]. 中国疼痛医学杂志, 2016, 22(3): 161-167. |
| [118] |
Kawai K, Gebremeskel BG, Acosta CJ. Systematic review of incidence and complications of herpes zoster:towards a global perspective[J]. BMJ Open, 2014, 4(6): 004833. DOI:10.1136/bmjopen-2014-004833 |
| [119] |
Lu L, Suo L, Li J, et al. A retrospective survey on herpes zoster disease burden and characteristics in Beijing, China[J]. Hum Vaccin Immunother, 2018, 14(11): 2632-2635. DOI:10.1080/21645515.2018.1489193 |
| [120] |
Oxman MN. Zoster vaccine:current status and future prospects[J]. Clin Infect Dis, 2010, 51(2): 197-213. DOI:10.1086/653605 |
| [121] |
Cunningham AL, Heineman TC, Lal H, et al. Immune Responses to a Recombinant Glycoprotein E Herpes Zoster Vaccine in Adults Aged 50 Years or Older[J]. J Infect Dis, 2018, 217(11): 1750-1760. DOI:10.1093/infdis/jiy095 |
| [122] |
Lal H, Cunningham AL, Godeaux O, et al. Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults[J]. N Engl J Med, 2015, 372(22): 2087-2096. DOI:10.1056/NEJMoa1501184 |
| [123] |
Cunningham AL, Lal H, Kovac M, et al. Efficacy of the Herpes Zoster Subunit Vaccine in Adults 70 Years of Age or Older[J]. N Engl J Med, 2016, 375(11): 1019-1032. DOI:10.1056/NEJMoa1603800 |
| [124] |
Hastie A, Catteau G, Enemuo A, et al. Immunogenicity of the adjuvanted recombinant zoster vaccine:persistence and anamnestic response to additional doses administered 10 years after primary vaccination[J]. J Infect Dis, 2020. DOI:10.1093/infdis/jiaa300 |
| [125] |
Godeaux O, Kovac M, Shu D, et al. Immunogenicity and safety of an adjuvanted herpes zoster subunit candidate vaccine in adults ≥ 50 years of age with a prior history of herpes zoster:A phase Ⅲ, non-randomized, open-label clinical trial[J]. Hum Vaccin Immunother, 2017, 13(5): 1051-1058. DOI:10.1080/21645515.2016.1265715 |
| [126] |
Bastidas A, de La Serna J, El Idrissi M, et al. Effect of Recombinant Zoster Vaccine on Incidence of Herpes Zoster After Autologous Stem Cell Transplantation:A Randomized Clinical Trial[J]. J Am Med Assoc, 2019, 322(2): 123-133. DOI:10.1001/jama.2019.9053 |
| [127] |
Vink P, Ramon Torrell JM, Sanchez Fructuoso A, et al. Immunogenicity and Safety of the Adjuvanted Recombinant Zoster Vaccine in Chronically Immunosuppressed Adults Following Renal Transplant:A Phase 3, Randomized Clinical Trial[J]. Clin Infect Dis, 2020, 70(2): 181-190. DOI:10.1093/cid/ciz177 |
| [128] |
Dagnew AF, Ilhan O, Lee WS, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in adults with haematological malignancies:a phase 3, randomised, clinical trial and post-hoc efficacy analysis[J]. Lancet Infect Dis, 2019, 19(9): 988-1000. DOI:10.1016/S1473-3099(19)30163-X |
| [129] |
Vink P, Delgado Mingorance I, Maximiano Alonso C, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine in patients with solid tumors, vaccinated before or during chemotherapy:A randomized trial[J]. Cancer, 2019, 125(8): 1301-1312. DOI:10.1002/cncr.31909 |
| [130] |
Berkowitz EM, Moyle G, Stellbrink HJ, et al. Safety and immunogenicity of an adjuvanted herpes zoster subunit candidate vaccine in HIV-infected adults:a phase 1/2a randomized, placebo-controlled study[J]. J Infect Dis, 2015, 211(8): 1279-1287. DOI:10.1093/infdis/jiu606 |
| [131] |
Schwarz TF, Aggarwal N, Moeckesch B, et al. Immunogenicity and Safety of an Adjuvanted Herpes Zoster Subunit Vaccine Coadministered With Seasonal Influenza Vaccine in Adults Aged 50 Years or Older[J]. J Infect Dis, 2017, 216(11): 1352-1361. DOI:10.1093/infdis/jix481 |
| [132] |
Maréchal C, Lal H, Poder A, et al. Immunogenicity and safety of the adjuvanted recombinant zoster vaccine co-administered with the 23-valent pneumococcal polysaccharide vaccine in adults ≥ 50 years of age:A randomized trial[J]. Vaccine, 2018, 36(29): 4278-4286. DOI:10.1016/j.vaccine.2018.05.110 |
| [133] |
Strezova A, Lal H, Enweonye I, et al. The adjuvanted recombinant zoster vaccine co-administered with a tetanus, diphtheria and pertussis vaccine in adults aged ≥ 50 years:A randomized trial[J]. Vaccine, 2019, 37(39): 5877-5885. DOI:10.1016/j.vaccine.2019.08.001 |
| [134] |
Andersson S, Safari H, Mints M, et al. Type distribution, viral load and integration status of high-risk human papillomaviruses in pre-stages of cervical cancer (CIN)[J]. Br J Cancer, 2005, 92(12): 2195-2200. DOI:10.1038/sj.bjc.6602648 |
| [135] |
Tomaic V. Functional Roles of E6 and E7 Oncoproteins in HPV-Induced Malignancies at Diverse Anatomical Sites[J]. Cancers (Basel), 2016, 8(10): 95. DOI:10.3390/cancers8100095 |
| [136] |
Kjaer SK, Frederiksen K, Munk C, et al. Long-term absolute risk of cervical intraepithelial neoplasia grade 3 or worse following human papillomavirus infection:role of persistence[J]. J Natl Cancer Inst, 2010, 102(19): 1478-1488. DOI:10.1093/jnci/djq356 |
| [137] |
Garland SM, Steben M, Sings HL, et al. Natural history of genital warts:analysis of the placebo arm of 2 randomized phase Ⅲ trials of a quadrivalent human papillomavirus (types 6, 11, 16, and 18) vaccine[J]. J Infect Dis, 2009, 199(6): 805-814. DOI:10.1086/597071 |
| [138] |
de Martel C, Plummer M, Vignat J, et al. Worldwide burden of cancer attributable to HPV by site, country and HPV type[J]. Int J Cancer, 2017, 141(4): 664-670. DOI:10.1002/ijc.30716 |
| [139] |
Tovar JM, Bazaldua OV, Vargas L, et al. Human papillomavirus, cervical cancer, and the vaccines[J]. Postgrad Med, 2008, 120(2): 79-84. DOI:10.3810/pgm.2008.07.1794 |
| [140] |
Alam S, Conway MJ, Chen HS, et al. The cigarette smoke carcinogen benzo[a]pyrene enhances human papillomavirus synthesis[J]. J Virol, 2008, 82(2): 1053-1058. DOI:10.1128/JVI.01813-07 |
| [141] |
Clifford GM, Smith JS, Plummer M, et al. Human papillomavirus types in invasive cervical cancer worldwide:a meta-analysis[J]. Br J Cancer, 2003, 88(1): 63-73. DOI:10.1038/sj.bjc.6600688 |
| [142] |
Zhang R, Velicer C, Chen W, et al. Human papillomavirus genotype distribution in cervical intraepithelial neoplasia grades 1 or worse among 4215 Chinese women in a population-based study[J]. Cancer Epidemiol, 2013, 37(6): 939-945. DOI:10.1016/j.canep.2013.10.005 |
| [143] |
Zhu F, Li J, Hu Y, et al. Immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese girls and women aged 9 to 45 years[J]. Hum Vaccin Immunother, 2014, 10(7): 1795-1806. DOI:10.4161/hv.28702 |
| [144] |
Hu YM, Guo M, Li CG, et al. Immunogenicity noninferiority study of 2 doses and 3 doses of an Escherichia coli-produced HPV bivalent vaccine in girls vs. 3 doses in young women[J]. Sci China Life Sci, 2020, 63(4): 582-591. DOI:10.1007/s11427-019-9547-7 |
| [145] |
Qiao YL, Wu T, Li RC, et al. Efficacy, Safety, and Immunogenicity of an Escherichia coli-Produced Bivalent Human Papillomavirus Vaccine:An Interim Analysis of a Randomized Clinical Trial[J]. J Natl Cancer Inst, 2020, 112(2): 145-153. DOI:10.1093/jnci/djz074 |
| [146] |
Li R, Li Y, Radley D, et al. Safety and immunogenicity of a vaccine targeting human papillomavirus types 6, 11, 16 and 18:a randomized, double-blind, placebo-controlled trial in Chinese males and females[J]. Vaccine, 2012, 30(28): 4284-4291. DOI:10.1016/j.vaccine.2012.02.079 |
| [147] |
Huang Z, He J, Su J, et al. Immunogenicity and safety of the quadrivalent human papillomavirus vaccine in Chinese females aged 9 to 26 years:A phase 3, open-label, immunobridging study[J]. Vaccine, 2021, 39(4): 760-766. DOI:10.1016/j.vaccine.2020.11.008 |
| [148] |
Vesikari T, Brodszki N, Van Damme P, et al. A Randomized, Double-Blind, Phase Ⅲ Study of the Immunogenicity and Safety of a 9-Valent Human Papillomavirus L1 Virus-Like Particle Vaccine (V503) Versus Gardasil(R) in 9-15-Year-Old Girls[J]. Pediatr Infect Dis J, 2015, 34(9): 992-998. DOI:10.1097/INF.0000000000000773 |
| [149] |
Joura EA, Giuliano AR, Iversen OE, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women[J]. N Engl J Med, 2015, 372(8): 711-723. DOI:10.1056/NEJMoa1405044 |
| [150] |
Garland SM, Pitisuttithum P, Ngan HYS, et al. Efficacy, Immunogenicity, and Safety of a 9-Valent Human Papillomavirus Vaccine:Subgroup Analysis of Participants From Asian Countries[J]. J. Infect. Dis., 2018, 218(1): 95-108. DOI:10.1093/infdis/jiy133 |
| [151] |
Zhu FC, Chen W, Hu YM, et al. Efficacy, immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine in healthy Chinese women aged 18-25 years:results from a randomized controlled trial[J]. Int J Cancer, 2014, 135(11): 2612-2622. DOI:10.1002/ijc.28897 |
| [152] |
Wei L, Xie X, Liu J, et al. Efficacy of quadrivalent human papillomavirus vaccine against persistent infection and genital disease in Chinese women:A randomized, placebo-controlled trial with 78-month follow-up[J]. Vaccine, 2019, 37(27): 3617-3624. DOI:10.1016/j.vaccine.2018.08.009 |
| [153] |
Drolet M, Bénard E, Pérez N, et al. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis[J]. Lancet, 2019, 394(10197): 497-509. DOI:10.1016/S0140-6736(19)30298-3 |
| [154] |
Lei J, Ploner A, Elfström KM, et al. HPV Vaccination and the Risk of Invasive Cervical Cancer[J]. N Engl J Med, 2020, 383(14): 1340-1348. DOI:10.1056/NEJMoa1917338 |
| [155] |
Artemchuk H, Eriksson T, Poljak M, et al. Long-term Antibody Response to Human Papillomavirus Vaccines: Up to 12 Years of Follow-up in the Finnish Maternity Cohort[J]. J Infect Dis, 2019, 219(4): 582-589. DOI:10.1093/infdis/jiy545 |
| [156] |
Skinner SR, Szarewski A, Romanowski B, et al. Efficacy, safety, and immunogenicity of the human papillomavirus 16/18 AS04-adjuvanted vaccine in women older than 25 years: 4-year interim follow-up of the phase 3, double-blind, randomised controlled VIVIANE study[J]. Lancet, 2014, 384(9961): 2213-2227. DOI:10.1016/S0140-6736(14)60920-X |
| [157] |
Schwarz TF, Huang LM, Medina DM, et al. Four-year follow-up of the immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine when administered to adolescent girls aged 10-14 years[J]. J Adolesc Health, 2012, 50(2): 187-194. DOI:10.1016/j.jadohealth.2011.11.004 |
| [158] |
Andrews N, Stowe J, Miller E. No increased risk of Guillain-Barre syndrome after human papilloma virus vaccine: A self-controlled case-series study in England[J]. Vaccine, 2017, 35(13): 1729-1732. DOI:10.1016/j.vaccine.2017.01.076 |
| [159] |
Gee J, Sukumaran L, Weintraub E, et al. Risk of Guillain-Barre Syndrome following quadrivalent human papillomavirus vaccine in the Vaccine Safety Datalink[J]. Vaccine, 2017, 35(43): 5756-5758. DOI:10.1016/j.vaccine.2017.09.009 |
| [160] |
Feiring B, Laake I, Bakken IJ, et al. HPV vaccination and risk of chronic fatigue syndrome/myalgic encephalomyelitis: A nationwide register-based study from Norway[J]. Vaccine, 2017, 35(33): 4203-4212. DOI:10.1016/j.vaccine.2017.06.031 |
| [161] |
Huygen F, Verschueren K, Mccabe C, et al. Investigating Reports of Complex Regional Pain Syndrome: An Analysis of HPV-16/18-Adjuvanted Vaccine Post-Licensure Data[J]. EBioMedicine, 2015, 2(9): 1114-1121. DOI:10.1016/j.ebiom.2015.07.003 |
| [162] |
Brinth LS, Pors K, Theibel AC, et al. Orthostatic intolerance and postural tachycardia syndrome as suspected adverse effects of vaccination against human papilloma virus[J]. Vaccine, 2015, 33(22): 2602-2605. DOI:10.1016/j.vaccine.2015.03.098 |
| [163] |
Arana J, Mba-Jonas A, Jankosky C, et al. Reports of Postural Orthostatic Tachycardia Syndrome After Human Papillomavirus Vaccination in the Vaccine Adverse Event Reporting System[J]. J Adolesc Health, 2017, 61(5): 577-582. DOI:10.1016/j.jadohealth.2017.08.004 |
| [164] |
Schilling A, Parra MM, Gutierrez M, et al. Coadministration of a 9-Valent Human Papillomavirus Vaccine With Meningococcal and Tdap Vaccines[J]. Pediatrics, 2015, 136(3): 17. DOI:10.1542/peds.2014-4199 |
| [165] |
Grimaldi-Bensouda L, Guillemot D, Godeau B, et al. Autoimmune disorders and quadrivalent human papillomavirus vaccination of young female subjects[J]. J Intern Med, 2014, 275(4): 398-408. DOI:10.1111/joim.12155 |
| [166] |
Heijstek MW, Scherpenisse M, Groot N, et al. Immunogenicity and safety of the bivalent HPV vaccine in female patients with juvenile idiopathic arthritis: a prospective controlled observational cohort study[J]. Ann Rheum Dis, 2014, 73(8): 1500-1507. DOI:10.1136/annrheumdis-2013-203429 |
| [167] |
Jacobson DL, Bousvaros A, Ashworth L, et al. Immunogenicity and tolerability to human papillomavirus-like particle vaccine in girls and young women with inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19(7): 1441-1449. DOI:10.1097/MIB.0b013e318281341b |
| [168] |
Toft L, Storgaard M, Muller M, et al. Comparison of the immunogenicity and reactogenicity of Cervarix and Gardasil human papillomavirus vaccines in HIV-infected adults: a randomized, double-blind clinical trial[J]. J Infect Dis, 2014, 209(8): 1165-1173. DOI:10.1093/infdis/jit657 |
| [169] |
Giacomet V, Penagini F, Trabattoni D, et al. Safety and immunogenicity of a quadrivalent human papillomavirus vaccine in HIV-infected and HIV-negative adolescents and young adults[J]. Vaccine, 2014, 32(43): 5657-5661. DOI:10.1016/j.vaccine.2014.08.011 |
| [170] |
Baril L, Rosillon D, Willame C, et al. Risk of spontaneous abortion and other pregnancy outcomes in 15-25 year old women exposed to human papillomavirus-16/18 AS04-adjuvanted vaccine in the United Kingdom[J]. Vaccine, 2015, 33(48): 6884-6891. DOI:10.1016/j.vaccine.2015.07.024 |
| [171] |
Goss MA, Lievano F, Buchanan KM, et al. Final report on exposure during pregnancy from a pregnancy registry for quadrivalent human papillomavirus vaccine[J]. Vaccine, 2015, 33(29): 3422-3428. DOI:10.1016/j.vaccine.2015.04.014 |
| [172] |
World Health Organization. Human papillomavirus vaccines: WHO position paper, May 2017[J]. Wkly Epidemiol Rec, 2017, 92(19): 241-268. DOI:10.1016/j.vaccine.2017.05.069 |
| [173] |
中华预防医学会疫苗与免疫分会. 子宫颈癌等人乳头瘤病毒相关疾病免疫预防专家共识[J]. 中华预防医学杂志, 2019, 53(8): 761-803. DOI:10.3760/cma.j.issn.0253-9624.2019.08.001 |
| [174] |
The International Committee on Taxonomy of Viruses. Rhabdoviridae[EB/OL]. [2020-04-05]. https://talk.ictvonline.org/ictvreports/ictv_9th_report/negative-sense-rna-viruses-2011/w/negrna_viruses/201/rhabdoviridae.
|
| [175] |
Mclean HQ, World Health Organization. The immunological basis for immunization series: module 17: rabies[M]. Geneva: World Health Organization, 2011.
|
| [176] |
World Health Organization. WHO Expert Consultation on Rabies[R]. Geneva: World Health Organization, 2013.
|
| [177] |
World Health Organization. WHO fact sheet on rabies [EB/OL]. [2020-04-05]. http://www.who.int/mediacentre/factsheets/fs099/en/.
|
| [178] |
Hampson K, Coudeville L, Lembo T, et al. Correction: Estimating the global burden of endemic canine rabies[J]. PLoS Negl Trop Dis, 2015, 9(5): 0003786. DOI:10.1371/journal.pntd.0003786 |
| [179] |
Dodet B, Africa Rabies Expert B, Adjogoua EV, et al. Fighting rabies in Africa: the Africa Rabies Expert Bureau (AfroREB)[J]. Vaccine, 2008, 26(50): 6295-6298. DOI:10.1016/j.vaccine.2008.04.087 |
| [180] |
Knobel DL, Cleaveland S, Coleman PG, et al. Re-evaluating the burden of rabies in Africa and Asia[J]. Bull World Health Organ, 2005, 83(5): 360-368. |
| [181] |
Rupprecht CE, Nagarajan T, Ertl H. Current Status and Development of Vaccines and Other Biologics for Human Rabies Prevention[J]. Expert Rev Vaccines, 2016, 15(6): 731-749. DOI:10.1586/14760584.2016.1140040 |
| [182] |
Franka R, Wu X, Jackson FR, et al. Rabies virus pathogenesis in relationship to intervention with inactivated and attenuated rabies vaccines[J]. Vaccine, 2009, 27(51): 7149-7155. DOI:10.1016/j.vaccine.2009.09.034 |
| [183] |
Rupprecht CE, Briggs D, Brown CM, et al. Use of a reduced (4-dose) vaccine schedule for postexposure prophylaxis to prevent human rabies: recommendations of the advisory committee on immunization practices[J]. MMWR Recomm Rep, 2010, 59(RR-2): 1-9. |
| [184] |
Hu Q, Liu MQ, Zhu ZG, et al. Comparison of safety and immunogenicity of purified chick embryo cell vaccine using Zagreb and Essen regimens in patients with category Ⅱ exposure in China[J]. Hum Vaccin Immunother, 2014, 10(6): 1645-1649. DOI:10.4161/hv.28420 |
| [185] |
Huang G, Liu H, Tang Q, et al. Making rabies prophylaxis more economical: immunogenicity and safety results from a preliminary study using a 2-1 intramuscular regimen in healthy volunteers[J]. Hum Vaccin Immunother, 2014, 10(1): 114-119. DOI:10.4161/hv.26264 |
| [186] |
Wasi C, Chaiprasithikul P, Auewarakul P, et al. The abbreviated 2-1-1 schedule of purified chick embryo cell rabies vaccination for rabies postexposure treatment[J]. SouthEast Asian J Trop Med Public Health, 1993, 24(3): 461-466. |
| [187] |
陈恩富, 王臻, 胡建锦, 等. 国产纯化Vero细胞狂犬病疫苗暴露前免疫效果观察[J]. 中华流行病学杂志, 2009, 30(1): 33. |
| [188] |
World Health Organization. Rabies vaccines: WHO position paper-recommendations[J]. Vaccine, 2010, 28(44): 7140-7142. DOI:10.1016/j.vaccine.2010.08.082 |
| [189] |
中国疾病预防控制中心. 狂犬病预防控制技术指南(2016版)[J]. 中国病毒病杂志, 2016, 6(3): 161-188. DOI:10.16505/j.2095-0136.2016.03.001 |
| [190] |
Manning SE, Rupprecht CE, Fishbein D, et al. Human rabies prevention-United States, 2008: recommendations of the Advisory Committee on Immunization Practices[J]. MMWR Recomm Rep, 2008, 57(RR-3): 1-27. |
| [191] |
Simons FER, Ardusso LRF, Bilò MB, et al. 2012 Update: World Allergy Organization Guidelines for the assessment and management of anaphylaxis[J]. Curr Opin Allergy Clin Immunol, 2012, 12(4): 389-399. DOI:10.1097/ACI.0b013e328355b7e4 |
| [192] |
Fishbein DB, Yenne KM, Dreesen DW, et al. Risk factors for systemic hypersensitivity reactions after booster vaccinations with human diploid cell rabies vaccine: a nationwide prospective study[J]. Vaccine, 1993, 11(14): 1390-1394. DOI:10.1016/0264-410x(93)90167-v |
| [193] |
中华人民共和国卫生部.过敏性紫癜等6种疾病诊疗指南[S]. 2010-09-18.
|
| [194] |
史建伟, 彭芝英, 汤卫平, 等. 狂犬病疫苗接种后不良反应观察研究[J]. 实用预防医学, 2006, 13(6): 1515-1516. |
| [195] |
苏雪媚, 李文东. 狂犬疫苗致不良反应156例文献分析[J]. 中国药房, 2009, 20(17): 1348-1350. |
| [196] |
黄肖梅. 人用狂犬病疫苗不良反应的调查报告[J]. 海峡药学, 2010, 22(4): 178-179. |
| [197] |
Abazeed ME, Cinti S. Rabies prophylaxis for pregnant women[J]. Emerg Infect Dis, 2007, 13(12): 1966-1967. DOI:10.3201/eid1312.070157 |
| [198] |
陈化新. 中国肾综合征出血热疫苗大规模应用研究[J]. 中华流行病学杂志, 2002, 23(2): 70-72. |
| [199] |
陈化新, 罗兆庄, 张家驹, 等. 肾综合征出血热疫苗预防效果和免疫策略研究[J]. 中国公共卫生, 1999, 15(7): 3-10. |
| [200] |
董关木. 肾综合征出血热疫苗研究现状[J]. 中华实验和临床病毒学杂志, 2003, 17(2): 96-100. |
| [201] |
王玉林, 罗兆庄. 中国肾综合征出血热疫苗的研究[J]. 中国媒介生物学及控制杂志, 2003, 14(5): 398-399. |
| [202] |
陈化新, 叶克龙, 张家驹, 等. 中国肾综合征出血热疫苗免疫效果评价和免疫策略研究[J]. 中国媒介生物学及控制杂志, 1996, 7(4): 241-247. |
| [203] |
Jung J, Ko SJ, Oh HS, et al. Protective Effectiveness of Inactivated Hantavirus Vaccine Against Hemorrhagic Fever With Renal Syndrome[J]. J Infect Dis, 2018, 217(9): 1417-1420. DOI:10.1093/infdis/jiy037 |
| [204] |
王鸣. 实用免疫接种培训教程[M]. 北京: 中国中医药出版社, 2007.
|
| [205] |
李凡, 徐志凯. 医学微生物学[M]. 北京: 人民卫生出版社, 2013: 198-202.
|
| [206] |
严杰, 戴保民, 于恩庶. 钩端螺旋体病学[M]. 北京: 人民卫生出版社, 2006: 471-476.
|
| [207] |
Faine S, Adler B, Bolin C, et al. Leptospira and Leptospirosis[M]. 2nd Edition. Melbourne: MediSci, 1999.
|
| [208] |
中华人民共和国国家药典委员会. 中华人民共和国药典(三部)[M]. 北京: 中国医药科技出版社, 2015.
|
| [209] |
支慧, 王克霞, 李朝品. 钩端螺旋体疫苗的研究现状[J]. 中国媒介生物学及控制杂志, 2005, 16(1): 71-73. DOI:10.3969/j.issn.1003-4692.2005.01.027 |
| [210] |
谢广中, 张锦麟, 秦进才, 等. 钩端螺旋体外膜疫苗的反应性和免疫效果研究[J]. 微生物学免疫学进展, 2002, 30(2): 14-18. DOI:10.3969/j.issn.1005-5673.2002.02.004 |
| [211] |
徐国英, 潘敏楠, 林光宇, 等. 福建省新丙五价钩端螺旋体菌苗接种后反应与免疫效果的观察[J]. 中国人兽共患病杂志, 2005, 21(11): 96-99. DOI:10.3969/j.issn.1002-2694.2005.11.025 |
| [212] |
严有望. 钩端螺旋体疫苗大面积接种的流行病学效果[J]. 中国生物制品学杂志, 2000, 13(3): 188-189. DOI:10.13200/j.cjb.2000.03.61.yanyw.024 |
| [213] |
秦进才, 高吉元, 蒲丛. 钩端螺旋体疫苗的接种反应和血清学效果观察[J]. 微生物学杂志, 2004, 24(5): 26-28. |
| [214] |
刁连东, 孙晓东. 实用疫苗学[M]. 上海: 上海科学技术出版社, 2015: 326-330.
|
| [215] |
寇志华, 魏茂提, 张松乐, 等. 炭疽疫苗A16R诱导小鼠的黏膜与系统免疫应答[J]. 中国生物制品学杂志, 2003, 5(5): 273-275. DOI:10.13200/j.cjb.2003.05.20.kouzhh.007 |
| [216] |
董树林. 新中国炭疽防治成果与研究进展[J]. 中华流行病学杂志, 1999, 20(3): 8-10. |
| [217] |
李澄, 闫绍宏, 郭卫东, 等. 2001-2011年内蒙古炭疽流行病学特征分析[J]. 中国人兽共患病学报, 2012, 28(8): 854-856. |
| [218] |
孙校金, 张国民, 郑徽, 等. 2004—2017年中国戊型肝炎流行特征分析[J]. 中华预防医学杂志, 2019, 53(4): 382-387. |
| [219] |
王富珍, 孙校金, 王锋, 等. 我国2014年1~29岁人群戊型肝炎血清流行病学特征分析[J]. 中华流行病学杂志, 2019, 40(11): 1426-1431. |
| [220] |
Yu XY, Chen ZP, Wang SY, et al. Safety and immunogenicity of hepatitis E vaccine in elderly people older than 65years[J]. Vaccine, 2019, 37(32): 4581-4586. DOI:10.1016/j.vaccine.2019.04.006 |
| [221] |
Zhu FC, Zhang J, Zhang XF, et al. Efficacy and safety of a recombinant hepatitis E vaccine in healthy adults: a large-scale, randomised, double-blind placebo-controlled, phase 3 trial[J]. Lancet, 2010, 376(9744): 895-902. DOI:10.1016/S0140-6736(10)61030-6 |
| [222] |
Zhang J, Zhang XF, Huang SJ, et al. Long-term efficacy of a hepatitis E vaccine[J]. N Engl J Med, 2015, 372(10): 914-922. DOI:10.1056/NEJMoa1406011 |
| [223] |
Albert MJ, Ansaruzzaman M, Bardhan PK, et al. Large epidemic of cholera-like disease in Bangladesh caused by Vibrio cholerae O139 synonym Bengal[J]. Lancet, 1993, 342(8868): 387-390. DOI:10.1016/0140-6736(93)92811-7 |
| [224] |
Ramamurthy T, Garg S, Sharma R, et al. Emergence of novel strain of Vibrio cholerae with epidemic potential in southern and eastern India[J]. Lancet, 1993, 341(8846): 703-704. DOI:10.1016/0140-6736(93)90480-5 |
| [225] |
Johnson JA, Salles CA, Panigrahi P, et al. Vibrio cholerae O139 synonym bengal is closely related to Vibrio cholerae El Tor but has important differences[J]. Infect Immun, 1994, 62(5): 2108-2110. DOI:10.1128/IAI.62.5.2108-2110.1994 |
| [226] |
Carpenter CC. Cholera: diagnosis and treatment[J]. Bull N Y Acad Med, 1971, 47(10): 1192-1203. DOI:10.1136/bmj.2.5464.749 |
| [227] |
Koch R. An Address on Cholera and its Bacillus[J]. Br Med J, 1884, 2(1235): 403-407. DOI:10.1136/bmj.2.1235.403 |
| [228] |
Howard-Jones N. Robert Koch and the cholera vibrio: a centenary[J]. Br Med J (Clin Res Ed), 1984, 288(6414): 379-381. DOI:10.1136/bmj.288.6414.379 |
| [229] |
Lowry PW, Pavia AT, Mcfarland LM, et al. Cholera in Louisiana. Widening spectrum of seafood vehicles[J]. Arch Intern Med, 1989, 149(9): 2079-2084. DOI:10.1001/archinte.149.9.2079 |
| [230] |
Svennerholm AM, Jertborn M, Gothefors L, et al. Mucosal antitoxic and antibacterial immunity after cholera disease and after immunization with a combined B subunit-whole cell vaccine[J]. J Infect Dis, 1984, 149(6): 884-893. DOI:10.1093/infdis/149.6.884 |
| [231] |
Sack DA, Clemens JD, Huda S, et al. Antibody responses after immunization with killed oral cholera vaccines during the 1985 vaccine field trial in Bangladesh[J]. J Infect Dis, 1991, 164(2): 407-411. DOI:10.1093/infdis/164.2.407 |
| [232] |
Svennerholm AM, Holmgren J. Synergistic protective effect in rabbits of immunization with Vibrio cholerae lipopolysaccharide and toxin/toxoid[J]. Infect Immun, 1976, 13(3): 735-740. DOI:10.1128/IAI.13.3.735-740.1976 |
| [233] |
陈清, 俞守义, 王雅贤, 等. 冻干口服霍乱rBS—WC菌苗安全性及免疫原性的人群试验[J]. 中华预防医学杂志, 1996, 30(6): 330-333. DOI:10.1007/BF02943147 |
| [234] |
甄蓓, 俞守义, 陈清, 等. 冻干口服霍乱rBS—WC疫苗现场试验及评价[J]. 中国计划免疫, 1999, 5(4): 210-214. |
| [235] |
Sanchez JL, Trofa AF, Taylor DN, et al. Safety and immunogenicity of the oral, whole cell/recombinant B subunit cholera vaccine in North American volunteers[J]. J Infect Dis, 1993, 167(6): 1446-1449. DOI:10.1093/infdis/167.6.1446 |
| [236] |
Begue RE, Castellares G, Ruiz R, et al. Community-based assessment of safety and immunogenicity of the whole cell plus recombinant B subunit (WC/rBS) oral cholera vaccine in Peru[J]. Vaccine, 1995, 13(7): 691-694. DOI:10.1016/0264-410x(94)00056-s |
| [237] |
时念民, 罗凤基, 李书明, 等. 大学生与务工人员服用口服重组B亚单位霍乱疫苗的安全性及效果分析[J]. 中华医学杂志, 2010, 90(3): 192-195. |
| [238] |
黄腾, 李荣成, 刘德平. 重组B亚单位/菌体霍乱疫苗以抗酸剂冲服对2~6岁健康人群的免疫原性和安全性研究[J]. 中华预防医学杂志, 2017, 51(9): 827-831. |
| [239] |
张鑫培, 陈恩富, 吕华坤, 等. 自然人群口服重组B亚单位/菌体霍乱疫苗现场安全性评价[J]. 中国疫苗和免疫, 2009, 15(3): 255-258. |
| [240] |
贾蕾, 吴疆, 黎新宇, 等. 口服霍乱菌苗安全性评价[J]. 现代预防医学, 2007, 34(1): 128-130. |
| [241] |
Fuerst HT. Typhoid Fever and Other Salmonella Infections[J]. Postgrad Med J, 1964, 40(462): 223-223. DOI:10.1136/pgmj.40.462.223-b |
| [242] |
Ewing WH. Edwards and Ewing's Identification of Enterobacteriaceae[M]. NewYork: Elsevier, 1986.
|
| [243] |
Brown KW, Donnelly KC, Deuel LEVIS. Effects of mineral nutrients, sludge application rate, and application frequency on biodegradation of two oily sludges[J]. Microb Ecol, 1983, 9(4): 363-373. DOI:10.1007/BF02019025 |
| [244] |
曲梅, 黄瑛, 张新, 等. 2008-2018年北京市伤寒、副伤寒沙门菌病原学特征[J]. 首都公共卫生, 2019, 13(2): 57-61. |
| [245] |
艾敏, 王树坤. 全球伤寒与副伤寒流行情况、危险因素和预防策略[J]. 中国公共卫生, 2019, 35(2): 250-256. |
| [246] |
Immunization Action Coalition. Vaccine Information Statements[EB/OL]. [2020-12-08]. http://www.immunize.org/vis.
|
| [247] |
周伟忠, 张亮才, 倪大新, 等. 国产与法国Merieux产伤寒Vi多糖菌苗人体接种反应与血清学效果观察[J]. 中国公共卫生, 1999, 15(10): 3-5. |
| [248] |
周伟忠, 曾明, 潘红星, 等. 伤寒Vi多糖疫苗的接种反应及其免疫效果[J]. 中国生物制品学杂志, 2008, 21(5): 425-427. DOI:10.13200/j.cjb.2008.05.78.zhouwzh.011 |
| [249] |
王志高, 周伟忠, 程信超, 等. 伤寒Vi多糖菌苗人体接种反应与血清学观察[J]. 江苏预防医学, 1996(4): 12-14. |
| [250] |
邱宇鹤, 王轶文, 何淑云. 森林脑炎疫苗的研究进展[J]. 中国生物制品学杂志, 2015, 28(11): 1228-1232. DOI:10.13200/j.cnki.cjb.001154 |
| [251] |
何淑云, 付博, 范学斌, 等. 森林脑炎灭活疫苗的安全性和免疫原性研究[J]. 中国实验诊断学, 2014, 18(5): 810-811. |
| [252] |
刘双军, 刘岩松, 孙宏亮, 等. 不同病毒培养方式制备森林脑炎灭活疫苗的比较[J]. 中国生物制品学杂志, 2018, 31(5): 449-452. DOI:10.13200/j.cnki.cjb.002163 |
| [253] |
杜瑞林, 宋宗明, 刘国云, 等. 森林脑炎灭活疫苗大规模人群接种的接种反应及免疫效果观察[J]. 中国生物制品学杂志, 2012, 25(11): 1511-1513. DOI:10.13200/j.cjb.2012.11.112.durl.011 |
| [254] |
周凤岩, 付博, 乔建国, 等. 不同年龄人群免疫森林脑炎灭活疫苗后28 d免疫效果观察[J]. 中国卫生工程学, 2013, 12(6): 504-507. |
| [255] |
李文娟, 张颖, 孙宏亮, 等. 两种不同培养工艺制备森林脑炎灭活疫苗的免疫原性及安全性评价[J]. 中国生物制品学杂志, 2020, 33(3): 246-249. DOI:10.13200/j.cnki.cjb.003000 |
| [256] |
费刚. 森林脑炎灭活疫苗细菌内毒素含量的测定[J]. 中国医药指南, 2013, 11(25): 356-357. DOI:10.15912/j.cnki.gocm.2013.25.002 |
| [257] |
刘长胜, 范晓宇. 注射森林脑炎灭活疫苗致过敏性休克1例[J]. 临床军医杂志, 2013, 41(11): 1210. |
| [258] |
何淑云, 王轶文, 乔建国, 等. 森林脑炎灭活疫苗加强免疫效果的临床观察[J]. 中国生物制品学杂志, 2015, 28(4): 377-378. DOI:10.13200/j.cnki.cjb.000851 |
 2021, Vol. 42
2021, Vol. 42