文章信息
- 赵宏婷, 彭质斌, 杨孝坤, 李志丽, 任敏睿, 秦颖, 孙校金, 余建兴, 安志杰, 毛乃颖, 许文波, 李中杰.
- Zhao Hongting, Peng Zhibin, Yang Xiaokun, Li Zhili, Ren Minrui, Qin Ying, Sun Xiaojin, Yu Jianxing, An Zhijie, Mao Naiying, Xu Wenbo, Li Zhongjie
- 新型冠状病毒感染者特异性抗体动态变化特征研究进展
- Progress in research of specific antibody dynamic characteristics in patients with COVID-19
- 中华流行病学杂志, 2020, 41(0): 0-0
- Chinese Journal of Epidemiology, 2020, 41(0): 0-0
- http://dx.doi.org/10.3760/cma.j.cn112338-20200809-01047
-
文章历史
收稿日期: 2020-08-09
2. 中国疾病预防控制中心传染病监测预警重点实验室, 传染病管理处, 呼吸道传染病室, 北京 102206;
3. 中国疾病预防控制中心免疫规划中心, 北京 100050;
4. 中国疾病预防控制中心传染病预防控制所, 北京 102206;
5. 中国疾病预防控制中心病毒病预防控制所, 北京 102206
2. Branch of Respiratory Disease Division of Infectious Disease, Key Laboratory of Infectious Disease Surveillawe and Ear-warning, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3. National Immunization Programme, Chinese Center for Disease Control and Prevention, Beijing 100050, China;
4. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
5. National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
新型冠状病毒肺炎(新冠肺炎,COVID-19)是一种由新冠病毒引起的传染性疾病。据WHO 2020年7月31日统计数据显示,COVID-19已造成全球216个国家和地区约1 710万人感染,超66万人死亡[1]。COVID-19大流行对全球公共卫生系统提出了巨大挑战,由于缺乏治疗药物和疫苗,对新冠病毒感染者的早发现和早隔离仍然是目前防控疫情最有效的手段。目前,开展新冠病毒核酸检测是最常用的实验室诊断方法,检测抗新冠病毒特异性抗体可作为重要的临床辅助诊断方法。此外,抗新冠病毒特异性抗体检测在识别机体感染状态,评估人群感染水平、再感染的风险以及治疗和管理效果等方面也起着至关重要的作用。在新冠肺炎疫情发生后的半年多时间里,越来越多新冠病毒感染引起的机体体液免疫应答及其特异性抗体动态变化特征的文章发表,对其认识不断加深。本文对新冠肺炎疫情暴发以来国内外开展的感染者血清特异性抗体动态变化特征相关研究进行归纳总结(图 1),同时比较了新型冠状病毒与严重急性呼吸综合征(Severe Acute Respiratory Syndrome,SARS)病毒感染所致的抗体动态变化特征(表 1),希望为进一步开展新冠血清抗体相关研究提供参考。
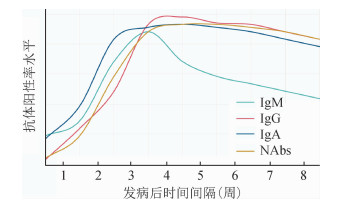
|
| 注:NAbs:中和抗体; 时间间隔和抗体检测阳性率水平基于本文综述的一些已报告发表的数据, 此图仅用于示意说明, 并不代表每种抗体的实际阳性率水平 图 1 新冠病毒感染特异性抗体阳性率动态变化特征示意图 |
1.抗新冠病毒特异性IgM抗体动态变化特征:IgM抗体被认为是新冠病毒感染后机体最早产生的特异性抗体之一。与SARS病毒、中东呼吸综合征(middle east respiratory syndrome,MERS)病毒等冠状病毒感染类似[27-28],多数新冠病毒感染者的血清抗体阳转发生在症状出现后第2或3周,现有研究表明新冠病毒感染确诊病例特异性IgM抗体阳转的中位时间为发病后10~12 d[11-12]。
多项研究发现,部分新冠病毒感染者(含确诊病例和无症状感染者)在发病后(或首次核酸检测阳性后)1周内就可以检测到特异性IgM抗体,阳性率约为11.1%~50.0%;发病后第2周,特异性IgM抗体水平上升达到或接近峰值状态,阳性率增加至59.7%~86.7%;自发病后第3或4周开始,特异性IgM抗体水平开始下降,但阳性率达到最高水平(约70.0%~100.0%)[2-14]。通常IgM抗体在体内维持时间较短,既往对SARS患者的研究显示,特异性IgM抗体持续时间在13周以内[15]。目前,尽管新冠病毒感染诱导的特异性IgM抗体在体内维持时间尚未能充分阐明,但现有研究显示,新冠病毒感染者在发病第4~5周后,特异性IgM抗体阳性率开始明显下降,降低10%~40%不等[4, 9, 14, 29]。
2.抗新冠病毒特异性IgG抗体动态变化特征:通常病原体感染机体后产生的特异性IgG抗体晚于IgM抗体。多个研究均显示,新冠病毒感染确诊病例特异性IgG抗体血清阳转的中位时间为发病后12~14 d[2, 11-12, 18],几乎与特异性IgM抗体同时产生。值得注意的是,个别研究中抗新冠病毒特异性IgG抗体血清阳转的时间要早于IgM抗体,Long等[8]的研究显示,对26名新冠病毒感染确诊病例的血清抗体水平进行随访,发现其中7名感染者的抗新冠病毒特异性IgM抗体阳转早于IgG,10名感染者的抗新冠病毒特异性IgG抗体血清阳转早于IgM抗体,9名感染者的特异性IgM和IgG抗体血清阳转时间基本相同。以往对SARS的研究也曾观察到类似现象,病毒感染后特异性IgG抗体血清阳转时间比IgM抗体略早(1~3 d)或同时发生[20, 30]。
多个研究发现,新冠病毒感染者特异性IgG抗体在发病后第1周的阳性率较低(3.7%~42.9%),第2周的阳性率逐渐上升到43.5%~76.0%[11, 13-14]。但也有研究报告,特异性IgG抗体阳性率在第2周能达到90%以上[3]。抗新冠病毒特异性IgG抗体水平在发病后第3~4周迅速上升并达到峰值[4-7, 9],阳性率为80.0%~100.0%[9, 11-14]。在第5~7周特异性IgG抗体阳性率可维持在100%左右[4, 14, 29]。多数研究中抗新冠病毒特异性IgG抗体水平达到的峰值高于IgM抗体[2-7, 9, 10];然而也有个别研究显示抗新冠病毒特异性IgG抗体水平的峰值低于IgM抗体[11-12],尽管两项研究均使用了同一个厂商的同一种检测试剂,但其研究结果不能排除检测试剂的影响。IgG抗体通常能维持较长时间,既往研究显示,抗SARS病毒特异性IgG抗体能在发病240 d后阳性率仍维持100%[20],平均能维持2年左右[17],是保护患者免于感染SARS病毒的主要抗体。然而,当前一项对新冠病毒感染者的研究中,超过90%的感染者(包括确诊病例和无症状感染者)在出院8周后(约发病2个月),特异性IgG抗体水平明显下降(下降约70%),且无症状感染者下降幅度比有症状者显著[16],与既往对SARS患者特异性IgG抗体水平变化规律的认识完全不同。
3.抗新冠病毒特异性IgA抗体动态变化特征:IgA抗体分布于血液和黏膜,在局部黏膜(如呼吸道上皮等)免疫中发挥重要作用[31-32]。新冠病毒感染确诊病例的特异性IgA抗体与IgM抗体类似,产生较早,阳转的中位时间为发病后11 d[18]。
多个研究发现,新冠病毒感染确诊病例发病后第1周特异性IgA抗体阳性率可以达50%以上[3, 19],第2周或第3周阳性率达到100%[3]。特异性IgA抗体水平在第3周达到高峰[2-3],之后略微下降,但特异性IgA抗体水平持续(至少在发病后42 d内)维持较高水平,阳性率接近100%[3, 18-19]。既往针对SARS的研究中,抗SARS病毒特异性IgA抗体的持续时间与IgM抗体类似,约63.6%的SARS患者在发病240 d后特异性IgA抗体消失[20]。
4.中和抗体(neutralizing antibodies):中和抗体是针对病毒某些表面蛋白质、抵御病毒入侵机体的一类免疫球蛋白,主要通过封闭与易感细胞受体结合的病毒抗原表位,或改变病毒表面构型,阻止病毒吸附、侵入细胞[33]。中和抗体具有抗病毒作用,是机体对抗病毒感染的有力武器,在评价病毒自然感染或疫苗接种后潜在免疫保护功效中常用作参考指标[34]。
研究发现,部分新冠病毒感染者在发病后第1~4天可产生中和抗体,但抗体水平较低;第10~15天后(第2周)抗体水平开始显著升高,第31~40天(第5~6周)抗体水平达到峰值后维持稳定状态或略微下降[23, 35-36]。既往对SARS的研究显示,中和抗体在动物模型中能够防止动物再感染,且在随访的两年内仍能检测到[21-22]。但当前一项对新冠病毒的研究中,超过60%的感染者(包括确诊病例和无症状感染者)在出院8周后(约发病2个月),中和抗体水平下降(下降约10%),且有症状感染者的中和抗体下降幅度比无症状者明显[16]。此外,虽然新冠病毒感染者多数能够产生具有抗病毒作用的中和抗体[23, 36],但也有少数重症患者在发病3周后仍无法检测出抗体,存在因无法产生抗体导致病情加重的可能[2]。
二、新冠病毒感染特异性抗体水平的影响因素1.病情严重程度对特异性抗体水平的影响:机体感染新冠病毒后,不同个体产生的抗体应答存在差异。基于目前的研究来看,与SARS患者相似[25],新冠病毒感染者的抗体水平主要受病情严重程度的影响。一项研究比较了康复患者(232名)与死亡患者(32名)的抗体水平,发现死亡患者体内特异性IgM抗体水平高于康复患者;该研究同时还比较了不同临床严重程度(轻型64例,重症199例,危重症75例)患者的特异性IgM抗体水平,发现重症及危重症患者特异性IgM抗体水平高于非重症患者,特异性IgM抗体持续高水平提示可能预后不良[6]。对于IgG抗体,多数研究显示重症及危重患者的特异性IgG抗体水平高于非重症患者[7, 9-10],无症状感染者的特异性IgG抗体水平比出现症状的感染者特异性IgG抗体水平低[16]。但也有个别研究中危重患者特异性IgG抗体水平略低于轻症和重症患者[6]。特异性IgA抗体与IgM抗体和IgG抗体类似,重症患者可能高于非重症患者[3]。中和抗体水平也与病情严重程度也相关,病情越严重产生的中和抗体水平越高[23]。
2.性别对特异性抗体水平的影响:新冠病毒感染者抗体水平还可能与性别有关,女性患者的特异性抗体水平比男性高。一项研究比较了127例男性病例与204例女性病例,发现女性在发病早期特异性IgG抗体水平高于男性患者;在重症患者中,女性特异性IgG抗体水平也高于男性[24]。有研究报道,新冠病毒感染确诊病例中男性重症比例和病死率都高于女性[37],造成上述差异的原因尚不明确,性别间IgG抗体的差异可能是潜在的原因之一[24]。既往对SARS患者的研究也同样发现,男性患者的病死率可能比女性患者高[38],且女性在不同病程时期里的抗体阳性率均高于男性[26],但两者之间是否存在因果关系尚未阐明。
三、问题与展望目前,国内外已经开展了一些针对新冠病毒感染后机体特异性抗体产生的时间、持续时间及抗体水平的研究,观察到抗体产生的一些动态变化特征,但仍存在一些争议。主要体现在几个方面:首先,现有研究多提示新冠病毒感染抗体变化与患者临床严重程度密切相关[3, 6-10, 16, 29, 35],无症状和轻症患者可能产生较低的抗体水平,但部分研究纳入的研究对象仅包括了轻型和普通型的确诊病例[2, 5, 13, 19, 23-24],未将无症状感染者和重症患者纳入研究范畴,而纳入的研究对象不同可能会导致研究结果产生偏倚。目前,我国COVID-19疫情处于低流行趋势,识别无症状感染者,防范社区传播尤为重要[39],但由于受当前纳入对象和观察时限等因素所致的研究结果局限性,尚无法明确血清特异性抗体检测识别这类人群的能力[16]。其次,由于在发病后第1~2周,特异性抗体阳性率较低,抗体检测可能在发病早期对及时诊断COVID-19的意义有限,但在核酸检测为阴性的疑似病例中,抗体检测提供了弥补核酸检测漏检风险的可能[2]。另外,特异性抗体可能在COVID-19发病第3周后阳性率较高,但目前COVID-19病例发病8周后的数据非常少,尚不清楚特异性抗体持续时间。而新冠病毒特异性抗体检测试剂在人群感染率较低时,即使检测方法具有较高的特异度,也会产生大量的假阳性结果[40]。因此,血清流行病学调查(基于人群的血清抗体检测)在人群感染水平、人群免疫水平及再感染可能性等公共卫生领域问题的作用尚有待进一步探索。再者,实验室检测方法及检测试剂的准确性、一致性等可能会对研究结果带来影响,且较难评估其影响。新冠肺炎疫情发生以来,快速检测特异性IgM、IgG和总抗体等特异性抗体的检测试剂被紧急投入使用,不同的检测试剂间评价和校准的工作相对缺乏。既往研究的中和抗体也有多种检测方法,包括使用分离得到的活病毒、重组的假病毒(如水疱性口炎病毒等)进行的噬斑减少中和试验(plaque reduction neutralization test,PRNT)和微量中和试验,而不同实验室得到的中和抗体实验结果存在差异,很难进行评价和相互比较[41]。除此以外,新冠病毒与SARS病毒之间可能存在免疫交叉反应[8],标本中可能存在的一些如类风湿因子、嗜异性抗体、补体等内源性干扰物等宿主本身内在因素以及样本采集时间等外在因素[42]都会影响抗体检测结果的准确性。此外,随着疫苗的上市使用,通过实验室方法检测到的抗体很难区分是通过自然感染获得还是因接种疫苗获得,为将来利用血清学方法辅助病例诊断带来更多的复杂性。
综上所述,当前新冠病毒感染者特异性抗体动态变化特征的研究多针对病例急性期,缺乏对抗体长期动态变化特征的认识,有必要针对不同病情严重程度的感染者和康复者开展样本量多、随访时间长的前瞻性随访,同时开展抗体检测方法和试剂的准确性和一致性评价,从而更科学、准确地认识抗体动态变化规律,更好发挥其在疾病诊断、治疗及防控中的作用。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. Coronavirus disease (COVID-19): Situation Report-193[EB/OL]. (2020-07-31)[2020-08-07]. https://reliefweb.int/report/world/coronavirus-disease-covid-19-situation-report-193-31-july-2020.
|
| [2] |
Guo L, Ren LL, Yang SY, et al. Profiling early humoral response to diagnose novel coronavirus disease (COVID-19)[J]. Clin Infect Dis, 2020, 71(15): 778-785. DOI:10.1093/cid/ciaa310 |
| [3] |
Ma H, Zeng WH, He HL, et al. Serum IgA, IgM, and IgG responses in COVID-19[J]. Cell Mol Immunol, 2020, 17(7): 773-775. DOI:10.1038/s41423-020-0474-z |
| [4] |
Xiao AT, Gao C, Zhang S. Profile of specific antibodies to SARS-CoV-2:The first report[J]. J Infect, 2020, 81(1): 147-178. DOI:10.1016/j.jinf.2020.03.012 |
| [5] |
Zhang GX, Nie SK, Zhang ZH, et al. Longitudinal change of severe acute respiratory syndrome coronavirus 2 Antibodies in patients with Coronavirus Disease 2019[J]. J Infect Dis, 2020, 222(2): 183-188. DOI:10.1093/infdis/jiaa229 |
| [6] |
Hou HY, Wang T, Zhang B, et al. Detection of IgM and IgG antibodies in patients with coronavirus disease 2019[J]. Clin Transl Immunol, 2020, 9(5): e01136. DOI:10.1002/cti2.1136 |
| [7] |
Zeng ZK, Chen LJ, Pan YB, et al. Re:profile of specific antibodies to SARS-CoV-2:the first report[J]. J Infect, 2020, 81(1): e80-81. DOI:10.1016/j.jinf.2020.03.052 |
| [8] |
Long QX, Liu BZ, Deng HJ, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19[J]. Nat Med, 2020, 26(6): 845-848. DOI:10.1038/s41591-020-0897-1 |
| [9] |
Liu XM, Wang J, Xu XL, et al. Patterns of IgG and IgM antibody response in COVID-19 patients[J]. Emerg Microbes Infect, 2020, 9(1): 1269-1274. DOI:10.1080/22221751.2020.1773324 |
| [10] |
Qu JX, Wu C, Li XY, et al. Profile of immunoglobulin G and IgM antibodies against severe acute respiratory syndrome coronavirus 2(SARS-CoV-2)[J/OL]. Clin Infect Dis, 2020: ciaa489. DOI: 10.1093/cid/ciaa489.
|
| [11] |
Lou B, Li TD, Zheng SF, et al. Serology characteristics of SARS-CoV-2 infection since exposure and post symptom onset[J/OL]. Eur Respir J, 2020: 2000763. DOI: 10.1183/13993003.00763-2020.
|
| [12] |
Zhao JJ, Yuan Q, Wang HY, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019[J/OL]. Clin Infect Dis, 2020: ciaa344. DOI: 10.1093/cid/ciaa344.
|
| [13] |
Pan YB, Li XR, Yang G, et al. Serological immunochromatographic approach in diagnosis with SARS-CoV-2 infected COVID-19 patients[J]. J Infect, 2020, 81(1): e28-32. DOI:10.1016/j.jinf.2020.03.051 |
| [14] |
Xiang F, Wang XR, He XL, et al. Antibody detection and dynamic characteristics in patients with COVID-19[J/OL]. Clin Infect Dis, 2020: ciaa461. DOI: 10.1093/cid/ciaa461.
|
| [15] |
Li G, Chen XJ, Xu AL. Profile of specific antibodies to the SARS-associated coronavirus[J]. N Engl J Med, 2003, 349(5): 508-509. DOI:10.1056/nejm200307313490520 |
| [16] |
Long QX, Tang XJ, Shi QL, et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections[J]. Nat Med, 2020, 26(8): 1200-1204. DOI:10.1038/s41591-020-0965-6 |
| [17] |
Wu LP, Wang NC, Chang YH, et al. Duration of antibody responses after severe acute respiratory syndrome[J]. Emerg Infect Dis, 2007, 13(10): 1562-1564. DOI:10.3201/eid1310.070576 |
| [18] |
Jääskeläinen AJ, Kekäläinen E, Kallio-Kokko H, et al. Evaluation of commercial and automated SARS-CoV-2 IgG and IgA ELISAs using coronavirus disease (COVID-19) patient samples[J]. Euro Surveill, 2020, 25(18): 2000603. DOI:10.2807/1560-7917.es.2020.25.18.2000603 |
| [19] |
Padoan A, Sciacovelli L, Basso D, et al. IgA-Ab response to spike glycoprotein of SARS-CoV-2 in patients with COVID-19:A longitudinal study[J]. Clin Chim Acta, 2020, 507: 164-166. DOI:10.1016/j.cca.2020.04.026 |
| [20] |
Woo PCY, Lau SKP, Wong BHL, et al. Longitudinal profile of immunoglobulin G (IgG), IgM, and IgA antibodies against the severe acute respiratory syndrome (SARS) coronavirus nucleocapsid protein in patients with pneumonia due to the SARS coronavirus[J]. Clin Diagn Lab Immunol, 2004, 11(4): 665-668. DOI:10.1128/cdli.11.4.665-668.2004 |
| [21] |
Liu W, Fontanet A, Zhang PH, et al. Two-year prospective study of the humoral immune response of patients with severe acute respiratory syndrome[J]. J Infect Dis, 2006, 193(6): 792-795. DOI:10.1086/500469 |
| [22] |
Chen J, Subbarao K. The immunobiology of SARS[J]. Annu Rev Immunol, 2007, 25: 443-472. DOI:10.1146/annurev.immunol.25.022106.141706 |
| [23] |
Wang XL, Guo XH, Xin QQ, et al. Neutralizing antibodies responses to SARS-CoV-2 in COVID-19 inpatients and convalescent patients[J]. Clin Infect Dis, 2020, ciaa721. DOI:10.1093/cid/ciaa721 |
| [24] |
Zeng FF, Dai C, Cai PC, et al. A comparison study of SARS-CoV-2 IgG antibody between male and female COVID-19 patients: a possible reason underlying different outcome between sex[J/OL]. J Med Virol, 2020. DOI: 10.1002/jmv.25989.
|
| [25] |
Lee N, Chan PKS, Ip M, et al. Anti-SARS-CoV IgG response in relation to disease severity of severe acute respiratory syndrome[J]. J Clin Virol, 2006, 35(2): 179-184. DOI:10.1016/j.jcv.2005.07.005 |
| [26] |
彭忆. SARS特异性抗体及其相关因素的研究[D].武汉: 华中科技大学, 2008. Peng Y. A study on antibody and relevant factors of SARS[D]. Wuhan: Huazhong University of Science & Technology, 2008. |
| [27] |
Corman VM, Albarrak AM, Omrani AS, et al. Viral shedding and antibody response in 37 patients with middle east respiratory syndrome coronavirus infection[J]. Clin Infect Dis, 2016, 62(4): 477-483. DOI:10.1093/cid/civ951 |
| [28] |
Park WB, Perera RAPM, Choe PG, et al. Kinetics of serologic responses to MERS coronavirus infection in humans, south Korea[J]. Emerg Infect Dis, 2015, 21(12): 2186-2189. DOI:10.3201/eid2112.151421 |
| [29] |
Zhang YC, Shen H, Wang XN, et al. Different longitudinal patterns of nucleic acid and serology testing results based on disease severity of COVID-19 patients[J]. Emerg Microbes Infect, 2020, 9(1): 833-836. DOI:10.1080/22221751.2020.1756699 |
| [30] |
Hsueh PR, Huang LM, Chen PJ, et al. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus[J]. Clin Microbiol Infect, 2004, 10(12): 1062-1066. DOI:10.1111/j.1469-0691.2004.01009.x |
| [31] |
Lu LL, Suscovich TJ, Fortune SM, et al. Beyond binding:antibody effector functions in infectious diseases[J]. Nat Rev Immunol, 2018, 18(1): 46-61. DOI:10.1038/nri.2017.106 |
| [32] |
陈静, 史利欢, 谢昕. 血清抗体联合DNA检测在儿童EB病毒感染中的诊断效能分析[J]. 中国民康医学, 2019, 31(9): 116-118. Chen J, Shi LH, Xie X. Diagnostic efficacy of serum antibody combined with DNA detection in children with EB virus infection[J]. Med J Chin People's Health, 2019, 31(9): 116-118. DOI:10.3969/j.issn.1672-0369.2019.09.052 |
| [33] |
Marasco WA, Sui JH. The growth and potential of human antiviral monoclonal antibody therapeutics[J]. Nat Biotechnol, 2007, 25(12): 1421-1434. DOI:10.1038/nbt1363 |
| [34] |
Zhu MS. SARS immunity and vaccination[J]. Cell Mol Immunol, 2004, 1(3): 193-198. |
| [35] |
Wu F, Wang AJ, Liu M, et al. Neutralizing antibody responses to SARS-CoV-2 in a COVID-19 recovered patient cohort and their implications[J/OL]. medRxiv, 2020. DOI: 10.1101/2020.03.30.20047365.
|
| [36] |
Liu PC, Cai JH, Jia R, et al. Dynamic surveillance of SARS-CoV-2 shedding and neutralizing antibody in children with COVID-19[J]. Emerg Microbes Infect, 2020, 9(1): 1254-1258. DOI:10.1080/22221751.2020.1772677 |
| [37] |
Huang CL, Wang YM, Li XW, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/s0140-6736(20)30183-5 |
| [38] |
Leung GM, Hedley AJ, Ho LM, et al. The epidemiology of severe acute respiratory syndrome in the 2003 Hong Kong epidemic:an analysis of all 1755 patients[J]. Ann Intern Med, 2004, 141(9): 662-673. DOI:10.7326/0003-4819-141-9-200411020-00006 |
| [39] |
Liu JT, Huang JQ, Xiang DD. Large SARS-CoV-2 outbreak caused by asymptomatic traveler, China[J]. Emerg Infect Dis J, 2020, 26(9). DOI:10.3201/eid2609.201798 |
| [40] |
Kumleben N, Bhopal R, Czypionka T, et al. Test, test, test for COVID-19 antibodies:the importance of sensitivity, specificity and predictive powers[J]. Public Health, 2020, 185: 88-90. DOI:10.1016/j.puhe.2020.06.006 |
| [41] |
毛群颖, 何鹏, 于祥, 等. 人肠道病毒71型中和抗体检测方法的实验室评价[J]. 中国生物制品学杂志, 2010, 23(8): 885-888. Mao QY, He P, Yu X, et al. Laboratory evaluation of method for determination of neutralizing antibody against Human Enterovirus 71[J]. Chin J Biol, 2010, 23(8): 885-888. DOI:10.13200/j.cjb.2010.08.99.maoqy.014 |
| [42] |
张瑞, 李金明. 2019新型冠状病毒特异抗体检测"假阳性"原因分析及对策[J]. 中华检验医学杂志, 2020, 43(5): 507-510. Zhang R, Li JM. Reasons and solutions for "false positive results" of 2019 Novel Coronavirus-specific antibodies detection[J]. Chin J Lab Med, 2020, 43(5): 507-510. DOI:10.3760/cma.j.cn114452-20200318-00271 |
 2020, Vol. 41
2020, Vol. 41



