文章信息
- 宋倩倩, 赵涵, 方立群, 刘玮, 郑创, 张勇.
- Song Qianqian, Zhao Han, Fang Liqun, Liu Wei, Zheng Chuang, Zhang Yong
- 新型冠状病毒肺炎的早期传染病流行病学参数估计研究
- Study on assessing early epidemiological parameters of coronavirus disease epidemic in China
- 中华流行病学杂志, 2020, 41(4): 461-465
- Chinese Journal of Epidemiology, 2020, 41(4): 461-465
- http://dx.doi.org/10.3760/cma.j.cn112338-20200205-00069
-
文章历史
收稿日期: 2020-02-05
2. 军事医学研究院微生物流行病研究所, 北京 100071
2. Institute of Microbiology and Epidemiology, Academy of Military Medical Sciences, Beijing 100071, China
2019年12月31日,湖北省武汉市暴发原因不明的肺炎,随后WHO确认这是由一种新型冠状病毒(2019-nCoV)引起的。自2019年12月12日以来,武汉市卫生健康委员会报告了27例新型冠状病毒肺炎(COVID-19)病例,其中7例为重症病例。截至2020年1月31日24时,中国内地共报告COVID-19确诊病例11 791例,2019-nCoV暴发疫情已引起全球关注[1]。2019-nCoV传播途径是经呼吸道飞沫传播,目前大多数病例与密切接触有关,并且人群普遍易感。
由于“春运”的到来,大规模的人口移动,使得全国大部分区域受到2019-nCoV不同程度的威胁,部分区域出现输入和暴发疫情。传染病的传播潜力通常以基本再生数(R0)、暴发高峰时间、高峰值及持续时间等流行病学特征描述,2019-nCoV疫情的这些特征目前尚未达成普遍共识。为阻止该病毒的扩散,2020年1月13日,武汉市宣布进入公共卫生应急状态,23日,中国政府对湖北省(除神农架)城市人口流动进行了限制。在当前和不断发展的干预措施下,持续地、及时地分析疫情发展趋势和流行病学特征及其动态具有重要意义,能为COVID-19疫情的科学防控提供依据。
疫情暴发后,已有学者开展了2019-nCoV流行病学参数估计的研究。Read等[2]通过拟合传播模型,估计2019-nCoV的R0在3.6~4.0之间,需要通过防控措施切断72%~75%的病毒传播才能阻止疫情的增长;Tang等[3]通过模型参数化估算出2019-nCoV的R0为6.47,并给出了疫情的达峰时间以及最终感染规模。Liu等[4]使用截至2020年1月23日的830例2019-nCoV确诊病例,估算出平均潜伏期为4.8 d,采用EG(Exponential Growth)和ML(Maximum Likelihood)法估计的R0分别为2.90(95%CI:2.32~3.63)和2.92(95%CI:2.28~3.67);Wu等[5]使用基于SEIR的集合种群(metapopulation)模型模拟主要城市的流行病,并用马尔科夫链蒙特卡洛方法估计R0为2.68(95%CI:2.47~2.86)。
本研究的目的是分析2019-nCoV早期的流行病学特征,根据报告病例数据估计潜伏期和世代间隔的分布,并应用3种方法对R0进行估计,评估不同方法对其估值的影响。
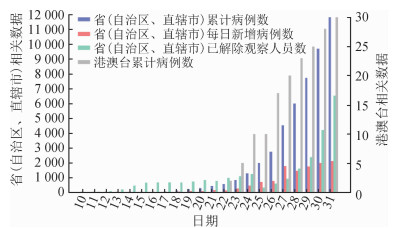
资料与方法1.数据来源:病例数据源于国家和各省份卫生健康委员会每日更新的日累计病例数及相关网站报告的病例和密切接触人群等信息,截至2020年1月31日,全国报告确诊病例为11 791例。收集的信息包括报告病例的累计数,每日新增病例数,已解除医学观察人员累计数(图 1)。其中2020年1月1-15日每天报告的累计病例数均为41例,期间无新增病例。
|
| 图 1 2020年1月全国2019-nCoV感染情况 |
2.潜伏期和世代间隔估计:潜伏期为一个感染者的被感染时间与其出现临床症状的时间之差[6],世代间隔指一个感染者的被感染时间与其下一代感染者的被感染时间之差[7]。潜伏期的估计至关重要,是确定暴露人员隔离期限和判断病例感染时间的重要依据,同时也是流行病学预测模型的关键参数;世代间隔代表了疾病从一个人传至另一个人的平均间隔时间,世代间隔时间越短疫情越容易呈现暴发模式。部分病例接触传染源的时间不能直接观察到,这导致对潜伏期的估计较为困难。通常我们不能精确地观察到暴露于传染源和症状出现的时间,它们可能落入某些间隔。但可通过确定每个病例暴露的最早和最晚时间以及出现症状时间之差估计潜伏期,将此时间视为每个人潜伏期的区间截断估计值[8]。
为了估计潜伏期的x和s,我们采用威布尔[6, 8-9]、伽马[6, 8, 10]和对数正态[6, 8, 11]3种概率密度分布模型拟合相关数据。通过对数据的定性分析比较拟合效果,为了使分析更加准确,又采用Akaike信息准则(AIC)进行定量分析[10],其中,AIC值越小说明模型越适合。上述分析应用R 3.6.2和MATLAB 2014b软件完成。通过对比报告数据与模型拟合值的概率密度图,结合AIC值可确定出最优分布,再利用Bootstrap方法进行1 000次重采样计算x的95%CI [12]。对世代间隔数据采用相同的方法进行分析和计算。
R0是流行病模型中的一个重要参数,它表示在发病初期,当所有人均为易感者时,一个病例在其患病期内所传染的平均人数。当R0>1时,流行病会暴发;否则疫情将会消亡。
对于新出现的传染病暴发疫情,在疾病暴发初期,多数情况下病例数会呈现指数增长的模式。世代间隔的分布决定了指数增长率和R0之间的函数关系[13-14]。本文采用的R0计算方法有以下3种:
(1)定义r为累计感染病例数的指数增长率,C(t)为COVID-19的累计病例数。在初始阶段,累计病例数往往呈指数增长,但这个指数增长阶段到底会持续多久就需要人们进行判定。本研究采用拟合优度系数R2的大小判断初始指数增长阶段的持续时间长度。由于病例数是整数值,因此采用泊松回归估计该参数[14]。参照文献[13]计算R0:
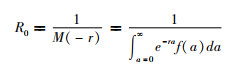
式中M(-r)是世代间隔分布f(a)的矩生成函数。
(2)假设二代病例服从期望值为R0的泊松分布,令N0,N1,…,NT表示连续单位时间内的病例数,世代间隔用ω表示,则R0可以由最大化对数似然估计函数估出[15]:

式中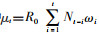
(3)应用经典的传染病SEIR仓室模型分析中国2019-nCoV的传播动态。需要强调:SEIR数学模型中的暴露人群(E(t))是指暴露但不具有传染性的人群。由于该疾病潜伏期后期可能具有传染性[16],故模型中将具有传染性的潜伏期病例归为感染类I,暴露类E为无传染性的暴露人员,从而疫情传播动态可以使用以下微分方程组描述:
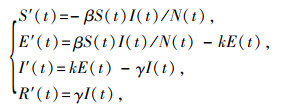
式中β表示传播系数,k是暴露类到感染类的转移率(数值上1/k即为感染后但无传染性时期的平均长度),γ表示移出率(数值上1/γ即为具有传染性时期的平均长度)。通过最小二乘法拟合累计病例数可以在适当的参数值范围内估计出模型中的3个参数值,进而通过下一代矩阵方法[17]给出的计算公式:
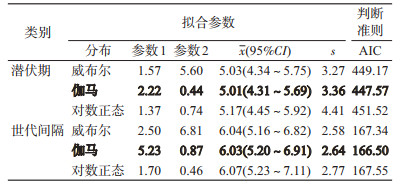
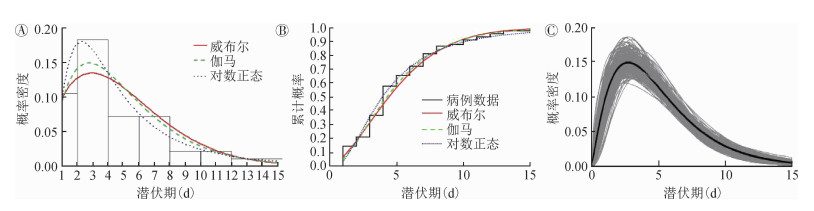
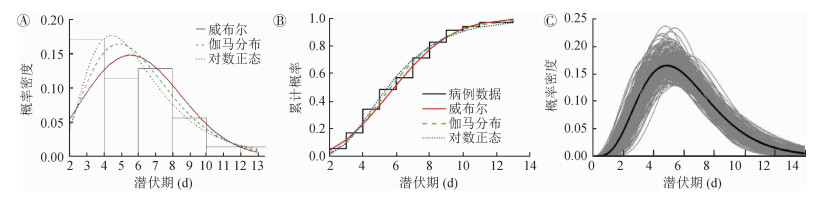
模型结果表明,3种分布的参数模型拟合值与非参数估计值基本一致(图 2,3),潜伏期的估计以伽马分布对应的AIC值最小,故潜伏期更倾向于伽马分布,潜伏期x为5.01(95%CI:4.31~5.69)d,s为3.36 d;拟合世代间隔时,仍然是伽马分布对应的AIC值最小,意味着世代间隔也更符合伽马分布,世代间隔x为6.03(95%CI:5.20~6.91)d,s为2.64 d(表 1)。
|
| 注:A:柱状图为90个病例潜伏期的频率分布,红色实线为威布尔分布拟合曲线,绿色虚线为伽马分布拟合曲线,蓝色点线为对数正态分布拟合曲线;B:使用威布尔(红线)、伽马(绿线)和对数正态(蓝线)分布模型估计的累计分布曲线与病例数据曲线(黑线)进行比较;C:1 000次Bootstrap重采样数据拟合的潜伏期伽马分布(图中显示了300次样数据拟合值与平均值) 图 2 潜伏期拟合结果 |
|
| 注:A:柱状图为35个病例世代间隔的频率分布,红色实线为威布尔分布拟合曲线,绿色虚线为伽马分布拟合曲线,蓝色点线为对数正态分布拟合曲线;B:使用威布尔(红线)、伽马(绿线)和对数正态(蓝线)分布模型估计的累计分布曲线与病例数据曲线(黑线)进行比较;C:1 000次Bootstrap重采样数据拟合的世代间隔伽马分布(图中展示了300次样数据拟合值与平均值) 图 3 世代间隔拟合结果 |
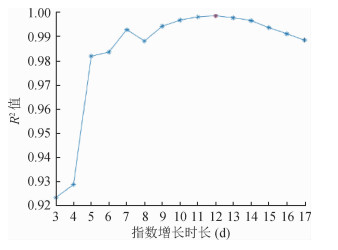
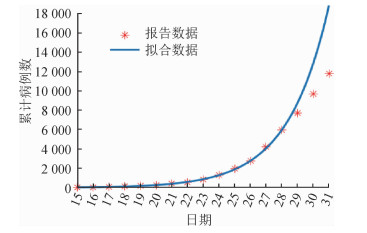
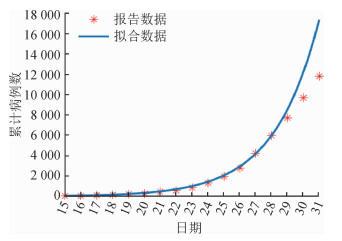
基于拟合优度系数R2(图 4),累计病例数对应的指数增长期为12 d(对应于2020年1月26日),相应的指数增长率为0.383(95%CI:0.366~0.400)。指数增长曲线拟合结果见图 5,拟合结果表明27日之后的增长率有所降低。由于在方法1和方法2两种计算R0的方法中均涉及到世代间隔,而从现有数据已经获得了世代间隔的估计值(表 1),从而应用方法1和方法2可计算出R0值分别为3.74(95%CI:3.63~3.87)和3.16(95%CI:2.90~3.43)。对于SEIR模型法,当采用SEIR模型拟合截至1月27日的数据时拟合效果整体最优,如果再纳入27日之后更多的数据点进行拟合的话,整体拟合误差急剧增加。因此本研究采用最小二乘法基于截至27日的数据拟合得到了SEIR模型中的参数值为:传播率β=1.327,1/k=2.579,1/γ=2.950,进而计算出R0=3.91(95%CI:3.71~4.11)。拟合效果见图 6。
|
| 图 4 初始指数增长阶段R2系数 |
|
| 图 5 指数增长曲线拟合累计病例数 |
|
| 图 6 SEIR模型拟合图 |
已有研究显示,2019-nCoV是一种类似于MERS和SARS的冠状病毒[18],蝙蝠可能是该病毒的自然宿主[19]。早期,武汉人群中发生的不明原因肺炎被认为与武汉华南海鲜市场的暴露有关,后被证实致病病原为2019-nCoV[20]。随着疫情的发展,越来越多的病例被报道并未到过该海鲜市场,以及后期出现的家庭和医务人员聚集性病例的发生[21-22],表明了该病存在“人-人”的传播途径。
根据截至2020年1月31日的2019-nCoV每日累计病例数,本研究使用指数增长法、最大似然法和经典SEIR模型估算早期疫情的R0。在前两种方法中,再生数对于世代间隔的变化较为敏感,Yan[23]指出世代间隔=潜伏期+传染期,本研究根据对潜伏期与世代间隔的估计可知,两者的差值为1.02 d,这些估值可以为相应数学模型中的参数设置提供参考,也有助于我们继续深入分析传染期的分布情况。此外,我们希望能在今后的工作中搜集到更多传播链数据,以便更准确地估计出潜伏期、世代间隔等传染病相关参数的估值及分布。
3种方法计算出的R0值都明显>1,平均为3.60,高于同为冠状病毒的SARS(R0=2.7)[24]和Riyadh的MERS(R0=2.0~2.8)[25]。这意味着2019-nCoV的疫情还处于暴发期,形势较为严峻。
拟合优度系数R2表明,1月26日是疫情发展的一个转折点,同时指数增长曲线和SEIR模型拟合结果均显示1月27日之后实际疫情数据比拟合数据明显偏低,表明后续疫情增长趋势有所减缓。综合以上分析,我们认为1月26日是疫情动态的一个转折点,之后疫情增长趋势有所减缓,这应该是1月23日起政府采取的高效且强力的防控措施所带来的效果,防控措施对2019-nCoV疫情的影响还需通过对后继的更多数据进行分析才能得以验证和评估。
此外,WHO报告的人与人(直接)传播的R0在1.4~2.5之间,文献[4, 26]中基于SARS或MERS的世代间隔对R0进行了估计,所得R0范围为2~3。本研究基于指数增长和最大似然及SEIR模型计算出的基本再生数数值高于他们的结果,一个潜在的因素是我们的数据是基于疫情早期指数增长阶段数据计算的,体现了疫情早期的传播特点。另外,R0的估算对世代间隔分布的变化较为敏感,现阶段受限于流行病学调查数据样本数据量偏少,该参数的估计可能存在偏倚,进而可能出现高估。
在模型的选取中,本研究选用经典的SEIR模型模拟此次疫情发展情况,模型对疫情早期的数据拟合效果良好,在后续研究中,我们将在模型中加入防控措施等因素,不断完善模型的构建,以及基于更多的疫情数据修正对参数的估值。这些工作还需基于医学专家们对2019-nCoV更深入的研究以及依赖更详细的流行病学调查数据。此外,隐性感染者不仅具有传染性,而且难以被发现,对其传播力的估算是当前研究的重要内容,对于疫情的防控决策至关重要,这也需我们在将来的研究工作中加以考虑。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
国家卫生健康委员会.截至2020年1月31日24时新型冠状病毒肺炎疫情最新情况. http://www.nhc.gov.cn/xcs/yqtb/202002/4a611bc7fa20411f8ba1c8084426c0d4.shtml. 2020年2月1日. National Health Commission of the People's Republic of China. An update of Novel Coronavirus Pneumonia outbreak as of 24: 00 on 31 January. http://www.nhc.gov.cn/xcs/yqtb/202002/4a611bc7fa20411f8ba1c8084426c0d4.shtml. 1 February 2020. |
| [2] |
Read JM, Bridgen JRE, Cummings DAT, et al. Novel coronavirus 2019-nCoV:early estimation of epidemiological parameters and epidemic predictions[J]. medRxiv, 2020. DOI:10.1101/2020.01.23.20018549 |
| [3] |
Tang B, Wang X, Li Q, et al. Estimation of the transmission risk of 2019-nCov and its implication for public health interventions[J]. DOI: 10.2139/ssrn.3525558. http://papers.ssrn.com/sol3/papers.cfm?abstract_id=3525558
|
| [4] |
Liu T, Hu JX, Xiao JP, et al. Time-varying transmission dynamics of Novel Coronavirus Pneumonia in China[J]. bioRxiv, 2020. DOI:10.1101/2020.01.25.919787 |
| [5] |
Wu JT, Leung K, Leung GM. Nowcasting and forecasting the potential domestic and international spread of the 2019-nCoV outbreak originating in Wuhan, China:a modelling study[J]. Lancet, 2020. DOI:10.1016/S0140-6736(20)30260-9 |
| [6] |
Cowling BJ, Park M, Fang VJ, et al. Preliminary epidemiological assessment of MERS-CoV outbreak in South Korea, May to June 2015[J]. Euro Surveill, 2015, 20(25): 7-13. DOI:10.2807/1560-7917.es2015.20.25.21163 |
| [7] |
Anderson RM, May RM. Infectious diseases of humans:dynamics and control[M]. Oxford, UK: Oxford University Press, 1991.
|
| [8] |
Virlogeux V, Fang VJ, Park M, et al. Comparison of incubation period distribution of human infections with MERS-CoV in South Korea and Saudi Arabia[J]. Sci Rep, 2016, 6: 35839. DOI:10.1038/srep35839 |
| [9] |
Virlogeux V, Li M, Tsang TK, et al. Estimating the distribution of the incubation periods of Human Avian Influenza A(H7N9) virus infections[J]. Am J Epidemiol, 2015, 182(8): 723-729. DOI:10.1093/aje/kwv115 |
| [10] |
Cauchemez S, Fraser C, Van Kerkhove MD, et al. Middle East respiratory syndrome coronavirus:quantification of the extent of the epidemic, surveillance biases, and transmissibility[J]. Lancet, 2014, 14(1): 50-56. DOI:10.1016/S1473-3099(13)70304-9 |
| [11] |
Virlogeux V, Fang V, Wu J, et al. Incubation period duration and severity of clinical disease following severe acute respiratory syndrome coronavirus infection[J]. Epidemiology, 2015, 26(5): 666-669. DOI:10.1097/EDE.0000000000000339 |
| [12] |
Davison AC, Hinkley DV. Bootstrap methods and their application[M]. Cambridge: Cambridge University Press, 1997: 193-255. DOI:10.1017/CBO9780511802843
|
| [13] |
Wallinga J, Lipsitch M. How generation intervals shape the relationship between growth rates and reproductive numbers[J]. Proc Biol Sci, 2007, 274(1609): 599-604. DOI:10.1098/rspb.2006.3754 |
| [14] |
Hens N, Van Ranst M, Aerts M, et al. Estimating the effective reproduction number for pandemic influenza from notification data made publicly available in real time:a multi-country analysis for influenza A/H1N1v 2009[J]. Vaccine, 2011, 29(5): 896-904. DOI:10.1016/j.vaccine.2010.05.010 |
| [15] |
White LF, Pagano M. A likelihoobased method for real-time estimation of the serial interval and reproductive number of an epidemic[J]. Stat Med, 2008, 27(16): 2999-3016. DOI:10.1002/sim.3136 |
| [16] |
北京日报.卫健委: 新型冠状病毒潜伏期1-14天, 潜伏期具有传染性[EB/OL]. (2020-01-26)[2020-01-29]. https://baijiahao.baidu.com/s?id=1656777529300298714&wfr=spider&for=pc. Beijing daily.The incubation period of novel coronavirus are 1-14 days. It is infectious in the incubation period[EB/OL]. (2020-01-26)[2020-01-29]. https://baijiahao.baidu.com/s?id=1656777529300298714&wfr=spider&for=pc. |
| [17] |
Diekmann O, Heesterbeek JAP. Mathematical epidemiology of infectious diseases:model building, analysis and interpretation[M]. Chichester: John Wiley, Sons, Itd., 2000.
|
| [18] |
Centers for Disease Control and Prevention. Coronavirus disease 2019 (COVID-19) situation summary[EB/OL].(2020-01-30)[2020-02-01]. https://www.cdc.gov/coronavirus/2019-ncov/summary.html.
|
| [19] |
Lu RJ, Zhao X, Li J, et al. Genomic characterisation and epidemiology of 2019 novel coronavirus:implications for virus origins and receptor binding[J]. Lancet, 2020. DOI:10.1016/S0140-6736(20)30251-8 |
| [20] |
Zhu N, Zhang DY, Wang WL, et al. A novel coronavirus from patients with pneumonia in China, 2019[J]. New Engl J Med, 2020, 382: 727-733. DOI:10.1056/NEJMoa2001017 |
| [21] |
Li Q, Guan XH, Wu P, et al. Early transmission dynamics in Wuhan, China, of novel coronavirus-infected pneumonia[J]. New Engl J Med, 2020. DOI:10.1056/NEJMoa2001316 |
| [22] |
Chan JFW, Yuan SF, Kok KH, et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission:a study of a family cluster[J]. Lancet, 2020. DOI:10.1016/S0140-6736(20)30154-9 |
| [23] |
Yan P. Separate roles of the latent and infectious periods in shaping the relation between the basic reproduction number and the intrinsic growth rate of infectious disease outbreaks[J]. J Theor Biol, 2008, 251(2): 238-252. DOI:10.1016/j.jtbi.2007.11.027 |
| [24] |
Riley S, Fraser C, Donnelly CA, et al. Transmission dynamics of the etiological agent of SARS in Hong Kong:impact of public health interventions[J]. Science, 2003, 300(5627): 1961-1966. DOI:10.1126/science.1086478 |
| [25] |
Majumder MS, Rivers C, Lofgren E, et al. Estimation of MERS-Coronavirus reproductive number and case fatality rate for the Spring 2014 Saudi Arabia outbreak:insights from publicly available data[J]. PLoS Curr, 2014, 6. DOI:10.1371/currents.outbreaks.98d2f8f3382d84f390736cd5f5fe133c |
| [26] |
Zhao S, Lin QY, Ran JJ, et al. Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, from 2019 to 2020:a data-driven analysis in the early phase of the outbreak[J]. Int J Infect Dis, 2020, 92: 214-217. DOI:10.1016/j.ijid.2020.01.050 |
 2020, Vol. 41
2020, Vol. 41