2. 株洲千金药业股份有限公司, 株洲 412000
2. Zhuzhou Qianjin Pharmaceutical Co., Ltd., Zhuzhou 412000, China
大叶千斤拔Moghania macrophylla(Willd.)Prain[1]为豆科千斤拔属植物,是2015年版《中华人民共和国药典》(以下简称《中国药典》)四部中规定的千斤拔基原之一[2],主产于云南、贵州、福建、广西等省,具有祛风湿、益脾肾、强筋骨的功效,用于风湿性关节炎、跌打损伤、腰腿痛、气虚脚肿等症[3],不仅是我国广泛使用的民族药和民间药[4],也是妇科千金片、妇科千金胶囊等中成药生产的重要原料。
大叶千斤拔的传统药用部位为根,个别标准以根和茎同时入药[5]。已有研究表明,茎与根相比,有效成分黄酮类的含量较低。相关研究大多基于总黄酮[6]或个别黄酮类成分[7]的测定,采用指纹图谱和含量测定同时对根、茎进行区分的研究尚未见到报道。基于此,本实验采用HPLC指纹图谱技术对大叶千斤拔根、茎的整体质量特征进行分析,对根、茎的主要成分进行检测,找出根、茎中的差异性成分,为大叶千斤拔不同药用部位的质量评价提供科学依据。
1 仪器与试药 1.1 仪器Waters e2695高效液相色谱仪,Agilent 1260-6410B串联四级杆液质联用仪,Mettler AE240、Mettler XS105DU电子天平,KQ-300DA型医用数控超声波清洗器(昆山市超声仪器有限公司,功率300 W,频率40 kHz),TGL-16G离心机(上海安亭科学仪器厂)。
1.2 试药对照品染料木素(批号111704-201703,含量以99.5%计)、染料木苷(批号111709-201702,含量以99.9%计)来自中国食品药品检定研究院,6″-O-丙二酰染料木苷(批号P25A9F59738,HPLC≥98%)购自上海源叶生物科技有限公司。甲醇(分析纯,国药集团化学试剂有限公司);乙腈、冰醋酸(色谱纯,Fisher公司);水为Milli-Q系统制备。
大叶千斤拔根11批(编号S1~S11),茎7批(编号S12~S18),由株洲千金药业有限公司提供,由中国食品药品检定研究院余坤子副研究员鉴定为豆科植物大叶千斤拔Moghania macrophylla(Willd.)Prain的根和茎。
2 方法与结果 2.1 混合对照品溶液的制备精密称取染料木苷、6″-O-丙二酰染料木苷、染料木素的对照品适量,加70%甲醇水溶液制成每1 mL含0.2 mg的溶液,作为对照品储备溶液;分别精密移取上述混合对照品储备溶液2、2、1 mL于同一10 mL量瓶中,加70%乙醇水稀释至刻度,摇匀,得到质量浓度分别为0.045 8、0.035 3、0.020 9 mg·mL–1的混合对照品溶液。
2.2 供试品溶液的制备取大叶千斤拔根、茎药材,分别粉碎,过3号筛。取各粉末约1.0 g,精密称定,精密加入70%甲醇水溶液25 mL,密塞,称量,超声处理(功率300 W,频率40 kHz)30 min,放冷,再称量,用70%甲醇水补足减失的量,摇匀,6 000 r·min-1离心10 min,取上清液,0.45 µm滤膜滤过,取续滤液,即得根供试品溶液及茎供试品溶液。
2.3 色谱条件采用Agilent Zorbax SB-phenyl色谱柱(4.6 mm× 250 mm,5 μm),流动相为乙腈(A)-0.5%乙酸水溶液(B),梯度洗脱(0~20 min,10%A→20%A;20~40 min,20%A→30%A;40~60 min,30%A→50%A;60~80 min,50%A→70%A;80~90 min,70%A→ 90%A),流速1.0 mL·min-1,柱温30℃,进样量10 µL,检测波长260 nm。典型色谱图如图 1所示。
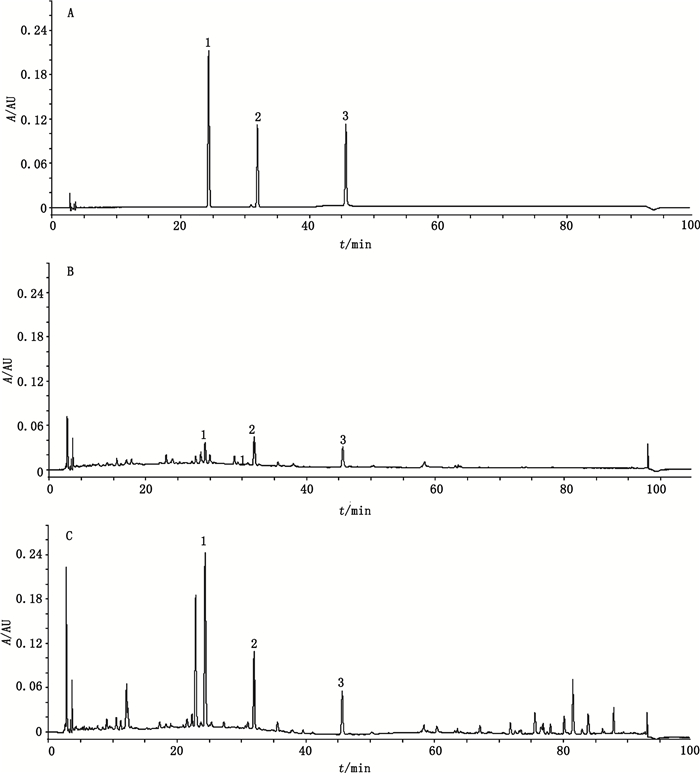
|
1.染料木苷(genistin)2. 6″-O-丙二酰染料木苷(6″-O-malonylgenistin)3.染料木素(genistein) 图 1 混合对照品(A)、茎(B)和根(C)样品的HPLC图谱 Fig.1 HPLC chromatograms of mixed reference substances(A), stem(B)and root(C)samples |
电喷雾离子源,正离子扫描模式,干燥气温度350 ℃,干燥气流量9 L·min-1,雾化器压力2.4×105 Pa,源电压4 kV,分流比10︰1。
2.5 HPLC指纹图谱的建立与分析 2.5.1 方法学考察 2.5.1.1 精密度试验精密吸取同一供试品溶液(样品S1)10 µL,连续进样6次,记录色谱图。采用国家药典委员会中药色谱指纹图谱相似度评价系统(2.0版)(以下简称相似度评价系统)对所得色谱图进行分析。结果显示,所得色谱图相似度不低于0.95,表明仪器精密度良好。
2.5.1.2 重复性试验取同一批样品(S1)6份,按照“2.2”项下方法制备供试品溶液,分别进样10 µL,记录色谱图。采用相似度评价系统对图谱进行分析。结果显示,所得色谱图相似度不低于0.95,表明方法重复性良好。
2.5.1.3 稳定性试验精密吸取同一供试品溶液(样品S1)10 µL,分别于0、2、4、8、16、24 h进行测定,记录色谱图。采用相似度评价系统对图谱进行分析。结果显示,所得色谱图相似度不低于0.95,表明供试品溶液在24 h内稳定。
2.5.2 指纹图谱建立取11批大叶千斤拔根和7批大叶千斤拔茎,按“2.2”项下方法制备供试品溶液,按照“2.3”项下色谱条件分别进样,记录色谱图(见图 2)。采用相似度评价系统,对11批根生成对照指纹图谱(见图 3),并对11批根、7批茎图谱计算相似度,结果见表 1。
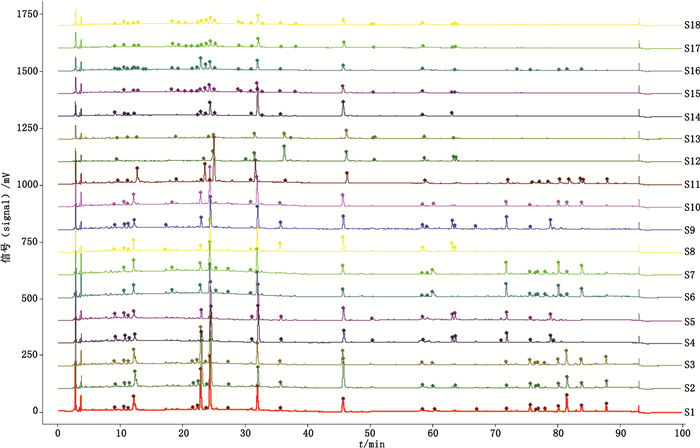
|
图 2 18批样品的HPLC图谱 Fig.2 HPLC chromatograms of 18 batches samples |
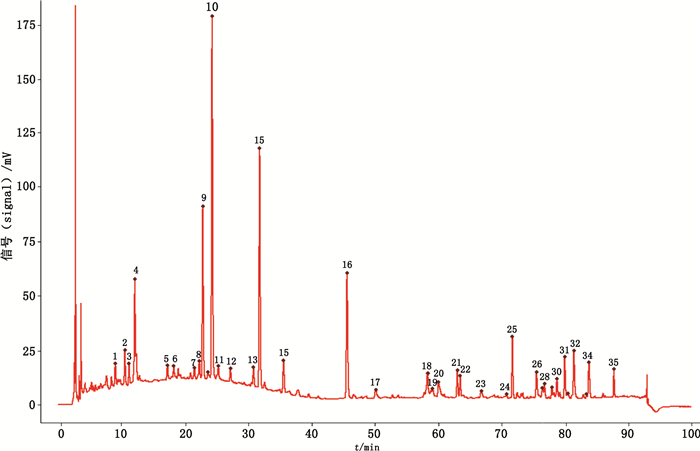
|
图 3 大叶千斤拔根的对照图谱 Fig.3 The contrast chromatogram of Moghania macrophylla root |
|
|
表 1 相似度计算结果 Tab.1 The similarity results |
按照“2.3”项下色谱条件及“2.4”项下质谱条件对供试品溶液进行分析。通过与对照品保留时间、准分子离子峰、质谱裂解碎片相比较,确定峰4为染料木素-4′,7-二-O-葡萄糖苷,峰10为染料木苷,峰14为6″-O-丙二酰染料木苷,峰16为染料木素;通过质谱信息分析,结合文献检索,推断峰9为5,4′-二羟基异黄酮-7-O-β-D-吡喃木糖基-(1→6)-β-D-吡喃葡萄糖苷,峰15为orobol,峰25为flemichin D或eriosemaone A,峰30为flemichin E,峰34为flemiphilippinone A,峰35为5,2′,4′-trihydroxy-8,5′-di-(3-methylbut-2-enyl)-6,7-(3,3- dimethylpyrano)flavanone(见表 2)。
|
|
表 2 大叶千斤拔根指纹图谱共有峰的鉴别 Tab.2 Identification of common peaks in fingerprint of Moghania macrophylla root |
精密吸取混合对照品溶液1、2、5、10、15、20 µL,按“2.3”项下色谱条件进样测定,记录峰面积。以进样量X为横坐标,峰面积Y为纵坐标,绘制标准曲线并进行线性回归,染料木苷、6″-O-丙二酰染料木苷和染料木素3个成分的线性范围、回归方程、相关系数分别见表 3。
|
|
表 3 3个成分的回归方程、线性范围、检测下限和定量下限 Tab.3 Regression equations, linear ranges, LODs and LOQs of 3 components |
将“2.1”项下混合对照品溶液逐步稀释,进行测定。以信噪比3:1时测得检测下限(LOD),10:1时测得定量下限(LOQ),结果见表 3。
3.1.3 精密度试验取“2.1”项下混合对照品溶液连续进样6次,染料木苷、6″-O-丙二酰染料木苷、染料木素峰面积的RSD分别为0.43%、0.88%和0.38%,表明方法精密度良好。
3.1.4 重复性试验分别精密称取同一大叶千斤拔根样品(S1)6份,按“2.2”项下方法制备供试品溶液,进样测得染料木苷、6″-O-丙二酰染料木苷、染料木素的平均含量为1.30、0.75和0.28 mg·g-1,RSD分别为2.0%、1.3%和1.7%,表明方法重复性良好。
3.1.5 稳定性试验取同一供试品溶液(样品S1),分别于0、2、4、8、16、24 h进样测定峰面积,结果染料木苷、6″-O-丙二酰染料木苷、染料木素峰面积的RSD分别为1.1%、2.1%和0.31%,表明供试品溶液在24 h内稳定性良好。
3.1.6 回收率试验精密称取已测知3个成分含量的大叶千斤拔根样品(S1)0.5 g共6份,分别精密加入染料木苷、6″-O-丙二酰染料木苷、染料木素质量浓度分别为0.022 9、0.017 6和0.005 2 mg·mL–1混合对照品溶液25 mL,按“2.1.2”项下方法平行制备供试溶液,进样测定,结果染料木苷、6″-O-丙二酰染料木苷、染料木素的平均回收率分别为96.7%、91.6%和95.4%,RSD为1.3%、2.8%和2.1%,见表 4。
|
|
表 4 回收率试验结果 Tab.4 The results of recovery test |
取11批大叶千斤拔根和7批大叶千斤拔茎样品,分别按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件测定,以外标法计算含量,结果见表 5。
|
|
表 5 大叶千斤拔根、茎中3个成分的含量测定(n=2) Tab.5 The content of three compounds in root or stem samples of Moghania macrophylla |
为了在指纹图谱中反映出尽量多的化学信息,同时兼顾提取效率,实验对提取方式(超声,回流)、提取溶剂(甲醇、70%甲醇水、50%甲醇水)和提取时间(30、60 min)进行考察。结果表明提取方式对染料木苷、6″-O-丙二酰染料木苷色谱峰的影响较大,回流提取样品的6″-O-丙二酰染料木苷峰明显减小,而染料木苷峰明显增大。文献报道6″-O-丙二酰染料木苷对热不稳定,加热时会转化为染料木苷[13-14],因此试验中选择超声提取的方式,以避免加热导致6″-O-丙二酰染料木苷损失。3种溶剂中70%甲醇水的提取效率最优,而30 min与60 min的提取效果相近,最终选择70%甲醇水超声提取30 min。
4.2 色谱条件优化大叶千斤拔主含异黄酮及其苷类成分,结构相近,对色谱柱的分离要求较高。实验中曾使用十八烷基硅烷键合相硅胶色谱柱,如XTerra C18 RP、Zorbax Eclipse XDB-C18、TC-C18、Xbridge Shield RP18等,分离效果均不理想。苯基硅烷键合相硅胶色谱柱与十八烷基硅烷键合相硅胶色谱柱相比,对异黄酮及其苷类成分具有独特的选择性。因此实验中选用苯基键和硅胶色谱柱,以改善色谱峰的峰形和分离情况,效果较为满意。
4.3 指纹图谱共有峰的推断本实验中通过质谱信息分析结合文献检索对指纹图谱6个共有峰进行推断。由于这6个共有峰分离度均较好,一级质谱干扰较小,通过一级质谱分析可确认相对分子质量,同时提供特征碎片离子,所得信息已足够支撑结构推断。如果指纹图谱色谱峰分离度较差,一级质谱存在干扰,则应使用二级质谱进行,以得到特征碎片离子信息。
4.4 根、茎样品指纹图谱及含量测定结果分析指纹图谱是中药整体质量评价的重要手段。为了定性表征大叶千斤拔根、茎的化学成分差异,对其进行指纹图谱研究。结果表明,与根相比,茎样品色谱图中主要色谱峰的高度明显偏低,色谱峰数量较少,甚至部分茎样品在低极性段未见色谱峰检出。以11批根的HPLC图谱生成对照图谱并计算相似度,结果表明,11批根的图谱相似度在0.919~0.984,而茎的图谱相似度仅为0.638~0.848,表明二者色谱图整体存在一定差异。
在豆科植物中,异黄酮类是一类重要的活性成分,具有雌激素和抗雌激素双重活性,可用于预防和治疗妇女更年期综合症[15]。文献报道染料木素、染料木苷具有抗肿瘤[16-18]、抗氧化[19-20]、防治骨质疏松[21]等多种作用,而6″-O-丙二酰染料木苷在加热过程会转化为染料木苷。实验中对根、茎中3个主要共有成分染料木苷、6″-O-丙二酰染料木苷和染料木素进行含量测定,并采用SPSS(16.0)软件对3个成分含量、总量以及成分比值进行独立样本t检验。结果表明,根和茎中染料木素含量具有统计学差异性(P < 0.05),染料木苷、6″-O-丙二酰染料木苷含量、3种成分总量、染料木苷与染料木素含量比值具有显著性统计学差异性(P < 0.01),6″-O-丙二酰染料木苷与染料木素含量比值不具有统计学差异性(P > 0.05)。从11批根和7批茎的测定结果来看,根中染料木苷的含量及染料木苷与染料木素的含量比值均明显高于茎,而其他2种成分含量或其比值与茎中数据存在一定交叉。综合上述结果,3个成分的总量可用于大叶千斤拔根的质量控制,而染料木苷含量或染料木苷与染料木素的含量比值可以作为区分大叶千斤拔根、茎的指标,对判断实际使用的药用部位具有参考意义。
综合本实验研究结果,大叶千斤拔的根、茎在化学成分方面存在一定差异。作为非传统用药部位,茎是否可与根同等入药,仍有待进一步研究确证。另一方面,大叶千斤拔虽然非《中国药典》一部正文收载品种,但是在妇科千金片等多个中成药大品种中都有使用。随着药材需求量的增加,资源不足的问题日渐凸显,建议积极开展规范化种植和同属其他有药用记载品种的研究,以开阔千斤拔开发利用的前景。
| [1] |
中国科学院中国植物志编委会.中国植物志[M/OL].北京: 科学出版社, 2004[2018-11-22].http://frps.eflora.cn/frps/Flemingia%20macrophylla Flora of China Committee, Chinese Academy of Sciences.Flora of China[M/OL].Beijing: Science Press, 2004[2018-11-22].http://frps.eflora.cn/frps/Flemingia%20macrophylla |
| [2] |
中华人民共和国药典2015年版.四部[S].2015: 418 ChP 2015.Vol Ⅳ[S].2015: 418 |
| [3] |
国家中医药管理局《中华本草》编委会. 中华本草, 第四卷[M]. 1999: 475. The State Administration of Traditional Chinese Medicine "Chinese Materin Medica" Editorial Board. Chinese Materin Medica.Vol Ⅵ[M]. 1999: 475. |
| [4] |
云南省药物研究所, 云南省民族药工程技术研究中心. 云南民族药志.第一卷[M]. 昆明: 云南民族出版社, 2008: 16. Center for Drug Discovery, Technology Development of Yunnan Traditional Medicine, Yunnan Institute of Material Medica. The Annals of National Medicine in Yunnan.Vol Ⅰ[M]. Kunming: The Nationalities Publishing House of Yunnan, 2008: 16. |
| [5] |
湖南省中药材标准[S].2009: 220 Hunan Chinese Materia Medica Standards[S].2009: 220 |
| [6] |
任朝琴, 刘圆. 不同种不同药用部位不同产地千斤拔中总黄酮的含量测定[J]. 时珍国医国药, 2010, 21(10): 2492. REN CQ, LIU Y. Determination of total flavones in different medicinal parts, different species and different places of Moghania philippinensis(Merr.et Rolfe)Li, Moghania macrophylla(Willd.)O.Kuntze, Moghania strobilifera(Linn.)Ait., Moghania glutiaosa(Prain.)Y.T.Wei and Moghania latifolia Benth[J]. Lishizhen Med Mater Med Res, 2010, 21(10): 2492. DOI:10.3969/j.issn.1008-0805.2010.10.032 |
| [7] |
牛迎凤, 李晓花, 李海涛, 等. 大叶千斤拔活性成分分布及积累动态[J]. 中国医药导报, 2016, 13(28): 17. NIU YF, LI XH, LI HT, et al. Distribution and accumulative dynamic variation of bioactive components in Moghania macrophylla[J]. China Med Her, 2016, 13(28): 17. |
| [8] |
吴拾保, 覃玉梅, 袁铭铭, 等. HPLC法同时测定不同产地蔓性千斤拔中5个异黄酮成分的含量[J]. 药物分析杂志, 2016, 36(11): 1988. WU SB, QIN YM, YUAN MM, et al. HPLC simultaneous determination of five isoflavone chemical components in the roots of Moghania philippinensis from different habitats[J]. Chin J Pharm Anal, 2016, 36(11): 1988. |
| [9] |
李莉, 刘志华, 秦民坚. HPLC法同时测定千斤拔属植物7种黄酮的含量[J]. 中国野生植物资源, 2011, 30(5): 54. LI L, LIU ZH, QIN MJ. Simultaneous determination of seven flavonoids in the radix of Flemingia by HPLC[J]. Chin Wild Plant Resour, 2011, 30(5): 54. DOI:10.3969/j.issn.1006-9690.2011.05.013 |
| [10] |
SUN F, LI Q, XU J. Chemical composition of roots Flemingia philippinensis and their inhibitory kinetics on aromatase[J]. Chem Biodivers, 2017, 14(1): e1600193. DOI:10.1002/cbdv.201600193 |
| [11] |
LAI WC, TSUI YT, SINGAB AN, et al. Phyto-SERM constitutes from Flemingia macrophylla[J]. Int J Mol Sci, 2013, 14(8): 15578. DOI:10.3390/ijms140815578 |
| [12] |
LI H, ZHAI FY, YANG MH, et al. A new benzofuran derivative from Flemingia philippinensis Merr.et Rolfe[J]. Molecules, 2012, 17(7): 7637. DOI:10.3390/molecules17077637 |
| [13] |
ROSTAGNO MA, PALMA M, BARROSO CG. Short-term stability of soy isoflavones extracts:sample conservation aspects[J]. Food Chem, 2005, 93(3): 557. DOI:10.1016/j.foodchem.2004.12.035 |
| [14] |
KUDOU S, FLEURY Y, WELTI D, et al. Malnoyl isoflavone glycosides in soybean seeds(Glycine max Merrill)[J]. Agric Biol Chem, 1991, 55(9): 2227. |
| [15] |
袁建平, 王江海, 刘昕. 大豆异黄酮生理活性的研究进展(1)大豆异黄酮的代谢及雌激素特性[J]. 中国食品学报, 2003, 3(3): 81. YUAN JP, WANG JH, LIU X. Research advance on the biological activities of soybean isoflavones(1)Metabolism and estrogenic behaviors of soybean isoflavones[J]. J Chin Inst Food Sci Technol, 2003, 3(3): 81. DOI:10.3969/j.issn.1009-7848.2003.03.016 |
| [16] |
ZHU YY, YAO Y, SHI ZX, et al. Synergistic effects of bioactive anticarcinogens from soybean on anti-proliferative activity in MDA-MA-231 and MCF-7 human brest cancer cells in vitro[J]. Molecules, 2018, 23(7): 1557. DOI:10.3390/molecules23071557 |
| [17] |
YANAGIHARA K, ITO A, TOGE T, et al. Antiproliferative effects of isoflavones on human cancer cell lines established from the gastrointestinal tract[J]. Cancer Res, 1993, 53(23): 5815. |
| [18] |
KATO K, TAKAHASHI S, CUI L, et al. Suppressive effects of dietary genistin and daidzin on rat prostate carcinogenesis[J]. Jpn J Cancer Res, 2000, 91(8): 786. DOI:10.1111/j.1349-7006.2000.tb01014.x |
| [19] |
RUIZ-LARREA MB, MOHAN AR, PAGANGA G, et al. Antioxidant activity of phytoestrogenic isoflavones[J]. Free Radic Res, 1997, 26(1): 63. DOI:10.3109/10715769709097785 |
| [20] |
LEE CH, YANG L, XU JZ, et al. Relative antioxidant activity of soybean isoflavones and their glycosides[J]. Food Chem, 2005, 90(4): 735. DOI:10.1016/j.foodchem.2004.04.034 |
| [21] |
LI XH, ZHANG JC, SUI SF, et al. Effect of daidzin, genistin, and glycitin on osteogenic and adipogenic differentiation of bone marrow stromal cells and adipocytic transdifferentiation of osteoblasts[J]. Acta Pharmacol Sin, 2005, 26(9): 1081. DOI:10.1111/j.1745-7254.2005.00161.x |
 2020, Vol. 40
2020, Vol. 40 
