清火栀麦片由穿心莲、栀子和麦冬3味中药经过提取加工制成的中药片剂,具有清热解毒和凉血消肿的功效,适用于咽喉肿痛、发热、牙痛、目赤等症状[1]。《中华人民共和国药典》(2015年版)及相关文献主要采用HPLC法以穿心莲和栀子中的脱水穿心莲内酯、穿心莲内酯、栀子苷为指标成分进行含量分析[2-5],仅测定其中1~2个主要成分,且分析时间较长,质量控制不够全面。目前,清火栀麦片中麦冬的成分尚未进行质量控制。麦冬的常见伪品是湖北麦冬,两者功能主治相同,性状相似,易被混用,由于湖北麦冬价格较麦冬低,部分厂家为了降低生产成本,在投料中掺入湖北麦冬的情况时有发生,而对于这种掺假情况缺乏有效的检测方法,在一定程度上阻碍了该药品的质量控制和市场监管。因此,本实验结合相关研究[6-14],采用超高效液相色谱-三重四极杆串联质谱(RRLC-QQQ-MS/MS)技术,在同时测定制剂中脱水穿心莲内酯、穿心莲内酯和栀子苷3个成分的基础上,还增加了对麦冬主要活性成分麦冬皂苷D[15]的含量测定,以及伪品湖北麦冬的主要活性成分山麦冬皂苷B[16]的筛查,既能有效控制清火栀麦片中穿心莲、栀子和麦冬的含量,又能检测麦冬投料中是否掺加伪品湖北麦冬,为其质量控制和市场监管提供新技术支撑和科学依据。
1 仪器与试药Shimadzu LC-30AD超高效液相色谱仪,配置Triple Quad 4500三重四极杆质谱仪,AB SCIEX公司;Mettler Xp26百万分之一天平,梅特勒公司;AS7240BT超声波清洗器,天津奥特赛恩斯仪器有限公司。
麦冬对照药材(批号110749-201115)及对照品脱水穿心莲内酯(批号110854-200306,含量100%)、穿心莲内酯(批号110797-200307,含量100%)、栀子苷(批号110749-201617,含量98.4%)、山麦冬皂苷B(批号111907-201102,含量100%)购自中国食品药品检定研究院,麦冬皂苷D(批号DST170103-023,含量98%)购自成都德恩特生物技术有限公司。甲醇、乙腈为色谱纯,迪马科技有限公司,水为超纯水,其他试剂均为分析纯。10批不同厂家的清火栀麦片均为市售样品。麦冬、湖北麦冬购自广西玉林中药材专业市场,经柳州市食品药品检验所李玲主任中药师鉴定为正品。
2 方法与结果 2.1 色谱条件色谱柱:XBridge BEH C18(2.1 mm× 100 mm,2.5 µm);流动相:以0.1%乙酸水溶液(含10 mmol·L-1乙酸铵)为流动相A,乙腈为流动相B,梯度洗脱(0~7 min,0%B→70%B;7~8 min,70%B→90%B);流速:0.3 mL·min-1;进样量:1 μL。
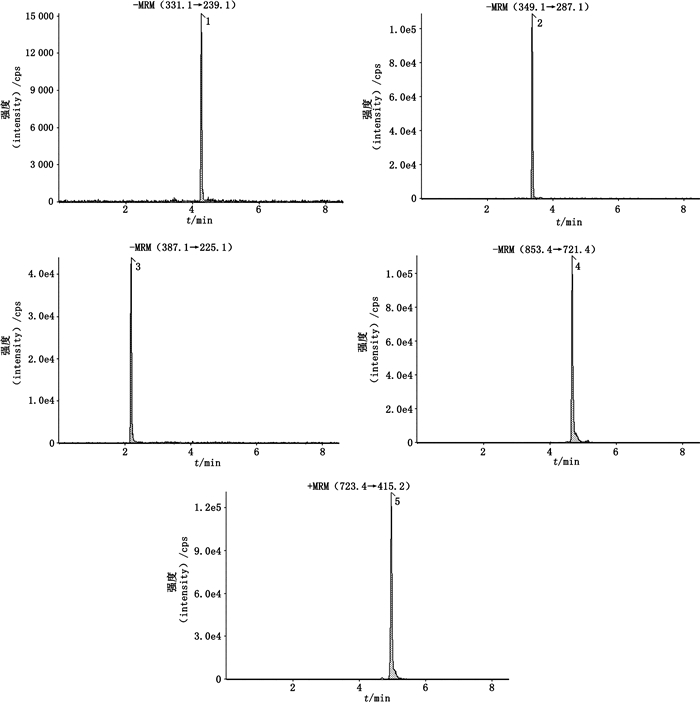
2.2 质谱条件离子源:电喷雾离子源(ESI);离子化电压:±4.5 kV;离子源温度:550 ℃;气帘气压力:1.7×105 Pa;喷雾气压力:3.8×105 Pa;辅助加热气压力:3.8×105 Pa;碰撞气:氮气;扫描模式:多反应监测模式(MRM)。具体参数见表 1,各成分的提取离子流色谱图见图 1。
|
|
表 1 各成分质谱参数 Tab.1 MS parameters of various components |
|
1.脱水穿心莲内酯(dehydroandrographolide)2.穿心莲内酯(andrographolide)3.栀子苷(geniposide)4.麦冬皂苷D(ophiopogonin D)5.山麦冬皂苷B(liriopesides B) 图 1 各成分的提取离子流色谱图 Fig.1 Extracted ion chromatograms of the analytes |
精密称取脱水穿心莲内脂13.17 mg,穿心莲内酯12.05 mg,栀子苷12.39 mg,麦冬皂苷D 10.27 mg和山麦冬皂苷B 10.55 mg,分别置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成各对照品储备液。精密吸取储备液各1 mL,置于同一200 mL量瓶中,加甲醇稀释至刻度摇匀,即得含脱水穿心莲内酯2.634 μg·mL-1,穿心莲内酯2.410 μg·mL-1,栀子苷2.471 μg·mL-1,麦冬皂苷D 2.013 μg·mL-1,山麦冬皂苷B 2.110 μg·mL-1的混合对照品溶液。
2.4 供试品溶液的制备取清火栀麦片20片,除去包衣,研细。精密称取细粉1 g,置具塞锥形瓶中,精密加入甲醇10 mL,称量,超声(功率250 W,频率50 kHz)20 min,放冷,用甲醇补足减失的量,摇匀,取适量上清液,用0.22 μm微孔滤膜过滤,即得。
2.5 阴性样品溶液及阳性样品溶液的制备按清火栀麦片的组成比例,去除麦冬制成缺麦冬阴性样品,按“2.4”项下方法制成缺麦冬阴性样品溶液。同法分别制成含麦冬和含湖北麦冬的阳性样品溶液。
2.6 线性关系考察将对照品储备液适量,用甲醇配制成不同质量浓度的混合对照品工作溶液,在“2.1”和“2.2”项下条件测定,以质量浓度X为横坐标,峰面积Y为纵坐标进行回归。结果表明,5个成分在相应的范围内线性关系良好,见表 2。
|
|
表 2 线性回归方程、线性范围、检测下限和定量下限 Tab.2 Regression equations, linear range, LOD and LOQ |
精密量取“2.3”项下的混合对照品溶液1.0 mL,置10 mL量瓶中,加甲醇稀释至刻度摇匀,按“2.1”和“2.2”项下条件进样分析,记录色谱图,以信噪比为3:1和10:1分别计算检测下限和定量下限,结果见表 2。
2.8 精密度考察取批号为160503的样品,按“2.4”项下方法制备供试品溶液,连续进样6次,记录色谱图,计算脱水穿心莲内酯、穿心莲内酯、栀子苷、麦冬皂苷D和山麦冬皂苷B峰面积的RSD分别为1.5%、1.8%、1.3%、2.1%、2.5%。表明该方法有较好的精密度。
2.9 稳定性考察取批号为160503的样品,按“2.4”项下方法制备供试品溶液,分别于0、2、4、6、8、12 h按“2.1”和“2.2”项下条件测定,记录色谱图,计算脱水穿心莲内酯、穿心莲内酯、栀子苷、麦冬皂苷D和山麦冬皂苷B峰面积的RSD分别为1.7%、1.2%、1.8%、2.2%、1.9%。表明供试品溶液在12 h内稳定。
2.10 重复性考察取批号为160503的样品6份,分别按“2.4”项下方法制备供试品溶液,按“2.1”和“2.2”项下条件测定,记录色谱图,计算脱水穿心莲内酯、穿心莲内酯、栀子苷、麦冬皂苷D和山麦冬皂苷B平均含量分别为1 205.37、305.01、585.12、7.33、2.19 μg·片-1,RSD分别为1.2%、1.9%、1.1%、2.5%、2.3%。表明该方法的重复性良好。
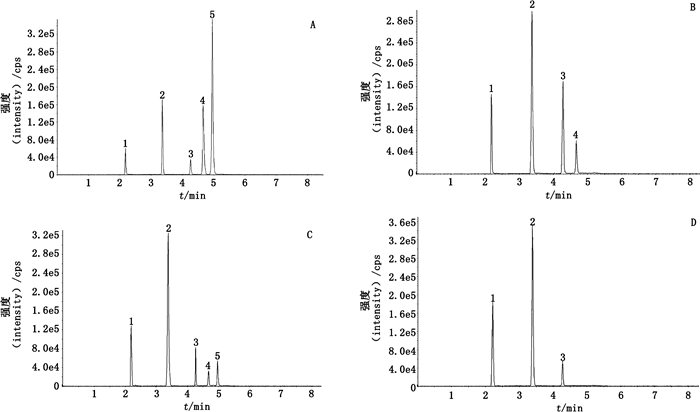
2.11 专属性试验取混合对照品溶液、阴性样品溶液、含麦冬阳性样品溶液和含湖北麦冬阳性样品溶液,分别按“2.1”和“2.2”项下条件进样测定,结果见图 2。如图所示,含麦冬阳性样品中检出与麦冬皂苷D对照品一致的离子峰,含湖北麦冬阳性样品中检出与山麦冬皂苷B对照品和麦冬皂苷D对照品一致的离子峰,阴性样品在与麦冬皂苷D、山麦冬皂苷B对照品相应的位置上均未见一致的离子峰,由此可见,麦冬中只含有麦冬皂苷D,湖北麦冬中含有麦冬皂苷D和山麦冬皂苷B,制剂中其他味药及辅料对检测结果无干扰。该方法可以通过检测山麦冬皂苷B来准确判定清火栀麦片投料中是否掺入湖北麦冬。
|
1.栀子苷(geniposide)2.穿心莲内酯(andrographolide)3.脱水穿心莲内酯(dehydroandrographolide)4.麦冬皂苷D(ophiopogonin D)5.山麦冬皂苷B(liriopeside B) 图 2 混合对照品(A)、含麦冬阳性样品(B)、含湖北麦冬阳性样品(C)和缺麦冬阴性样品(D)的总离子流图 Fig.2 Total ion chromatograms of mixed standards(A), positive sample with Ophiopogon japonicas(B), positive sample with Liripe spicata(C), and negative sample without Ophiopogon japonicas(D) |
取已知含量的样品(160503)40片,除去包衣,研细,精密称取9份,每份0.5 g,分别置锥形瓶中,分别加入低、中、高3种浓度的对照品储备液适量,按“2.4”项下方法制备供试溶液,进样1 μL测定,计算加样回收率,结果见表 3,表明本方法回收率良好。
|
|
表 3 回收率试验结果 Tab.3 Results of recovery |
按照“2.4”项下方法制备10个批次不同厂家样品的供试品溶液各2份,精密吸取各供试品溶液1 μL测定,代入线性回归方程计算,结果见表 4。测定数据显示,厂家对于《中华人民共和国药典》(2015年版)控制品种穿心莲和栀子的加入量较为接近,差异不大,但是对于控制相对较弱的麦冬,其主要活性指标麦冬皂苷D的含量相差较大,说明不同厂家投料所用麦冬质量存在一定差异,其中有3个厂家检出山麦冬皂苷B,表明这3个厂家极可能在投料中掺入了湖北麦冬。
|
|
表 4 样品中5个成分的含量(μg·片-1,n=2) Tab.4 Results of content determination(μg per tablet, n=2) |
分别考察加热回流提取、超声提取和索氏提取,结果发现这3种方法的提取率无明显差异,但是由于超声提取操作相对简单,耗时最短,故选用超声提取作为制备供试品溶液的方法。此外,通过比较不同有机溶剂的提取(甲醇、乙醇、乙酸乙酯、正丁醇),结果发现选择用甲醇对样品进行提取,各成分响应较高,提取较为完全,确定甲醇作为提取溶剂。
3.2 检测模式的考察分别对5个成分进行了正、负离子扫描,结果显示脱水穿心莲内酯、穿心莲内酯、栀子苷、麦冬皂苷D在负离子检测模式下[M-H]-的响应较强,而山麦冬皂苷B在正离子检测模式下[M+H]+响应较强。因此,分别采用正负离子模式对5个成分进行扫描,在8 min中即可完成分析测定,相比普通液相色谱,极大地缩短了进样时间,提高了实验效率。
3.3 结果分析清火栀麦片的现行质量标准中尚无关于麦冬的定量检测,麦冬和湖北麦冬在性状上极其相似,易发生混用,虽然凭借显微鉴别、薄层鉴别可以区分二者,但在制剂检测中常规方法较难鉴别麦冬的具体品种。湖北麦冬中含有山麦冬皂苷B,而麦冬中无此成分,因此检测清火栀麦片中是否含有山麦冬皂苷B可判断制剂中是否存在以湖北麦冬代替麦冬投料的情况。10批次样品含量测定结果显示有3个批次样品检出山麦冬皂苷B,表明实际生产中存在混用湖北麦冬投料的情况。本实验建立的RRLC-QQQ-MS/MS法可同时对清火栀麦片的多个指标成分进行定量测定及检查湖北麦冬,监测企业是否存在投料中混入湖北麦冬的情况,对于全面控制药品质量,保证人民用药的有效起到了积极的作用。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 1535 ChP 2015.Vol Ⅰ[S].2015: 1535 |
| [2] |
海学武, 王永春. HPLC法测定清火栀麦片中穿心莲内酯、脱水穿心莲内酯的含量[J]. 西北药学杂志, 2004, 19(6): 254. HAI XW, WANG YC. Content determination of andrographolide and dehydroandrographolide in Qinhuo Zhimai tablets by HPLC[J]. Northwest Pharm J, 2004, 19(6): 254. DOI:10.3969/j.issn.1004-2407.2004.06.007 |
| [3] |
杨静, 罗廷顺. 清火栀麦片HPLC指纹图谱的建立和3种成分含量测定[J]. 中国药师, 2017, 20(4): 673. YANG J, LUO TS. Establishment of the HPLC fingerprint of Qinghuo Zhimai tablets and determination of three constituents[J]. China Pharm, 2017, 20(4): 673. DOI:10.3969/j.issn.1008-049X.2017.04.019 |
| [4] |
李成平, 朱砚屏, 高捷, 等. 生物分配胶束色谱法同时测定清火栀麦片中3种有效成分[J]. 药物分析杂志, 2016, 36(5): 816. LI CP, ZHU YP, GAO J, et al. Simultaneous determination of three effective compounds in Qinghuo Zhimai tablets by biopartitioning micellar chromatography[J]. Chin J Pharm Anal, 2016, 36(5): 816. |
| [5] |
蓝晓玉, 林华. HPLC法同时测定清火栀麦片中3种有效成分的含量[J]. 药物分析杂志, 2011, 31(2): 228. LAN XY, LIN H. HPLC Determination of three effective components in Qinghuo Zhimai tablets[J]. Chin J Pharm Anal, 2011, 31(2): 228. |
| [6] |
俞建平, 马月光, 邵建峰, 等. ELSD-HPLC法测定浙麦冬、川麦冬中麦冬皂苷D含量的方法研究[J]. 中药新药与临床药理, 2002, 13(4): 253. YU JP, MA YG, SHAO JF, et al. Determination of ophiopogonin D in Ophiopogon japonicas and Ophiopogon japonicus by ELSD-HPLC[J]. Tradit Chin Drug Res Clin Pharmacol, 2002, 13(4): 253. DOI:10.3321/j.issn:1003-9783.2002.04.022 |
| [7] |
吴弢, 余伯阳, 程志红, 等. HPLC-ELSD法测定湖北麦冬中主要皂苷的含量[J]. 中草药, 2000, 31(3): 175. WU T, YU BY, CHENG ZH, et al. Quantitative determination of the main sponin content in Hubei Liriope(Liriope spicata var.prolifera)by HPLC-ELSD[J]. Chin Tradit Herb Drugs, 2000, 31(3): 175. DOI:10.3321/j.issn:0253-2670.2000.03.008 |
| [8] |
邓惠方, 王东明, 富瑶瑶, 等. 麦冬皂苷D的分离提纯[J]. 大连工业大学学报, 2011, 30(4): 235. DENG HF, WANG DM, FU YY, et al. Separation and purification of ophiopogonin D[J]. J Dalian Polytech Univ, 2011, 30(4): 235. DOI:10.3969/j.issn.1674-1404.2011.04.001 |
| [9] |
徐暾海, 陈萍, 徐雅娟, 等. 川麦冬中的新呋甾皂苷的分离与鉴定[J]. 高等学校化学学报, 2007, 28(2): 286. XU TH, CHEN P, XU YJ, et al. Separation and identify of new furostanol glycosides in Ophiopogon japonicas[J]. Chem J Chin Univ, 2007, 28(2): 286. DOI:10.3321/j.issn:0251-0790.2007.02.043 |
| [10] |
张炜, 宋文静, 武嘉庚, 等. UPLC-MS/MS法检测妇康宁片中掺加的山麦冬[J]. 中成药, 2017, 34(4): 867. ZHANG W, SONG WJ, WU JG, et al. Determination of Liriopes Radix added in Fukangning pills by UPLC-MS/MS[J]. Chin Tradit Pat Med, 2017, 34(4): 867. DOI:10.3969/j.issn.1001-1528.2017.04.048 |
| [11] |
张加余, 乔延江, 高晓燕, 等. 清火栀麦片中化学成分的SPE-HPLC-ESI-MSn快速识别与鉴定[J]. 中国中药杂志, 2013, 38(2): 186. ZHANG JY, QIAO YJ, GAO XY, et al. Rapid recognize and identify chemical composition in Qinghuo Zhimai tablets by SPE-HPLC-ESI-MSn[J]. China J Chin Mater Med, 2013, 38(2): 186. |
| [12] |
缪菊连, 黄照昌, 王成军, 等. HPLC-ELSD法测定生脉饮中麦冬皂苷D[J]. 中成药, 2015, 37(2): 462. MIU JL, HUANG ZC, WANG CJ, et al. Determination of ophiopogonin D in Shengmaiyin by HPLC-ELSD[J]. Chin Tradit Pat Med, 2015, 37(2): 462. |
| [13] |
吴茵, 穆华, 刘勇, 等. UPLC-MS/MS法同时测定玄麦甘桔颗粒中8种有效成分[J]. 中草药, 2015, 46(20): 3034. WU Y, MU H, LIU Y, et al. Determination of eight active components in Xuanmai Ganjie granules by UPLC-MS/MS[J]. Chin Tradit Herb Drugs, 2015, 46(20): 3034. DOI:10.7501/j.issn.0253-2670.2015.20.018 |
| [14] |
张炜, 宋文静, 武嘉庚, 等. UPLC-MS/MS法检测妇康宁片中掺加的山麦冬[J]. 中成药, 2017, 39(4): 867. ZHANG W, SONG WJ, WU JG, et al. Determination Liriopes Radix in Fukangning tablets by UPLC-MS/MS[J]. Chin Tradit Pat Med, 2017, 39(4): 867. DOI:10.3969/j.issn.1001-1528.2017.04.048 |
| [15] |
王建忠, 陈小兵, 王锋鹏, 等. 川麦冬皂苷类化学成分的研究[J]. 有机化学, 2008, 28(9): 1620. WANG JZ, CHEN XB, WANG FP, et al. Research on the chemical constituents of saponins in Ophiopogonis Radix[J]. Chin J Org Chem, 2008, 28(9): 1620. |
| [16] |
杨文双, 陈家春. 湖北麦冬的研究及展望[J]. 时珍国医国药, 2006, 17(10): 1939. YANG WS, CHEN JC. Research and prospect of Liripe spicata[J]. Lishizhen Med Mater Med Res, 2006, 17(10): 1939. DOI:10.3969/j.issn.1008-0805.2006.10.106 |
 2020, Vol. 40
2020, Vol. 40 
