2. 南昌大学, 南昌 330006;
3. 江西省药品检验检测研究院, 江西省药品与医疗器械质量工程技术研究中心, 南昌 330029
2. Nanchang University, Nanchang 330006, China;
3. Jiangxi Institute for Drug Control, Jiangxi Provincial Engineering Research Center for Drug and Medical Device Quality, Nanchang 330029, China
真菌竹黄胶囊为肉座菌科真菌竹黄(Shiraia bambusicola P. Henn.)的子座经提取加工制成的胶囊,具有祛风通络及散寒理湿的功效,用于风寒湿痹[1]。民间常用白酒浸竹黄,用于类风湿性关节炎等风寒湿痹病症的治疗,对关节发热、肿胀和疼痛症状的疗效较好[2];现代药理研究表明,竹黄的乙醇提取物治疗类风湿性关节炎的作用可能是通过影响TNF-α通路和对NF-kB抑制蛋白的活化而发挥作用的[3];此外,竹黄还具有镇痛抗炎[4-5]、局麻[6]、抗菌[7]、抗肿瘤(粘膜癌[8]、乳腺癌[9]及人源的恶性肿瘤细胞HIC、MGC803、HeLa、Hce-8693盲肠癌细胞[10])等作用。
林海萍等[11-12]报道采用分光光度法在465 nm波长下测定竹黄药材中竹红菌甲素含量;采用苯酚-硫酸法测定不同来源竹黄的多糖量,分析比较了不同来源竹黄的多糖量。黄宝美等[13]报道采用毛细管电泳电导法测定竹黄中竹红菌甲素的含量。分光光度法易受竹黄样品复杂性影响,准确性受到限制;毛细管电泳法进样时间和分离电压不易选择,稳定性受到限制[14]。竹红菌素类成分的含量是衡量竹黄药材质量的重要指标,但很少有人深入研究竹黄药材中竹红菌素类成分的含量测定方法。
真菌竹黄胶囊质量标准收载于《卫生部药品标准中药成方制剂》第十七册,现有质量标准简单,仅有“鉴别”和“检查”项[15],无薄层色谱鉴别,无含量测定项,不能很好地保证有效成分的均一可控,不能很好地保证药品质量。
目前尚未有文献报道关于真菌竹黄胶囊的系统质量控制方法研究,因此本研究建立了采用反相高效液相色谱法同时测定真菌竹黄胶囊中竹红菌丙素、竹红菌甲素、竹红菌乙素3个苝醌类化合物含量的测定方法,考察了3批真菌竹黄胶囊中3个成分的含量差异,为进一步完善真菌竹黄胶囊的质量评价方法提供参考依据。
1 仪器与试药 1.1 仪器Agilent 1260系列(全自动)高效液相色谱仪,Agilent 1260化学工作站,DAD可变波长检测器;Sartorius BT25S电子天平(十万分之一),Sartorius BSA124S-CW电子天平(万分之一)。
1.2 试药对照品竹红菌丙素、竹红菌甲素、竹红菌乙素均为本课题组自制,通过1H-NMR、13C-NMR、MS等手段确证了其结构,纯度经HPLC法检测 > 98%(面积归一法)。水为娃哈哈饮用纯净水;乙腈、甲醇为色谱纯。3批真菌竹黄胶囊样品均由江西众心堂制药有限公司提供,批号分别为171210、171211、171212;缺真菌竹黄阴性样品由江西众心堂制药有限公司提供。
2 溶液的制备 2.1 混合对照品溶液精密称取竹红菌丙素、竹红菌甲素、竹红菌乙素对照品适量,置于同一棕色量瓶中,以乙腈制成质量浓度分别为16.32、19.64、40.32 μg·mL-1的混合溶液,即得。
2.2 供试品溶液取装量差异项下的样品内容物,研细,取约0.2 g,精密称定,置棕色的具塞锥形瓶中,精密加入乙腈25 mL,称量,超声处理(功率500 W,频率40 kHz)20 min,放冷,再称量,用乙腈补足减失的量,摇匀,0.45 μm微孔滤膜滤过,取续滤液,即得。
2.3 阴性样品溶液取缺真菌竹黄阴性样品,按“2.2”项下方法操作制得阴性样品溶液。
3 色谱条件采用CAPCELL PAK C18色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,以乙腈-0.1%磷酸溶液(62:38)为流动相,流速1.0 mL·min-1;检测波长460 nm,进样量10 μL;理论板数按竹红菌甲素峰计算应不低于5 000。在上述色谱条件下,色谱图见图 1。
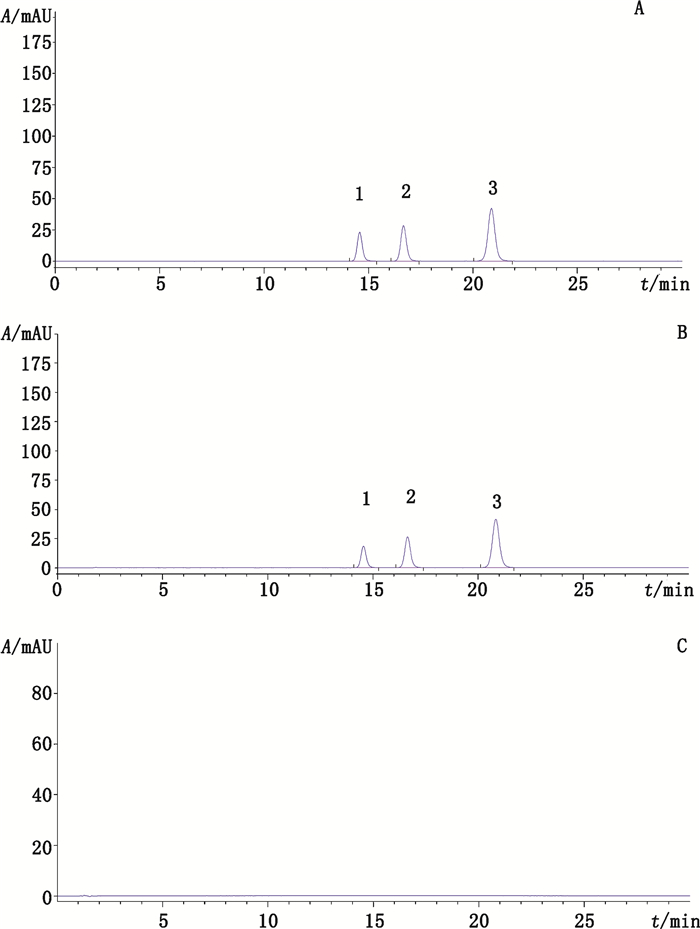
|
1.竹红菌丙素(hypocrellin C)2.竹红菌甲素(hypocrellin A)3.竹红菌乙素(hypocrellin B) 图 1 混合对照品(A)、真菌竹黄胶囊(B)、缺真菌竹黄阴性样品(C)的色谱图 Fig.1 HPLC chromatograms of mixed reference substances(A), Zhenjun Zhuhuang capsules(B)and negative sample without Shiraia bambusicola(C) |
精密吸取“2.1”项下混合对照品溶液1、2、5、10、20、50 µL,分别按“3”项下色谱条件进样分析,以进样量X(μg)为横坐标,峰面积Y为纵坐标,绘制标准曲线并进行回归计算,得3种成分的回归方程,结果见表 1。
|
|
表 1 3种成分的线性关系 Tab.1 Linearity of 3 components |
精密吸取混合对照品溶液10 μL,按“3”项下色谱条件连续进样6次,依次测定峰面积,结果竹红菌丙素、竹红菌甲素、竹红菌乙素峰面积的RSD(n=6)分别为0.30%、0.30%、0.50%,表明仪器精密度良好。
4.3 稳定性试验精密吸取样品为批号171210的供试品溶液10 μL,按“3”项下色谱条件,在24 h内于0、1、2、4、8、12、24 h分别进样测定,结果竹红菌丙素、竹红菌甲素、竹红菌乙素峰面积的RSD(n=7)分别为0.40%、0.20%、0.30%,表明供试品溶液在24 h内稳定。
4.4 重复性试验取装量差异项下的样品(批号171210)内容物6份,各约0.2 g,精密称定,按“2.2”项下方法制备供试品溶液,并按“3”项下色谱条件进样测定,测得竹红菌丙素、竹红菌甲素、竹红菌乙素平均含量(n=6)分别为1.598、2.429、4.808 mg·g-1,RSD分别为0.40%、0.30%、0.30%。
4.5 回收率试验精密称取“4.4”项下已测知含量的装量差异项下的真菌竹黄胶囊粉末9份,每份约0.1 g,3份为一组,精密称定,置棕色具塞锥形瓶中,分别精密加入含竹红菌丙素、竹红菌甲素、竹红菌乙素高、中、低3个浓度的混合对照品溶液各25 mL,按“2.2”项下方法制备供试溶液,并按“3”项下色谱条件进样测定,计算平均回收率,结果见表 2。
|
|
表 2 回收率试验结果 Tab.2 Results of recovery |
取混合对照品溶液适量,逐级稀释,按“3”项下色谱条件进行测定。信噪比为2:1时,测得竹红菌丙素、竹红菌甲素、竹红菌乙素检测下限分别为1.63、1.96、2.01 ng;信噪比为10:1时,测得的定量下限分别为8.15、9.80、4.01 ng。
4.7 色谱柱耐用性试验取同一批装量差异项下的样品(批号171210)内容物约0.2 g,精密称定,按“2.2”项下方法制备供试品溶液,分别采用CAPCELL PAK C18(250 mm×4.6 mm,5 μm)、SHIMADZU VP-ODS C18(250 mm×4.6 mm,5 μm)、依利特C18(250 mm×4.6 mm,5 μm)3种品牌的色谱柱,按“3”项下色谱条件进行测定,结果无明显差别。
5 样品含量测定取不同批次装量差异项下的真菌竹黄胶囊粉末,每批取2份,分别按“2.2”项下方法制备供试品溶液,并按“3”项下色谱条件进行分析,测定峰面积,用外标法计算出竹红菌丙素、竹红菌甲素、竹红菌乙素的含量,结果见表 3。
|
|
表 3 样品含量测定结果(mg·粒-1,n=2) Tab.3 Results of content determination of samples(mg per capsule, n=2) |
取竹红菌丙素、竹红菌甲素、竹红菌乙素的对照品适量,加乙腈制成适当的浓度的溶液,以乙腈为空白,在800~200 nm波长范围内进行光谱扫描,结果表明,在460 nm波长附近3个成分均有最大吸收,干扰少且稳定,故选择460 nm作为检测波长。
6.2 提取方式的考察考察了回流提取法和超声提取法对竹红菌丙素、竹红菌甲素、竹红菌乙素含量测定的影响;结果显示,两者无明显区别,故选择超声提取;提取溶剂考察了甲醇、乙醇、乙腈,结果以乙腈为溶剂提取时,竹红菌丙素、竹红菌甲素、竹红菌乙素含量均较高;还考察了提取时间(10、20、30 min)、提取溶剂用量(15、25、50 mL),结果表明提取时间为20 min,提取溶剂用量为25 mL时提取效果最好。
6.3 流动相的确定考察了乙腈-水、甲醇-水、乙腈-0.1%磷酸溶液3个溶剂系统;结果显示,以乙腈-0.1%磷酸溶液(62:38)为流动相,所得色谱峰峰形较好,分离效果最佳。
6.4 小结综上所述,本研究建立的真菌竹黄胶囊中3个主要苝醌类成分的HPLC含量测定方法,色谱峰分离效果较好,基线较平,重现性较好,经方法学验证,该方法准确、可靠,为进一步完善真菌竹黄胶囊的质量评价方法提供参考依据。
| [1] |
胡红胜. 真菌竹黄胶囊[J]. 中药新药与临床药理, 1994, 5(1): 32. HU HS. Fungus Shiraia bambusicola Capsules[J]. Tradit Chin Drug Res Clin Pharmacol, 1994, 5(1): 32. |
| [2] |
陈月桂, 刘艳春, 郭凯, 等. 竹黄菌与竹红菌的化学成分及细胞毒活性比较研究[J]. 天然产物研究与开发, 2019, 31(6): 1006. CHEN YG, LIU YC, GUO K, et al. Chemical constituents of Shiraia bambusicola and Hypocrella bambusae and their cytotoxic activity[J]. Nat Prod Res Dev, 2019, 31(6): 1006. |
| [3] |
朱力宇.竹黄有效成份的提取及其对类风湿性关节炎TNF-α通路影响的探讨[D].长沙: 中南大学, 2010: 29 ZHU LY.The Extract of Shiraia bambusicola and Its Effects on the TNF-α Pathway in Rheumatoid Arthritis[D].Changsha: Central South University, 2010: 29 |
| [4] |
赵宁, 陈双林. 竹黄遗传多样性与竹红菌素合成和抗癌作用的研究进展[J]. 生物技术通报, 2018, 34(4): 16. ZHAO N, CHEN SL. Research progress on genetic diversity of Shiraia bambusicola, biosynthesis and anticancer activity of hypocrellin[J]. Biotechnol Bull, 2018, 34(4): 16. |
| [5] |
张启浩, 雷雨露, 朱晓兰, 等. 中药竹黄不同提取部位抗炎镇痛活性的研究[J]. 山东化工, 2018, 47(16): 44. ZHANG QH, LEI YL, ZHU XL, et al. Study on traditional Chinese medicine Shiraia bambusicola anti-inflammatory and analgesic activity of different extracts[J]. Shandong Chem Ind, 2018, 47(16): 44. DOI:10.3969/j.issn.1008-021X.2018.16.018 |
| [6] |
陈艺萌.竹黄生物学特性与遗传多样性研究[D].昆明: 昆明理工大学, 2014: 3 CHEN YM.Research on Biological Characteristics and Genetic Diversity of Shiraia bambusicola P.Henn.[D].Kunming: Kunming University of Science and Technology, 2014: 3 |
| [7] |
LEUNG AW, IP M, XU CS, et al. Sonodynamic bactericidal efficacy of hypocrellin A and B against methicillin-resistant Staphylococcus aureus[J]. Hong Kong Med J, 2017, 23(4): 36. |
| [8] |
ALI SM, CHEE SK, YUEN GY, et al. Hypericin and hypocrellin induced apoptosis in human mucosal carcinoma cells[J]. J Photochem Photobiol B, 2001, 65(1): 59. DOI:10.1016/S1011-1344(01)00252-4 |
| [9] |
JIA Y, WANG X, LIU Q, et al. Sonodynamic action of hypocrellin B triggers cell apoptoisis of breast cancer cells involving caspase pathway[J]. Ultrasonics, 2017(73): 154. |
| [10] |
FEI XF, JIE C, ZHENG KY, et al. Apoptotic effects of hypocrellin A on HeLa cells[J]. Chem Res Chin Univ, 2006, 22(6): 772. DOI:10.1016/S1005-9040(06)60210-9 |
| [11] |
林海萍, 陈虹, 叶勇, 等. 竹黄竹红菌甲素含量测定方法[J]. 浙江农林大学学报, 2002, 19(2): 157. LIN HP, CHEN H, YE Y, et al. Determining method for content of hypocrellin A in Shiraia bambusicola[J]. J Zhejiang Agric Forest Univ, 2002, 19(2): 157. DOI:10.3969/j.issn.2095-0756.2002.02.010 |
| [12] |
林海萍, 殷红福, 黄小波, 等. 不同来源竹黄中多糖量的分析与比较[J]. 中草药, 2010, 41(9): 1549. LIN HP, YIN HF, HUANG XB, et al. Analysis and comparison of polysaccharides in Shiraia bambusicola from different sources[J]. Chin Tradit Herb Drugs, 2010, 41(9): 1549. |
| [13] |
黄宝美, 姚程炜, 王志国, 等. 毛细管电泳电导法测定竹黄中竹红菌甲素含量[J]. 理化检验(化学分册), 2011, 47(6): 656. HUANG BM, YAO CW, WANG ZG, et al. Capillary electrophoreto-conductometric determining of hypocrellin A in Shiraia bambusicola[J]. Phys Test Chem Anal(Part B:Chem Anal), 2011, 47(6): 656. |
| [14] |
李野, 尹利辉, 高尚, 等. 食品和药品中维生素C含量测定方法的研究进展[J]. 药物分析杂志, 2016, 36(5): 756. LI Y, YIN LH, GAO S, et al. Research progress of vitamin C content determination in food and drug[J]. Chin J Pharm Anal, 2016, 36(5): 756. |
| [15] |
卫生部药品标准中药成方制剂.第十七册[S].1998: 228 The Chinese Herbal Medicine Product Specification Promulgated by the Ministry of Public Health, P.R.China.Vol 17[S].1998: 228 |
 2020, Vol. 40
2020, Vol. 40 
