近年来基因治疗产品成为新药研发的热点,大多采用病毒作为载体,剂型以注射剂为主,包括注射液和注射用无菌粉末,但是给药方式比较多样化,包括静脉注射、瘤内注射、肌内注射、皮下注射、眼内注射等[1-4]。2015年版《中华人民共和国药典》三部通则0102关于注射剂的相关要求中明确:溶液型注射液应澄清;除另有规定外,注射剂应进行可见异物和不溶性微粒检查[5-6]。因此,注射用的基因治疗制品也应进行外观、可见异物及不溶性微粒检查。但是,由于方法简单,在产品研发阶段,外观和可见异物检查项往往得不到重视。以病毒为载体的基因治疗产品比较特殊,一是作为活的有机体,病毒颗粒的动态变化过程难以控制;二是产品浓度一般较高(1×1010 VP·mL-1以上),易出现高浓度聚集的情况[7-8]。这些问题导致以病毒为载体的基因治疗产品的外观和可见异物项易出现不符合相关规定的情况。
病毒颗粒的异质性主要因样品中存在的大量的不完整颗粒和聚集体,可能对产品的安全性和有效性都产生重大影响,会影响病毒载体的转导效率、生物分布,甚至诱发免疫反应[9-10]。尽管如此,目前对于病毒颗粒均一性的考察尚无统一的检测方法及相关标准[11]。聚集体可以在生产或纯化过程中产生,一般聚集程度与制剂缓冲液的pH和离子强度密切相关[12-13]。聚集体的大小可以是纳米级(寡聚体)至肉眼可见级别。对于不同粒径范围的微粒,可采用不同的技术进行分析。对于纳米级微粒,一般可采用原子力显微镜、电镜、光散射法、SEC-HPLC等;对于微米级微粒,可采用显微成像法、光阻法等;而可见颗粒一般采用红外显微镜法或目测法进行检测[14-19]。将不同的方法进行优势组合,即可实现全范围的微粒分析。
本研究采用一系列互补的检测技术,包括透射电镜法(transmission electron microscope,TEM)、动态光散射法(dynamic light scattering,DLS)、微流数字成像法(microflow digital imaging,MDI)、光阻法及目测法,对以病毒为载体的基因治疗产品进行观察研究,初步探索制品外观异常产生的内在原因,为相关产品的研发和质控提供一些参考和提示。本研究选择了3种比较常见的病毒载体:腺病毒(adenovirus,AdV)、腺相关病毒(adeno-associated virus,AAV)和单纯疱疹病毒(herpes simplex virus,HSV)进行研究。3种病毒衣壳形状均为二十面体,AdV的直径为70~90 nm,无包膜;AAV为20~30 nm,无包膜;HSV为120~150 nm,有包膜[20-21]。
1 仪器与试药 1.1 仪器TECNAI12型透射电子显微镜,FEI公司;MORADA G3型CCD相机,Emsis公司;Zetasizer Nano ZS型粒度分析仪,Malvern公司;FlowCAM8100型流体微粒成像系统,Fluid Imaging公司;GWJ-5型微粒检测仪和YB-2型澄明度检测仪,天大天发科技有限公司。
1.2 试药AdV、AAV和HSV样品均为中国食品药品检定研究院重组药物室留存样品,不同编号的样品来自不同厂家;30、60、100、200、300、400和600 nm的NanosphereTM粒径标准品(颗粒密度均为1.05 g·mL-1)购自Thermo Scientific公司。
2 方法与结果 2.1 扫描电镜(TEM)法采用负染结合TEM技术,对病毒样品进行检测。具体方法:将样本吸附于覆有碳膜的铜网5 min,用滤纸吸去多余样本,然后用1%磷钨酸(pH 6.8)染色1 min,吸去多余染液,室温晾干后进行检测。在透射电子显微镜下以加速电压120 kV状态下进行观察,并以CCD相机拍照记录,结果见图 1。3种病毒样品中均存在不完整病毒颗粒,包括空心衣壳(红色箭头)和破碎的衣壳(黄色箭头),AAV有病毒颗粒聚集的情况;HSV作为包膜病毒,存在脱包膜现象,也有1个包膜内存在2个衣壳的情况。

|
图 1 AdV、AAV和HSV样品中病毒颗粒的TEM检测结果 Fig.1 Virus particles in AdV, AAV and HSV samples observed by TEM |
NanosphereTM粒径标准品用超纯水稀释100倍后进行检测;热敏感试验的样品置室温融化后,分别在4、25、37 ℃放置2、4、6和24 h再进行检测。
直接取100 μL样本或粒径标准品加入样品杯,放入粒度分析仪进行分析。采用手动测量方式,设置测量类型为“size”。选择分散剂为“water”,样品池类型为“Disposable sizing cuvette”,设定测量角度为90°,温度为25 ℃,平衡时间为60 s。
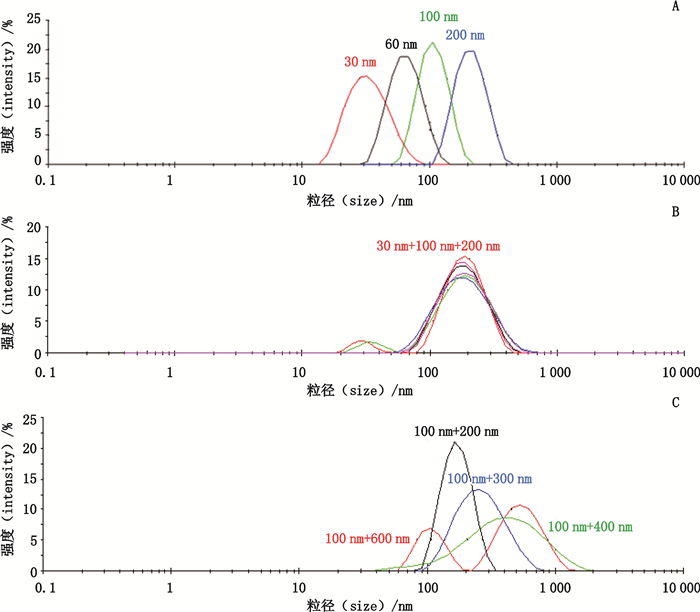
2.2.2 DLS准确性和分辨率验证DLS的测量范围为0.3 nm~10 μm,主要关注2个数据:平均粒径(直径Z average size)和多分散指数(polydispersity index,PDI)。PDI数值越小,粒径的分布越均一[11]。首先用粒径标准品对该法的准确性和分辨率进行了验证。分别检测30、60、100和200 nm的粒径标准品,粒径分布情况见图 2-A,实测值与标示值基本一致(表 1)。但是将不同粒径的标准颗粒等比例混合后检测发现,30 nm和100 nm的峰可以分离(图 2-B),但是100 nm和200、300、400 nm的峰均不能分离,100 nm和600 nm的峰可以基本分离(图 2-C)。这也提示,对于粒径在100 nm左右的病毒颗粒来说,寡聚体将不能和单体进行良好分离。
|
A.30、60、100和200 nm粒径标准品分别检测(size standards of 30 nm,60 nm,100 nm and 200 nm were detected seperately)B.30、100和200 nm粒径标准品混合检测(size standards of 30 nm,100 nm and 200 nm were mixed and detected)C.100 nm分别和200、300、400、600 nm粒径标准品混合检测(size standards of 200 nm,300 nm,or 600 nm were mixed with 100 nm separately and detected) 图 2 粒径标准品的DLS检测结果 Fig.2 Test results of size standards by DLS |
|
|
表 1 粒径标准品的理论值和实测平均粒径 Tab.1 The theoretical values and measured Z average sizes of size standards |
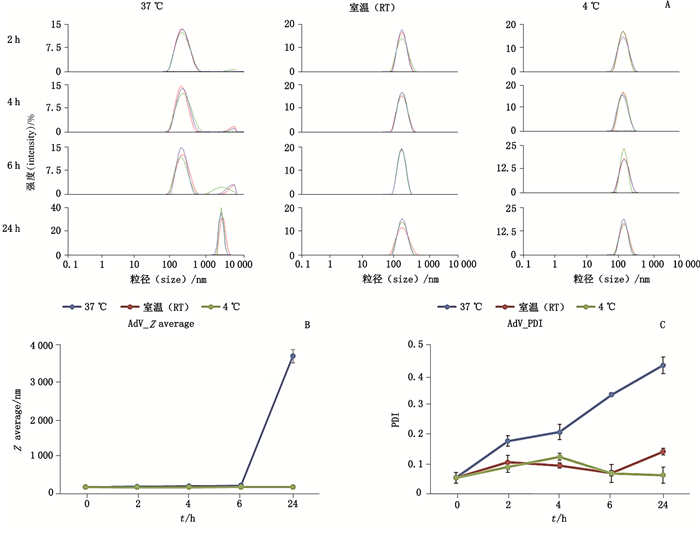
AdV实测平均粒径为158 nm,比理论值(70~90 nm)稍微偏大,PDI为0.05,粒径分布较均一。热敏感试验发现,37 ℃处理后有微米级聚集体产生,而且随着时间延长聚集体增加,24 h后仅检测到聚集体峰(图 3-A),平均粒径增加到3 800 nm左右(图 3-B),PDI也增加到0.4以上(图 3-C),说明AdV样品对温度比较敏感,高温易出现聚集体。
|
A.不同温度处理后的粒径分布图(particle size distribution profile of AdV samples incubated at different temperature)B.平均粒径随时间变化趋势图(time-changing trend diagram of Z average values)C.PDI随时间变化趋势图(time-changing trend diagram of PDI values) 图 3 AdV的DLS检测结果 Fig.3 Test results of AdV by DLS |
AAV实测平均粒径为22.2 nm,与理论值(20~30 nm)基本一致。但是PDI为0.6,说明粒径分布不够均一。热敏感试验显示,不同温度处理后的平均粒径没有明显变化(图 4-B),但是PDI值有所降低(图 4-C),且同一样品连续测试3次的结果变异较大(图 4-A),提示样品中可能存在一些可逆的小聚集体,处于动态平衡状态。

|
A.不同温度处理后的粒径分布图(particle size distribution profile of AAV samples incubated at different temperature)B.平均粒径随时间变化趋势图(time-changing trend diagram of Z average values)C.PDI随时间变化趋势图(time-changing trend diagram of PDI values) 图 4 AAV的DLS检测结果 Fig.4 Test results of AAV by DLS |
HSV实测平均粒径为340.8 nm,比理论值(120~150 nm)明显偏大,而且粒径分布更不均一,存在聚集体和碎片。热敏感试验显示,平均粒径没有明显变化(图 5-A),只有37 ℃放置24 h,粒径有所减小(图 5-B),PDI值增加到1(图 5-C),说明样品的颗粒异质性增大。结合电镜结果分析,可能出现更多的病毒脱包膜,导致平均粒径减小,异质性增大。

|
不同温度处理后的粒径分布图(particle size distribution profile of HSV samples incubated at different temperature)B.平均粒径随时间变化趋势图(time-changing trend diagram of Z average values)C.PDI随时间变化趋势图(time-changing trend diagram of PDI values) 图 5 HSV的DLS检测结果 Fig.5 Test results of HSV by DLS |
MDI技术是对微米级别的不溶性微粒进行拍摄,从形态上对微粒进行分类,并报告不同粒径大小和微粒类别的绝对计数。FlowCAM 8100系统主要参数设定如下:流通池采用FC80FV(80 μm×700 μm),物镜放大倍数为10倍,检测体积为150 μL,测试流速为0.1 mL·min-1,拍照频率为每秒20帧,采样效率为71.5%。MDI法检测结果见表 2。AdV#1、AdV#2和HSV#2均存在粒径50 μm以上微粒,与典型的蛋白聚集体形态相似(图 6),这些聚集体是蛋白聚集体还是病毒聚集体,还需要进一步鉴定。HSV#2样品有甘油存在,可能对检测背景有干扰。
|
|
表 2 MDI检测结果 Tab.2 Test results by MDI |

|
图 6 样本中聚集体MDI检测图像 Fig.6 Images of aggregates in samples captured by MDI |
采用光阻法检测不溶性微粒的大小和数量,GWJ-5系统同时设置7个通道:2.0、5.0、10.0、25.0、50.0、75.0、和100.0 μm,检测体积为0.5 mL。AdV#1、AAV和HSV #1样品汇总结果见表 3。与MDI法相比,光阻法检测数值偏低,可能是因为有些蛋白聚集体的折光性与溶剂接近,光阻法无法有效检出。
|
|
表 3 光阻法检测结果 Tab.3 Test results by light obscuration |
将样品瓶除去标签,置伞棚灯遮光板边缘处,照度为1 200 lx,轻轻旋转和翻转容器,使样品中可能存在的可见异物悬浮,并避免产生气泡,分别在黑色和白色背景下于明视距离重复观察,总检查时限为20 s。如图 7所示,AAV和HSV #1液体澄清;AdV#2、AdV#1和HSV#2液体带有乳光(3个样品的浊度递增);AdV#2有明显絮状沉淀物。结合MDI检测结果可以看出:未检测到50 μm以上颗粒的液体澄清,50 μm以上颗粒的数量与液体的浊度呈正相关,100 μm以上颗粒与絮状沉淀物相关。

|
图 7 样本目测结果 Fig.7 Test results by visual observation |
聚集体的存在可能会影响病毒的转导效率,还有可能引起严重的免疫反应。研究聚集体的形成原因并找到相应的解决方法对于基因治疗制剂的研发和质控至关重要。根据聚集体的大小可分为纳米级、亚可见级(2~100 μm)和肉眼可见级(100 μm以上)。肉眼可见聚集体通常为雪花状混悬液或沉淀物。聚集体的形成过程是循序渐进的,先形成小的内核,然后再逐步形成大的聚集体[22-23]。因此USP 42-NF 37通则 < 1787>建议,对治疗性蛋白注射剂中2~10 μm范围的微粒进行监测[24]。同样,对于病毒颗粒来说,监测微粒分布情况及动态变化过程,有利于探索聚集体形成的原因。本研究采用多种技术手段,对基因治疗产品常用的3种病毒载体AdV、AAV和HSV的微粒特性进行了观察研究,结果显示不同种类病毒的微粒特性不同,AdV、AAV和HSV样品中均存在不完整颗粒(空心病毒颗粒、衣壳碎片);AdV对温度敏感,易形成聚集体;AAV的粒径分布不均一,变异度大,可能存在可逆的低聚体;HSV实测粒径偏大且分布不均一,存在包膜脱落或融合(1个包膜里有2个衣壳)的情况;AdV和HSV样品中存在的50 μm以上的微粒,与典型的蛋白聚集体形态相似。可以看出,包膜病毒的异质性更大,这类病毒的质控将面临更多难点。本研究仅考察了24 h内病毒颗粒的动态变化过程,为了进一步探索病毒颗粒的微粒特性及其在不同储存条件下的长期稳定性,后续还将参考ICH指南的相关要求,开展基因治疗产品的稳定性研究。
电镜法可以在微观上直接观察病毒颗粒,包括完整病毒、空心病毒和衣壳碎片等;DLS法可以在一定范围内(0.3 nm~10 μm)检测病毒颗粒的粒径分布及动态变化情况;光阻法可以检测溶液中2 μm以上不溶性微粒的大小和数量;MDI法通过光学拍照和软件分析,可以定性和定量检测溶液中2 μm以上的微粒。基因治疗产品在研发过程中,可采用多种检测方法优势互补,对微粒进行全范围监测。在生产、纯化、储存过程中持续考察样品中的微粒分布情况(均一性),监测微粒的动态变化过程,探索聚集体形成的原因,通过优化生产、纯化工艺、缓冲体系、储存条件及制剂配方(赋形剂的选择),提高产品的稳定性,减少聚集体产生[13, 25]。
| [1] |
欧力. 基因治疗临床应用的现状及展望[J]. 中国食品药品监管, 2019(4): 34. OU L. Current situation and prospect of gene therapy clinical application[J]. Chin Food Drug Adm Mag, 2019(4): 34. |
| [2] |
RUBIN JD, NGUYEN TV, ALLEN KL, et al. Comparison of gene delivery to the kidney by adenovirus, adeno-associated virus, and lentiviral vectors after intravenous and direct kidney injections[J]. Hum Gene Ther, 2019. DOI:10.1089/hum.2019.127.[Epubaheadofprint |
| [3] |
GINN SL, ALEXANDER IE, EDELSTEIN ML, et al. Gene therapy clinical trials worldwide to 2012-an update[J]. J Gene Med, 2013, 15(2)65. |
| [4] |
SMITH E, BLOMBERG P. Gene therapy-from idea to reality[J]. Lakartidningen, 2017, 114. |
| [5] |
中华人民共和国药典2015年版.一部[S].2015: 404 ChP 2015. Vol Ⅰ[S]. 2015: 404 |
| [6] |
MATHONET S, MAHLER HC, ESSWEIN ST, et al. A biopharmaceutical industry perspective on the control of visible particles in biotechnology-derived injectable drug products[J]. PDA J Pharm Sci Technol, 2016, 70(4): 392. DOI:10.5731/pdajpst.2015.006189 |
| [7] |
WRIGHT JF, QU G, TANG C, et al. Recombinant adeno-associated virus:formulation challenges and strategies for a gene therapy vector[J]. Curr Opin Drug Discov Devel, 2003, 6(2): 174. |
| [8] |
CROYLE MA, CHENG X, WILSON JM. Development of formulations that enhance physical stability of viral vectors for gene therapy[J]. Gene Ther, 2001, 8(17): 1281. DOI:10.1038/sj.gt.3301527 |
| [9] |
WANG W, SINGH SK, LI N, et al. Immunogenicity of protein aggregates-concerns and realities[J]. Int J Pharm, 2012, 431(1-2): 1. DOI:10.1016/j.ijpharm.2012.04.040 |
| [10] |
CHIRA S, JACKSON CS, OPREA I, et al. Progresses towards safe and efficient gene therapy vectors[J]. Oncotarget, 2015, 6(31): 30675. |
| [11] |
李永红, 毕华, 陈伟, 等. 动态光散射法测定病毒载体基因治疗产品的平均粒径及粒径分布[J]. 现代生物医学进展, 2014, 14(34): 6611. LI YH, BI H, CHEN W, et al. Measurement of Particle size and distribution of viral vector gene therapy products using dynamic light scattering(DLS)[J]. Prog Mod Biomed, 2014, 14(34): 6611. |
| [12] |
REXROAD J, EVANS RK, MIDDAUGH CR. Effect of pH and ionic strength on the physical stability of adenovirus type 5[J]. J Pharm Sci, 2006, 95(2): 237. |
| [13] |
WRIGHT JF, LE T, PRADO J, et al. Identification of factors that contribute to recombinant AAV2 particle aggregation and methods to prevent its occurrence during vector purification and formulation[J]. Mol Ther, 2005, 12(1): 171. DOI:10.1016/j.ymthe.2005.02.021 |
| [14] |
KONDYLIS P, SCHLICKSUP CJ, ZLOTNICK A, et al. Analytical techniques to characterize the structure, properties, and assembly of virus capsids[J]. Anal Chem, 2019, 91(1): 622. DOI:10.1021/acs.analchem.8b04824 |
| [15] |
RUDT M, VORMITTA P, HILLEBRANDT N, et al. Process monitoring of virus-like particle reassembly by diafiltration with UV/Vis spectroscopy and light scattering[J]. Biotechnol Bioeng, 2019, 116(6): 1366. DOI:10.1002/bit.26935 |
| [16] |
BAMARD JG, SINGH S, RANDOLPH TW, et al. Subvisible particle counting provides a sensitive method of detecting and quantifying aggregation of monoclonal antibody caused by freeze-thawing:insights into the roles of particles in the protein aggregation pathway[J]. J Pharm Sci, 2011, 100(2): 492. |
| [17] |
GABRIEL DA, GIORDANO K. Microparticle sizing and counting using light scattering methods[J]. Semin Thromb Hemost, 2010, 36(8): 824. DOI:10.1055/s-0030-1267036 |
| [18] |
MCEVOY M, RAZINKOV V, WEI Z, et al. Improved particle counting and size distribution determination of aggregated virus populations by asymmetric flow field-flow fractionation and multiangle light scattering techniques[J]. Biotechnol Prog, 2011, 27(2): 547. DOI:10.1002/btpr.499 |
| [19] |
NARHI LO, JIANG Y, CAO S, et al. A critical review of analytical methods for subvisible and visible particles[J]. Curr Pharm Biotechnol, 2009, 10(4): 373. DOI:10.2174/138920109788488905 |
| [20] |
王军志. 生物技术药物研究开发和质量控制[M]. 第3版. 北京: 科学出版社, 2018: 883. WANG JZ. Research, Development and Quality Control of Biopharmaceuticals[M]. 3rd Ed.. Beijing: Science Press, 2018: 883. |
| [21] |
GONCALVES G, PAIVA R. Gene therapy:advances, challenges and perspectives[J]. Einstein(Sao Paulo), 2017, 15(3): 369. DOI:10.1590/s1679-45082017rb4024 |
| [22] |
PHILO JS, ARAKAWA T. Mechanisms of protein aggregation[J]. Curr Pharm Biotechnol, 2009, 10(4): 348. DOI:10.2174/138920109788488932 |
| [23] |
SESHADRI S, OBERG KA, UVERSKY VN. Mechanisms and consequences of protein aggregation:the role of folding intermediates[J]. Curr Protein Pept Sci, 2009, 10(5): 456. DOI:10.2174/138920309789351976 |
| [24] |
USP 42-NF 37[S].2019: 8401
|
| [25] |
RODRIGUES GA, SHALAEV E, KARAMI TK, et al. Pharmaceutical development of AAV-based gene therapy products for the eye[J]. Pharm Res, 2018, 36(2): 29. |
 2020, Vol. 40
2020, Vol. 40 
