2. CE & Biopharma Sciex, 北京 100026
2. CE & Biopharma Sciex, Beijing 100026, China
基因治疗是目前生物治疗领域的热点之一,基因治疗药物分为非病毒载体(如质粒等)和病毒载体(如腺病毒等)2类,以病毒为载体的基因治疗药物因为其可以高效率地导入而占据了绝对主导地位[1-3],为保障基因治疗药物的安全性和有效性,必须研究建立质量控制分析方法和质量标准。鉴别作为关键质量属性,在基因治疗药物的质控中是不可或缺的,基因治疗药物的鉴别通常从核酸水平和蛋白质水平进行。在核酸水平常采用限制性酶切图谱分析等方法,对载体及目的基因进行酶切和琼脂糖电泳分离分析鉴定。毛细管电泳(capillary electrophoresis,CE)是近几年发展快速的一种新的分离分析技术,与传统电泳方法相比,具有自动化程度高,分辨率高,重复性好,灵敏度高,试剂消耗少,环境污染小等特点[4-6],在蛋白质、多肽、核酸等分离分析领域有着越来越多的应用[7-9]。
本文以重组人1型单纯疱疹病毒(rHSV-1)为研究对象,利用Nde Ⅰ限制性内切酶将其特异性酶切为大小、数量不同的DNA片段,通过荧光标记,采用激光诱导荧光(laser induced fluorescence,LIF)检测器,研究建立了毛细管电泳的分离分析方法,对该基因治疗药物载体进行了限制性酶切图谱的鉴别分析。
1 仪器与试药 1.1 仪器PA800 Plus毛细管电泳系统(Sciex公司);32 Karat软件,Version 10.0(Sciex公司);激光诱导荧光检测器(Sciex公司),激发波长488 nm,检测波长520 nm。DU800紫外分光光度计(BeckmanCoulter公司);H2O3金属浴温控系统(金银杏生物科技公司);FLX96核酸提取仪(Thermo公司);TRANSSONIC460超声波清洗仪(Elma公司)。
1.2 试剂和样品核酸提取试剂盒(北京万泰生物药业股份有限公司),内含DNA提取液1~6;dsDNA1000分析试剂盒(Sciex公司),内含CE筛分介质,DNA涂层熔融石英毛细管(内径100 µm,Sciex公司);SYBRTM Gold nucleic acid(Invitrogen公司);超纯水(Milli-Q Labsystem,Millipore公司)。Nde I限制性内切酶及限制性内切酶缓冲液(TAKARA公司),琼脂糖(BIOWEST公司);DL15000 DNA Marker(TAKARA公司)。本研究用rHSV-1为中国食品药品检定研究院重组药物室检验留样。
2 方法与结果 2.1 样品的处理取3块96孔深孔板,在第1块96孔深孔板每孔中加600 μL DNA提取液1;向第2块深孔板每孔中加500 μL DNA提取液2、10 μL DNA提取液6和20 μL DNA提取液5;向第3块深孔板每孔中加500 μL DNA提取液3;取样品400 μL,加至第1块深孔板中,共加9孔。在核酸提取仪上按照试剂盒说明书设置程序,至最后一步洗脱前停止程序,回收第3块深孔板中样品孔的混悬液,置于磁力架上吸附混悬液中磁珠,小心吸除上清,将磁珠室温静置15 min充分晾干后加入超纯水60 μL,于55 ℃震摇5 min后,置磁力架上,上清即为提取后病毒核酸,经紫外分光光度仪于260 nm波长处检测,质量浓度为64 μg·mL-1。取病毒核酸42 μL,加入限制性内切酶(NdeⅠ)和限制性内切酶缓冲液各3 μL,轻弹混匀,5 000 r·min-1离心5 s后,于37 ℃孵育15 min后即得样品酶解液,可用于琼脂糖电泳,取样品酶解液50 μL,加入超纯水84 μL,混匀,取10 μL,再加入超纯水90 μL,混匀,即得供试品溶液,质量浓度为2 μg·mL-1;取超纯水42 μL,按提取后的病毒核酸处理方法同法处理,即得空白品溶液。
取1支CE筛分介质,加入超纯水20 mL,在室温下搅拌24 h,保证其充分溶解。再加入SYBRTM Gold nucleic acid 2 μL,充分混合均匀,用超声波清洗仪460 Hz超声5 min去除气泡,即得CE筛分介质溶液。
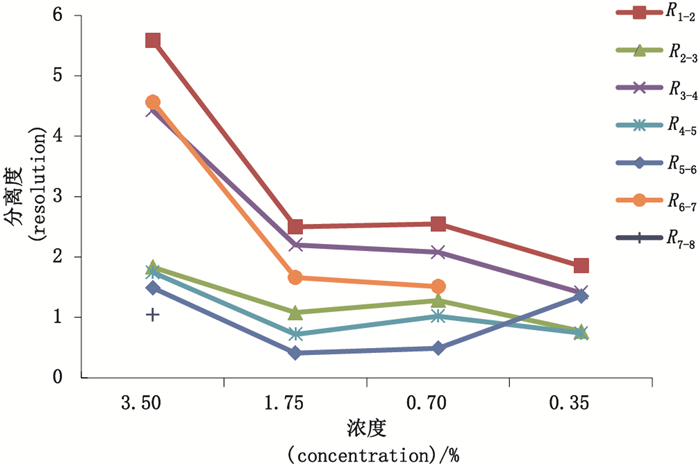
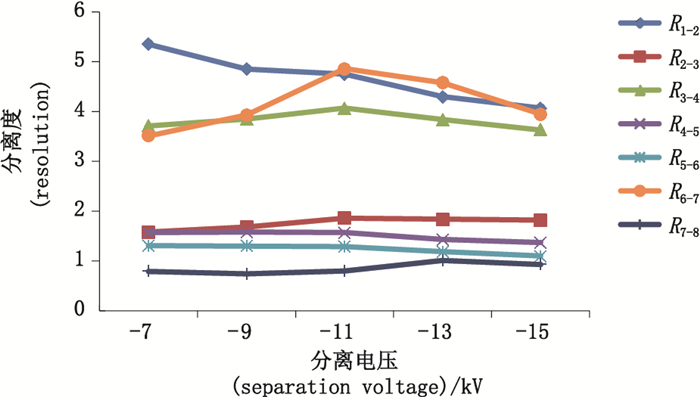
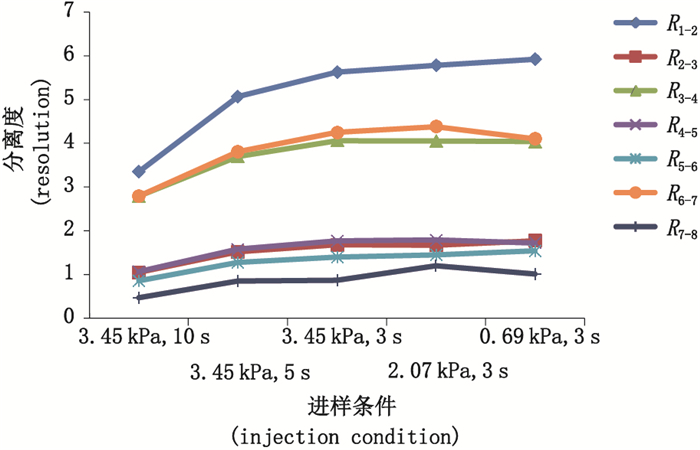
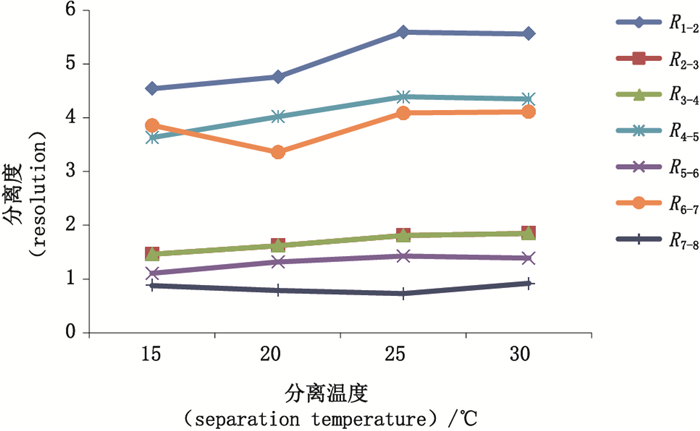
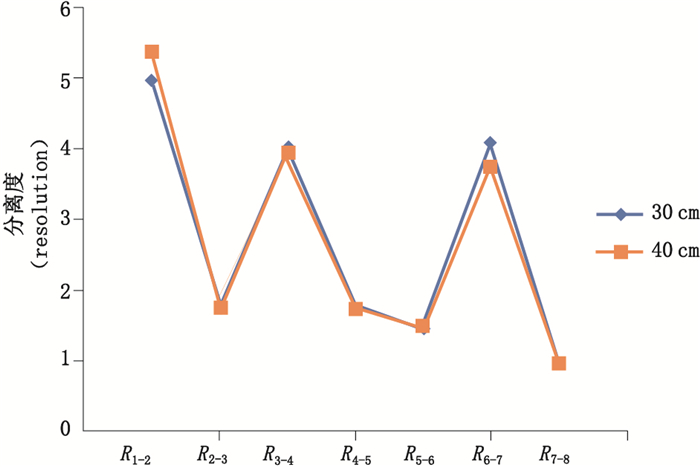
2.2 实验条件的优化及建立影响毛细管电泳分离DNA片段的因素有很多,如分离胶浓度、进样电压、毛细管长度等,为得到最优实验条件,本研究对筛分介质溶液浓度、进样条件、分离电压、分离温度及毛细管长度对各片段峰分离度的影响分别进行了比较,结果见图 1~5,样品片段峰1与峰2的分离度表示为R1-2,峰2与峰3的分离度表示为R2-3,依次类推,样品各片段峰分离度依次记为R1-2、R2-3、R3-4、R4-5、R5-6、R6-7、R7-8。分离度按美国药典USP的计算公式,即R1-2=2(t2-t1)/(W2-W1),其中t1和t2是峰1和峰2的迁移时间,W1和W2是峰1和峰2的峰宽。分离度可由仪器软件直接计算得到,实验结果显示,在筛分介质浓度为3.5%时,各峰分离度最好。降低进样压力或减少进样时间可以提高分离度,但导致信号降低,高分离电压虽然可以缩短峰迁移时间,但是过快的迁移会导致分离度的降低,综合选择分离电压为-7 kV。分离温度能够影响筛分介质的粘稠度,同样对分离效果也产生影响,这些都需要综合考量选择。研究比较了30 cm有效长度和40 cm有效长度的毛细管对分离效果的影响,结果表明2种长度的毛细管分离效果相差不大,故本实验采用分离时间更短的30 cm有效长度的毛细管。
|
图 1 不同浓度的筛分介质下样品的分离度折线图 Fig.1 Resolution turning curve gram of sample under different concentrations of separation medium |
|
图 2 不同分离电压下样品的分离度折线图 Fig.2 Resolution turning curve gram of sample under different separation voltages |
|
图 3 不同进样条件下样品的分离度折线图 Fig.3 Resolution turning curve gram of sample under different injection conditions |
|
图 4 不同分离温度下样品的分离度折线图 Fig.4 Resolution turning curve gram of sample under different separation temperatures |
|
图 5 不同长度的毛细管中样品的分离度折线图 Fig.5 Resolution turning curve gram of sample under different capillary lengths |
通过比较,综合考虑分离度、迁移时间以及信号响应值,确立的实验条件为采用有效长度为30 cm的涂层毛细管,分离温度设为25 ℃,样品储存温度设为10 ℃;压力进样,进样压力设为3.45 kPa,进样时间3 s;毛细管分离电压为-7 kV,分离时间40 min;检测器为LIF,激发波长及发射波长分别为488 nm和520 nm;用超纯水做空白品,实验图谱见图 6。

|
1~8.样品各片段峰(peak of each fragment of the sample) a.样品的CE-LIF图(CE-LIF of sample)b.空白品的CE-LIF图(CE-LIF of blank) A.样品和空白品的CE-LIF图(CE-LIF of sample and blank)B.样品和DNA ladder(1~15 kbp)的琼脂糖电泳图(agarose electrophoresis of sample and DNA ladder)C. DNA ladder的CE-LIF图(CE-LIF of DNA ladder)D. DNA ladder的片段大小拟合曲线(fragment size fitting curve of DNA ladder) 图 6 样品、空白品和DNA ladder的CE-LIF图与琼脂糖电泳图 Fig.6 CE-LIF and agarose electrophoresis of sample, blank and DNA ladder |
取供试品溶液通过改变进样压力和进样时间,由SCIEX的软件计算得到进样体积分别为0.89、2.67、4.45、7.42、14.85 nL,样品进样量范围为1.78~29.7 pg,在该范围内各校正峰面积Y与进样量X线性相关,峰1~7的R2均大于0.993 2,线性关系良好。结果见表 1。
|
|
表 1 线性关系考察 Tab.1 Validation of linearity |
取供试品溶液,重复进样6针,考察方法精密度,各峰迁移时间的RSD均小于0.32%,峰1~7校正峰面积百分比的RSD均小于5.6%,各峰的片段大小计算结果RSD均小于5.8%,精密度良好。统计结果见表 2。
|
|
表 2 精密度试验结果(n=6) Tab.2 Results of precision test |
将供试品溶液在10 ℃下分别放置0、2、4、8、12、24 h后进样分析,表现出较好的稳定性。其各个峰迁移时间的RSD均小于0.50%,校正峰面积百分比的RSD均小于5.8%,结果见表 3,供试品溶液24 h内稳定性良好。
|
|
表 3 稳定性试验结果(n=6) Tab.3 Results of stability test |
通过DNA ladder DL 15000,由32 Karat分析软件拟合曲线方程:Y=aX3+bX2+cX+d(其中Y为片段分子大小,X为片段迁移时间,a=4.955×10-7,b=-0.002 8,c=5.239,d=-3 284,R2=0.998 8)计算各片段大小。DNA ladder结果见图 6。采用传统的琼脂糖电泳的方法[10]检测出7条带,结果见图 6,将琼脂糖电泳结果经过灰度扫描分析后,与CE方法的结果相一致,比较结果见表 4。
|
|
表 4 CE方法与琼脂糖电泳方法对DNA片段大小的测定结果比较 Tab.4 Comparison of the test results of DNA fragments by CE and agarose electrophoresis |
rHSV是常用的基因治疗药物载体之一,分为2个血清型(rHSV-1、rHSV-2)。目前用于基因治疗的载体主要为rHSV-1型,该类病毒颗粒较大,是双链DNA病毒[11-12],对此类病毒载体结构的鉴别主要采用限制酶酶切图谱的方法,通过对酶切产物进行琼脂糖凝胶电泳检测,与理论酶切位点、酶切片段大小比较,确认重组病毒载体结构是否与预期改造结果一致,但由于分离技术的原因,一些过大或过小的酶切片段无法有效分离检出,因此在限制性酶切图谱鉴别上,通常采用酶切后与对照品酶切产物比较的方法,通过电泳分析,以确认酶切图谱与对照品酶切图谱是否一致。本研究对象rHSV-1经Nde Ⅰ酶切,理论上可获得13个特定大小的DNA片段,片段大小从51 bp到26 629 bp不等,跨度较大,虽然从实际分离的结果看CE和琼脂糖电泳尚无法全部顾及,但从实验结果看CE的分离效果要优于琼脂糖电泳。
本研究所采用的CE筛分介质为商品化的试剂,是一种亲水高分子聚合物溶液,易于毛细管的填充,每次进样更新分离介质非常方便。目前对于DNA在高分子溶液中的分离机理还不很清楚,被广泛接受的一种理论是爬行理论假说[13],该假说认为高分子聚合物溶液如同很多根管道,如线团一样的DNA片段像蛇一样在这些管子中爬行穿过,在电场力作用下DNA片段的淌度与电场强度平方成正比,与其大小成反比。这种高分子介质的浓度,以及分离条件如电压、温度等都会对DNA电泳迁移产生重要影响,低浓度的筛分介质无法形成有效的筛网,造成分离度的降低,高电压虽然可以提高电泳速度,缩短迁移时间,但是会降低分离度,而低电压由于电泳速度缓慢,条带更容易扩散,也会降低分离度。本研究通过多实验条件的优化,研究建立了rHSV-1的限制性酶切图谱CE-LIF分离分析方法,测定结果与琼脂糖电泳结果相符合,CE-LIF方法精密度好,灵敏度高,试剂消耗少,环境污染少,自动化程度高,适用于该类基因治疗产品的酶切片段的鉴别检测。
| [1] |
SLOBODKINA EA, MAKAREVICH PI, DOLINKIN AO. Issues of the development of gene therapy drugs[J]. Russ J Biopharm, 2018, 10(5): 3. |
| [2] |
AFIONE SA, CONRAD CK, FLOTTE TR. Gene therapy vectors as drug delivery systems[J]. Clin Pharmacokinet, 1995, 28(3): 181. DOI:10.2165/00003088-199528030-00001 |
| [3] |
BOUARD D, ALAZARD-DANY D, COSSET FL. Viral vectors:from virology to transgene expression[J]. Br J Pharmacol, 2009, 157(2): 153. |
| [4] |
HARSTAD RK, JOHNSON AC, WEISENBERGER MM, et al. Capillary electrophoresis[J]. Anal Chem, 2016, 88(1): 299. DOI:10.1021/acs.analchem.5b04125 |
| [5] |
LI LS, ZHAO Y, WANG HM, et al. Annual review of capillary electrophoresis technology in 2018[J]. Chin J Chromatogr, 2019, 87(5): 463. |
| [6] |
ATTALLAH AM, ABDALLAH SO, EL-DESOUKY MA, et al. A rapid, low-cost quantitative diagnostic method for hepatitis C virus infection using capillary zone electrophoresis[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(3): 439. DOI:10.1007/s10096-013-1976-8 |
| [7] |
BELOV AM, VINER R, SANTOS MR, et al. Analysis of proteins, protein complexes, and organellar proteomes using sheathless capillary zone electrophoresis-native mass spectrometry[J]. J Am Soc Mass Spectrom, 2017, 28(12): 2614. DOI:10.1007/s13361-017-1781-1 |
| [8] |
KOSTAL V, KATZENMEYER J, ARRIAGA EA. Capillary electrophoresis in bioanalysis[J]. Anal Chem, 2008, 80(12): 4533. DOI:10.1021/ac8007384 |
| [9] |
SUN H, LI L, SU M. Simultaneous determination of proline and pipemidic acid in human urine by capillary electrophoresis with electrochemilum-inescence detection[J]. Clin Lab Anal, 2010, 24(5): 327. DOI:10.1002/jcla.20284 |
| [10] |
中华人民共和国药典2015年版.三部[S].2015: 通则29 ChP 2015.Vol Ⅲ[S].2015: General rule 29
|
| [11] |
MANSERVIGI R, ARGNANI R, MARCONI P. HSV recombinant vectors for gene therapy[J]. Open Virol J, 2010, 4: 123. |
| [12] |
WORKENHE ST, SIMMONS G, POL JG, et al. Immunogenic HSV-mediated oncolysis shapes the antitumor immune response and contributes totherapeutic efficacy[J]. Mol Ther, 2014, 22(1): 123. DOI:10.1038/mt.2013.238 |
| [13] |
SLATER GW. DNA gel electrophoresis:the reptation model(s)[J]. Electrophoresis, 2009, 30(Suppl 1): S181. |
 2020, Vol. 40
2020, Vol. 40 
