随着基因治疗研究的逐渐深入,作为其基础的病毒载体研究有了突飞猛进的发展。基因工程改造的溶瘤病毒是一类具有在肿瘤细胞内复制及特异性杀伤肿瘤的病毒,是重要的基因治疗载体之一。其中,1型单纯疱疹病毒(herpes simplex virus 1,HSV-1)具有感染宿主范围广,病毒复制周期短,基因组容量大,安全性较高等优势[1-3],因此,目前对HSV-1的研究较多,取得的进展较大[4-7]。2015年10月27日,美国FDA批准了溶瘤病毒类治疗药物talimogene laherparepvec(T-Vec,ImLygic,安进公司)用于首次手术后复发的黑色素瘤患者不可切除的皮肤、皮下和淋巴结病灶的局部治疗,这也是首个获得FDA批准的溶瘤病毒类治疗药物[8]。目前,国内也有多家以HSV-1为载体的病毒产品进入临床试验。
在HSV-1载体药物开发的过程中,其质量控制尤为重要,而溶瘤活性测定是其关键的质量属性之一[9]。HSV-1是具有包膜的双链DNA病毒,在感染细胞时,其包膜糖蛋白首先通过黏附于细胞表面的硫酸肝素及黏多糖(GAG)与受体结合,在病毒包膜和细胞膜融合后,皮层蛋白和衣壳进入胞质,脱包膜的衣壳在核孔处将病毒DNA释放入核内开始复制转录,然后组装成新的病毒,最后裂解细胞[10]。目前,一些研究机构和医药公司在HSV-1溶瘤活性的检测中通常采用MTT法测定HSV-1裂解后存活的肿瘤细胞,以杀伤率为纵坐标,感染复数(multiple of infection,MOI)的对数值为横坐标,利用统计软件计算杀伤率为50%时对应的MOI值来表示溶瘤活性。该方法实验操作和结果计算较复杂,检测结果变异度较大,重复性差。因此,针对HSV-1溶瘤活性的检测,本研究采用CCK-8检测存活细胞的活性,采用四参数方程对HSV-1溶瘤活性的量效关系进行拟合[11],并引入标准品进行校准,建立了新的HSV-1溶瘤活性检测方法。
1 实验材料 1.1 实验耗材及仪器BIOSTAR生物安全柜购自Telstar公司;3111二氧化碳培养箱购自Thermo公司;M5酶标仪购自Molecular Devices公司;TE300倒置显微镜购自NIKON公司;AP-0650030细胞计数板购自MARIENFELD公司等。
1.2 试剂及细胞DMEM/F12培养基(货号11320082)、新生牛血清(货号16010159)、L-Glutamine(货号25030-081)、青链霉素双抗(货号15140-122)、0.25%胰酶(货号25200056)、DPBS(货号A1285601)均购自Thermo公司;CCK-8(货号CK04)购自北仁化学科技有限公司;人骨肉瘤细胞U-2 OS、人宫颈癌细胞Hela、猴肾细胞Vero、HSV-1标准品和3批HSV-1样品(S1、S2和S3)均为中国食品药品检定研究院重组药物室留存。
2 方法与结果 2.1 HSV-1溶瘤活性检测步骤 2.1.1 准备细胞T75培养瓶中,取生长正常的单层细胞U-2 OS(或者Hela、Vero),弃培养上清,用10 mL的DPBS洗涤细胞后弃去,重复操作1次后,加入0.25%胰酶2~3 mL,待细胞出现滑落时弃去胰酶,轻拍瓶壁脱落细胞后,用10 mL完全培养基(DMEM/F12培养基+10%新生牛血清(NBCS)+1% L-Glutamine+1%青链霉素双抗)终止消化,吹悬分散细胞,显微计数细胞密度。
2.1.2 细胞铺板用完全培养基稀释细胞密度为1.25×105个·mL-1,每孔200 μL接种至透明的96孔板,第12列不接种细胞。
2.1.3 细胞培养96孔板放置于37 ℃、5% CO2的培养箱,培养18~20 h。
2.1.4 标准品溶液及供试品溶液的配制用完全培养基分别稀释标准品和供试品至病毒浓度为5×104 PFU·mL-1后,再4倍比系列稀释,共8个稀释度,每个浓度设置2个复孔。
2.1.5 接毒弃96孔板微孔内细胞培养上清,用滤纸将孔内残余液体吸尽,然后加完全培养基,每孔150 μL,接着加入稀释后的标准品溶液和供试品溶液各50 μL·孔-1。96孔板的第1列、第12列加入完全培养基,每孔50 μL,分别作为阴性对照和空白对照。
2.1.6 培养及读数在37 ℃、5% CO2培养箱中连续培养72 h后,每孔加入CCK-8 10 μL,加药时枪头伸入液面以下,防止CCK-8残留在孔板壁上,轻轻振摇培养板。继续37 ℃培养4 h,取出后,在酶标仪上终点法读取吸收值A450。
2.1.7 数据的统计和分析在Softmax软件上,使用四参数方程对结果进行分析,得到量效关系曲线。
2.2 方法学优化 2.2.1 细胞种类的选择选取目前在病毒溶瘤活性检测实验中常见的3种细胞(U-2 OS、Vero和Hela细胞),其余条件按“2.1”项方法进行试验,得到如图 1-A所示的量效曲线,结果显示,在相同的病毒浓度下,U-2 OS细胞被杀伤的效果最明显,说明U2-OS对HSV-1最敏感,故选为溶瘤活性检测用细胞。
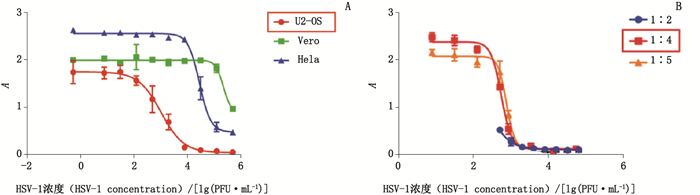
|
图 1 HSV-1感染不同细胞(A)及HSV-1不同系列稀释比例(B)的量效曲线 Fig.1 Dose-response curves of different cells(A) and different serial dilution ratio(B) |
将HSV-1样品以5×104 PFU·mL-1为起始浓度,分别按照2倍、4倍和5倍的比例进行8个稀释度的系列稀释,其余按“2.1”项方法进行试验。结果显示,4倍比例稀释时曲线上各点分布均匀(上、下平台和线性部分分别有2、4、2个点),信噪比也较好(图 1-B)。所以选择以4倍比例进行8个稀释度的系列稀释作为优化后条件。
2.2.3 样品预稀释后初始浓度分别选择2×104、3×104、4×104、5×104和6×104 PFU·mL-1浓度作为预稀释初始浓度,以完全培养基进行4倍比系列稀释,共8个稀释度,其余按“2.1”项方法进行试验,得到的拟合量效关系四参数曲线显示(见图 2-A),初始浓度为5×104 PFU·mL-1时,R2 > 0.99,信噪比最高。因此,选择5×104 PFU·mL-1作为优化后预稀释初始浓度。
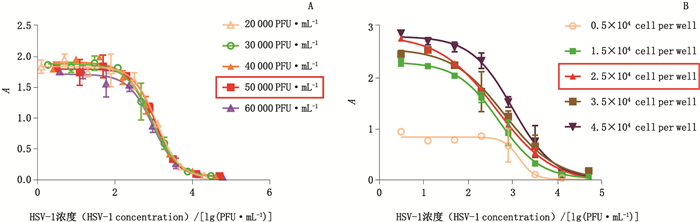
|
图 2 不同预稀释后初始浓度(A)及感染不同细胞数量(B)的HSV-1量效曲线 Fig.2 Dose-response curves of different initial concentration of HSV-1(A)and different cell numbers(B) |
每孔分别接种0.5×104、1.5×104、2.5×104、3.5×104和4.5×104个细胞,其余按“2.1”项方法进行试验,检测HSV-1溶瘤病毒样品的量效反应性,结果见图 2-B。根据四参数曲线变化趋势和上下平台计算得出信噪比,确定细胞铺板数量为每孔2.5×104个。
2.2.5 感染时间在确定细胞种类、铺板数量、HSV-1稀释倍数和预稀释后初始浓度的基础上进一步探究HSV-1感染细胞的最佳时间。96孔板接毒后,于37 ℃,5% CO2条件下培养24、48、72、96和120 h,加入CCK-8进行检测,其余试验条件同“2.1”项。图 3-A所示,24 h和48 h条件下,HSV-1杀伤细胞作用不明显;96 h和120 h条件下,HSV-1杀伤细胞作用过度;72 h条件下才呈现出典型的S型曲线。故选择72 h作为优化后条件。
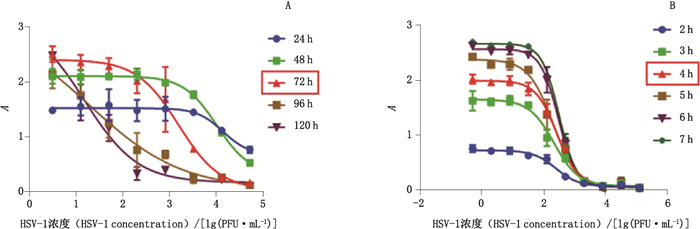
|
图 3 HSV-1不同感染时间(A)及不同反应时间(B)的量效曲线 Fig.3 Dose-response curves of different infection time(A) and different CCK-8 reaction time(B) |
CCK-8试剂可用于简便而准确的细胞增殖分析。该试剂中含有WST-8(其化学名称为2-(2-甲基氧-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4二磺酸苯)-2H-四唑单钠盐),在电子载体1-甲氧基5-甲基吩嗪鎓硫酸二甲酯的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲臜染料,随着反应时间的增加,使溶液的颜色不断加深,A450值不断增加。本实验在加入CCK-8后,分别在2、3、4、5、6和7 h后进行检测(图 3-B),其余试验条件同“2.1”项。从信噪比和检测周期综合考虑,选择4 h作为CCK-8与细胞的最佳作用时间。
2.2.7 方法学优化结果根据“2.1”项的实验方案,选择细胞种类、样品系列稀释比例、样品预稀释后初始浓度、细胞铺板数量、感染时间和CCK-8试剂反应时间6个参数,对HSV-1溶瘤活性检测方法进行了优化。优化后的条件:U-2 OS细胞株,1:4的样品系列稀释比例,5×104 PFU·mL-1的样品系列稀释初始浓度,每孔2.5×104个细胞的铺板数量,72 h感染时间和4 h CCK-8试剂反应时间,四参数方程拟合的量效关系曲线R2大于0.99,信噪比也较高,达到了预期目标。
2.3 方法学验证 2.3.1 准确度用完全培养基将样品预稀释100倍,标准品预稀释到387 U·mL-1后将二者等体积混合,作为回收试验样品进行检测,其余操作同“2.1”项方法。结果显示,预稀释后样品的溶瘤活性为1 277 U·mL-1,回收样品的溶瘤活性为858 U·mL-1,经计算回收率为113.4%,准确度在可接受范围内。
2.3.2 日间精密度按照最终确定的实验条件,用S1样品连续3 d重复检测溶瘤活性,并且对实验中有无使用标准品校准进行对比。实验结果如表 1所示,样品在有标准品校准的情况下溶瘤活性的几何均值(GM)为3.52×103 U·mL-1,几何变异系数(GCV)为21.8%,精密度在可接受范围内,而在无标准品校准的情况下检测的溶瘤活性GM为3.11×103 U·mL-1,GCV为41.7%。该初步实验结果显示,样品在有标准品校准的情况下GCV小于无标准品校准的,说明在溶瘤活性检测中引入标准品校准提高了分析方法的精密度。
|
|
表 1 日间精密度的结果 Tab.1 The results of intra-day precision |
取HSV-1标准品和样品S1、S2和S3,按“2.1”项下方法检测溶瘤活性,每个样品重复检测3次。结果如表 2所示,样品S1、S2和S3的溶瘤活性分别为3.52×103、3.93×104和1.61×105 U·mL-1。
|
|
表 2 3批供试品的溶瘤活性测定 Tab.2 Oncolytic activity determination of 3 batches of test samples |
基因治疗作为肿瘤生物治疗的新型手段,多年来已证明了其安全性和有效性,但其抗肿瘤效应仍有待于进一步提高。包括HSV-1在内的复制型溶瘤病毒载体是近年来肿瘤基因治疗的研究热点之一[12]。单纯疱疹病毒是α疱疹病毒的成员,通过删除其非必需的神经毒性基因(如γ34.5、tk、核糖核苷酸还原酶基因),并在相应位点插入有外源治疗性的基因(如PD-1,GM-CSF,IL-2)[13],HSV-1病毒可选择性地在分裂活跃的肿瘤细胞中增殖并导致肿瘤细胞的死亡,并且通过裂解肿瘤细胞、释放子代病毒并继续感染其他肿瘤细胞的链式反应,能够进一步扩大溶瘤效果。当HSV-1作为一种溶瘤病毒进行临床应用时,其治疗的目的在于能够准确地杀伤肿瘤细胞,病毒用量过少肿瘤杀伤效果不明显,用量过多可能会产生相应的副作用。HSV-1溶瘤病毒药物的溶瘤活性与产品的有效性密切相关,在新药开发和药物质量控制中,对其进行准确的定量测定,具有重要意义。目前,企业开发的HSV-1溶瘤病毒药物一般采用感染滴度作为临床剂量的指标,而感染滴度的测定则采用人工计数噬斑的方法,结果的准确性和精密度较差。HSV-1的溶瘤活性与其临床有效性的关系更为直接,如果能得到更为准确的测定,则有可能是作为剂量指标更好的选择。
本研究首先选择了细胞种类、样品系列稀释比例、样品预稀释后初始浓度、细胞铺板数量、感染时间和CCK-8试剂反应时间6个参数,对HSV-1溶瘤活性检测方法进行了优化;条件优化后四参数方程拟合的量效关系曲线R2大于0.99,信噪比也较高,达到了预期目标。其次,本研究采用了CCK-8显色法测定活细胞,其基本原理为CCK-8中含有WST-8,它在电子载体1-甲氧基5-甲基吩嗪鎓硫酸二甲酯的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲臜染料;生成的甲臢染料与活细胞的数量成正比,因此可利用这一特性直接进行细胞增殖和毒性分析;与MTT法相比,本方法还原后的黄色甲臜染料是水溶性的,不需要加有机溶剂做进一步溶解,可实时检测,操作简便,并且重现性好。
最后,本研究引入了溶瘤活性同质标准品进行校准,不仅提高了溶瘤活性检测的精密度,而且使HSV-1的溶瘤活性检测不依赖于感染滴度进行定量,使其能够独立作为HSV-1生物学活性的检测项目,更好地反映HSV-1的生物学活性,因此在其溶瘤活性检测中有必要引入标准品进行校准。按照2019年6月国家药典委员会公示的《人用基因治疗总论草案》的要求,对于效价、感染性滴度等活性检测方法,应建立具有长期稳定性的活性标准品。本实验室正在进行HSV-1国家标准品的研制,在没有国家标准品之前,研发或生产企业应建立内部的活性测定标准品。总之,该法经初步的验证,准确度和精密度在可接受范围内,可用于以HSV-1为载体的基因治疗药物的溶瘤活性测定。
| [1] |
ZEYAULLAH M, PATRO M, AHMAD I, et al. Oncolytic viruses in the treatment of cancer:a review of current atrategies[J]. Pathol Oncol Res, 2012, 18(4): 771. DOI:10.1007/s12253-012-9548-2 |
| [2] |
DAI MH, ZAMARIN D, GAO SP, et al. Synergistic action of oncolytic herpes simplex virus and radiotherapy in pancreatic cancer cell lines[J]. Br J Surg, 2010, 97(9): 1385. DOI:10.1002/bjs.7124 |
| [3] |
WATANABE D. Medical application of herpes simplex virus[J]. J Dermatol Sci, 2010, 57(2): 75. DOI:10.1016/j.jdermsci.2009.10.014 |
| [4] |
COFFIN R. Interview with Robert Coffin, inventor of T-VEC:the first oncolytic immunotherapy approved for the treatment of cancer[J]. Immunotherapy, 2016, 8(2): 103. DOI:10.2217/imt.15.116 |
| [5] |
MATTILA RK, HARILA K, KANGAS SM, et al. An investigation of herpes simplex virus type 1 latency in a novel mouse dorsal root ganglion model suggests a role for ICP34.5 in reactivation[J]. J Gen Virol, 2015, 96(8): 2304. DOI:10.1099/vir.0.000138 |
| [6] |
LIPSON EJ, SHARFMAN WH, CHEN S, et al. Safety and immunologic correlates of Melanoma GVAX, a GM-CSF secreting allogeneic melanoma cell vaccine administered in the adjuvant setting[J]. J Transl Med, 2015, 13(1): 214. DOI:10.1186/s12967-015-0572-3 |
| [7] |
KOHLHAPP FJ, KAUFMAN HL. Molecular pathway:mechanism of action for talimogene laherparepvec, a new oncolytic virus immunotherapy[J]. Clin Cancer Res, 2016, 22(5): 1048. DOI:10.1158/1078-0432.CCR-15-2667 |
| [8] |
SHERIDAN C. First oncolytic virus edges towards approval in surprise vote[J]. Nat Biotechnol, 2015, 33(6): 569. DOI:10.1038/nbt0615-569 |
| [9] |
李永红.基因治疗药物的质量控制[C]//2016年生物技术药物理化特性分析与质量研究技术研讨会资料汇编.北京: 中国药学会, 2016: 50 LI YH.Quality control of gene therapy drugs[C]//Data Collection of 2016 Technical Seminar on Analysis of Physical and Chemical Properties and Quality Research of Biotechnology Drugs.Beijing: Chinese Pharmaceutical Association, 2016: 50 |
| [10] |
伍立群. 单纯疱疹病毒进入细胞机制的研究进展[J]. 国际病毒学杂志, 2010, 17(5): 143. WU LQ. Advances in the mechanism of herpes simplex virus entry into cells[J]. Int J Virol, 2010, 17(5): 143. DOI:10.3760/cma.j.issn.1673-4092.2010.05.004 |
| [11] |
段徐华, 吴利红, 董闪闪, 等. 不同质量标准中生物学活性测定四参数回归计算法的比较[J]. 中国医药工业杂志, 2018, 49(10): 1428. DUAN XH, WU LH, DONG SS, et al. Comparison of four parameter regression calculation methods for biological activity determination in different quality standards[J]. Chin J Pharm, 2018, 49(10): 1428. |
| [12] |
高凯, 付志浩, 李永红, 等. 重组复制型溶瘤单纯疱疹病毒人细胞巨噬细胞集落刺激因子的质量研究[J]. 中国药学杂志, 2011, 46(19): 1520. GAO K, FU ZH, LI YH, et al. Quality control research on recombinant oncolytic herpes simplex virus serotype 1 encoding human GM-CSF gene[J]. Chin Pharm J, 2011, 46(19): 1520. |
| [13] |
CAREW JF, KOOBY DA, HALTERMAN MW, et al. A novel approach to cancel therapy using an oncolytic herpes virus to package amplicons contain cytokine genes[J]. Mol Ther, 2001, 4(3): 250. DOI:10.1006/mthe.2001.0448 |
 2020, Vol. 40
2020, Vol. 40 
